Физиология человека, 2020, T. 46, № 5, стр. 107-114
Полиреактивная трансформация иммуноглобулинов класса G как вектор поиска потенциальных средств повышения активности антиэндотоксинового иммунитета
А. И. Гордиенко 1, Н. В. Химич 1, В. А. Белоглазов 1, А. В. Кубышкин 1, М. Ю. Яковлев 2, 3, *
1 Медицинская академия имени С.И. Георгиевского
ФГАОУ ВО Крымский федеральный университет
имени В.И. Вернадского
Симферополь, Россия
2 ФГБНУ Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
3 ФГБОУ ВО Российский национальный исследовательский медицинский университет
имени Н.И. Пирогова Министерства здравоохранения РФ
Москва, Россия
* E-mail: yakovlev-lps@yandex.ru
Поступила в редакцию 12.09.2019
После доработки 03.12.2019
Принята к публикации 20.03.2020
Аннотация
Установлено, что кратковременное воздействие in vitro хаотропного реагента на нативные иммуноглобулины класса G способно достоверно повышать активность антиэндотоксинового иммунитета и обуславливать снижение способности эффекторных клеток связывать липополисахарады (ЛПС) энтеробактерий, а значит и уменьшать ЛПС-зависимую активацию этих клеток и последующий синтез медиаторов воспаления. Это может быть крайне полезно не только для лечения септических больных, но и для профилактики прогрессирования болезней атеросклеротической природы, поскольку ЛПС считается важнейшим фактором индукции атерогенеза. Механизм полиреактивной трансформации нативных иммуноглобулинов класса G под воздействием хаотропного реагента пока остается неизвестным. Предположительно он может заключаться в индукции внутримолекулярных конформационных перестроек нативных γ-глобулинов, в результате которых на Fab-фрагментах появляются “предковые” сайты низкоаффинного полиспецифичного связывания, что и определяет возникновение комплементарности к эволюционно устойчивым молекулярным структурам патогенов. Полученные результаты указывают на необходимость дальнейшего изучения механизмов полиреактивной трансформации нативных иммуноглобулинов класса G и поиска нетоксичных хаотропных агентов, которые потенциально могут быть использованы в клинической практике.
Исследования последних лет убедительно свидетельствуют о том, что нарушения физиологических защитных механизмов, развитие различных заболеваний, снижение качества и продолжительности жизни тесно ассоциированы со сбоями в сложнейшей системе взаимных связей между кишечной микробиотой и многочисленными клетками макроорганизма, в том числе эпителиальными, иммунными и нейроэндокринными. Становится все более очевидным, что микробиота кишечника играет огромную роль в поддержании здоровья человека во всех возрастных категориях [1–3]. Значительную часть микробиоты дистальных отделов кишечника составляют условно-патогенные грамотрицательные энтеробактерии, относящиеся к родам Escherichia, Bacteroides, Enterobacter, Klebsiella, Eubacterium, Acidaminococcus, Fusobacterium, Megamonas, Megasphaera, Proteus и Veillonella [4, 5]. Основным компонентом клеточной стенки этой группы микроорганизмов является липополисахарид (ЛПС) или эндотоксин. ЛПС считается одним из наиболее мощных флогогенных факторов микробного происхождения. При этом биологически активная часть молекулы ЛПС представлена липидом А, который способен взаимодействовать с мембранными рецепторами различных клеток млекопитающих, что ведет к их активации и синтезу широкого спектра медиаторов воспаления [6].
Известно, что в крови здоровых людей всегда присутствует небольшое количество ЛПС кишечного происхождения [7]. Фундаментальная роль этого явления, получившего название системная эндотоксинемия (СЭЕ), в биологии человека в первую очередь определяется способностью ЛПС кишечной микробиоты взаимодействовать с ключевым клеточным рецептором врожденного иммунитета TLR4 и определять уровень активности адаптивного звена иммунной системы. Патогенное действие СЭЕ, обусловленное избыточным содержанием ЛПС кишечного и/или иного происхождения в гемоциркуляции, получило название эндотоксиновая агрессия (ЭА), которая квалифицируется как предболезнь или универсальный фактор патогенеза многих заболеваний и синдромов [8]. Феноменологическое подтверждение этой дефиниции было получено в клинических исследованиях. Использование средств снижения концентрации ЛПС в крови и нормализации показателей активности антиэндотоксинового иммунитета (АЭИ) позволяет существенно повысить эффективность общепринятых схем лечения многих заболеваний, включая аллергозы; хронические воспалительные заболевания глаза, женской половой сферы; хронические вирусные заболевания; сепсис и др. [8, 9]. Наличие ЭА или же только некоторых из ее признаков также обнаружено у больных с аутоиммунными заболеваниями; сахарным диабетом 1 и 2 типа; при абдоминальной, сердечно-сосудистой и урологической хирургической патологии у детей и взрослых; при нервной анорексии (клиническая модель), инфаркте миокарда и прогрессировании атерогенеза [10–15].
Способность устранять ЭА или уменьшать ее патогенное действие обнаружили селективная гемосорбция (ЛПС-фильтры), иммунопрепараты (концентраты анти-ЛПС-антител, полученные из человеческой крови, моноклональные антитела к липиду А), энтеросорбенты, живые бифидумбактерии и желчегонные средства [8, 16–18]. Однако возможен и иной вектор устранения ЭА, который на сегодняшний день практически не разработан – это повышение активности АЭИ. Косвенные признаки такой способности демонстрируют внутривенное лазерное облучение крови, ультрафиолетовое облучение крови in vitro и рентгеновское облучение 5% раствора глюкозы непосредственно перед его последующей перфузией [8]. Потенциально перспективным средством повышения АЭИ могут быть и хаотропные агенты – химические соединения, инициирующие внутримолекулярные конформационные перестройки нативных иммуноглобулинов класса G (ИГ), в результате которых они приобретают не свойственную им ранее комплементарность. Принципиальная возможность получения полиреактивно трансформированных ИГ по отношению к антигенам белковой природы при кратковременном воздействии хаотропного реагента (тиоционата калия) была обнаружена ранее в экспериментах in vitro [19, 20]. В связи с этим целью настоящего исследования явилось изучение способности хаотропного реагента повышать активность АЭИ.
МЕТОДИКА
Объектом исследования являлась пулированная сыворотка крови 40 постоянных доноров Крымской республиканской станции переливания крови (г. Симферополь), а также индивидуальные образцы сыворотки крови двух групп волонтеров (60 чел. обоего пола), полученные общепринятым способом и хранившиеся в присутствии 0.1% азида натрия при температуре +(4–8)°С. Первая группа волонтеров состояла из 30 условно здоровых людей, не имеющих верифицированных острых и хронических заболеваний. Во вторую группу вошло 30 чел., которые страдали хронической толстокишечной непроходимостью (ХТКН) и нуждались в оперативном вмешательстве. Нативные ИГ выделяли из образцов сыворотки крови четырехкратным переосаждением сульфатом аммония (40% от насыщения); их качественный состав контролировали методом электрофореза в полиакриламидном геле с последующим окрашиванием белковым красителем Coomassie R-250 [21]. Количественное содержание белка во всех случаях определяли методом M.M. Bredford [22].
После выделения нативные ИГ разделяли на две части − одна из них служила контролем, а другую использовали для получения полиреактивно трансформированных иммуноглобулинов (ПРИГ). Для этого к 0.5 мл раствора нативных ИГ (20 мг/мл) прибавляли равный объем 7 М тиоцианата калия, тщательно перемешивали, инкубировали 10 мин при комнатной температуре +(18–22)°С и затем центрифугировали 10 мин при 1500 g. Хаотропный реагент удаляли гель-фильтрацией на колонке (13 × 1.4 см) с Сефадексом G-25 в 0.01 М фосфатном буфере (рН 7.4), содержащем 1% NaCl. Во время выполнения экспериментов нативные ИГ и ПРИГ хранили при +(4–8)°С в присутствии 0.1% азида натрия.
Предполагаемую способность хаотропного реагента повышать активность АЭИ оценивали in vitro двумя различными методами: иммуноферментным анализом (ИФА) и проточной лазерной цитофлюориметрией. ИФА проводили по следующей схеме [23]. В лунки полистироловых планшетов RIA/EIA polystyrene microplates, medium binding (Corning, США) вносили по 100 мкл раствора коммерческих препаратов ЛПС Escherichia coli K235, Salmonella minnesota и Salmonella enteritidis (Sigma Сhem. Co., США) с концентрацией 10 мкг/мл в 0.05 моль карбонатном буфере (рН 9.6), содержащим 70% сульфата аммония. Контрольным антигеном служил раствор овальбумина (10 мкг/мл) в 0.05 М карбонатном буфере (рН 9.6), который вносили в лунки по 100 мкл. После этого планшеты инкубировали в течение 18 ч при 37°С. Для удаления не связавшихся антигенов и блокирования свободных центров неспецифического связывания лунки промывали (4 раза по 1 мин) 0.033 М фосфатным буфером (рН 7.4), содержащим 1%-й NaCl и 0.05%-й Tween-20 (PBS-T). Затем в лунки последовательно вносили по 100 мкл раствора нативных ИГ или ПРИГ (25 мкг/мл) в PBS-T и иммунопероксидазного конъюгата козьих аффинно очищенных антител к IgG человека (Sigma Chemicals Co., США) в PBS-T (разведение 1 : 8000). С каждым реагентом проводили 60-минутную инкубацию при 37°С. Неспецифически связавшиеся компоненты после каждого этапа отмывали PBS-T (5 раз по 2 мин). Для регистрации пероксидазной активности в лунки вносили по 100 мкл субстратно-буферной смеси (0.1 моль фосфатно-цитратный буфер (рН 6.0) содержащий 3.3',5.5'-тетраметилбензидин в концентрации 0.1 мг/мл и 0.005% H2O2) и инкубировали 60 мин при 37°С. Развитие окрашивания останавливали прибавлением в лунки 25 мкл 3 М серной кислоты. Оптическую плотность конечного продукта ферментативной реакции определяли с помощью микропланшетного анализатора Multiskan FC (Thermo Fisher Scientific™) при длине волны 450 нм. Уровни связывания нативных ИГ или ПРИГ представлены в единицах оптической плотности конечного продукта ферментативной реакции (усл. ед.). Результаты анализа считали корректными, если для трех контролей (“Low”, “Medium” и “High”) показатели экстинкции при длине волны 450 нм находились в установленном диапазоне значений.
ЛПС-связывающий потенциал гранулоцитов и моноцитов периферической крови человека определяли методом проточной лазерной цитофлуориметрии в соответствии с разработанным нами ранее протоколом [24]. Фракцию лейкоцитов выделяли из стабилизированной цитратом натрия периферической крови здоровых людей (n = 50) с помощью стандартной процедуры лизиса эритроцитов в присутствии хлорида аммония (Current Protocols in Cytometry, 1997) с последующей отмывкой клеток от детрита, гемоглобина и остатков лизирующего раствора изотоническим фосфатно-солевым буфером (ФСБ). В качестве флуоресцентного зонда для выявления ЛПС-связывающих рецепторов использовали ЛПС E. coli K235, конъюгированный с флуоресцеинизотиоцианатом (конъюгат ЛПС-FITC). К 25 мкл суспензии лейкоцитов прибавляли 12.5 мкл конъюгата ЛПС-FITC (рабочее разведение 1 : 20) и 12.5 мкл 0.06% раствора бычьего сывороточного альбумина (Sigma Chem. Co., США), что необходимо для блокирования неспецифического связывания флуоресцентного зонда. После 30-минутного инкубирования в темноте при +(18–20)°С в пробирки вносили по 1 мл ФСБ и подготовленную таким образом суспензию лейкоцитов анализировали на проточном лазерном цитофлуориметре PAS (Partec GmbH, Германия). Сбор и анализ данных проводили с помощью программного обеспечения Partec FloMax V. 2.4d (Partec G-mbH, Германия); в каждом образце анализировали 10 000 клеток с регистрацией показателей переднего и малоуглового светорассеяния в линейном масштабе (соответственно FSC и SSC), а также флуоресценции по каналу FL1 в четы-рехразрядном логарифмическом масштабе. После “гейтирования” кластеров гранулоцитов и моноцитов по параметрам FSC и SSC определяли средний уровень флуоресценции этих клеток (усл. ед.), численное значение которого характеризует их ЛПС-связывающий потенциал.
Достоверность различий между изучаемыми показателями оценивали с помощью Т-критерия Стьюдента. Различия считали значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В первой серии экспериментов были охарактеризованы свойства ПРИГ, которые получали путем 10-минутной экспозиции в присутствии 3.5 М тиоцианата калия нативных ИГ, выделенных из пулированной сыворотки крови здоровых людей. Установлено, что кратковременный контакт нативных ИГ с хаотропным реагентом приводит к существенному изменению их способности к взаимодействию не только с антигеном белковой природы (овальбумин), но и с ЛПС ряда условно-патогенных энтеробактерий (табл. 1). Образующиеся при этом ПРИГ связывались с ЛПС E. coli K235, S. minnesota и S. enteritidis намного активнее, чем нативные ИГ (в среднем их ЛПС-связывающая способность возрастала соответственно в 6.40, 2.56 и 7.91 раза). Этот факт имеет принципиальное значение, поскольку свидетельствует о возможности повышения активности АЭИ при помощи хаотропных реагентов и перспективе их использования в клинических условиях. Большой разброс показателей эффективности связывания ПРИГ с ЛПС различных энтеробактерий пока остается необъяснимым. Это можно было бы связать с существенными отличиями в молекулярной массе ЛПС этих энтеробактерий, а значит и со степенью их биологической активности (или токсичности), которая определяется общим и наиболее консервативным гидрофобным фрагментом молекулы ЛПС независимо от источника его происхождения. Кроме того, по данному вопросу не обнаружено убедительных литературных данных.
Таблица 1.
Показатели связывания нативных иммуноглобулинов класса G и полученных из них полиреактивно трансформированных иммуноглобулинов с ЛПС условно-патогенных грамотрицательных энтеробактерий и овальбумином (M ± m)
| Антиген | Нативные иммуноглобулины класса G | Полиреактивно трансформированные иммуноглобулины |
|---|---|---|
| уровень связывания, усл. ед. | ||
| ЛПС E. coli K235 | 0.184 ± 0.02 | 1.178 ± 0.11* |
| ЛПС S. minnesota | 0.105 ± 0.01 | 0.269 ± 0.03* |
| ЛПС S. enteritidis | 0.151 ± 0.04 | 1.195 ± 0.09* |
| Овальбумин | 0.100 ± 0.02 | 0.925 ± 0.07* |
Наиболее вероятным механизмом предполагаемого протективного действия ПРИГ при сепсисе, обусловленном грамотрицательной микрофлорой и/или ЭА кишечного происхождения, может быть блокирование взаимодействия ЛПС с ЛПС-распознающими рецепторными структурами эффекторных клеток, к которым в первую очередь относится TLR4 − основной клеточный рецептор системы врожденного иммунитета. В связи с этим на следующем этапе исследований методом проточной лазерной цитофлуориметрии было изучено влияние ПРИГ на ЛПС-связывающий потенциал гранулоцитов и моноцитов периферической крови 50 здоровых людей (табл. 2). При этом за 100% принимали уровень связывания флуоресцентно меченого ЛПС с ЛПС-связывающими рецепторами в контроле, когда в инкубационной среде отсутствовали как нативные ИГ, так и ПРИГ (рис. 1).
Таблица 2.
Влияние полиреактивно трансформированных иммуноглобулинов на взаимодействие флуоресцентно меченого ЛПС с ЛПС-связывающими рецепторами гранулоцитов и моноцитов периферической крови здоровых людей (M ± m)
| Условия проведения эксперимента | ЛПС-связывающий потенциал, усл. ед. | |
|---|---|---|
| гранулоциты | моноциты | |
| В присутствии нативных иммуноглобулинов класса G, n = 50 | 0.83 ± 0.06 | 0.90 ± 0.08 |
| р < 0.001 | р < 0.001 | |
| В присутствии полиреактивно трансформированных иммуноглобулинов, n = 50 | 0.70 ± 0.04 | 0.68 ± 0.06 |
| р < 0.001 | р < 0.001 | |
| р1 < 0.001 | р1 < 0.001 | |
| Только инкубационная среда (контроль), n = 50 | 1.12 ± 0.07 | 1.36 ± 0.07 |
Рис. 1.
Сравнительная характеристика изменений ЛПС-связывающего потенциала гранулоцитов и моноцитов периферической крови здоровых людей в присутствии нативных иммуноглобулинов класса G (а) и полиреактивно трансформированных иммуноглобулинов (б). Контроль − инкубационная среда, не содержащая нативных или полиреактивно трансформированных иммуноглобулинов (в).
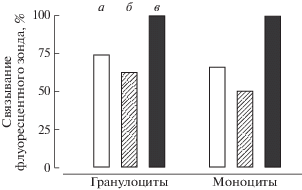
Результаты выполненных экспериментов убедительно демонстрируют способность ПРИГ достоверно (p < 0.001) снижать уровень связывания флуоресцентно меченого ЛПС как с гранулоцитами, так и с моноцитами здоровых людей. Представляется возможным полагать, что взаимодействие ПРИГ с ЛПС ведет к формированию стерических препятствий, которые осложняют последующее связывание ЛПС с ЛПС-связывающими клеточными рецепторами. Это означает, что нативные ИГ, подвергнутые in vitro кратковременному воздействию хаотропных агентов, потенциально способны предотвращать чрезмерную ЛПС-зависимую активацию эффекторных клеток, тем самым снижая избыточную продукцию провоспалительных медиаторов и риск развития неконтролируемого системного воспалительного ответа.
Основные результаты изучения различных аспектов феномена полиреактивной трансформации нативных ИГ были получены с использованием пулированной сыворотки крови здоровых людей. Между тем структурно-функциональный репертуар молекул антител у каждого отдельно взятого человека может существенно варьировать, что, в первую очередь, определяется различиями антиген-связывающих центров иммуноглобулинов, образующихся при адаптивном иммунном ответе на антигенную нагрузку [25]. В следующей серии экспериментов нами было проведено сравнительное изучение ЛПС-связывающих свойств ПРИГ, которые образуются при воздействии хаотропного реагента на нативные ИГ, выделенные из индивидуальных образцов сыворотки крови 30 здоровых людей, а также 30 больных ХТКН с высоким риском развития сепсиса.
Установлено, что нативные ИГ больных ХТКН в меньшей степени подвержены полиреактивной трансформации в присутствии 3.5 М тиоцианата калия по сравнению с нативными ИГ здоровых людей (рис. 2). При этом уровень связывания таких ПРИГ с ЛПС E. coli K235, S. minnesota и S. enteritidis был достоверно ниже (p < 0.001) по сравнению с ПРИГ, образующимися при полиреактивной трансформации нативных ИГ здоровых людей (в среднем ниже соответственно на 16.5, 37.2 и 25.2%). Вероятнее всего, это является одним из следствий сопровождающей ХТКН хронической ЭА, для которой характерен дефицит ИГ не только к гидрофобной структуре молекулы ЛПС, но и предположительно других ИГ [8].
Рис. 2.
Основные статистические показатели взаимодействия нативных иммуноглобулинов класса G (А) и полиреактивно трансформированных иммуноглобулинов (Б) с ЛПС различных энтеробактерий для здоровых людей (а) и больных ХТКН (б). На диаграмме размаха (box-and-whiskers diagram) представлены среднее значение, верхний и нижний квартили, минимальное и максимальное значение выборки.
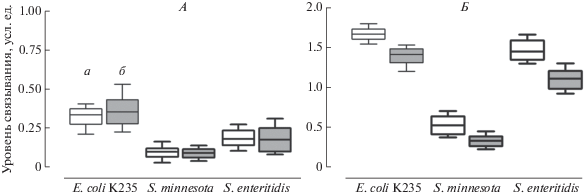
На сегодняшний день нет единого мнения о механизмах, лежащих в основе полиреактивной трансформации ИГ. Предполагается, что во внутридоменной структуре антигенсвязывающих центров γ-глобулинов могут присутствовать полиспецифичные “предковые” сайты связывания, которые содержат богатые лейцином повторы (Leucine-Rich Repeats, LRR) [26]. В рамках этой гипотезы вероятность существования “предковых” сайтов связывания с высококонсервативными структурами молекулы ЛПС должна быть крайне велика, поскольку продолжительность присутствия на нашей планете сине-зеленых водорослей как основного источника ЛПС в окружающей среде, исчисляется миллиардами лет [27]. Хаотропные реагенты нарушают упорядоченную структуру водородных связей в водном окружении молекул γ-глобулинов, что сопровождается ослаблением гидрофобных связей между VL- и VH-доменами и доменными структурами L- и Н-цепей. Это, в свою очередь, благоприятствует образованию метастабильных конформеров γ-глобулинов, в которых “предковые” сайты полиспецифичного связывания транслоцируются на поверхность Fab-фрагментов, определяя появление низкоаффинной комплементарности по отношению к структурно неродственным антигенам [26].
ЗАКЛЮЧЕНИЕ
Проведенное исследование свидетельствует о принципиальном важном факте – кратковременное воздействие in vitro хаотропного реагента на нативные иммуноглобулины класса G способно достоверно повышать активность АЭИ и обуславливать снижение способности эффекторных клеток связывать ЛПС, а значит, и уменьшать ЛПС-зависимую активацию этих клеток и последующий синтез медиаторов воспаления. Это может быть крайне полезно не только для лечения септических больных, но и для профилактики прогрессирования болезней атеросклеротической природы, поскольку роль ЛПС как важнейшего причинного фактора в индукции атерогенеза трудно переоценить [15, 28 ] . Механизм полиреактивной трансформации нативных иммуноглобулинов класса G под воздействием хаотропного реагента пока остается неизвестным. Предположительно он может заключаться в индукции внутримолекулярных конформационных перестроек нативных γ-глобулинов, в результате которых на Fab-фрагментах появляются “предковые” сайты низкоаффинного полиспецифичного связывания, что и определяет возникновение комплементарности к эволюционно устойчивым молекулярным структурам патогенов. Дальнейшее изучение механизмов полиреактивной трансформации нативных иммуноглобулинов класса G и поиск нетоксичных хаотропных агентов, которые потенциально могут быть использованы в клинической практике, являются основной целью предстоящих исследований.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 года и ее последующих дополнениях, и одобрены локальным биоэтическим комитетом Крымского федерального университета им. В.И. Вернадского (Симферополь).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при финансовой поддержке сторонних организаций.
Благодарности. Авторы выражают благодарность сотрудникам Центральной научно-исследовательской лаборатории Крымского федерального университета им. В.И. Вернадского (Симферополь).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Taylor T.N., Lacey R.L., Janelle C.A. The influence of the microbiota on immune development, chronic inflammation, and cancer in the context of aging // Microdial Cell. 2019. V. 6. № 8. P. 324.
Быков А.Т., Шапошников А.В., Маляренко Т.Н. Микробиота кишечника: вклад в здоровье и профилактику заболеваний человека // Медицинский журнал. 2016. № 4. С. 16.
Кузнецова Э.Э., Горохова В.Г., Богородская С.Л. Микробиота кишечника. Роль в развитии различных патологий // Клиническая лабораторная диагностика. 2016. Т. 61. № 10. С. 723.
Sansonetti P.J. Host-bacteria homeostasis in the healthy and inflamed gut // Curr. Opin. Gastroenterol. 2008. V. 24. № 4. P. 435.
Rastall R.A. Bacteria in the gut: friends and foes and how to alter the balance // J. Nutr. 2004. V. 134. № 8 (Suppl.). P. 2022.
Rhee S.H. Lipopolysaccharide: basic biochemistry, intracellular signaling, and physiological impacts in the gut // Intest. Res. 2014. V. 12. № 2. P. 90.
de Punder K., Pruimboom L. Stress induces endotoxemia and low-grade inflammation by increasing barrier permeability // Front. Immunol. 2015. V. 6. № 223. P. 1.
Яковлев М.Ю. Кишечный эндотоксин и воспаление. Дерматовенерология. Национальное руководство. Краткое издание. М.: ГЭОТАР-Медиа, 2013. С. 70.
Зулкарнаев А.Б., Крстич М., Ватазин А.В., Губарев К.К. Современный этиопатогенетический подход к лечению гнойно-септических осложнений после трансплантации почки // Медицинский альманах. 2013. № 5. С. 161.
Гордиенко А.И., Белоглазов В.А., Кубышкин А.В. и др. Дисбаланс гуморального звена антиэндотоксинового иммунитета как вероятный фактор патогенеза аутоиммунных заболеваний // Физиология человека. 2019. Т. 45. № 3. С. 123. Gordienko A.I., Beloglazov V.A., Kubyshkin A.V. et al. Humoral Anti-Endotoxin Immunity Imbalance as a Probable Factor in the Pathogenesis of Autoimmune Diseases // Human Physiology. 2019. V. 45. № 3. P. 337.
Окороков П.Л., Аниховская И.А., Волков И.Э., Яковлев М.Ю. Кишечный эндотоксин в индукции сахарного диабета 1 типа // Физиология человека. 2011. Т. 37. № 2. С. 138. Okorokov P.L., Anikhovskaya I.A., Volkov I.E., Yakovlev M.Y. Intestinal Endotoxin as a Triger of Type 1 Diabetes Mellitus // Human Physiology. 2011. V. 37. № 2. P. 247.
Савельев В.С., Петухов В.А., Каралкин А.В. и др. Синдром кишечной недостаточности в ургентной абдоминальной хирургии: новые методические подходы к лечению // Трудный пациент. 2005. № 4. С. 2.
Гордиенко А.И., Белоглазов В.А., Кубышкин А.В. Дисбаланс показателей гуморального антиэндотоксинового иммунитета и низкоинтенсивное воспаление при сахарном диабете 1 и 2 типа // Патологическая физиология и экспериментальная терапия. 2016. Т. 60. № 3. С. 61. Gordienko A.I., Beloglazov V.A., Kubyshkin A.V. [Changes of humoral anti-endotoxin immunity and low-intensity inflammation in diabetes mellitus type 1 and 2] // Patol. Fiziol. Eksp. Ter. 2016. V. 60. № 3. P. 61.
Окороков П.Л., Аниховская И.А., Яковлева М.М и др. Алиментарный фактор как вероятный индуктор воспаления или липидный компонент механизма транспорта кишечного эндотоксина // Физиология человека. 2012. Т. 38. № 6. С. 105. Okorokov P.L., Anikhovskaya I.A., Yakovleva M.M. et al. Nutritional factors of inflammation induction or lipid mechanism of endotoxin transport // Human Physiology. 2012. V. 38. № 6. P. 649.
Покусаева Д.П., Аниховская И.А., Коробкова Л.А. и др. Прогностическая значимость показателей системной эндотоксинемии в атерогенезе // Физиология человека. 2019. Т. 45. № 5. С. 99. Pokusaeva D.P., Anikhovskaya I.A., Korobkova L.A. et al. Prognostic importance of systemic endotoxinemia indicators in atherogenesis // Human Physiology. 2019. V. 45. № 5. P. 543.
Чернихова Е.А., Аниховская И.А., Гатауллин Ю.К. и др. Энтеросорбция как важное средство устранения хронической эндотоксиновой агрессии // Физиология человека. 2007. Т. 33. № 3. С. 135. Chernikhova E.A., Anikhovskaya I.A., Gataullin Yu.K. et al. Enterosorption as an approach to the elimination of chronic endotoxin aggression // Human Physiology. 2007. V. 33. № 3. P. 373.
Tani T., Shimizu T., Tani M. et al. Anti-endotoxin properties of polymyxin B-immobilized fibers // Adv. Exp. Med. Biol. 2019. № 1145. P. 321.
Cross A.S. Anti-endotoxin vaccines: back to the future // Virulence. 2014. V. 5. № 1. P. 219.
Бобровник С.А. Активация “молчащих” антител и их взаимодействие с антигенами // Укр. биохим. журн. 1990. Т. 62. № 5. С. 86.
Бобровник С.А., Лященко К.П., Комиссаренко С.В. Полиспецифичные антитела и их активация // До-кл. АН УССР. 1990. № 6. С. 71.
Остерман Л.А. Хроматография белков и нуклеиновых кислот. М.: Наука, 1985. 536 с.
Bradford M.M. An A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Analytical biochemistry. 1976. V. 72. P. 248.
Гордиенко А.И. Новый подход к повышению специфичности определения антител к липополисахаридам грамотрицательных бактерий методом твердофазного иммуноферментного анализа // Укр. біохім. журн. 2004. Т. 76. № 6. С. 130. Gordienko A.I. [New approach to an increase in specificity of determination of antibodies to lipopolysaccharides of gram-negative bacteria by solid-phase enzyme-linked immunosorbent assay] // Ukr. Biokhim. Zh. 2004. V. 76. № 6. P. 130.
Гордиенко А.И. Улучшенный метод получения флуоресцентного зонда для определения липополисахарид-связывающих рецепторов методом проточной лазерной цитофлуориметрии // Таврический медико-биологический вестник. 2007. Т. 10. № 4. С. 156.
Jolles S., Sewell W.A.C., Misbah S.A. Clinical uses of intravenous immunoglobulin // Clin. Exp. Immunol. 2005. V. 142. № 1. P. 1.
Bouvet J.P., Dighiero G. Polyreactivity is not an artifact // J. Immunol. Methods. 2001. V. 254. № 1–2. P. 199.
Hamilton T.L., Bryant D.A., Macalady J.L. The role of biology in planetary evolution: cyanobacterial primary production in low-oxygen Proterozoic oceans // Environ. Microbiol. 2016. V. 18. № 2. P. 325.
Аниховская И.А., Кубатиев А.А., Яковлев М.Ю. Эндотоксиновая теория атеросклероза // Физиология человека. 2015. Т. 41. № 1. С. 106. Anikhovskaya I.A., Kubatiev A.A., Yakovlev M.Y. Endotoxin theory of atherosclerosis // Human Physiology. 2015. V. 41. № 1. P. 89.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


