Физиология человека, 2020, T. 46, № 6, стр. 50-59
Структурные особенности таламо-кортикальной системы и спектральные характеристики альфа-ритма у психически здоровых людей и больных шизофренией
В. О. Манюхина 1, *, А. С. Томышев 1, В. Г. Каледа 1, И. С. Лебедева 1
1 ФГБНУ Научный центр психического здоровья
Москвa, Россия
* E-mail: mvo96@inbox.ru
Поступила в редакцию 27.11.2019
После доработки 23.03.2020
Принята к публикации 19.05.2020
Аннотация
Известные данные об анатомо-морфологических аномалиях таламо-кортикальной системы (ТКС) и нарушениях ее функционирования при шизофрении неполны и противоречивы. Для исследования данной системы были обследованы группы из 23 мужчин с юношеской приступообразной шизофренией и 30 подобранных по возрасту психически здоровых мужчин с применением структурной (сМРТ), диффузионно-взвешенной магнитно-резонансной томографии (ДВ-МРТ) и ЭЭГ. По сравнению с контролем, у больных выявлены структурные аномалии (в передней (ПТЛ) и задней (ЗТЛ) таламических лучистостях, ряде теменно-затылочных областей коры, таламусе) и снижение спектральной мощности (СМ) α-ритма в поддиапазоне 11–12.5 Гц. Толщина серого вещества в медиальной части префронтальной коры обратно коррелировала c отклонениями структурных показателей в таламусе и ПТЛ (все в правом полушарии). Полученные результаты подтверждают наличие распределенных структурных аномалий ТКС на начальных этапах шизофрении.
Шизофрения является одним из наиболее распространенных хронических психических заболеваний, патогенез которого остается до конца не известным. Одной из распространенных гипотез является предположение о нарушениях функциональной интеграции и взаимосвязей распределенных мозговых сетей [1], к числу важнейших из которых относится таламо-кортикальная система (ТКС) головного мозга.
Важная роль ТКС в патогенезе шизофрении основывается на представлении о роли таламуса как релейной структуры, которая принимает участие в передаче и обработке информации между корой больших полушарий и подкорковыми структурами [2], а также в обеспечении кортико-кортикальных взаимодействий [3]. Особое значение для реализации когнитивных функций, таких как обучение, принятие решений, зрительное восприятие, имеет ассоциативная часть ТКС [4, 5]. Ее компонентами являются медиодорсальные ядра и ядра подушки таламуса, связанные с ними префронтальные, цингулярные и задние теменные области ассоциативной коры, а также два основных тракта, посредством которых обеспечивается это взаимодействие – передняя (ПТЛ) и задняя (ЗТЛ) таламические лучистости. Методами нейровизуализации у больных шизофренией ранее были выявлены выраженные изменения в ассоциативной части ТКС: изменения микроструктурных показателей ПТЛ и ЗТЛ [6–11], толщины ряда областей коры больших полушарий [7, 9–11], средней диффузии (СД) и объема таламуса [9, 12].
Для некоторых из описанных структурных нарушений ассоциативной части ТКС были обнаружены корреляции с измененными показателями функциональной активности мозга пациентов (например, с α-ритмом [13, 14]), что свидетельствует о важной роли структурной дезорганизации в функциональных проявлениях и о возможной роли этих областей как одних из генераторов данного ритма.
В целом, работы, в которых одновременно исследуются структурные показатели ТKС и электрофизиологические характеристики мозга человека, немногочисленны, а мультимодальные МРТ-исследования представлены лишь несколькими публикациями [15, 16].
Как следствие, целью данного исследования стало выявление структурных особенностей ТКС и анализ их корреляций с характеристиками α-ритма у здоровых людей и пациентов с шизофренией.
Основываясь на предыдущих исследованиях лаборатории и работах других авторов [6–10], мы предположили, что в данной работе будет выявлена структурная патология в первую очередь в ПТЛ и префронтальных областях коры. Задачами исследования было выявление межгрупповых различий по исследованным показателям ассоциативной части ТКС: коры (толщина), таламо-кортикальных трактов (ПТЛ и ЗТЛ: фракционная анизотропия (ФА), аксиальная диффузия (АД), радиальная диффузия (РД)), таламуса (объем, СД) и ЭЭГ (спектральная мощность (СМ) отдельных поддиапазонов α-ритма), а также анализ корреляций между теми показателями, которые были выявлены по результатам межгрупповых сравнений.
МЕТОДИКА
В исследовании принимали участие 23 праворуких пациента мужского пола (в возрасте 16.4–28.8 лет, 22.9 ± 3.4 года), госпитализированных в клинику ФГБНУ Научный центр психического здоровья (г. Москвa) на раннем этапе развития эндогенного заболевания (не более 5-ти лет с момента манифестации) с диагнозом юношеской приступообразной шизофрении (F20 по МКБ-10), перенесшие первый или повторный манифестные состояния в рамках указанной нозологии. Обследование проводили на этапе становления ремиссии или в ремиссии. Выраженность психопатологических расстройств оценивали по шкале PANSS (суммарная оценка позитивных симптомов составляла 11.1 ± 2.7, негативных симптомов: 19.1 ± 5.1, суммарный балл по всей шкале – 60.5 ± ± 11.8). Все больные получали индивидуально подобранную медикаментозную терапию. Группу контроля составили 30 подобранных по полу и возрасту здоровых добровольцев правшей (в возрасте 17.7–27 лет, 22.2 ± 2.7 года; межгрупповые различия по возрасту отсутствовали, t = 0.75, p = 0.46).
Критериями исключения при отборе испытуемых были соматические заболевания в состоянии обострения, наркотическая или алкогольная зависимость, тяжелые нейроинфекционные заболевания или черепно-мозговые травмы с потерей сознания более 5 мин в анамнезе, леворукость.
Регистрация фоновой ЭЭГ. Регистрацию фоновой ЭЭГ проводили на аппаратно-программном комплексе топографического картирования биопотенциалов мозга (NeuroKM, НМФ “Статокин”, Россия), обработку осуществляли с помощью программы Brainsys (“Нейрометрикс”, Россия). Биоэлектрическую активность регистрировали в 16 отведениях (система 10–20), с референтным объединенным ушным электродом. Полоса пропускания составляла 0.3–70 Гц (с последующей off-line фильтрацией 1.6–30 Гц), частота оцифровки 500 Гц. Регистрацию осуществляли в течение двух минут, участники находились в состоянии спокойного бодрствования с закрытыми глазами. В связи с поисковым характером нашего исследования, а также данными литературы о поликомпонентной структуре α-ритма с неоднозначностью частотных границ поддиапазонов (обсуждение, например, в [17, 18]), анализируемый диапазон был разделен на три субкомпонента с равными интервалами величиной 1.5 Гц (8–9.5 Гц (α1), 9.5–11 Гц (α2), 11–12.5 Гц (α3)). Анализ спектральной мощности α-ритма (8–13 Гц), а также выделенных субдиапазонов, проводили отдельно для 16 отведений, а также для 6 показателей, усредненных на основе анатомической локализации следующим образом: F3–F4, T3–F7–T5, T4–F8–T6, C3–Cz–C4, P3–Pz–P4, O1–O2.
Нейровизуализационное исследование. Исследование проводили на МР томографе Achieva 3.0 Тесла (Philips, Голландия) в отделении лучевой диагностики НИИ неотложной детской хирургии и травматологии (зав. отделением д.м.н., профессор Т.А. Ахадов).
Структурная МРТ. Для T1-взвешенного сканирования использовалась последовательность турбо-полевого эхо со следующими параметрами: TR 8.2, TE 3.7 мс, угол поворота 8 град (средний), поле обзора (FOV) 240 мм, размер воксела 0.83 × 0.83 с толщиной среза в 1.0 мм.
Т1-взвешенные изображения были обработаны в пакете FreeSurfer (версия 5.3.0, http://surfer.nmr.mgh.harvard.edu/) для получения детальных анатомических реконструкций каждого испытуемого. Использованные алгоритмы FreeSurfer включали, в том числе, устранение интенсивности поля подмагничивания, удаление немозговой ткани из изображений, присваивание анатомических меток (например, таламус, гиппокамп, желудочки и т.д.) каждому вокселу [19]. Далее были реконструированы модели кортикальных поверхностей и определены показатели толщины коры с использованием алгоритмов, описанных в [20].
В результате, для каждого испытуемого были получены показатели объема правого и левого таламуса, а также толщины серого вещества по всей коре головного мозга. Далее была проведена сегментация коры на зоны функциональных сетей согласно атласу B.T.T. Yeo et al. [21]. Атлас B.T.T. Yeo выбрали ввиду его функциональной значимости и базирования на данных большого количества испытуемых. Из всех полученных областей были выбраны префронтальные и теменные зоны коры, которые, согласно данным литературы [5, 22], структурно связаны с ПТЛ и ЗТЛ.
Диффузионно-взвешенная МРТ. Диффузионно-взвешенные изображения были получены с использованием эхо-планарной импульсной последовательности: TR = 6657–7212 мс, TE = 70 мс, угол поворота 90°, матрица 144/144, поле обзора 240 мм, размер вокселa 1.7 × 1.7 × 2 мм, межсрезовое расстояние 0. Диффузионные градиенты были приложены в 32 неколлинеарных направлениях с фактором диффузии b = 800 с/мм2 и в одном направлении с фактором диффузии b = 0.
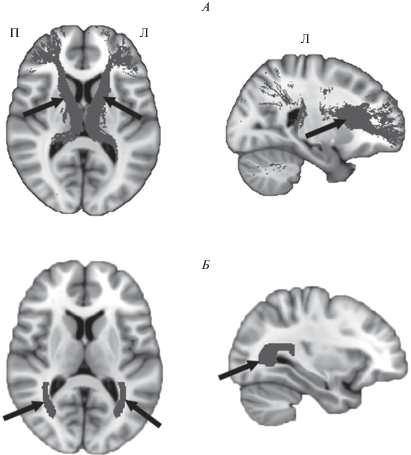
Обработку изображений проводили с использованием пакета TBSS [23], компонента программного обеспечения FSL 5.0 (http://www.fmrib.ox.ac.uk/fsl). Для каждого участника проводили реконструкцию таламо-кортикальных трактов: передней таламической лучистости (ПТЛ; атлас JHU White-Matter Tractography) и задней таламической лучистости (ЗТЛ; атлас JHU ICBM-DTI-81 White-Matter Labels) (рис. 1). Также реконструировали правый и левый таламус (атлас Harvard-Oxford Subcortical Structural Atlas). На основе полученных анатомических масок трактов и таламуса получили усредненные значения коэффициентов фракционной анизотропии (ФА), радиальной (РД) и аксиальной (АД) диффузии по трактам и показателя средней диффузии (СД) в таламусе для каждого участника исследования.
Рис. 1.
Реконструкция передней (А) таламической лучистости (атлас JHU White-Matter Tractography) и задней (Б) таламической лучистости (атлас Harvard-Oxford Subcortical Structural Atlas) с помощью FSL. Тракты указаны стрелками. П – правое полушарие; Л – левое полушарие.
Статистический анализ. Статистический анализ проводили с помощью Python 2.7 (библиотека scipy). Межгрупповые сравнения проводили для показателей: 1) СД и объема таламуса; 2) ФА, АД, РД для ПТЛ и ЗТЛ; 3) толщины серого вещества коры в зонах проекции ПТЛ и ЗТЛ; 4) спектральной мощности α-ритма по 16 отведениям и по 6-ти усредненным показателям (для всего диапазона и отдельных поддиапазонов). Для анализа использовали U-критерий Манна-Уитни и t-критерий Стьюдента, распределения проверяли на нормальность с помощью теста Д’Агостино и Пирсона. Коррекцию на множественные сравнения осуществляли с помощью поправки Бонферрони. Корреляционный анализ проводили между значимо различающимися показателями таламуса, ПТЛ и ЗТЛ, толщиной коры в зонах проекции ПТЛ и ЗТЛ, а также СМ α-ритма. В связи с тем, что часть показателей не прошли проверку на нормальность распределения, для выявления корреляций использовали коэффициент ранговой корреляции Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Объем таламуса и СД таламуса. Межгрупповые различия были выявлены для показателя СД таламуса, как в правом, так и в левом полушарии. Данный показатель был повышен у пациентов по сравнению со здоровыми участниками (справа: U = 201.00, p = 0.005; слева: U = 263.00, p = 0.0006).
Величина СД используется, в том числе, для оценки плотности тканей и объема межклеточного пространства [24]. Хотя увеличение СД, найденное нами в таламусе, невозможно интерпретировать однозначно, некоторые авторы указывают на то, что рост СД отражает увеличение объема межклеточного пространства в сером веществе [25]. Также, ранее описана взаимосвязь увеличенной СД с редукцией числа нейронов и/или глии, а также с реорганизацией внеклеточного матрикса у пациентов с шизофренией [26]. Таким образом, полученные результаты указывают на вероятное увеличение объема межклеточного пространства как в правом, так и в левом таламусе, что может быть связано с текущим воспалительным процессом и реорганизацией на тканевом уровне.
Хотя ряд исследователей отмечают снижение объема таламуса у больных [9], в нашей работе снижения обнаружено не было, как и в некоторых других [12]. Отсутствие изменений данного морфологического показателя может быть связано с молодым возрастом пациентов, в то время как показатель СД таламуса, увеличенный у пациентов, является более чувствительным показателем тканевых изменений [12], и, вероятно, поэтому его изменения могут быть выявлены на более ранней стадии патогенеза.
Показатели диффузии таламо-кортикальных трактов. У больных был статистически значимо снижен показатель ФА (справа: t = 3.60, р = = 0.0007) и повышена РД (справа: U = 136.00, p = = 0.00005; слева: t = –2.30, p = 0.0005) в ПТЛ, а в левой ЗТЛ — снижена ФА (t = 2.84, p = 0.0065). Таким образом, как и ожидалось, наиболее выраженные микроструктурные изменения среди исследуемых трактов были обнаружены для ПТЛ (в обоих полушариях) и в меньшей степени для ЗТЛ (слева). Снижение ФА в ПТЛ также было показано в левом полушарии (t = 2.65, p = 0.01), однако данный результат не прошел коррекцию на множественность сравнений.
Исходя из имеющихся данных о физиологической природе изменений показателей диффузии [27, 28], обнаруженное в настоящей работе снижение ФА, совместно с увеличением РД и неизменной АД в ПТЛ, может являться маркером снижения структурированности тракта и патологии миелиновых оболочек. Полученный результат согласуется с существующими данными о нарушении миелинизации при шизофрении, полученными как с помощью методов нейровизуализации, так и на гистологических препаратах [28].
Аномалии ПТЛ у пациентов с шизофренией, а также у людей с ультравысоким риском развития психоза неоднократно выявлялись и в предыдущих работах [6, 8–10]. Однако увеличение показателя РД совместно с редукцией ФА хотя бы в одном полушарии выявлялось реже [6, 8]. Роль ПТЛ в патогенезе шизофрении связана с ее обширными проекциями в префронтальную кору – область, которая интегрирует сенсорную, моторную и аффективную информацию, участвует в формировании целенаправленного поведения и аномалии которой связаны, в том числе, с нарушением ряда исполнительных функций при шизофрении [22].
Изменения микроструктурных показателей ЗТЛ также были показаны ранее у пациентов с шизофренией [9, 10], однако, в отличие от этих исследований, в данной работе нарушения были обнаружены только в левом тракте. ЗТЛ участвует в обеспечении передачи зрительной информации от латеральных коленчатых ядер и ядер подушки таламуса в затылочную и ассоциативную часть теменной коры, обеспечивая поддержание ретинотопической организации и обработку зрительной информации [22]. Выявленные в нашей работе изменения характеристик диффузии для левой ЗТЛ, а также для ПТЛ (снижение ФА), указывают на возможное снижение числа аксонов или изменение пространственной структурированности трактов у больных по сравнению со здоровыми людьми [29].
Толщина коры в зонах проекции ПТЛ и ЗТЛ. У пациентов по сравнению с психически здоровым контролем обнаружили статистически значимое и прошедшее коррекцию на множественность сравнений снижение толщины коры в ряде областей, принимающих проекции как от ПТЛ (табл. 1 и рис. 2), так и от ЗТЛ (табл. 2 и рис. 3). Можно отметить, что наиболее выраженные изменения толщины коры у больных были выявлены в правом полушарии.
Таблица 1.
Толщина коры (мм) в зонах проекции ПТЛ с фрагментацией на зоны функциональных сетей (согласно атласу B.T.T. Yeo [21])
| Пол. | Область коры | Сеть (по B.T.T.Yeo [21]) |
Группа нормы (n = 30) |
Группа пациентов (n = 23) |
Тест | p |
|---|---|---|---|---|---|---|
| Л | (1) Латеральная ПФК | В. В. | 2.10 ± 0.28 | 2.13 ± 0.25 | t = 0.43 | 0.66 |
| (2) Дорсальная ПФК | Ф.-П. К. | 2.53 ± 0.21 | 2.39 ± 0.31 | U = 248.50 | 0.04 | |
| (3) Латеральная ПФК | 2.34 ± 0.12 | 2.26 ± 0.10 | t = 2.42 | 0.02 | ||
| (4) Вентральная ПФК | 3.19 ± 0.32 | 3.01 ± 0.25 | t = 2.18 | 0.03 | ||
| (5) Медиальная ПФК | 2.88 ± 0.33 | 2.74 ± 0.29 | t = 1.59 | 0.12 | ||
| (6) ПФК | П. Р. | 2.74 ± 0.13 | 2.62 ± 0.12 | t = 3.56 | 0.0008** | |
| (7) ОФК | Л. | 2.66 ± 0.12 | 2.55 ± 0.09 | t =3.63 | 0.0006** | |
| П | (1) Латеральная ПФК | В. В. | 2.21 ± 0.32 | 2.05 ± 0.20 | t = 2.07 | 0.04 |
| (2) Вентральная ПФК | 2.83 ± 0.36 | 2.52 ± 0.36 | t = 3.12 | 0.03 | ||
| (3) Латеральная ПФК | Ф.-П. К. | 2.49 ± 0.12 | 2.33 ± 0.10 | t = 4.94 | 0.000009** | |
| (4) Вентральная ПФК | 3.05 ± 0.26 | 2.79 ± 0.23 | t = 3.79 | 0.0004** | ||
| (5) Медиальная ПФК | 3.00 ± 0.26 | 2.81 ± 0.23 | U = 195.50 | 0.004** | ||
| (6) Вентральная ПФК | П. Р. | 3.03 ± 0.15 | 2.77 ± 0.18 | t = 5.70 | 0.0000007** | |
| (7) Медиальная ПФК | 2.77 ± 0.14 | 2.63 ± 0.13 | t = 3.60 | 0.0007** | ||
| (8) ОФК | Л. | 2.65 ± 0.14 | 2.54 ± 0.13 | t = 3.00 | 0.004** |
Примечание: Пол. – полушарие, Л – левое, П – правое. ПФК – префронтальная кора, ОФК – орбитофронтальная кора. В. В. – вентральная сеть внимания; Ф.-П. К. – фронто-париетальная сеть контроля; П. Р. – сеть пассивного режима; Л. – лимбическая сеть. ** – результат проходит коррекцию на множественность сравнений.
Таблица 2.
Толщина коры в зонах проекции ЗТЛ (мм) с фрагментацией на зоны функциональных сетей (согласно атласу B.T.T. Yeo [21]) в группах здоровых людей и пациентов с шизофренией
| Пол. | Область коры | Сеть (по B.T.T.Yeo [21]) |
Группа нормы (n = 30) |
Группа пациентов (n = 23) |
Тест | p |
|---|---|---|---|---|---|---|
| Л | (1) Зрительная | З. | 2.13 ± 0.08 | 2.05 ± 0.11 | t = 2.98 | 0.004** |
| (2) Теменно-затылочная | Д. В. | 2.37 ± 0.08 | 2.27 ± 0.14 | t = 2.99 | 0.004** | |
| (3) Теменная | В. В. | 2.65 ± 0.20 | 2.56 ± 0.20 | t = 1.58 | 0.12 | |
| (4) Височно-затылочная | 2.71 ± 0.30 | 2.66 ± 0.29 | t = 0.67 | 0.50 | ||
| (5) Теменная | Ф.-П. К. | 2.34 ± 0.11 | 2.27 ± 0.17 | t = 1.88 | 0.07 | |
| (6) Прекунеус | 2.26 ± 0.21 | 2.12 ± 0.21 | t = 2.41 | 0.02 | ||
| (7) Теменная | П. Р. | 2.58 ± 0.11 | 2.51 ± 0.14 | U = 246.00 | 0.04 | |
| (8) Задняя поясная | 2.72 ± 0.11 | 2.61 ± 0.16 | t = 3.10 | 0.003** | ||
| П | (1) Зрительная | З. | 2.16 ± 0.07 | 2.08 ± 0.10 | t = 3.55 | 0.0008** |
| (2) Теменно-затылочная | Д. В. | 2.35 ± 0.09 | 2.26 ± 0.10 | t = 3.61 | 0.0007** | |
| (3) Височно-затылочно-теменная | В. В. | 2.75 ± 0.14 | 2.63 ± 0.16 | U = 198.00 | 0.004** | |
| (4) Теменная | Ф.-П. К. | 2.40 ± 0.11 | 2.30 ± 0.12 | t = 2.90 | 0.006 | |
| (5) Прекунеус | 2.19 ± 0.26 | 2.04 ± 0.19 | t = 2.27 | 0.027 | ||
| (6) Теменная | П. Р. | 2.54 ± 0.21 | 2.44 ± 0.14 | t = 2.03 | 0.05 | |
| (7) Задняя поясная | 2.71 ± 0.15 | 2.58 ± 0.11 | t = 3.45 | 0.001* |
Примечание: З – зрительная сеть; Д. В. – дорсальная сеть внимания. Остальные обозначения см. табл. 1.
Снижение толщины серого вещества в лобных и теменно-затылочных областях коры, принимающих проекции ПТЛ и ЗТЛ, было показано ранее во многих работах у пациентов с шизофренией [9, 10], в том числе, в ранее проведенных нами исследованиях [7, 11]. Особое место в таких исследованиях уделено префронтальной коре, изменения которой наиболее обширны при данном заболевании. Помимо нее, также отмечают ключевую роль нижней теменной коры в патогенезе заболевания [9], в которую, как было отмечено выше, приходит зрительная информация через ПТЛ [22]. Снижение толщины серого вещества в этих областях коры наблюдается в процессе течения шизофрении и связывается с факторами, относящимися к болезни, однако такое снижение не всегда напрямую ассоциировано с клиническими проявлениями или нарушением когнитивного и социального функционирования [30, 31].
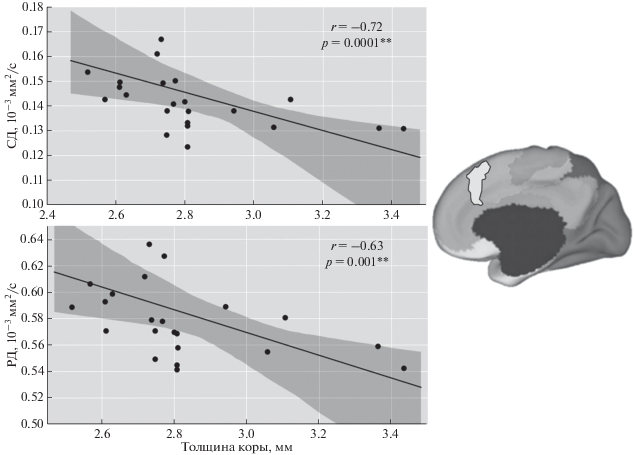
Корреляционный анализ структурных показателей. В группе пациентов, но не у здоровых испытуемых, толщина медиальной части префронтальной коры обратно коррелировала с выявленными нами измененными показателями: со СД в таламусе (r = –0.72, p = 0.0001) и с РД в ПТЛ (r = = –0.63, p = 0.0013). Все показано для правого полушария (рис. 4).
Рис. 4.
Корреляции измененных показателей (СД в правом таламусе и РД в ПТЛ) и толщины серого вещества медиальной части префронтальной коры (выделена справа) в правом полушарии. ** – результаты проходят коррекцию на множественность сравнений.
Срединная часть медиальной префронтальной коры, для которой были выявлены указанные корреляции с двумя измененными показателями в правом полушарии (рис. 2), согласно [21], относится к фронто-париетальной сети контроля, участвующей в обеспечении когнитивного контроля и принятия решений [32]. Обнаруженное сопряжение структурной патологии различных отделов ТКС при шизофрении только в правом полушарии было показано впервые, и причина подобной латеральности станет предметом дальнейших исследований.
Кроме того, обнаруженный в настоящем исследовании в группе шизофрении паттерн (отрицательная корреляция показателя РД в ПТЛ и толщины серого вещества в области префронтальной коры) противоположен паттерну, показанному на большой выборке здоровых испытуемых [33], что косвенно свидетельствует о потенциальной значимости подобных взаимосвязей в патогенезе заболевания.
Сравнение спектральной мощности α-ритма и ее корреляции. В настоящем исследовании статистически значимых различий СМ всего диапазона α-ритма между исследуемыми группами не обнаружено. Однако было показано снижение СМ поддиапазона 11–12.5 Гц у больных по сравнению с психически здоровым контролем в усредненных теменных (P; U = 200, p = 0.005) и в левых височных (F7–T3–T5; U = 120, p = 0.0004) отведениях. Корреляций между спектральной мощностью α-ритма и измененными структурными показателями в обеих исследуемых группах также показано не было.
В отличие от результатов представленного исследования, в ряде других исследований была выявлена редукция СМ α-ритма у пациентов с шизофренией [34–36]. Такое расхождение может быть связано с рядом факторов, среди которых молодой возраст и относительно небольшая длительность заболевания пациентов в нашей работе. Локализация же сниженной α-активности широко варьирует: исследователи отмечают как повсеместную редукцию СМ в α-диапазоне [36], так и отдельно в лобных или затылочных отведениях [34], а также, подобно показанному в нашем исследовании, в теменной области [35].
Что касается корреляций α-активности со структурными характеристиками ТКС, такими как толщина и объем серого вещества коры, ФА в ПТЛ и ЗТЛ, то их обнаруживают сравнительно редко [13, 14], а общее число исследований, оценивающих наличие нейроанатомических коррелятов ритмов ЭЭГ, невелико даже для здоровых людей [14].
Корреляционный анализ с балльной оценкой шкалы PANSS. По результатам настоящего исследования, корреляций между выраженностью психопатологических расстройств, оцененной по шкале PANSS, и измененными структурными и функциональными показателями обнаружено не было.
В отдельных исследованиях были выявлены корреляции некоторых структурных изменений ТКС (толщины коры [37]) и α-ритма [36] с суммарной оценкой позитивных и негативных синдромов. В то же время, в других работах, как и в настоящей работе, для аналогичных структурных показателей таких корреляций показано не было [34, 38]. Одним из возможных объяснений является то, что психопатологические проявления могут быть ассоциированы с целым комплексом связанных структурных и функциональных нарушений, нежели с отдельными структурными нарушениями серого вещества или проводящих путей головного мозга.
В целом, полученные нами результаты подтверждают наличие распределенных структурных аномалий таламо-кортикальной системы при шизофрении. Наиболее выраженные изменения в микроструктуре белого вещества наблюдались в передней таламической лучистости. При этом профиль обнаруженных отклонений диффузионных показателей может являться маркером патологии миелиновых оболочек, что согласуется с существующими данными о нарушении миелинизации при шизофрении. Что касается серого вещества, то наиболее существенные структурные аномалии были выявлены в префронтальной коре, включая области, принимающие проекции передней таламической лучистости. Более того, обнаруженные корреляции между структурными аномалиями могут свидетельствовать о сопряжении патологических процессов, затрагивающих белое и серое вещество ТКС при шизофрении. Отсутствие межгрупповых различий в показателях спектральной мощности всего α-диапазона может быть связано с молодым возрастом и относительно небольшой длительностью заболевания у пациентов в исследуемой выборке.
ВЫВОДЫ
1. Структурные изменения таламо-кортикальной системы у пациентов с шизофренией затронули таламус, переднюю и заднюю таламические лучистости, а также области их проекций в префронтальной, теменной и затылочной коре.
2. В группе шизофрении были обнаружены отрицательные корреляции между толщиной серого вещества в медиальной части префронтальной коры и 1) показателем средней диффузии в таламусе в правом полушарии; 2) показателем радиальной диффузии в правой передней таламической лучистости. Роль этого паттерна взаимосвязанных аномалий нейроархитектуры головного мозга относительно психопатологических проявлений, когнитивного и социального функционирования станет предметом дальнейших исследований.
3. Было выявлено снижение спектральной мощности высокочастотного поддиапазона α-ритма 11–12.5 Гц в группе шизофрении. Межгрупповых различий всего α-диапазона, также как и корреляций сниженной мощности в указанном поддиапазоне с измененными структурными показателями, обнаружено не было.
4. Выраженность психопатологической симптоматики не коррелировала с выявленными изменениями структурных и функциональных показателей.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным Этическим комитетом Научного центра психического здоровья (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование было частично поддержано РФФИ (грант № 18-013-01214).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Friston K.J. The disconnection hypothesis // Schizophr. Res. 1998. V. 30. № 2. P. 115.
Anticevic A. Understanding the role of thalamic circuits in schizophrenia neuropathology // Schizophr. Res. 2017. V. 180. P. 1.
Guo K., Yamawaki N., Barrett J.M. et al. Cortico-thalamo-cortical circuits of mouse forelimb S1 are organized primarily as recurrent loops // J. Neurosci. 2020. V. 40. № 14. P. 2849.
Mitchell A.S. The mediodorsal thalamus as a higher order thalamic relay nucleus important for learning and decision-making // Neurosci. Biobehav. Rev. 2015. V. 54. P. 76.
Benarroch E.E. Pulvinar: Associative role in cortical function and clinical correlations // Neurology. 2015. V. 84. № 7. P. 738.
Томышев А.С., Лебедева И.С., Ахадов Т.А. и др. МРТ-исследование особенностей проводящих путей головного мозга у пациентов c ультравысоким риском развития эндогенных психозов // БЭБиМ. 2016. Т. 162. С. 417.
Лебедева И.С., Томышев А.С., Ахадов Т.А., Каледа В.Г. О корреляциях особенностей серого и белого вещества головного мозга при шизофрении (научная статья) // Психиатрия. 2017. Т. 75. № 3. С. 22.
Tomyshev A.S., Lebedeva I.S., Akhadov T.A. et al. Alterations in white matter microstructure and cortical thickness in individuals at ultra-high risk of psychosis: A multimodal tractography and surface-based morphometry study // Psychiatry Res. Neuroimaging. 2019. V. 289. P. 26.
Birur B., Kraguljac N.V., Shelton R.C., Lahti A.C. Brain structure, function, and neurochemistry in schizophrenia and bipolar disorder — a systematic review of the magnetic resonance neuroimaging literature // NPJ. Schizophrenia. 2017. V. 3. P. 15.
Parnanzone S., Serrone D., Rossetti M.D. et al. Alterations of cerebral white matter structure in psychosis and their clinical correlations: a systematic review of diffusion tensor imaging studies // Riv. Psychiatr. 2017. V. 52. № 2. P. 49.
Каледа В.Г., Божко О.В., Ахадов Т.А. и др. Нейроанатомические особенности головного мозга при юношеской приступообразной шизофрении: морфометрия серого вещества префронтальной коры и подкорковых структур // Журнал неврологии и психиатрии им. С.С. Корсакова. 2019. Т. 119. № 8. С. 7.
Spoletini I., Cherubini A., Banfi G. et al. Hippocampi, thalami, and accumbens microstructural damage in schizophrenia: A volumetry, diffusivity, and neuropsychological Study // Schizophr. Bull. 2011. V. 37. № 1. P. 118.
Bruder G.E., Bansal R., Tenke C.E. et al. Relationship of resting EEG with anatomical MRI measures in individuals at high and low risk for depression // Hum. Brain Mapp. 2011. V. 33. № 6. P. 1325.
Valdés-Hernández P.A, Ojeda-González A., Martínez-Montes E. et al. White matter architecture rather than cortical surface area correlates with the EEG alpha rhythm // NeuroImage. 2010. V. 49. № 3. P. 2328.
Wagner G., De la Cruz F., Schachtzabel C. et al. Structural and functional dysconnectivity of the fronto-thalamic system in schizophrenia: A DCM-DTI study // Cortex. 2015. V. 66. P. 35.
Marenco S., Stein J.L., Savostyanova A.A. et al. Investigation of anatomical thalamo-cortical connectivity and fMRI activation in schizophrenia // Neuropsychopharm. 2011. V. 37. № 2. P. 499.
Shackman A.J., McMenamin B.W., Maxwell J.S. et al. Identifying robust and sensitive frequency bands for interrogating neural oscillations // NeuroImage. 2010. V. 51. № 4. P. 1319.
Barzegaran E., Vildavski V.Y., Knyazeva M.G. Fine structure of posterior alpha rhythm in human EEG: frequency components, their cortical sources, and temporal behavior // Scientific Reports. 2017. V. 7. № 1. P. 1.
Fischl B., Salat D.H., Busa E. et al. Whole brain segmentation: automated labeling of neuroanatomical structures in the human brain // Neuron. 2002. V. 33. № 3. P. 341.
Fischl B., van der Kouwe A., Destrieux C. et al. Automatically parcellating the human cerebral cortex // Cerebral Cortex. 2004. V. 14. № 1. P. 11.
Yeo B.T.T., Krienen F.M., Sepulcre J. et al. The organization of the human cerebral cortex estimated by intrinsic functional connectivity // J. Neurophysiol. 2011. V. 106. № 3. P. 1125.
Aralasmak A., Ulmer J.L., Kocak M. et al. Association, commissural, and projection pathways and their functional deficit reported in literature // J. Comput. Ass. Tom. 2006. V. 30. № 5. P. 695.
Smith S.M., Jenkinson M., Johansen-Berg H. et al. Tract-based spatial statistics: Voxelwise analysis of multi-subject diffusion data // NeuroImage. 2006. V. 31. № 4. P. 1487.
Levitt J.J., Kubicki M., Nestor P.G. et al. A diffusion tensor imaging study of the anterior limb of the internal capsule in schizophrenia // Psychiatry Res. 2010. V. 184. № 3. P. 143.
Sykova E. Extrasynaptic volume transmission and diffusion parameters of the extracellular space // Neuroscience. 2004. V. 129. № 4. P. 861.
Rose S.E., Chalk J.B., Janke A.L. et al. Evidence of altered prefrontal–thalamic circuitry in schizophrenia: An optimized diffusion MRI study // Neuroimage. 2006. V. 32. № 1. P. 16.
Song S.-K., Yoshino J., Le T.Q. et al. Demyelination increases radial diffusivity in corpus callosum of mouse brain // Neuroimage. 2005. V. 26. № 1. P. 132.
Aung W.Y., Mar S., Benzinger T.L. Diffusion tensor MRI as a biomarker in axonal and myelin damage // Imaging Med. 2013. V. 5. № 5. P. 427.
Papadelis C., Ahtam B., Feldman H.A. et al. Altered white matter connectivity associated with intergyral brain disorganization in hemiplegic cerebral palsy // Neuroscience. 2018. V. 399. P. 146.
Алфимова М.В., Лебедева И.С., Томышев А.С. и др. Вербальная беглость на начальных этапах шизофрении: структурные и нейрофизиологические корреляты // Социальная и клиничеcкая психиатрия. 2016. Т. 26. № 4. С. 5.
Gao X., Zhang W., Yao L. et al. Association between structural and functional brain alterations in drug-free patients with schizophrenia: a multimodal meta-analysis // J. Psychiatry Neurosci. 2018. V. 43. № 2. P. 131.
Waskom M.L., Frank M.C., Wagner A.D. Adaptive engagement of cognitive control in context-dependent decision making // Cereb. Cortex. 2017. V. 27. № 2. P. 1270.
Tamnes C.K., Østby Y., Fjell A.M. et al. Brain maturation in adolescence and young adulthood: regional age-related changes in cortical thickness and white matter volume and microstructure // Cereb. Cortex. 2009. V. 20. № 3. P. 534.
Goldstein M.R., Peterson M.J., Sanguinetti J.L. et al. Topographic deficits in alpha-range resting EEG activity and steady state visual evoked responses in schizophrenia // Schizophr. Res. 2015. V. 168. № 1. P. 145.
Garakh Z., Zaytseva Y., Kapranova A. et al. EEG correlates of a mental arithmetic task in patients with first episode schizophrenia and schizoaffective disorder // Clinical Neurophys. 2015. V. 126. № 11. P. 2090.
Zeev-Wolf M., Levy J., Jahshan C. et al. MEG resting-state oscillations and their relationship to clinical symptoms in schizophrenia // NeuroImage: Clinical. 2018. V. 20. P. 753.
Xiao Y., Lui S., Deng W. et al. Altered Cortical Thickness Related to Clinical Severity But Not the Untreated Disease Duration in Schizophrenia // Schizophr. Bull. 2013. V. 41. № 1. P. 201.
Knöchel C., Reuter J., Reinke B. et al. Cortical thinning in bipolar disorder and schizophrenia // Schizophr. Res. 2016. V. 172. № 1. P. 78.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека