Физиология человека, 2020, T. 46, № 6, стр. 43-49
Количественная ЭЭГ в прогнозе эффективности комбинированной антидепрессивной терапии, включающей транскраниальную магнитную стимуляцию
Е. В. Изнак 1, *, А. Ф. Изнак 1, И. В. Олейчик 1
1 ФГБНУ Научный центр психического здоровья
Москва, Россия
* E-mail: ek_iznak@mail.ru
Поступила в редакцию 22.04.2020
После доработки 08.06.2020
Принята к публикации 01.08.2020
Аннотация
С целью поиска возможных ЭЭГ-предикторов эффективности комбинированной антидепрессивной терапии, включающей 3-х недельный курс высокочастотной ритмической транскраниальной магнитной стимуляции (рТМС) дорсолатеральной префронтальной коры (ДЛПФК) левого полушария, у 30 больных фармакорезистентной депрессией проанализировали корреляции между спектральными параметрами исходной ЭЭГ и количественными клиническими оценками состояния пациентов после курса терапии. У “респондеров” (23 из 30) выявлены достоверные отрицательные корреляции общей суммы баллов шкалы HDRS-17 со значениями спектральной мощности θ2 (6–8 Гц)- и α1 (8–9 Гц)-частотных поддиапазонов ЭЭГ в теменно-затылочно-задневисочных отведениях. У “нон-респондеров” (7 из 30) аналогичные корреляции выявлены между значениями общей суммы баллов шкалы HDRS-17 и спектральной мощности θ2 (6–8 Гц)-поддиапазона ЭЭГ в лобно-центрально-височных зонах правого полушария. Таким образом, возможными ЭЭГ-предикторами эффективности комбинированной антидепрессивной терапии, включающей рТМС левой ДЛПФК являются параметры θ2- и α1-частотных поддиапазонов исходной ЭЭГ.
Одной из высоко актуальных задач современной психиатрии является необходимость оптимизации терапии депрессий [1–6]. Эта задача определяется очень широкой распространенностью депрессивных расстройств (во всем мире свыше 350 млн больных [1]), тяжелым социально-экономическим бременем этих заболеваний [1–3], а также значительной долей (от 30 до 60%) “нон-респондеров” – пациентов, проявляющих фармакорезистентность, т.е. недостаточный клинический ответ на лечение антидепрессантами [4–6]. “Нон-респондерами” считаются больные, у которых после курса терапии антидепрессантами количественные оценки улучшения состояния по клиническим оценочным шкалам для депрессии Гамильтона (Hamilton’s Depression Rating Scale – HDRS) или Монтгомери-Асберг (Montgomery-Asberg Depression Rating Scale – MADRS) составляет менее 50%. Высокий процент “нон-респондеров” требует разработки новых подходов к оптимизации терапии депрессивных расстройств.
Одним из таких подходов является включение в состав комбинированной антидепрессивной терапии сеансов ритмической транскраниальной магнитной стимуляции (рТМС) [7–16]. В большей части исследований терапевтического действия рТМС при лечении депрессии в качестве “мишени” используется дорсолатеральная префронтальная кора (ДЛПФК) левого полушария головного мозга [7–16], поскольку структурные нарушения и снижение метаболизма в этой области мозга ассоциируются с развитием депрессивных расстройств [5, 6]. С целью активации нейрональных сетей и улучшения локального мозгового кровотока в области ДЛПФК применяется высокочастотная (20–25 Гц) рТМС. Показано, что этот нелекарственный метод усиливает и ускоряет эффект антидепрессантов в отношении симптомов депрессии в рамках разных нозологических категорий, не дает нежелательных побочных эффектов, у некоторых больных позволяет преодолеть фармакорезистентность [5, 7, 13, 15, 16], а также улучшает ряд когнитивных функций [11, 13, 15].
Вместе с тем, даже при таком комбинированном способе лечения часть фармакорезистентных пациентов остаются “нон-респондерами”. Поэтому актуальным является поиск нейрофизиологических показателей прогноза комбинированной антидепрессивной терапии, включающей рТМС. В доступной литературе встречаются лишь единичные работы, посвященные непосредственно этой теме, в которых были получены лишь частично совпадающие результаты [17]. Так, выраженность терапевтического ответа на рТМС левой ДЛПФК у больных с фармакорезистентной депрессией отрицательно коррелирует со значениями спектральной мощности (СпМ) α-ритма исходной ЭЭГ в теменно-височных отведениях обоих полушарий [10]. У больных с депрессией сосудистого генеза таким ЭЭГ-предиктором является повышенная СпМ θ-ритма в проекции субгенуальной области поясной извилины коры [9]. В работе [14] прогностическую информативность проявили показатели асимметрии α-ритма в затылочных отведениях, а также соотношение СпМ α- и θ-активности в височных областях. Ранее мы показали, что на роль ЭЭГ-предикторов эффективности антидепрессивной фармакотерапии у больных с депрессивными состояниями разной нозологической принадлежности могут претендовать параметры СпМ α-, θ- и β-частотных компонентов исходной фоновой ЭЭГ [18–20].
Цель настоящего исследования – поиск и уточнение возможных ЭЭГ-предикторов эффективности комбинированной антидепрессивной терапии, включающей курс высокочастотной ритмической транскраниальной магнитной стимуляции дорсолатеральной префронтальной коры левого полушария, у больных фармакорезистентной депрессией.
МЕТОДИКА
Клинико-нейрофизиологическое исследование выполняли на базе лаборатории нейрофизиологии и отдела по изучению эндогенных психических расстройств и аффективных состояний ФГБНУ “Научный центр психического здоровья” (г. Москва).
В исследование было включено 30 пациентов клиники ФГБНУ НЦПЗ (все женщины, праворукие, в возрасте от 20 до 50 лет, средний возраст 36.9 ± 10.3 лет) с депрессивными состояниями преимущественно средней, а также тяжелой степени тяжести, отвечающими критериям рубрик F31.3, F33.0, F33.1 и F43.21 по Международной классификации болезней (МКБ-10). Клиническое состояние больных при госпитализации характеризовалось наличием комплекса характерных симптомов депрессии в виде сниженного настроения, пессимизма, тревоги, раздражительности, эмоциональной лабильности, замедления моторики и мышления, нарушений сна, а также снижения работоспособности. При предшествовавших курсах лечения клинический эффект антидепрессивной фармакотерапии этих пациентов оказывался недостаточным, что, согласно общепринятым критериям [4–6], отвечает критериям фармакорезистентной депрессии.
В ходе исследования все пациенты получали комплексную синдромально обусловленную антидепрессивную терапию, включавшую прием антидепрессантов (преимущественно, класса селективных ингибиторов обратного захвата серотонина – СИОЗС) и курс высокочастотной рТМС ДЛПФК левого полушария.
Клиническая оценка динамики состояния. Количественную клиническую оценку исходного состояния больных и эффекта терапии проводили с помощью оценочной шкалы Гамильтона для депрессии (HDRS-17) дважды: до начала (на визите 1) и по окончании 3-х недельного курса комбинированной терапии, включавшей рТМС левой ДЛПФК (на визите 2). По окончании курса комбинированной терапии, включавшей рТМС, все больные по стандартному критерию процента улучшения клинических оценок по общей сумме баллов шкалы HDRS-17 [4] были разделены на две подгруппы – “респондеров” и “нон-респондеров”.
Транскраниальная магнитная стимуляция. Сеансы ТМС проводили в течение трех недель ежедневно, кроме выходных (всего 15 сеансов) с помощью магнитного стимулятора “Нейро-МС/Д” с 8-образным индуктором (ООО “Нейрософт”, Россия). Во время сеанса пациенты сидели в удобном кресле. Каждый сеанс рТМС левой ДЛПФК включал 40 серий по 40 прямоугольных магнитных импульсов с частотой 20 Гц. Длительность каждой серии составляла 2 с (всего 1600 импульсов), а интервал между сериями – 14 с. Интенсивность импульсов, наносимых на область проекции левой ДЛПФК (в зоне лобно-передневисочных ЭЭГ-отведений Fp1, F3, F7), составляла 60–80% от предварительно определенного индивидуального моторного порога. Порог определяли по интенсивности одиночного магнитного импульса, наносимого на область корковой проекции кисти правой руки в левом полушарии (точка вблизи ЭЭГ-отведения С3) и вызывавшего моторный ответ в виде вздрагивания большого пальца правой руки. Индивидуальная интенсивность рТМС подбирали таким образом, чтобы в процессе рТМС ДЛПФК не происходило сокращений лицевой мускулатуры.
Регистрация и анализ ЭЭГ. В данной работе, в соответствии с целью исследования, для оценки исходного функционального состояния головного мозга у всех пациентов до начала курса терапии (на визите 1) проводили многоканальную регистрацию фоновой ЭЭГ в состоянии спокойного бодрствования с закрытыми глазами. Для записи и анализа ЭЭГ использовали аппаратно-программный комплекс “Нейро-КМ” (“Статокин”, Россия) с компьютерной программой “BrainSys” (автор – А.А. Митрофанов) [21]. ЭЭГ записывали в 16-ти отведениях: F7, F3, F4, F8, T3, C3, Cz, C4, T4, T5, P3, Pz, P4, T6, O1 и O2 относительно ипсилатеральных ушных референтов А1 и А2, по Международной системе 10–20, с полосой пропускания 35 Гц, постоянной времени 0.1 с и частоте оцифровки 200 Гц.
Затем проводили спектральный анализ и топографическое картирование абсолютной СпМ безартефактных фрагментов ЭЭГ (не менее 30-ти 4-секундных эпох) в узких частотных поддиапазонах (∆ – 2–4 Гц, θ1 – 4–6 Гц, θ2 – 6–8 Гц, α1 – 8–9 Гц, α2 – 9–11 Гц, α3 – 11–13 Гц, β1 – 13–20 Гц и β2 – 20–30 Гц). Анализировали количественные значения СпМ ЭЭГ подгрупп “респондеров” и “нон-респондеров до начала курса терапии (на визите 1).
Статистический анализ. Статистическую обработку комплекса клинических и ЭЭГ-данных осуществляли с использованием программ описательной и непараметрической статистики пакетов “STATISTICA для Windows”, а также статистических программ, встроенных в пакет программ для анализа и топографического картирования ЭЭГ “BrainSys” [21]. Достоверность различий средних значений клинических показателей, определенных у пациентов до начала лечения (на визите 1) и после 15-ти сеансов рТМС левой ДЛПФК (на визите 2) определяли с использованием W-теста Уилкоксона для связанных выборок. Достоверность различий средних значений СпМ исходной ЭЭГ между подгруппами “респондеров” и “нон-респондеров” определяли с использованием U-теста Манна-Уитни для независимых выборок. Кроме того, с целью поиска возможных ЭЭГ-предикторов эффективности комбинированной терапии, включающей рТМС ДЛПФК левого полушария, методом корреляционного анализа (по Спирмену) сопоставляли параметры ЭЭГ, зарегистрированной до начала курса терапии (на визите 1), с количественными клиническими показателями после курса терапии (на визите 2).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Клинические оценки эффективности терапии. У большинства пациентов уже после 3-х недель комбинированной антидепрессивной терапии, включавшей 15 сеансов рТМС ДЛПФК левого полушария, отмечено выраженное улучшение клинического состояния по показателям шкалы HDRS-17. Среднее по всей группе значение общей суммы баллов шкалы HDRS-17 достоверно (p < < 0.001) уменьшилось с 20.5 ± 5.3 баллов до начала терапии до 7.6 ± 5.6 баллов после 15-ти сеансов рТМС. При этом у 14-ти из 30-ти пациентов (46.7%) общая сумма баллов шкалы HDRS-17 после 15-ти сеансов рТМС составила 7 и менее баллов, что, по клиническим оценкам, соответствует выходу в ремиссию. Еще у 14-ти пациентов (46.7%) она составила от 8 до 13 баллов, что клинически соответствует сохранению депрессивного состояния легкой степени тяжести. И только у 2-х из 30-ти больных (6.6%) сумма оценок по шкале HDRS-17 после курса рТМС составила 20 и 23 балла (при исходных значениях у обеих больных, равных 26 баллам), что клинически соответствует сохранению состояния депрессии крайне тяжелой степени.
По окончании 3-х недельного курса комбинированной терапии, включающей рТМС, все больные были разделены на две подгруппы – “респондеров” и “нон-респондеров”. У “респондеров” улучшение клинических оценок (в виде уменьшения общей суммы баллов шкалы HDRS-17) превысило 50% и составило от 52 до 96%, в среднем по подгруппе 73.0 ± 13.5%. У “нон-респондеров” улучшение не достигло 50% и составило от 12 до 45%, в среднем по подгруппе 30.1 ± 11.4%. По этому стандартному критерию, доля “респондеров” в исследованной выборке больных депрессией после курса комбинированной антидепрессивной терапии, включающей рТМС левой ДЛПФК, составила 76.7% (23 из 30-ти пациентов), причем больше половины из них (14 из 23-х больных) вышли в ремиссию. Доля “нон-респондеров” составила 23.3% (7 из 30-ти пациентов), причем у двух из них сохранилось состояние депрессии крайне тяжелой степени. Подгруппы “респондеров” и “нон-респондеров” не различались ни по среднему возрасту (36.3 ± 10.2 и 37.2 ± ± 10.8 лет, соответственно), ни по исходной тяжести депрессивного состояния по шкале HDRS-17 на визите 1 (20.3 ± 5.5 и 20.8 ± 5.2 баллов соответственно). Однако средние значения общей суммы баллов шкалы HDRS-17 после курса комбинированной терапии (на визите 2) в подгруппе “респондеров”, естественно, были ниже, чем в подгруппе “нон-респондеров” и составили соответственно 5.2 ± 3.1 и 15.3 ± 5.4 баллов.
Особенности исходной ЭЭГ подгрупп “респондеров” и “нон-респондеров”. Результаты спектрального анализа исходной фоновой ЭЭГ подгрупп “респондеров” и “нон-респондеров” представлены в виде топографических карт СпМ ЭЭГ в узких частотных поддиапазонах, усредненных по двум подгруппам (рис. 1).
Рис. 1.
Топографические карты спектральной мощности ЭЭГ подгрупп “респондеров” (А) и “нон-респондеров” (Б) до начала комбинированной антидепрессивной терапии, включающей рТМС ДЛПФК левого полушария. Под каждой картой указан частотный поддиапазон ЭЭГ: θ2 (6–8 Гц), α1 (8–9 Гц), α2 (9–11 Гц), α3 (11–13 Гц) и β1 (13–20 Гц). Черно-белая шкала справа – в значениях спектральной мощности ЭЭГ (в мкВ2).
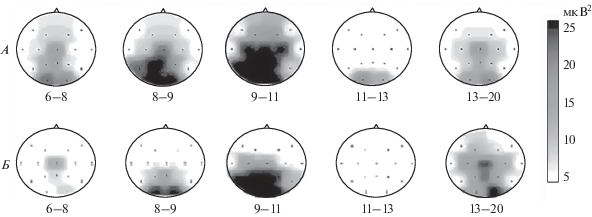
При визуальном анализе этих карт отмечается несколько более замедленный характер исходной фоновой ЭЭГ в виде больших значений СпМ низкочастотного поддиапазона α-ритма (α1, 8–9 Гц) и СпМ поддиапазона θ2 (6–8 Гц) в теменно-затылочных отведениях, а также меньших значений СпМ поддиапазона β1 (13–20 Гц) в подгруппе “респондеров”, по сравнению с подгруппой “нон-респондеров. Эти различия частотной структуры ЭЭГ двух подгрупп больных в отношении СпМ α1 и СпМ θ2 в отведениях P3, Pz, P4, O1 и O2 достигли уровня статистической достоверности (p < 0.05).
Возможные ЭЭГ-предикторы комбинированной терапии. В соответствии с целью исследования по поиску возможных ЭЭГ-предикторов эффективности комбинированной терапии, включающей рТМС ДЛПФК, методом ранговой корреляции (по Спирмену) сопоставляли параметры исходной (зарегистрированной до начала курса терапии на визите 1) фоновой ЭЭГ подгрупп “респондеров” и “нон-респондеров” с количественными клиническими показателями после курса терапии (на визите 2). Результаты корреляционного анализа приведены на рис. 2.
Рис. 2.
Топографические карты распределения и уровня достоверности коэффициентов корреляции Спирмена между значениями спектральной мощности θ2- и α1-частотных поддиапазонов ЭЭГ до начала комбинированной антидепрессивной терапии, включающей рТМС ДЛПФК левого полушария, и клиническими оценками тяжести депрессии (общая сумма баллов шкалы HDRS-17) после курса терапии в подгруппах “респондеров” (А) и “нон-респондеров” (Б). Все корреляции отрицательные. Под каждой картой указан частотный поддиапазон ЭЭГ: θ2 (6–8 Гц), α1 (8–9 Гц). Шкала в оттенках серого справа – в значениях уровня достоверности Спирмена.
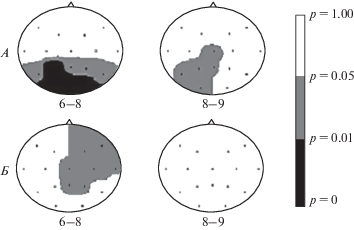
В подгруппе “респондеров” получены достоверные отрицательные корреляции значений общей суммы баллов шкалы HDRS-17 после курса комбинированной терапии со значениями СпМ поддиапазона θ2 (6–8 Гц) исходной (на визите 1) фоновой ЭЭГ в теменно-затылочно-задневисочных отведениях (в P3, O1 и O2 на уровне p < 0.01; в T5, Pz, P4 и T6 на уровне p < 0.05) и со значениями СпМ поддиапазона α1 (8–9 Гц) в теменно-затылочных отведениях (в P3, Pz, P4, O1 и O2 на уровне p < 0.05).
В подгруппе “нон-респондеров” значения общей суммы баллов шкалы HDRS-17 после курса комбинированной терапии так же достоверно отрицательно (на уровне p < 0.05) коррелировали со значениями спектральной мощности поддиапазона θ2 (6–8 Гц) исходной (на визите 1) фоновой ЭЭГ в лобно-центрально-височно-теменных отведениях правого полушария (F4, F8, Cz, C4, T4, Pz и P4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Прежде всего, следует отметить, что у подавляющего большинства наших больных положительные эффекты комбинированной терапии, включавшей, наряду с антидепрессантами, рТМС ДЛПФК левого полушария, проявились уже после 3-х недельного курса лечения. При этом доля “респондеров” оказалась очень высока (76.7%), а почти половина пациентов вышла в ремиссию. Учитывая, что при предшествующих госпитализациях у этих пациентов отмечалась фармакорезистентность, т.е. клинический эффект антидепрессивной фармакотерапии оказывался недостаточным, а терапевтическое действие большинства антидепрессантов только начинает проявляться к 3-й неделе курса терапии [5]. Можно утверждать, что высокочастотная рТМС левой ДЛПФК не только существенно усиливает и ускоряет действие антидепрессантов, но и позволяет преодолеть фармакорезистентность у части больных.
Полученные данные также указывают на то, что исходное функциональное состояние головного мозга пациентов, оцениваемое по данным ЭЭГ, оказывает влияние на эффективность комбинированной терапии, включающей рТМС ДЛПФК. Об этом свидетельствуют различия частотной структуры исходной фоновой ЭЭГ, а также разная структура корреляций между параметрами исходной ЭЭГ и количественными клиническими оценками после курса терапии в подгруппах “респондеров” и “нон-респондеров”.
В подгруппе “респондеров” более выраженный терапевтический ответ (в виде меньших значений общей суммы баллов шкалы HDRS-17 после курса комбинированной терапии) ассоциировался с более замедленным характером исходной ЭЭГ в виде больших значений СпМ низкочастотного поддиапазона α-ритма (α1, 8–9 Гц) и поддиапазона θ2 (6–8 Гц) в задних (теменно-затылочно-задневисочных) отведениях в подгруппе “респондеров”, по сравнению с подгруппой “нон-респондеров”. В подгруппе “нон-респондеров” относительно лучший (хотя и недостаточный) терапевтический ответ коррелировал с замедленной исходной ЭЭГ в передних отведениях правого полушария в виде больших значений СпМ поддиапазона θ2 (6–8 Гц).
Возможна следующая нейрофизиологическая интерпретация таких соотношений. Ранее мы показали, что повышенное содержание θ2 ЭЭГ-активности в центрально-теменно-затылочных отведениях отражает сниженное функциональное состояние не только этих отделов головного мозга, но и лобной и префронтальной зон коры [19, 22]. Высокочастотная рТМС ДЛПФК левого полушария оказывает активирующее влияние как на эту зону [12], так и на другие области коры, улучшая их функциональное состояние. Так, после курса комбинированной терапии, включающей рТМС левой ДЛПФК, происходят изменения частотной структуры теменно-затылочного α-ритма фоновой ЭЭГ в виде снижения СпМ его низкочастотного компонента α1 и повышения СпМ высокочастотного компонента α3 [13], а также возрастает СпМ поддиапазона β2 (20–30 Гц) в зоне непосредственного воздействия рТМС – в левой лобной области [16]. Возможно, что у тех больных, у которых функциональное состояние некоторых областей коры исходно снижено (в нашей работе это задние отделы у “респондеров” и передние отделы правого полушария у “нон-респондеров”), активация этих областей путем рТМС, нормализующая их функциональное состояние, дает больший терапевтический эффект, чем их излишняя активация у исходно более активированных пациентов.
В настоящей работе в роли кандидатов в ЭЭГ-предикторы эффективности комбинированной антидепрессивной терапии, включающей рТМС ДЛПФК левого полушария, выступили значения СпМ поддиапазонов θ2 (6–8 Гц) и α1 (8–9 Гц). Эти данные согласуются с результатами работы [9], в которой прогностически информативными в отношении терапевтического ответа также оказались параметры θ-ритма. В других работах в качестве ЭЭГ-предикторов выступили показатели СпМ α-ритма [10], а также асимметрии α-ритма и соотношения СпМ α- и θ-активности [14]. По-видимому, при депрессивных состояниях разной синдромальной структуры и нозологической принадлежности ЭЭГ-предикторами эффективности разных методов антидепрессивной терапии, включая рТМС ДЛПФК, будут разные параметры исходной ЭЭГ и их сочетания, что, учитывая актуальность проблемы оптимизации и прогноза эффективности терапии депрессий, требует дальнейших исследований.
Ограничения данной работы определяются относительно небольшим числом пациентов, включенных в исследование. В перспективе планируется увеличение объема выборки с целью получения клинико-нейробиологических данных для построения и валидизации математических моделей индивидуального количественного прогноза терапевтического ответа пациентов с фармакорезистентной депрессией на комбинированную антидепрессивную терапию, включающую сеансы высокочастотной транскраниальной магнитной стимуляции дорсолатеральной префронтальной коры головного мозга.
ЗАКЛЮЧЕНИЕ
Полученные данные позволяют сделать вывод, что даже относительно короткий курс высокочастотной транскраниальной магнитной стимуляции дорсолатеральной префронтальной коры левого полушария существенно усиливает и ускоряет действие антидепрессантов у пациентов с ранее диагностированной фармакорезистентной депрессией. Кандидатами на роль предикторов эффективности комбинированной антидепрессивной терапии, включающей курс высокочастотной транскраниальной магнитной стимуляции дорсолатеральной префронтальной коры левого полушария, могут служить значения спектральной мощности θ2- и α1-ритмов исходной фоновой ЭЭГ.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Научного центра психического здоровья (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование поддержано РФФИ (грант РФФИ № 18-01-00029а).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
World Health Organization. Preventing suicide: a global imperative. Geneva: WHO Press, 2014. 92 p.
Смулевич А.Б. Депрессии при соматических и психических заболеваниях. М.: МИА, 2007. 432 с.
Краснов В.Н. Расстройства аффективного спектра. М.: Практическая медицина, 2011. 432 с.
Fava M. Diagnosis and definition of treatment-resistant depression // Biol. Psychiat. 2003. V. 53. № 8. P. 649.
Мосолов С.Н. Резистентность к психофармакотерапии и методы ее преодоления // Психиатрия и психофармакотерапия. 2002. Т. 4. № 4. С. 132.
Мазо Г.Э., Крижановский А.С. Специфический нейробиологический профиль терапевтически резистентной депрессии: pro et contra // Современная терапия психических расстройств. 2012. № 1. С. 2.
Padberg F., Zwanzger P., Thoma H. et al. Repetitive transcranial magnetic stimulation (rTMS) in pharmacotherapy-refractory major depression: comparative study of fast, slow and sham rTMS // Psychiatry Res. 1999. V. 88. № 3. P. 163.
Gross M., Nakamura L., Pascual-Leone A., Fregni F. Has repetitive transcranial magnetic stimulation (rTMS) treatment for depression improved? A systematic review and meta-analysis comparing the recent vs. the earlier rTMS studies // Acta Psychiatr. Scand. 2007. V. 116. № 3. P. 165.
Narushima K., McCormick L.M., Yamada T. et al. Subgenual cingulate theta activity predicts treatment response of repetitive transcranial magnetic stimulation in participants with vascular depression // J. Neuropsychiatry Clin Neurosci. 2010. V. 22. № 1. P. 75.
Micoulaud-Franchi J.A., Richieri R., Cermolacce M. et al. Parieto-temporal alpha EEG band power at baseline as a predictor of antidepressant treatment response with repetitive transcranial magnetic stimulation: a preliminary study // J. Affect Disord. 2012. V. 137. № 1–3. P. 156.
Маслеников Н.В., Цукарзи Э.Э., Мосолов С.Н. Депрессии при шизофрении: оценка когнитивных функций в динамике при лечении транскраниальной магнитной стимуляцией // Социальная и клиническая психиатрия. 2013. Т. 23. № 1. С. 5.
Noda Y., Nakamura M., Saeki T. et al. Potentiation of quantitative electroencephalograms following prefrontal repetitive transcranial magnetic stimulation in patients with major depression // Neurosci. Res. 2013. V. 77. № 1–2. P. 70.
Изнак А.Ф., Изнак Е.В., Дамянович Е.В. и др. Транскраниальная магнитная стимуляция в комплексной терапии фармакорезистентной депрессии: динамика клинических, психологических и ЭЭГ показателей // Физиология человека. 2015. Т. 41. № 5. С. 57. Iznak A.F., Iznak E.V., Damyanovich E.V. et al. Transcranial Magnetic Stimulation in Combined Treatment of Pharmacoresistant Depression: Dynamics of Clinical, Psychological, and EEG Parameters // Human Physiology. 2015. V. 41. № 5. P. 503.
Мельникова Т.С., Цукарзи Э.Э., Ковалев А.В., Мосолов С.Н. Спектральные характеристики электроэнцефалограммы (ЭЭГ) – потенциальные биомаркеры эффективности терапии транскраниальной магнитной стимуляции при резистентных депрессиях // Современная терапия психических расстройств. 2016. № 3. С. 2.
Iznak A., Iznak E., Damyanovich E., Medvedeva T., Oleichik I. Comparative efficiency of rTMS in combined treatment of pharmaco-resistant depression // L’Encéphale. 2019. V. 45. Suppl. 2. P. S65.
Дамянович Е.В., Изнак Е.В., Олейчик И.В. и др. Изменения пространственной организации деятельности мозга под влиянием комбинированной антидепрессивной терапии, включающей транскраниальную магнитную стимуляцию // Физиология человека. 2019. Т. 45. № 1. С. 29. Damyanovich E.V., Iznak E.V., Oleichik I.V. et al. Changes in the Spatial Organization of Brain Activity after Combined Antidepressive Therapy Including Transcranial Magnetic Stimulation // Human Physiology. 2019. V. 45. № 1. P. 23.
Sujita Kumar Kar. Predictors of Response to Repetitive Transcranial Magnetic Stimulation in Depression: A Review of Recent Updates // Clin. Psychopharmacol. Neurosci. 2019. V. 17. № 1. P. 25.
Изнак А.Ф., Тиганов А.С., Изнак Е.В., Сорокин С.А. ЭЭГ-корреляты и возможные предикторы эффективности терапии эндогенной депрессии // Физиология человека. 2013. Т. 39. № 4. С. 49. Iznak A.F., Tiganov A.S., Iznak E.V., Sorokin S.A. EEG Correlates and Possible Predictors of the Efficacy of the Treatment of Endogenous Depression // Human Physiology. 2013. V. 39. № 4. P. 378.
Изнак А.Ф., Изнак Е.В., Олейчик И.В. и др. ЭЭГ-корреляты лобной дисфункции как предикторы относительной фармакорезистентности при терапии эндогенных аффективных расстройств // Журн. неврологии и психиатрии им. С.С. Корсакова. 2014. Т. 114. № 12. С. 53. Iznak A.F., Iznak E.V., Oleichik I.V. et al. [EEG correlates of frontal dysfunction as predictors of relative pharmacoresistance in the treatment of endogenous affective disorders] // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. 2014. V. 114. № 12. P. 53.
Изнак А.Ф., Изнак Е.В., Абрамова Л.И., Ложников М.А. Модели количественного прогноза терапевтического ответа больных депрессией по параметрам исходной ЭЭГ // Физиология человека. 2019. Т. 45. № 6. С. 40. Iznak A.F., Iznak E.V., Abramova L.I., Lozhnikov M.A. Models for the Quantitative Prediction of Therapeutic Responses Based on the Baseline EEG Parameters in Depressive Patients // Human Physiology. 2019. V. 45. № 6. P. 614.
Митрофанов А.А. Компьютерная система анализа и топографического картирования электрической активности мозга с нейрометрическим банком ЭЭГ-данных (описание и применение). М., 2005. 63 с.
Изнак А.Ф., Жигульская С.Е., Рощина И.Ф. и др. ЭЭГ-корреляты “мягких” нарушений высших корковых функций // Физиология человека. 2001. Т. 27. № 1. С. 5. Iznak A.F., Zhigulskaya S.E., Roshchina I.F. et al. EEG correlates of “mild” disorders of higher cortical functions // Human Physiology. 2001. V. 27. № 1. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


