Физиология человека, 2020, T. 46, № 6, стр. 27-42
Нейрофизиологические механизмы операции сличения ориентационных зрительных признаков в задаче рабочей памяти
Е. С. Михайлова 1, *, Н. Ю. Герасименко 1, К. А. Салтыков 1
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: esmikhailova@mail.ru
Поступила в редакцию 23.03.2020
После доработки 22.04.2020
Принята к публикации 20.05.2020
Аннотация
Данное исследование направлено на понимание мозговых механизмов обнаружения различий между текущей и кратковременно удерживаемой в рабочей памяти (РП) ориентациями. Результаты сопоставляли с данными, полученными при исследовании РП на пространственные паттерны. У 33 здоровых испытуемых анализировали связанные с событием потенциалы и данные моделирования распределенной дипольной активности в интервале 160–280 мс после тестового стимула. Показано, что информативным показателем несовпадения текущей и удерживаемой в памяти информации является увеличение амплитуды потенциалов, которое одновременно разворачивается во фронтальных и в теменно-затылочных областях коры, и не зависит от типа стимула. При анализе распределенных дипольных источников установлено, что топография различий между этими ЭЭГ-параметрами при совпадении и несовпадении текущей и удерживаемой в РП информации определяется типом стимула. Для ориентаций различия носили локальный характер и преобладали в каудальных отделах левого полушария, для пространственных паттернов характерна более обширная область различий преимущественно в правом полушарии. Результаты указывают, с одной стороны, на общность в организации нейросетей детектирования несоответствия текущего сигнала с удерживаемым в памяти, с другой, на возможность их пластических перестроек, связанных с характером перерабатываемой информации.
Сопоставление вновь поступившей зрительной информации с хранящейся в кратковременной памяти играет важную роль в осуществлении многих когнитивных функций. Эта операция позволяет обнаружить несовпадение зрительных характеристик реальной среды с теми, которые хранятся в кратковременной памяти, обновить (“update”) сведения об образе или сцене и, таким образом, получить и закрепить новые знания об окружающем нас мире. Кратковременная память на базовые характеристики зрительной среды обеспечивает уникальный механизм поддержания их внутренних репрезентаций при естественных процессах, неожиданно прерывающих сенсорный вход, таких, например, как саккадические движения глаз. Сличение предсаккадической и постсаккадической информации о самом объекте и о направлении взора, обнаружение несовпадения репрезентаций, – эти функции кратковременной зрительной памяти чрезвычайно важны для поддержания стабильности восприятия зрительной среды (“visual stability”) [1].
Специфика мозговой организации памяти на базовые низкоуровневые признаки зрительной среды впервые была сформулирована S. Magnussen в модели низкоуровневой перцептивной памяти – “low-level perceptual memory” [2]. Согласно этой модели, перцептивная память обеспечивает пресемантический уровень обработки, завершающийся сенсорной идентификацией объекта, и ограничивается процессами на нижних уровнях зрительной иерархии. Позднее была показана важная роль префронтальных образований, причем, не только в обеспечении различных операций рабочей памяти (РП) на ориентационные характеристики, но и в поддерживании их высокоуровневых абстрактных репрезентаций [3]. Необходимо особо выделить работу [4], в которой авторы впервые обратились к вопросу о роли нисходящих управляющих влияний и функциональной связи низко- и высокоуровневых областей в мозговых механизмах РП на ориентации.
В связи с этим особую важность приобретает вопрос об организации нейросети, включающей разные иерархические уровни переработки информации, деятельность которой связана с обнаружением несоответствия текущей и хранящейся в кратковременной памяти репрезентаций ориентационных средовых характеристик.
Ранее мы показали, что изменения амплитуды фронтальной негативности N2 является информативным показателем несовпадения текущей и удерживаемой в памяти ориентаций, и выделили комплекс структур фронтальной коры, активность которых повышается при несовпадении ориентаций [5]. Кроме того, были обнаружены изменения ранних компонентов связанных с событием потенциалов (ССП) затылочной коры, возникающие при несоответствии текущего и удерживаемого в памяти стимулов, которые были специфичны для РП на ориентации и отражали их имплицитную дискриминацию [6]. Интересно, что по данным исследования [5], компонент N2 в ССП каудальных зрительных областей не продемонстрировал тесной связи с условием несовпадения эталона и теста. Более четкая зависимость от этого условия была показана для амплитуды компонента Р2, который предшествовал негативности, однако этот факт не был предметом специального анализа. В связи с этим, в настоящем исследовании мы акцентировали внимание на временны́ х и топографических характеристиках вызванной активности, регистрируемой во временнóм интервале развития фронтальной негативности N2 и затылочно-теменной позитивности P2. Мы предполагали, что анализ амплитудных показателей потенциалов, развивающихся в этом временнóм интервале, и привлечение метода моделирования распределенных дипольных источников ЭЭГ-сигналов позволит охарактеризовать деятельность распределенной нейросети, которая связана с обнаружением несоответствия текущей и хранящейся в кратковременной памяти репрезентаций. Для определения специфики ее организации в задаче РП на ориентационные признаки, в настоящей работе использовали два вида зрительных стимулов – наборы прямоугольных решеток разной ориентации и пространственные паттерны, представляющие собой триплеты небольших кружков с разным расположением друг относительно друга. Значимость оценки событий в период развития среднелатентных компонентов ССП для понимания скоординированной деятельности фронтальных и каудальных областей коры в РП ранее продемонстрирована в работе [7].
МЕТОДИКА
В исследовании принимали участие 33 испытуемых (16 мужчин и 17 женщин, правши, средний возраст 22.6 ± 0.5 лет) c нормальным зрением. Исследования проводили в утреннее и дневное время c 9 до 15 ч.
Стимулы. Использовали две категории стимулов. Первая представляла собой черно-белые изображения высококонтрастных прямоугольных решеток с наклоном линий 0° (горизонталь), 90° (вертикаль) и 45° (наклонная ориентация). Вторая категория – пространственные паттерны, представляющие собой триплеты небольших черных кружков на белом фоне с разным расположением элементов (40 вариантов расположения). Cходные стимулы были использованы в исследовании зрительной РП [8]. Примеры стимулов приведены на рис. 1, А, Б.
Рис. 1.
Стимулы, использованные в работе. А – ориентационные решетки. Б – пространственные паттерны. В – временнáя последовательность событий в одном блоке эксперимента попарного сравнения ориентационных решеток или пространственных паттернов.

Для моделирования в эксперименте ситуации сравнения новой и удерживаемой в памяти информации использовали модель отставленного сопоставления с образцом (“delayed matching to sample”). Испытуемым предъявляли пары совпадающих и несовпадающих стимулов. Первый стимул (эталонный) испытуемый должен был запомнить, второй стимул был тестовым. При совпадении эталонного и тестового стимулов испытуемый должен был нажать на клавишу “1” выносной клавиатуры Response Box (Psychology Software Tools, Inc., США), при несовпадении – на клавишу “2”. Выносную клавиатуру располагали перед испытуемым. Нажатие осуществлялось в удобной для него манере: указательными пальцами правой и левой руки или указательным и средним пальцем одной руки.
С каждым испытуемым проводили по 2 эксперимента. В одном эксперименте в качестве стимулов для запоминания и сравнения использовали прямоугольные решетки с линиями разной ориентации. Испытуемым в случайном порядке предъявляли 90 пар решеток, совпадающих (0°–0°, 90°–90° и 45°–45°) и 180 пар несовпадающих (0°–90°, 0°–45°, 90°–0°, 90°–45°, и 45°–0°, 45°–90°) по ориентации. То есть каждое сочетание эталонной и тестовой ориентации предъявляли по 30 раз. В другом эксперименте испытуемым в случайном порядке предъявляли 30 пар совпадающих и 30 пар несовпадающих изображений пространственных паттернов. Последовательность этих двух экспериментов меняли от испытуемого к испытуемому.
Процедура эксперимента. Во время исследования испытуемый сидел в удобном кресле в затемненной и звукозаглушенной комнате на расстоянии 120 см от экрана монитора Dell E1911c (диагональ 17 дюймов, частота обновления экрана 60 Гц). Размер стимула на экране монитора составлял 5.5 угл. град. Освещенность на уровне глаз испытуемого – 3 лк. Горизонтальные и вертикальные края корпуса экрана и монитора были закрыты экраном с закругленными краями и круглой апертурой. Стимулы предъявляли в центр поля зрения с помощью программы E-Prime 2.0 (Psychology Software Tools, Inc., США). Временнáя схема эксперимента представлена на рис. 1, В. Каждая последовательность, или блок, состоял из следующих событий: зеленая точка длительностью 100 мс, при появлении которой испытуемый должен был сосредоточиться и фиксировать взгляд в центре экрана; черная фиксационная точка, длительность которой в случайном порядке изменялась от 1500 до 1700 мс; эталонный стимул – 100 мс; интервал между эталонным и тестовым стимулами, длительность которого изменялась в случайном порядке от 1500 до 1800 мс, в центре экрана находилась фиксационная точка; тестовый стимул – 100 мс; интервал между блоками 3000 мс, в это время в центре экрана – фиксационная точка. В ходе экспериментов делали перерыв для отдыха испытуемого 15–20 мин и коррекции сопротивления электродов. Регистрировали правильность ответа и время нажатия на клавишу.
Регистрация и анализ связанных с событием потенциалов. Регистрацию электроэнцефалограммы (ЭЭГ) проводили с помощью 128-канального электроэнцефалографа (Electrical Geodesics Inc., США) с использованием шлема Hydro Cel Geodesic Sensor Net. Размер шлема подбирали индивидуально с учетом окружности головы испытуемого. Частота квантования сигнала составляла 500 Гц. Согласно рекомендации производителя электроэнцефалографа, сопротивление электродов не превышало 50 кОм. При записи в качестве референтного электрода использовали датчик, расположенный в отведении вертекс (Cz). При off-line обработке записи в качестве референтного выбирали усредненный электрод.
Данные ЭЭГ обрабатывались off-line в программе NetStation 4.5.4 (Electrical Geodesics Inc., США). Предварительно фильтрованные (0.5–45 Гц) записи ЭЭГ каждого испытуемого сегментировали на отрезки длительностью 1300 мс, содержащие интервалы 300 мс до предъявления тестового стимула и 1000 мс после. Программно исключали реализации с глазными движениями, для которых амплитуда электроокулограмы (ЭОГ) превышала 80 µV. Далее, при дополнительном визуальном анализе отмечали фрагменты записи с двигательными и электромиографическими артефактами. После этого для каждого испытуемого по безартефактным отрезкам ЭЭГ проводили усреднение ССП на тестовый стимул для правильных ответов. Коррекцию базовой линии проводили по отрезку в 300 мс ЭЭГ до предъявления тестового стимула. Для каждого испытуемого в эксперименте с рабочей памятью на ориентации получено по 9 усредненных ССП: 3 для совпадающих эталона и теста и 6 для несовпадающих эталона и теста. В эксперименте с пространственными паттернами для каждого испытуемого усредняли ССП для совпадающих и несовпадающих стимулов, т.е. получали по 2 ССП.
Амплитуду выбранных для анализа компонентов N2 и P2 индивидуальных ССП измеряли в программе NetStation 4.5.4. Замеряли адаптивный минимум компонента N2 фронтальных ССП и максимум компонента Р2 каудальных ССП во временнóм окне 160–280 мс. Программно регистрировали среднее значение амплитуды в 4-миллисекундном интервале (2 мс до и 2 мс после пика компонента). При последующей статистической обработке анализировали амплитуду компонентов ССП, усредненную по кластерам электродов, расположенных над затылочной (в левом полушарии сенсоры № 66, 70, 71, в правом – 76, 83, 84), теменной (в левом полушарии – № 52, 60, 67, в правом – 77, 85, 92) и лобной (в левом полушарии – № 21, 22, 25, в правом – 9, 14, 124) областями коры. Приведенные номера сенсоров соответствуют номерам в 128-канальном шлеме Hydro Cel Geodesic Sensor Net.
Статистический анализ амплитуд компонентов индивидуальных ССП, усредненных по группам электродов, проводили с использованием дисперсионного анализа ANOVA RM (метод повторных измерений). Для каждой ориентации данные для условия несовпадения вычисляли как среднее по соответствующим этой ориентации двум парам несовпадающих эталонных и тестовых стимулов. Результаты дисперсионного анализа при необходимости были скорректированы поправкой Гринхауса-Гейссера. При внутригрупповых post-hoc сопоставлениях использовали поправку на множественные сравнения Бенджамини-Хохберга [9].
Статистический анализ результатов моделирования распределенных дипольных источников. Моделирование распределенных дипольных источников компонентов ССП проводили в пакете Brainstorm 3.2 на платформе MATLAB. Использовали метод взвешенных минимальных нормальных оценок, стандартную анатомию головы ICBM 152, реалистичную объемную модель головы OpenMEEG BEM и стандартные координаты электродов (ASA-10-20). Процедура моделирования детально описана в [10].
Статистическому анализу подвергали данные моделирования ССП на тестовый стимул, усредненных по условиям “совпадение” и “несовпадение” эталона и теста для каждой ориентации и для пространственных паттернов. Например, для горизонтальной ориентации сравнивали пары “горизонталь–горизонталь” vs “вертикаль−горизонталь” или “45 град−горизонталь”. Для выбора временны́ х интервалов, в которых оценивали различия между двумя условиями, предварительно для каждой пары строили разностные ССП и выбирали интервалы в 20 мс, соответствующие максимальной амплитуде разностного ССП во временнóм окне развития компонентов N2 и P2. Проводили усреднение плотности тока источников в интервалах в 20 мс с последующей проекцией данных на магнитно-резонансное томографическое (МРТ) пространство, объемом 128 × 128 × × 128 вокселей, имеющееся в базе данных Brainstorm 3.2. Результатом являлась матрица, содержащая положение каждого из получившихся в результате редукции 218 578 вокселей и значения плотности дипольного тока в каждом из них.
Полученные результаты моделирования объемных распределенных источников ССП в выбранных интервалах экспортировали в программный пакет статистической обработки SPM12 на платформе MATLAB. Статистический анализ различий плотности тока источников на групповом уровне между условиями “совпадение” и “несовпадение” эталонной и тестовой ориентаций проводили с использованием двустороннего t-критерия Стьюдента (контрасты “совпадение” > “несовпадение” и “совпадение” < “несовпадение”). Результаты t-статистики (SPM{t}) были трансформированы в нормальное стандартное распределение (SPM{z}). Воксельный порог различий в активации соответствовал puncorr ≤ 0.0001. Далее использовали пакет MarsBar [11], являющийся инструментом SPM 12 и позволяющий выделять в качестве масок области значимых различий по данным статистических карт, полученных в ходе группового анализа в SPM12. Построенные таким образом в пакете MarsBar функциональные маски использовали для локализации областей значимых различий, согласно анатомическим структурам атласа AAL (Automated Anatomic Labeling) [12]. Результаты статистического анализа представляли в виде схематических рисунков, где выделяли анатомические структуры мозга, демонстрирующие значимые (puncorr ≤ 0.0001) различия между условиями совпадения и несовпадения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На первом этапе проведена обобщенная оценка (overall ANOVA) влияния всех факторов, включая Область (3 уровня: затылочная, теменная, лобная), Стимул (2 уровня: ориентация линий, пространственный паттерн), Совпадение (2 уровня: совпадение и несовпадение эталона и тестового стимулов) и Полушарие (2 уровня) на амплитуду ССП во временнóм окне (160–280 мс), соответствующему компоненту N2 ССП лобных областей и компоненту Р2 ССП теменных и затылочных областей коры. Здесь и далее значения амплитуды компонентов в лобной, теменной и затылочной областях коры определялись как средние по кластеру сенсоров этой области. Для исключения влияния различий в знаке амплитуды компонентов N2 и Р2 в анализ включали абсолютные значения амплитуды N2. Показан основной эффект фактора Совпадение (F1, 32 = 82.23; p < 0.0001), который проявлялся в большей амплитуде ССП при несовпадении по сравнению с совпадением (T = 9.07, df = 32, p < 0.0005). Выявлено значимое взаимодействие Стимул × Совпадение (F1, 32 = 17.03; p < 0.0001), что позволило в дальнейшем провести анализ влияния фактора Совпадение раздельно для ориентаций и для пространственных паттернов. Кроме того, выявлены взаимодействия Совпадение × Область (F1, 64 = = 16.95; p < 0.0001) и Стимул × Область (F2, 64 = = 18.63; p < 0.0001).
Анализ ССП в рабочей памяти на ориентации. Дисперсионный анализ амплитуд компонентов N2 (абсолютные значения) и P2 с факторами Совпадение, Полушарие, Область и Ориентация выявил основной эффект Совпадения (F1, 32 = = 40.52; p < 0.0005), Ориентации (F2, 64 = 4.30; p < 0.05), а также взаимодействия Совпадение × × Область (F2, 64 = 10.03; p < 0.0005) и Совпадение × Область × Ориентация (F 4, 128 = 3.24; p < < 0.05).
На следующем этапе анализа данных с учетом значимости взаимодействия Совпадение × Область, дисперсионный анализ (Совпадение, Ориентация, Полушарие) проводили раздельно в лобной, теменной и затылочной областях. Результаты ANOVA RM приведены в табл. 1.
Таблица 1.
Результаты дисперсионного анализа амплитуды компонентов, связанных с событием потенциалов (ССП) с факторами СОВПАДЕНИЕ, ПОЛУШАРИЕ, ОРИЕНТАЦИЯ
| Компонент ССП | Область коры (кластер) | Факторы и их взаимодействие | df | F | p |
|---|---|---|---|---|---|
| N2 | Лобная | СОВПАДЕНИЕ | 1, 32 | 56.66 | <0.0001 |
| ПОЛУШАРИЕ | 1, 32 | 8.40 | <0.05 | ||
| ОРИЕНТАЦИЯ | 2, 64 | 2.64 | 0.078 | ||
| Р2 | Теменная | СОВПАДЕНИЕ | 1, 32 | 54.64 | <0.0001 |
| ОРИЕНТАЦИЯ | 2, 64 | 3.26 | <0.05 | ||
| Р2 | Затылочная | СОВПАДЕНИЕ | 1, 32 | 10.88 | <0.005 |
| ОРИЕНТАЦИЯ | 2, 64 | 3.88 | <0.05 | ||
| СОВПАДЕНИЕ × ПОЛУШАРИЕ | 1, 32 | 5.14 | <0.05 |
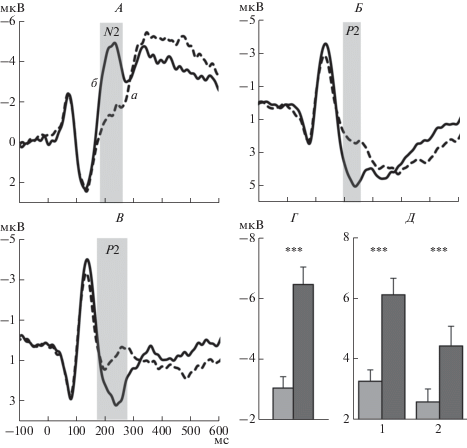
В лобных областях коры показан значимый эффект Совпадения (p < 0.0005). Как видно на усредненных ССП (рис. 2, А) и диаграммах (рис. 2, Б), амплитуда N2 выше при несовпадении эталонной и тестовой ориентаций (T = 7.53, df = 32, p < 0.0005). Взаимодействие Совпадение × × Ориентация имело характер тенденции (р = = 0.06), и последующий post-hoc анализ выявил сходство изменений амплитуды N2 при всех вариантах ориентации. Амплитуда N2 выше при несовпадении тестовой и эталонной ориентаций: для горизонтали (в правом полушарии T = 3.9, df = 32, p < 0.0005, в левом T = 3.7, df = 32, p < < 0.001), для вертикали (в правом полушарии T = 5.18, df = 32, p < 0.0005, в левом T = 3.88, df = = 32, p < 0.0005) и для наклонной ориентации (справа T = 6.18, df = 32, p < 0.0005 и слева T = 5.75, df = 32, p < 0.0005). Эффект Полушария (p < 0.01) проявлялся в большей амплитуде N2 в правом полушарии (T = 2.90, df = 32, p < 0.05).
Рис. 2.
Влияние совпадения и несовпадения эталонной и тестовой ориентаций на амплитуду компонентов N2 лобных и Р2 теменных и затылочных областей коры. А – усредненные по группе ССП на тестовый стимул лобных, теменных и затылочных кластеров правого полушария при совпадении и несовпадении текущей и удерживаемой в рабочей памяти ориентации. Слева приведены тестовые ориентации. Серой полосой выделены компоненты N2 и P2 ССП. Вертикальным черным штрихом отмечено время предъявления тестового стимула. а – несовпадение, б – совпадение. Б – средние по группе значения амплитуды N2 в правом лобном кластере, В – амплитуды Р2 в правом теменном кластере, Г – амплитуды Р2 в левом затылочном кластере. Светлые столбики – совпадение эталонного и тестового стимулов, темные столбики – несовпадение. Внизу указана ориентация тестового стимула. Достоверность различий: * – р < 0.05; ** – р < 0.01; *** – р < 0.001.

В теменных областях коры для амплитуды компонента Р2 показано значимое влияние Совпадения (p < 0.0005): амплитуда Р2 выше при несовпадении эталонной и тестовой ориентации (T = 7.39, df = 32, p < 0.0005) (рис. 2, А, В). С учетом значимого влияния Ориентации (p < 0.05) провели сравнение Р2 в условиях совпадения и несовпадения эталона и теста для каждой ориентации. Все сопоставления показали высокую значимость различий: для горизонтали (в правом полушарии T = 4.37, df = 32, p < 0.0005, в левом T = 5.15, df = = 32, p < 0.0005), для вертикали (в правом полушарии T = 5.65, df = 32, p < 0.0005, в левом T = 5.9, df = 32, p < 0.0005) и для наклонной ориентации 45° (справа T = 3.76, df = 32, p < 0.001 и слева T = = 5.38, df = 32, p < 0.0005). То есть, для всех ориентаций значимость различий между условиями совпадения и несовпадения сопоставима, об этом говорит и отсутствие значимого взаимодействия Совпадения × Ориентация. Эффект Полушария (p < 0.01) проявлялся в большей амплитуде Р2 в правом полушарии (T = 2.90, df = 32, p < 0.05).
В затылочных областях коры показан основной эффект Совпадения (p < 0.005), амплитуда Р2 выше при несовпадении эталона и тестового стимулов (T = 3.30, df = 32, p < 0.005). Это проиллюстрировано на усредненных ССП (рис. 2, А), и гистограмме амплитуды Р2 (рис. 2, Г). Значимый эффект Ориентации (p < 0.05) проявляется как более низкая амплитуда Р2 на вертикальную тестовую ориентацию по сравнению с наклонной (T = –3.17, df = 32; p < 0.005) и горизонтальной (T = –2.16, df = 32; p < 0.05). Эффект Совпадения не зависит от ориентации: значимое взаимодействие Совпадение × Ориентация отсутствует. С учетом эффекта Ориентации (p < 0.05) провели анализ контрастов Совпадение vs Несовпадение для каждой ориентации. Показано, что различия в виде более высокой амплитуды Р2 при несовпадении значимы для горизонтали (в правом полушарии T = 2.68, df = 32, p < 0.01, в левом T = 3.85, df = 32, p < 0.005), для наклонной ориентации 45° (справа T = 2.06, df = 32, p < 0.05 и слева T = 4.1, df = 32, p < 0.0005), а для вертикали они значимы только в левом полушарии (T = 2.39, df = 32, p < < 0.05).
Взаимодействие Совпадение × Полушарие (p < 0.05) проявляется как большая степень различий между совпадением и несовпадением в левом полушарии. В левом различия значимы при T = 8.04, df = 32, p < 0.0001 (3.55 ± 0.34 vs 5.06 ± ± 0.38), а в правом – при T = 5.51, df = 32, p < < 0.0001 (3.61 ± 0.43 vs 4.87 ± 0.44).
Анализ ССП в рабочей памяти на пространственные паттерны. Дисперсионный анализ амплитуд компонентов N2 (абсолютные значения) и P2 с факторами Совпадение, Область, Полушарие выявил основной эффект Совпадения (F1, 31 = = 75.7; p < 0.0005), Области (F2, 62 = 11.41; p < < 0.0005) и взаимодействие Совпадение × Область (F2, 62 = 10.39; p < 0.0005). С учетом этого взаимодействия проведен дисперсионный анализ амплитуды N2 и Р2 раздельно в лобной, теменной и затылочной областях коры. Результаты приведены в табл. 1. Выявлен основной эффект Совпадения (p < 0.0005) во всех областях коры. Так же, как в сессии с использованием ориентационных решеток, для пространственных паттернов амплитуда компонентов выше при несовпадении эталонного и тестового стимулов, что видно на усредненных ССП (рис. 3, А–В). Различия между условиями совпадения и несовпадения значимы как в лобной (рис. 3, Г), так и в теменной и затылочной (рис. 3, Д, Е) областях. В лобной области контрасты (Совпадение vs Несовпадение) значимы при T = 8.58, df = 32, p < 0.0005, в теменной – при T = 9.08, df = 32, p < 0.0005 и в затылочной – при T = 5.05, df = 32, p < 0.0005.
Рис. 3.
Влияние совпадения и несовпадения эталонного и тестового пространственных паттернов на амплитуду компонентов N2 в лобных и Р2 в теменных и затылочных областях коры. А – усредненные по группе ССП на тестовый стимул в правом лобном кластере. Б – ССП в правом теменном кластере. В – ССП в правом затылочном кластере. а – несовпадение эталона и теста, б – совпадение. Серой полосой выделены компоненты N2 и P2. Вертикальным черным штрихом отмечено время предъявления тестового стимула. Г – амплитуда N2 в правом лобном кластере. Д – амплитуда Р2 в правом теменном (1) и затылочном (2) кластере. Светлые столбики – совпадение эталонного и тестового стимулов, темные – несовпадение. Достоверность различий: *** – р < 0.001. На Г и Д приведены средние по группе значения и ошибки среднего.
Влияние типа зрительного стимула на зависимость ССП от сходства текущей и удерживаемой в рабочей памяти репрезентации. На первом этапе дисперсионного анализа (Совпадение, Стимул, Область, Полушарие) были выявлено значимое взаимодействие Совпадение × Стимул × Область (F2, 62 = 11.84, p < 0.0005). Интересно выяснить, существует ли связанная с типом стимула специфика влияния фактора Совпадение в каждой из областей, для чего провели дисперсионный анализ с факторами Совпадение, Стимул, Полушарие в каждой из них. Поскольку ранее мы не выявили значимого взаимодействия Совпадение × × Ориентация, в анализ включили амплитуду компонентов ССП, усредненную по трем ориентациям. На рис. 4 приведено сравнение амплитуд компонентов ССП на ориентационные решетки и пространственные паттерны в лобной, теменной и затылочной областях правого и левого полушарий.
Рис. 4.
Влияние совпадения и несовпадения эталонной и тестовой ориентаций на амплитуду компонентов N2 лобных и Р2 теменных и затылочных областей коры. А, Г – амплитуда N2 в лобном кластере, Б, Д – амплитуда Р2 в теменном кластере, В, Е – амплитуда Р2 в затылочном кластере. Верхний ряд – данные правого полушария, нижний – левого. 1 – совпадение эталонной и тестовой ориентации, 2 – несовпадение. а – данные для ориентаций, б – данные для пространственных паттернов. Приведены средние по группе значения и ошибки среднего. Достоверность различий: * – р < 0.05; ** – р < 0.01; *** – р < 0.001.

В лобной области для амплитуды N 2 выявлен значимый эффект Совпадения (F1, 32 = 99.55; p < < 0.0005) и взаимодействие Совпадение × Стимул (F1, 32 = 11.21; p < 0.005). Различия между условиями совпадения и несовпадения были высоко значимыми и для ориентаций (p < 0.0005, paired t-test) и для пространственных паттернов (p < < 0.0005), но как видно на рис. 4, А, Г, более отчетливы для пространственных паттернов.
В теменной области для амплитуды Р2 выявлен значимый эффект Совпадения (F1, 32 = 117.93; p < < 0.0005) и взаимодействие Совпадение × Стимул (F1, 32 = 17.21; p < 0.0005). Разница между условиями совпадения/несовпадения отчетлива и для ориентаций (p < 0.0005) и для пространственных паттернов (p < 0.0005), но, как видно на рис. 4, Б, Д, более отчетлива для последних.
В затылочной области для амплитуды Р2 выявлен эффект Совпадения (F1, 32 = 27.63; p < 0.0005) и взаимодействия Совпадение × Стимул (F1, 32 = = 7.02; p < 0.01) и Совпадение × Полушарие (F1, 32 = = 4.24; p < 0.05). Как видно на рис. 4, В, Е, разница между условиями совпадения и несовпадения для ориентаций выше в левом полушарии (слева – p < < 0.001, справа – p < 0.05), для пространственных паттернов она сходна в обоих полушариях (p < < 0.0005).
Важно выяснить, существуют ли в зрительных областях коры различия во влиянии фактора Совпадение на амплитуду ССП в задачах РП на ориентации и РП на пространственные паттерны. Был выполнен дисперсионный анализ амплитуды Р2 с факторами Совпадение, Область (теменная и затылочная), Стимул (ориентации, пространственные паттерны). Выявлены эффекты Совпадения (F1, 31 = 59.93; p < 0.0001), Области (F1, 31 = 32.01; p < 0.005) и взаимодействия Совпадение × Стимул (F1, 31 = 11.55; p < 0.005), Совпадение × Область (F1, 31 = 28.54; p < 0.0005) и на уровне тенденции Совпадение × Стимул × Область (F1, 31 = 3.06; p = 0.09). То есть проведенный анализ не выявил связанных с типом стимула различий в регионарной специфике эффектов совпадения или несовпадения эталона и тестового стимулов. Вместе с тем показана регионарная специфика для самой амплитуды Р2 вне зависимости от сходства или различия эталонного и тестового стимулов. Для пространственных паттернов амплитуда Р2 зависит от Области (F1, 31 = = 31.59; p < 0.0001) и выше в теменной по сравнению с затылочной, а для ориентаций такие регионарные различия отсутствуют. Этот эффект хорошо виден на рис. 4 при сравнении фрагментов Б и В и Д и Е.
Анализ распределенных дипольных источников ССП. Проводили моделирование распределенных источников ССП во временнóм окне 160–280 мс, соответствующем развитию фронтальной негативности и каудальной позитивности. Моделирование проводили для усредненных по группе ССП для ситуаций совпадения и несовпадения эталонного и тестового стимулов. В SPM12 был выполнен статистический анализ различий плотности тока между ситуациями совпадения и несовпадения.
В табл. 2 приведен список корковых зон, в которых обнаружены значимые различиями между ситуациями совпадения и несовпадения эталонного и тестового стимулов, на рис. 5, А–Г представлена их топография. На рис. 5, А, Б представлена топография различий в сессии с использованием ориентационных стимулов. Видно, что значимые различия локализуются в следующих зонах левого полушария: Lateral Occipital G., Middle Temporal G., Inferior Parietal G., Pars Opercularis. Аналогичный анализ распределения дипольных источников вызванной активности в сессии с использованием пространственных паттернов выявил другую топографию корковых зон, “чувствительных” к различиям эталона и теста.
Таблица 2.
Анатомические структуры, в которых обнаружены значимые различия плотности дипольного тока (p ≤ 0.0001) между условиями совпадения и несовпадения текущего и удерживаемого в памяти стимулов
| Анатомические структуры | Brodmann area | Полушарие |
|---|---|---|
| РП на ориентации | ||
| Pars Opercularis | 44 | Л |
| Inferior Parietal | 39, 40 | Л |
| Superior Temporal | 22, частично 41, 42 | Л |
| Lateral Occipital | 17, 18, 19 | Л |
| РП на пространственные паттерны | ||
| Superior Frontal | 8, частично 6, 9 | П, Л |
| Rostral Middle Frontal | 10 | Л |
| Caudal Middle Frontal | 46, частично 9 | П |
| Precentral | 4 | П |
| Postcentral | 1, 2, 3 | П |
| Inferior Parietal | 39, 40 | П |
| Superior Temporal | 22, частично 41, 42 | П |
| Middle Temporal | 21, частично 38 | П |
| Lateral Occipital | 17, 18, 19 | П |
Рис. 5.
Корковая топография различий между ситуациями совпадения и несовпадения эталонного и тестового стимулов. Темным выделены анатомические структуры, в которых различия плотности дипольного тока значимы (p ≤ 0.0001). Представлены латеральные проекции правого (А) и левого (Б) полушарий в рабочей памяти (РП) на ориентации и правого (В) и левого (Г) полушарий в РП на пространственные паттерны. Цифрами обозначены следующие структуры: 1 – Superior Frontal g., 2 – Rostral Middle Frontal g., 3 – Caudal Middle Frontal g., 4 – Pars Opercularis; 5 – Precentral g., 6 – Postcentral g., 7 – Inferior Parietal g., 8 – Superior Temporal g., 9 – Middle Temporal g., 10 – Lateral Occipital g.

Как видно на рис. 5, В, Г, значимые различия локализованы преимущественно в правом полушарии в следующих зонах интереса: Lateral Occipital G., Superior Temporal G., Middle Temporal G., Postcentral G., Precentral G., Caudal Middle Frontal G. и Superior Frontal G. В левом полушарии значимые различия показаны в Rostral Middle Frontal G. и Superior Frontal G.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Настоящее исследование было направлено на дальнейший анализ нейрофизиологических механизмов детектирования несовпадения текущей информации об ориентационных свойствах объекта, удерживаемой в РП. Результаты предыдущих этапов работы представлены в [5, 6]. В настоящей работе мы провели анализ событий, разворачивающихся одновременно в проекционных (компонент P2) и переднеассоциативных (компонент N2) отделах коры, и соответствующих одному из заключительных этапов сличения текущей и удерживаемой в памяти ориентаций. Значимость оценки событий в этом временнóм интервале для понимания скоординированной деятельности фронтальных и каудальных областей коры в РП продемонстрирована в [7]. Применение моделирования распределенных дипольных источников компонентов N2 и P2 позволило определить, участие каких структур мозга критично для выполнения операции сличения стимулов, а сопоставление с результатами, полученными в модели РП на пространственные паттерны, позволило выделить особенности организации этой нейросети, специфичные для памяти на низкоуровневые зрительные признаки.
Наиболее важными, из полученных результатов, представляются следующие: 1) несовпадение текущей и удерживаемой в памяти ориентаций по сравнению с совпадением характеризуется увеличением амплитуды одновременно разворачивающихся фронтальной негативности N2 и позитивности Р2 каудальных отделов коры; 2) моделирование распределенных дипольных источников показало, что в этом временнóм интервале наиболее значимыми для детектирования различий ориентаций являются процессы переработки в затылочной, нижнетеменной и верхней височной зонах, а также в оперкулярной части нижнелобной коры левого полушария; 3) для пространственных паттернов – детектирование их несовпадения также сопровождается увеличением амплитуды ССП в проанализированном временнóм интервале, но с иной корковой топографией различий дипольной активности и преимуществом правого полушария.
Увеличение амплитуды N2 в лобных отделах коры при несовпадении текущей и удерживаемой в памяти ориентаций было описано нами ранее [5]. Ряд исследователей рассматривают негативность ССП передних отделов коры (N270) как электрографическое отражение конфликта текущей и хранящейся в РП информации о форме [13–15], цвете [15], характеристиках лицевого паттерна [13]. По предположению этих авторов N270 возникает при несоответствии между сенсорным входом и внутренней репрезентацией. N270 отличается устойчивым максимумом амплитуды в передних отделах, а ее источник локализован в структурах префронтальной коры и передней цингулярной зоны [15]. В нашей работе [5] роль фронтальных образований в выявлении несовпадения двух ориентаций показана при моделировании источников N2. Плотность дипольного тока увеличивалась во фронтальных структурах middle frontal gyrus, frontal pole и pars orbitalis.
В настоящей работе сходный эффект повышения N2 при несовпадении эталонного и тестового стимула показан и для РП на пространственные паттерны. Значимое взаимодействие факторов Совпадение и Тип стимула проявлялось лишь в большей степени прироста N2 для пространственных паттернов по сравнению с ориентациями. Эти различия могут быть связаны как с привлечением большего ресурса пространственного внимания к выполнению операции сличения стимулов-паттернов с различным расположением их внутренних элементов, так и с большей амплитудой самого ССП на пространственные паттерны по сравнению с ориентациями [16]. Но в целом характер изменений фронтальной негативности N2 для ориентаций и пространственных паттернов сходен, что соответствует литературным сведениям об отсутствии зависимости динамики N2 во фронтальных зонах коры от типа стимула [13, 15].
В теменных и затылочных областях несовпадение текущей и удерживаемой в памяти ориентаций сопровождается увеличением амплитуды компонента Р2, развивающегося на том же временнóм отрезке, что и фронтальная негативность N2.
Представленные литературные сведения о топографии компонента Р 2, его изменениях в различных экспериментальных парадигмах и функциональной значимости неоднозначны. Согласно литературе, топография этого компонента имеет определенное сходство для стимулов разных модальностей и в большинстве случаев имеет максимум в центральном отведении [17, 18], хотя есть данные о максимуме зрительного P 2 в теменно-затылочных областях [19]. Корковые источники Р 2 локализуются в проекционных областях, соответствующих модальности стимулов [20].
Что касается функциональной значимости Р2, то многие исследователи связывают изменения этого компонента с реакцией на нецелевые стимулы [17, 21–23]. В работе [18] наблюдали увеличение Р2 слухового ССП при ошибках, что авторы связывают с подавлением “ошибочной” переработки информации. P2 интерпретируется как отражение тормозного процесса, подавляющего нерелевантную информацию [24]. Роль этой позитивности в разделении значимой и незначимой информации показана в работе [23], где выделение целевой буквы на фоне неконгруэнтного контекста сопровождалось ростом позитивности с латентностью 200 мс в лобных, центральных и теменных областях коры. В работе [21] авторы указывают на информативность компонента P200/P300 (латентность около 250 мс) в теменных областях коры как показателя операции выделения несовпадения текущих и ранее прослушанных цифр. По данным исследования [20], компонент Р2, не являясь маркером собственно обучения, отражает операцию классификации поступившей информации. На значимость Р2 как показателя сопоставления сенсорных входов со следами памяти указывают авторы работы [19].
Возможный механизм увеличения амплитуды Р2 при несовпадении текущего и предшествующего сигналов обсуждается в работе [22]. Авторы исследовали изменения комплекса N1–P2 соматосенсорных и слуховых ССП на девиантный сигнал в последовательности стимулов при различных межстимульных интервалах (100–1000 мс). Обнаружен независимый от модальности стимула эффект повышения N1 и снижения Р2 при коротких интервалах и, напротив, понижения N1 и повышения Р2 при более длительных. Авторы предполагают, что такая динамика объясняется возникновением отдельного компонента, перекрывающегося по времени с комплексом N1–P2, нейронные генераторы которого запускаются в ситуации, когда входящий стимул не соответствует репрезентации, сформировавшейся в памяти на предшествующий. Более подробно генез этого компонента рассмотрен в [25]. Но при коротких интервалах (до 200 мс) и, следовательно, недостаточной сформированности следа предшествующего стимула, возникает не позитивное, а негативное отклонение, увеличивающее N1. Напротив, при достаточной длительности интервала позитивность повторения увеличивает амплитуду Р2.
Несмотря на сходство в изменениях амплитуды Р2 в РП на ориентации и пространственные паттерны, мы обнаружили ряд различий. Так, в теменной области при сходстве динамики амплитуды Р2 ее увеличение при несоответствии эталона и теста значительно выше для пространственных паттернов по сравнению с ориентациями. Сходные различия отмечены и для фронтальной негативности N2. В затылочных областях коры различия, связанные с типом стимула, более отчетливы. Во-первых, это более высокая амплитуда Р2 на ориентации по сравнению с пространственными паттернами в ситуации совпадения эталона и теста, что говорит о большей чувствительности затылочной коры к этому типу стимулов. Во-вторых, в ситуации несовпадения амплитуда Р2 на оба типа стимулов сходна, тогда как во фронтальной и теменной областях она значительно выше на пространственные паттерны. В-третьих, есть различия в характере межполушарной асимметрии. Для ориентаций различия между ситуациями совпадения и несовпадения выше в левом полушарии, для пространственных паттернов межполушарные различия в эффектах отсутствуют.
Хорошо известно, что затылочная область является ранним звеном анализа ориентационных характеристик [26]. В затылочной коре происходит раннее сопоставление текущей и удерживаемой в памяти ориентаций и имплицитная их дискриминация [2]. По нашим данным [6], нейрофизиологическим маркером различий текущей и удерживаемой в памяти ориентаций является рост амплитуды раннего комплекса Р100/N150 в затылочной коре. То есть, обнаруженное в настоящей работе увеличение амплитуды Р2, можно рассматривать как этап следующий за “сенсорным” этапом сопоставления ориентаций. Тот факт, что в затылочной области коры несовпадение текущей и удерживаемой в памяти ориентаций вызывает изменение амплитуды нескольких компонентов, включая ранние сенсорные, подчеркивает роль этой области как активного участника этапа воспроизведения. В работе [27], методом связанной с событиями фМРТ показано участие проекционных областей коры не только на этапе запечатления информации, но и при ее воспроизведении. Авторы подчеркивают специфику активации проекционных областей, которая определяется сенсорным признаком запоминаемого стимула, и в меньшей степени зависит от деятельности как таковой (practice), чем активация более высоких корковых уровней.
Для оценки регионарных особенностей операции сличения ориентаций и пространственных паттернов проведен анализ топографии зон коры, в которых различия плотности дипольного тока между условиями сходства и различия эталонного и тестового стимулов были высоко значимыми (p ≤ 0.0001). Важно подчеркнуть, что обсуждение данных о топографии корковой активности, связанной с процессом различения актуальных и хранящихся в памяти характеристик стимула, имеет свои ограничения, так как в литературе преимущественно представлены данные фМРТ, зарегистрированной на этапе удержания репрезентаций стимулов (период “delay”). Однако аргументом в пользу возможности подобных сопоставлений является работа [28], в которой показано перекрытие областей коры, активирующихся при удержании и воспроизведении информации, хотя и при неодинаковой динамике их вовлечения по показателю фазовой когерентности (“coherence phase analyses”). Важным обстоятельством, так же накладывающим ограничения на такое сопоставление, является разное временнóе разрешение методов фМРТ и ССП.
Для вызванной электрической активности при сравнении ориентационных стимулов значимые контрасты обнаружены в левом полушарии в следующих зонах: латеральной области затылочной коры (Lateral Occipital G.), нижнетеменной области коры (Inferior Parietal G.), верхней височной извилине (Superior Temporal G.), оперкулярной части нижнелобной извилины (Pars Opercularis Inferior Frontal G.). Эти данные о затылочной локализации значимых контрастов между условиями совпадения и несовпадения ориентаций согласуются с повышением амплитуды затылочного компонента Р2 при несовпадении эталона и теста и соответствуют многочисленным сведениям о роли затылочной области коры в РП на низкоуровневые зрительные признаки.
Значимые контрасты между условиями совпадения и несовпадения эталонной и тестовой ориентаций также были обнаружены в теменной коре, верхней височной извилине и оперкулярной части нижнелобной коры. Эти результаты соотносятся с данными об устойчивой активации в период удержания зрительной информации в РП не только проекционных затылочных, но и нижневисочных, теменных и префронтальных областей, где сохраняются высокоуровневые репрезентации этих стимулов [3, 29–32].
В префронтальной коре только одна зона – оперкулярная (Pars opercularis), продемонстрировала высоко значимые различия между двумя условиями сличения. Оперкулярная зона является одним из трех субрегионов вентролатеральной префронтальной коры. Эти субрегионы (pars orbitalis, pars triangularis, pars opercularis) имеют между собой тесные функциональные и морфологические связи [33, 34] и совместно с теменной и височной областями образуют источник нисходящих влияний, поддерживающих в РП воспроизведение информации [35, 36].
По нашим данным зоны значимых контрастов в задачах на удержание в РП ориентационных характеристик зрительного стимула локализованы в левом полушарии. Есть два возможных объяснения такой межполушарной асимметрии. Во-первых, ориентации являются локальными характеристиками объектов и сцен, которые анализируются преимущественно в левом полушарии [37]. Во-вторых, использованные нами в работе ориентации – горизонталь, вертикаль и наклонная ориентация – относятся к ориентационным категориям, имеющим конвенциональные вербальные метки [38]. Наличие категориального и вербального компонентов так же может определять левополушарное преобладание обнаруженных эффектов [39, 40].
Для другой категории стимулов – пространственных паттернов – топография значимых различий между двумя условиями сличения была иной. Значимые контрасты получены в большем числе корковых зон. Они включают следующие области правого полушария: латеральную затылочную область (Lateral Occipital G.), нижнетеменную область коры (Inferior Parietal G.), верхнюю и среднюю височные извилины (Superior и Middle Temporal G.), прецентральную (Precentral G.) и постцентральную (Postcentral G.) извилины и префронтальные области (Superior Frontal G., Rostral Middle Frontal G. и Caudal Middle Frontal G.).
В РП на пространственные паттерны, так же как в РП на ориентации, значимые контрасты между двумя условиями сличения выявлены нами в затылочной и нижнетеменной областях коры. Затылочная область, как первичная проекционная, активируется в РП при различных типах зрительных стимулов [3]. В работе [39] приведены данные позитронно-эмиссионной томографии об активации средней и верхней затылочной извилин в РП на фигуры, представляющие упорядоченные группы квадратов, т.е., стимулы сходные с использованными нами пространственными паттернами. По данным анализа фМРТ и ССП воспроизведение информации о сложных изображениях (“recollection”) сопровождается активацией затылочной коры [41]. Сведения об активации нижнетеменной области в РП на пространственные паттерны и другие сложные зрительные стимулы представлены в работах [39, 41, 42]. При этом уровень активации нижнетеменной области на сложные изображения выше, чем на более простые [16, 42].
Сведения о топографии изменений во фронтальной коре в задачах, требующих вовлечения пространственной РП, представлены в большом числе публикаций [3, 27, 41, 43]. По данным анализа литературы, представленном в [43], при выполнении таких задач активируется широкий круг структур префронтальной коры, включающий нижнелобную, среднелобную и верхнелобную извилины, а также моторная кора (SMA) и латеральная премоторная область.
Обнаруженное нами правополушарное преобладание значимых различий между условиями совпадения и несовпадения зрительно-пространственных характеристик стимулов связано с преимуществом правого полушария в анализе сложных зрительных стимулов [37, 43–45]. В работе [46] приведены данные о правополушарном преобладании активности при анализе геометрических фигур, похожих на использованные нами пространственные паттерны, и представляющих собой упорядоченные группы небольших квадратов. Преимущественное участие фронтальных структур правого полушария в пространственной РП убедительно показано в работе [43].
Более широкая топография зон значимых различий между условиями сличения пространственных паттернов по сравнению со сличением ориентаций связана с вовлечением в пространственную РП не только проекционных областей и управляющих префронтальных структур, но также областей моторной и сенсомоторной коры, глазодвигательных полей и связанных с гиппокампом височных областей. Напротив, память на ориентации ближе к особому виду “низкоуровневой перцептивной памяти” [2]. Как мы указывали выше, она имеет имплицитный характер, при котором сличение происходит рано, уже на этапе сенсорного анализа на уровне первичных корковых уровней переработки зрительного сигнала. Такая организация делает ее достаточно независимой от влияния многих дополнительных внешних и внутренних факторов, обеспечивая надежность важной функции восприятия основных пространственных осей и поддержание стабильности характеристик зрительного пространства.
ЗАКЛЮЧЕНИЕ
Анализ связанных с событиями потенциалов и данных моделирования распределенных дипольных источников ЭЭГ на этапе, соответствующем обнаружению несоответствия текущего и удерживаемого в РП сигнала, показал, что:
1) несовпадение текущей и удерживаемой в памяти ориентаций по сравнению с совпадением характеризуется увеличением амплитуды одновременно разворачивающихся негативных отклонений ССП во фронтальных отделах коры и позитивных отклонений ССП в каудальных отделах коры;
2) в этом временнóм интервале наиболее значимыми для детектирования различий ориентаций являются нейрональные процессы в затылочной, нижнетеменной и верхней височной областях, а также в оперкулярной части нижнелобной коры левого полушария;
3) для других зрительных стимулов – пространственных паттернов – детектирование их несовпадения также сопровождается увеличением амплитуды фронтальных негативных и каудальных позитивных компонентов ССП, но с иной корковой топографией различий в активности распределенных диполей и преимуществом правого полушария.
Полученные результаты подчеркивают, с одной стороны, общность в организации нейросетей, участвующих в выявлении несоответствия текущего сигнала с удерживаемой в памяти репрезентацией, с другой, возможность их пластических перестроек, связанных с характером обрабатываемой информации.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института высшей нервной деятельности и нейрофизиологии РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа поддержана Грантом РФФИ (Проект № 19-013-00918\19).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Hollingworth A., Richard A.M., Luck S.J. Understanding the function of visual short-term memory in human cognition: Transsaccadic memory, object correspondence, and gaze correction // J. Exp. Psychol. Gen. 2008. V. 137. P. 163.
Magnussen S. Low-level memory processes in vision // Trends Neurosci. 2000. V. 23. № 6. P. 247.
Christophel T.B., King P. C., Spitzer B. et al. The disturbed nature of working memory // Trends in Cogn. Sciences. 2017. V. 21. № 2. P. 111.
Harrison S.A., Tong F. Decoding reveals the contents of visual working memory in early visual areas // Nature. 2009. V. 458. № 7238. P. 632.
Михайлова Е.С., Герасименко Н.Ю., Славуцкая А.В. и др. Временны́е и топографические характеристики вызванных потенциалов в ситуации конфликта двух последовательных зрительных стимулов в задаче на зрительную память // Физиология человека. 2017. V. 43. № 3. P. 13. Mikhailova E.S., Gerasimenko N.Yu., Slavutskaya A.V. et al. Temporal and Topographic Characteristics of Evoked Potentials in the Conflict of Two Consecutive Visual Stimuli in a Working Memory Task // Human Physiology. 2017. V. 43. № 3. P. 248.
Михайлова Е.С., Герасименко Н.Ю., Славуцкая А.В. Сенсорные механизмы ранней дискриминации ориентаций в модели зрительной рабочей памяти // Журн. высш. нерв. деятельности. 2019. T. 69. № 5. C. 577. Mikhailova E.S., Gerasimenko N.Yu., Slavutskaya A.V. [Sensory mechanism of early discrimination of orientations in the visual working memory] // Zh. Vyssh. Nerv. Deyat. Im. I.P. Pavlova. 2019. V. 69. № 5. P. 577.
Potts G.F., Tucker D.M. Frontal Evaluation and Posterior Representation in Target Detection // Cognitive Brain Res. 2001. V. 11. P. 147.
Pinal D., Zurrón M., Díaz F. Effects of load and maintenance durationon the time course of information encoding and retrieval in working memory:from perceptual analysis to post-categorization processes // Front. Hum. Neurosci. 2014. V. 8. Article 165. P. 1.
Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. Royal Stat. Soc. 1995. Series B. V. 57. № 1. P. 289.
Крылова М.А., Изъюров И.В., Герасименко Н.Ю. и др. Моделирование источников компонентов зрительных вызванных потенциалов человека в задаче определения ориентации отрезков линий // Журн. высш. нервн. деят. 2015. Т. 65. № 6. С. 685. Krylova M.A., Izyurov I.V., Gerasimenko N.Y. et al. [The Modeling of Human Visual ERPs Sources in the Task of Line Orientation Identification] // Zh. Vyssh. Nerv. Deyat. Im. I.P. Pavlova. 2015. V. 65. № 6. P. 685.
Mazoyer B., Joliot M. Automated Anatomical Labeling of activations in SPM using a Macroscopic Anatomical Parcellation of the MNI MRI single-subject brain // NeuroImage. 2002. V. 15. № 1. P. 273.
Brett M., Anton J.-L., Valabregue R., Poline J.-B. Region of interest analysis using an SPM toolbox [abstract] // NeuroImage. 2002. V. 16. № 2. https://doi.org/10.1016/S1053-8119(02)90013-3
Zhang Y., Wang Y., Wang H. et al. Different processes are involved in human brain for shape and face comparisons // Neurosci. Lett. 2001. V. 303. № 3. P. 157.
Wang H., Wang Y., Kong J. et al. Enhancement of conflict processing activity in human brain under task relevant condition // Neurosci. Lett. 2001. V. 298. № 3. P. 155.
Yin J., Gao Z., Jin X. et al. Tracking the mismatch information in visual short term memory: An event-related potential study // Neurosci. Lett. 2011. V. 491. № 1. P. 26.
Gao Z., Li J., Liang J. et al. Storing fine detailed information in visual working memory—Evidence from event-related potentials // J. Vis. 2009. V. 9. № 7. P. 17.
Crowley K.E., Colrain I.M. A review of the evidence for P2 being an independent component process: age, sleep and modality // Clin. Neurophysiol. 2004. V. 115. № 4. P. 732.
Chernyshev B.V., Medvedev V. Event-related potential study of P2 and N2 components on fast and slow responses in the auditory condensation task / BASIC RESEARCH PROGRAM WORKING PAPERS SERIES: PSYCHOLOGY. WP BRP 70/PSY/2016
Freunberger R., Klimesch W., Doppelmayr D., Holler Y. Visual P2 component is related to theta phase-locking // Neurosci. Lett. 2007. V. 426. № 3. P. 181.
Tremblay K.L., Ross B., Inoue K. et al. Is the auditory evoked P2 response a biomarker of learning? // Front. Syst. Neurosci. 2014. V. 8. P. 28.
Lefebvre C.D., Marchanda Y., Eskes G.A., Connoll J.F. Assessment of working memory abilities using an event-related brain potential (ERP)-compatible digit span backward task // Clin. Neurophysiol. 2005. V. 116. № 7. P. 1665.
Wang A.L., Mouraux A., Liang M., Iannetti G.D. The Enhancement of the N1 Wave Elicited by Sensory Stimuli Presented at Very Short Inter-Stimulus Intervals Is a General Feature across Sensory Systems // PLoS ONE. 2008. V. 3. № 12. e3929.
Novak G., Ritter W., Vaughan H.G., Jr. Mismatch detection and the latency of temporal judgements // Psychophysiology. 1992. V. 29. № 4. P. 398.
Coenen A. Modelling of auditory evoked potentials of human sleep–wake states // Int. J. Psychophysiol. 2012. V. 85. № 1. P. 37.
Haenschel C., Vernon D.J., Dwivedi P. et al. Event related brain potential correlates of human auditory sensory memory-trace formation // J. Neurosci. 2005. V. 25. № 45. P. 10 494.
Hubel D.H., Wiesel T.N. Receptive fields, binocular interaction and functional architecture in the cat’s visual cortex // J. Physiol. 1962. V. 160. № 1. P. 106.
Landau S., Garavan M.H., Schumacher E.H., D’Esposito M. Regional specificity and practice: Dynamic changes in object and spatial working memory // Brain Res. 2007. V. 1180. P. 78.
Miller B.T., D’Esposito M. Spatial and temporal dynamics of cortical networks engaged in memory encoding and retrieval // Front. Hum. Neurosci. 2012. V. 6. P. 109.
Courtney S.M., Petit L., Maisog J.M. et al. An area specialized for spatial working memory in human frontal cortex // Science. 1998. V. 279. № 5355. P. 1347.
Curtis C.E., D’Esposito M. Persistent activity in the prefrontal cortex during working memory // Trends. Cogn. Sci. 2003. V. 7. P. 415.
Xu X., Collins C.E., Khaytin I. et al. Unequal representation of cardinal vs. oblique orientations in the middle temporal visual area // PNAS. 2006. V. 103. P. 17490.
Ester E.F., Sprague T.C., Serences J.T. Parietal and frontal cortex encode stimulus-specific mnemonic representations during visual working memory // Neuron. 2015. V. 87. № 4. P. 893.
Barredo J., Öztekin I., Badre D. Ventral fronto-temporal pathway supporting cognitive control of episodic memory retrieval // Cereb. Cortex. 2015. V. 25. № 4. P. 1004.
Barredo J., Verstynen T.D., Badre D. Organization of cortico-cortical pathways supporting memory retrieval across subregions of the left ventrolateral prefrontal cortex // J. Neurophysiol. 2016. V. 116. № 3. P. 920.
Wagner A., Paré-Blagoev E., Clark J., Poldrack R. Recovering meaning: left prefrontal cortex guides controlled semantic retrieval // Neuron. 2001. V. 31. № 2. P. 329.
Badre D., Poldrack R.A., Paré-Blagoev E.J. et al. Dissociable controlled retrieval and generalized selection mechanisms in ventrolateral prefrontal cortex // Neuron. 2005. V. 47. № 6. P. 907.
Fink G.R., Halligan P.W., Marshall J.C. et al. Neural mechanisms involved in the processing of global and local aspects of hierarchically organized visual stimuli // Brain. 1997. V. 120. P. 1779.
Wakita M. Categorical perception of orientation in monkeys // Behav. Processes. 2004. V. 67. № 2. P. 263.
Smith E.E., Jonides J. Working memory: A view from neuroimaging // Cogn. Psychol. 1997. V. 33. № 1. P. 5.
Slotnick S.D., Moo L.R. Prefrontal cortex hemispheric specialization for categorical and coordinate visual spatial memory // Neuropsychologia. 2006. V. 44. P. 1560.
Herzmann G., Jin M., Cordes D., Curran T. A within-subject ERP and fMRI investigation of orientation-specific recognition memory for pictures // Cogn. Neurosci. 2012. V. 3. № 3–4. P. 174.
Barton B., Brewer A.A. Visual working memory in human cortex // Psychology. 2013. V. 4. № 8. P. 655.
D’Esposito M., Aguirre G.K., Zarahn E. et al. Functional MRI studies of spatial and nonspatial working memory // Cognit. Brain Res. 1998. V. 7. № 1. P. 1.
Levelt W.J., Praamstra P., Meyer A.S. et al. An MEG study of picture naming // J. Cogn. Neurosci. 1998. V. 10. № 5. P. 553.
Corbetta M., Kincade J.M., Ollinger J.M. et al. Voluntary orienting is dissociated from target detection in human posterior parietal cortex // Nat. Neurosci. 2000. V. 3. P. 292.
Omoto S., Kuroiwa Y., Otsuka S. et al. P1 and P2 components of human visual evoked potentials are modulated by depth perception of 3-dimensional images // Clin. Neurophysiol. 2010. V. 121. № 3. P. 386.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


