Физиология человека, 2021, T. 47, № 1, стр. 5-19
Контроль функционального состояния мозга на основе оценки динамики интегральных параметров многоканальной ЭЭГ у человека в условиях гипоксии
В. П. Рожков 1, *, М. И. Трифонов 1, С. И. Сороко 1
1 ФГБУН Институт эволюционной физиологии и биохимии имени И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: vlrozhkov@mail.ru
Поступила в редакцию 30.04.2020
После доработки 08.06.2020
Принята к публикации 02.09.2020
Аннотация
Разработка методов контроля функционального состояния (ФС) человека в экстремальных условиях имеет важное прикладное значение. Целью работы являлось изучение динамики интегральных параметров ЭЭГ при пребывании в условиях дефицита кислорода у лиц с различной чувствительностью и устойчивостью к гипоксии. Острую гипоксию вызывали, используя для дыхания смесь с 8% кислорода в азоте. В исследовании участвовал 41 мужчина в возрасте от 19 до 45 лет. Регистрировали комплекс физиологических показателей и многоканальную ЭЭГ, по которой строили структурную функцию и рассчитывали нормированные интегральные параметры Pt и Ps. Данные параметры использовали в качестве меры временно́й (Pt) и пространственной (Ps) связности колебаний потенциалов мозга. Крайние значения параметров 0 и 1 соответствовали полностью детерминированной и “случайной” временно́й и пространственной организации ЭЭГ. Уменьшение Pt по мере углубления гипоксии свидетельствовало о росте временно́й связности, инерционности в ЭЭГ, характеризующем снижение физиологической лабильности и ФС мозга. Значимые изменения Ps, свидетельствующие о повышении степени пространственной связности в ЭЭГ, выявлены только у лиц с низкой устойчивостью к гипоксии в предколлаптоидном состоянии. Использование нормированных параметров Pt и Ps позволяет провести классификацию испытуемых по степени чувствительности к гипоксии и выявлять лиц с высокой чувствительностью при относительно небольшом падении кислородной сатурации гемоглобина (SaO2) и лиц, устойчивых к гипоксии даже при низких уровнях SaO2, что имеет важное значение для отбора лиц, работа которых связана с воздействием гипоксии.
Изучение механизмов срочной адаптации к среде с острым дефицитом кислорода и определение физиологических критериев быстро развивающегося состояния гипоксии имеет важное значение для обеспечения безопасности жизни и деятельности человека. Это касается пребывания и работы человека в условиях среднегорья и высокогорья, спортсменов и туристов, занимающихся горными восхождениями [1–3]. Нередко состояние острой гипоксии возникает в условиях аварийных ситуаций при управлении сложными техническими устройствами на больших высотах, подводных и подземных работах [1, 2, 4].
Знание системных механизмов адаптации к острой кислородной недостаточности у здоровых людей может существенно приблизить нас к пониманию причин и последствий острого развития гипоксемии у пациентов отделений интенсивной терапии, поскольку эти физиологические компенсаторно-приспособительные реакции также вовлекаются в ответ организма на остро развивающуюся гипоксию и гипоксемию у больных в критическом состоянии [5].
Острая гипоксия в крайнем своем выражении ведет к нарушению витальных функций, однако на более раннем этапе может приводить к частичной дезинтеграции системной деятельности мозга с развитием психических расстройств и нарушением деятельности [1, 2, 4, 6]. Наиболее ранними механизмами срочной компенсации гипоксического состояния является увеличение минутного объема дыхания и кровообращения. Поэтому в качестве критериев гипоксической чувствительности и устойчивости часто используют величину снижения уровня кислородной сатурации гемоглобина крови [6–8], а также частоту сердечных сокращений (ЧСС) или показатели ее вариабельности [9]. Между тем, если под гипоксической устойчивостью подразумевать сохранение способности адекватно оценивать обстановку и осуществлять целенаправленную деятельность, то на первом плане оказываются показатели ЭЭГ, характеризующие уровень активности и изменение функционального состояния мозга. Установлено, что развитие гипоксического состояния организма сопровождается выраженными изменениями ЭЭГ: замедлением частоты колебаний потенциалов с постепенным переходом к доминированию Δ-диапазона частот, появлением пароксизмальных форм активности и в тяжелых случаях угнетением активности [1, 2]. У лиц с хронической сосудистой патологией уже на ранних стадиях развития гипоксии мозга в ЭЭГ наблюдаются ирритативные изменения в форме заостренности колебаний потенциалов, диффузной низкоамплитудной островолновой активности, нарастания выраженности высокочастотных составляющих ЭЭГ [10].
Решение задачи автоматического определения глубины гипоксического состояния требует выявления информативных в этом отношении параметров ЭЭГ и их численной оценки. На практике глубину гипоксии наиболее часто оценивают на основе измерений спектра мощности колебаний потенциалов в различных диапазонах частот ЭЭГ, в особенности в Δ-диапазоне частот, а также расчета различных соотношений спектральных мощностей в Δ-, θ-, α-, β-диапазонах частот [3, 11, 12]. Признаки функциональных перестроек, вызываемых гипоксией, проявляются в динамике коэффициентов корреляции между ЭЭГ в различных отведениях [13–15] и коэффициентов когерентности в различных отведениях и частотных диапазонах [14, 16], характеризующих изменения пространственной организации ЭЭГ, а также обнаруживаются в перестройке “алгоритма” взаимосвязей (вероятностей переходов) между волновыми компонентами основных ритмов ЭЭГ [14], характеризующих изменения временно́й организации ЭЭГ.
Этот далеко не полный список параметров многоканальной “количественной” ЭЭГ (qEEG) может быть дополнен показателями, характеризующими ЭЭГ как процесс со свойствами динамического хаоса. В исследовании [17] выявлено уменьшение значения показателя аппроксимированной энтропии (Approximate Entropy) ЭЭГ, свидетельствующее о росте доли детерминированной и уменьшении хаотической составляющей ЭЭГ-процесса в условиях гипоксии. Поскольку глубинные причины наблюдаемых изменений ЭЭГ остаются до сих пор не ясными, то среди исследователей нет единого мнения о том, какие из этих показателей являются наиболее информативными при оценке воздействия гипоксии – спектральные [3, 12], кросс-корреляционные [13–15], кросс-спектральные [16] или энтропийные [17].
Примерами успешного решения проблемы оценки уровня бодрствования и степени угнетения сознания по данным количественной ЭЭГ служат экспертные системы, применяемые в анестезиологии для объективного контроля глубины наркоза у пациентов во время операции. Можно отметить как различия, так и определенные сходствa в динамике развития острой гипоксии и погружения в медикаментозный сон, которые состоят в изменении сознания – от сумеречного состояния до полного угнетения, а также изменениях ЭЭГ – от замедления электрической активности мозга до ее подавления. Так, степень замедления ЭЭГ, характеризующую уровень угнетения сознания и глубину медикаментозного сна, определяют по параметру SEF (spectral edge frequency), который включает оценку граничных частот, в пределах которых, в частности, лежит 90 или 95% спектральной мощности сигнала [18]. Однако наиболее эффективным нейрофизиологическим методом интраоперационного мониторинга в настоящее время признают анализ ЭЭГ с расчетом параметра “биспектральный индекс” (Bispectral Index, BIS). В алгоритм анализа входит расчет: 1) отношения спектральной плотности мощности в диапазонах частот 30–47 и 11–20 Гц, 2) отношения биспектральной активности в диапазонах 0.5–47 и 40–47 Гц, а также 3) показателя BSR (Burst-Suppression Ratio) – отношения длительности эпизодов вспышек и угнетения электрической активности мозга. Исходя из значений этих показателей, рассчитывают BIS – интегральную безразмерную величину от 0 (угнетенное сознание, депрессия ЭЭГ) до 100 (полное сознание, ЭЭГ бодрствования) [19]. Другой алгоритм оценки глубины анестезии и уровня сознания построен на определении CSI (Cerebral State Index) – комбинированного параметра, основанного на расчете величин, характеризующих сдвиг энергии сигнала от высокочастотного диапазона (30–42.5 Гц) к более низкочастотным (6–12 и 11–21 Гц), а также показателя BSR (Сerebral State Monitor, Danmeter, Дания).
Следует отметить, что в настоящее время не существует универсального способа контроля глубины медикаментозного сна, поскольку отмечается сильная зависимость показателей от индивидуальных особенностей пациента, многообразия видов анестезии, включая комбинированную анестезию [20]. Тем самым сохраняется актуальность поиска подходов к ЭЭГ – оценке глубины анестезии и уровня сознания [21].
Сведения относительно использования BIS- и CSI-мониторов в оценке уровня гипоксии отсутствуют. Следует также отметить, что данные экспертные системы базируются на эмпирически найденных соотношениях вторичных параметров ЭЭГ, которые используются в качестве входных данных для классификационного анализа с применением нечеткой логики и искусственных нейронных сетей. Трудно разрешимую проблему представляет содержательная физиологическая интерпретация получаемых значений коэффициентов связей вторичных параметров ЭЭГ.
В прикладных задачах анестезиологии и реаниматологии расчеты BIS- и CSI-индексов базируются на анализе ЭЭГ исключительно в лобных отведениях, что также может ограничивать использование этих индексов в иных приложениях. Поиск корковых зон, где при гипоксии обнаруживаются наибольшие изменения спектральных характеристик ЭЭГ, либо областей, наиболее “чувствительных” к гипоксемии, дает противоречивые результаты. По данным разных исследователей, к числу таких зон можно отнести затылочные [12], теменно-височные зоны правого полушария [3], лобные и центральные зоны [17], а также префронтальные зоны [22]. Более того, изменения ЭЭГ при гипоксии могут быть разнонаправленными для различных диапазонов частот в различных корковых зонах: уменьшение активности α-диапазона частот в каудальных в сочетании с увеличением активности θ-диапазона в ростральных областях коры мозга [11].
Существенным препятствием для использования данных ЭЭГ в разработке систем контроля функционального состояния мозга, в частности, в условиях нарастающей гипоксии или гипоксемии, является высокая межиндивидуальная вариабельность как реакция самой ЦНС, так и оцениваемых параметров в исходном состоянии. Это делает неприемлемым применение “стандартных” методов сравнения “усредненных” значений этих параметров и требует изучения основ индивидуальных и индивидуально-типологических различий центральных механизмов, обеспечивающих деятельность человека и его адаптацию к среде. Именно такой подход становится одним из ведущих трендов как современных нейрофизиологических исследований когнитивных процессов [23–25], так и изучения динамических перестроек электрической активности мозга при воздействии факторов внешней среды [26, 27].
При выборе электрофизиологических критериев для объективной оценки ФС мозга можно исходить из того, что используемые параметры должны: 1) представлять собой обобщенные характеристики многоканальной ЭЭГ, что позволяет оценивать интегральную реакцию мозга как единой системы на воздействие физических факторов окружающей среды; 2) быть соразмерными у разных лиц, т.е. обеспечивающими уменьшение межиндивидуальной вариабельности величин показателей; 3) принимать значения в максимально возможном диапазоне, границами которого служат “полностью” детерминированный и “абсолютно” случайный процесс; 4) допускать содержательную физиологическую интерпретацию.
В предыдущих работах мы предложили ввести нормированные интегральные параметры, рассчитываемые по временно́й мультивариативной структурной функции (СФ1) первого порядка многоканальной ЭЭГ, характеризующие ее пространственную (Ps) и временну́ю (Pt) связность [25, 27]. Крайние значения (0 и 1) этих параметров соответствуют полностью детерминированной и “случайной” пространственной и временно́й организации ЭЭГ. Использование предложенных параметров Ps и Pt позволяет рассмотреть интегральный ЭЭГ-образ в пространстве двух переменных, одна из которых характеризует пространственную (корреляционную) структуру связей между отведениями, а другая – обобщенную временну́ю организацию ЭЭГ-сигнала.
Процедура предварительного нормирования ЭЭГ, примененная до построения СФ1, обеспечивала соразмерность оценок анализируемых характеристик ЭЭГ у разных лиц и позволяла уменьшить межиндивидуальную вариабельность величин показателей. Примеры индивидуальных реакций биоэлектрической активности мозга с отображением динамики интегральных параметров и амплитудно-частотных спектров СФ1 на острую гипоксию у лиц с различной чувствительностью и устойчивостью к дефициту кислорода представлены в работе [27].
Цель данной работы – изучение вариативности и динамики интегральных параметров многоканальной ЭЭГ, характеризующих пространственную и временну́ю связность колебаний биопотенциалов мозга, у человека в состоянии острой гипоксии с оценкой индивидуальной устойчивости и чувствительности ЦНС к условиям острого дефицита кислорода.
МЕТОДИКА
В исследовании участвовал 41 здоровый мужчина (в возрасте от 19 до 45 лет). Испытуемые располагались в удобном кресле с подлокотниками, с кислородной маской на лице на протяжении всего исследования. Согласно инструкции испытуемые должны были находиться в состоянии спокойного бодрствования с закрытыми глазами, максимально ограничивая движения тела, конечностей, глаз и напряжение мышц лица и шеи. Не допускали к исследованию лиц, испытывавших недомогание, имевших накануне интенсивные физические нагрузки, употреблявших алкоголь, психотропные или нейротропные препараты.
Гипоксическое состояние создавали, используя для дыхания гипоксическую газовую смесь (ГГС) с 8% содержанием кислорода в азоте. Планируемое время дыхания ГГС составляло 15 мин для 12 лиц, 25 мин для 8 лиц и 40 мин для 21 лица.
Проводили комплексное электрофизиологическое исследование с использованием компьютерной энцефалографии (электроэнцефалограф ЭЭГА-21/26 “Энцефалан-131-03”, фирмы “Медиком МТД”, Россия), непрерывной регистрации кислородной сатурации гемоглобина и динамики ЧСС (пульсоксиметр “Nonin 8500”, США), регистрации артериального давления, мониторинга тканевого (транскутанного) напряжения кислорода и углекислого газа (транскутанный монитор TCM-3, фирмы “Radiometer”, Дания), газового анализа вдыхаемого и выдыхаемого воздуха (компьютерный газоанализатор с датчиком кислорода КЕ-25 фирмы “Figaro”, Япония).
ЭЭГ регистрировали в 21 отведении по международной системе “10–20” в полосе 0.5–70 Гц с частотой дискретизации 250 Гц. Использовали монополярные отведения с объединенными ушными референтными электродами. Представленные в статье результаты относятся к 16-ти отведениям: Fp1, Fp2, F7, F3, F4, F8, T3, C3, C4, T4, T5, P3, P4, T6, O1, O2. Анализировали ЭЭГ в исходном состоянии (“фон”, 5 мин), при экспозиции гипоксии (“гипоксия”, 15, 25 или 40 мин), в восстановительный период (“восстановление”, 15 мин). При наличии в одном или нескольких отведениях ЭЭГ электромиографической активности эту аддитивную помеху, представляющую собой сугубо локальный процесс, устраняли методом удаления некоррелированной с другими отведениями составляющей колебаний потенциалов (https:// www.elibrary.ru/item.asp?id=39 320 820). Дополнительно применяли процедуру цифровой фильтрации, ограничивая рабочий диапазон частот ЭЭГ полосой от 1 до 30 Гц, что позволяло устранять как тонические, так и фазические медленные спонтанные колебания электрокожного потенциала. Участки записей, содержащие двигательные, электроокулографические, неустранимые электродные артефакты, исключали из обработки.
Согласно предложенному нами ранее методу анализа ЭЭГ-данных [25, 27], каждая запись ЭЭГ, представленная в виде векторного временнóго ряда X(t) последовательных значений амплитуд в 16-ти отведениях, предварительно центрировалась путем вычитания соответствующего среднего в каждом отведении и нормировалась на величину определителя выборочной ковариационной матрицы в степени 1/32. В результате получали новый векторный временнóй ряд Y(t), который являлся безразмерным и характеризовался одинаковой выборочной обобщенной дисперсией для всех испытуемых. Полученный векторный временнóй ряд Y(t) анализировали на основе СФ1, определяемой как среднее приращение амплитуды вектора Y(t) в 16-мерном (по числу отведений ЭЭГ) пространстве на интервалах, кратных интервалу дискретизации ЭЭГ (4 мс).
Было установлено, что для каждой 4-секундной эпохи анализа ЭЭГ, СФ1(τΔt) с течением времени либо выходила на установившийся уровень (горизонтальную асимптоту Asf), либо осциллировала относительно этого уровня. При увеличении эпохи анализа подобное поведение СФ1 проявлялось еще ярче. Данный факт косвенно свидетельствует о том, что использованные ЭЭГ можно рассматривать с некоторым приближением как случайные процессы со стационарными первыми приращениями, по крайней мере, при 4 с эпохе анализа. Тем самым, можно считать, что применение структурной функции для оценки ЭЭГ при этих эпохах анализа является совершенно оправданным.
Оценка Asf для каждой эпохи анализа может быть произведена на основе усреднения СФ1п для гипотетической ЭЭГп, полученной из реальной ЭЭГ путем случайного перемешивания порядка следования в ней значений амплитуд ЭЭГ одновременно по всем отведениям. Такое перемешивание приводит к разрушению корреляционных связей между значениями амплитуд внутри каждого отведения, но сохраняет неизменной выборочную корреляционную матрицу. Поскольку любая случайная перестановка представляет собой также случайный процесс, то для получения статистически устойчивой оценки Asf на основе усреднения СФ1п необходимо иметь выборку определенного объема. Опытным путем было установлено, что использование сотни перестановок, производимых в среде MATLAB, достаточно для того, чтобы коэффициент вариации эмпирической оценки Asf в нашем случае в среднем не превосходил принятого для нас уровня 0.3%. Искомая оценка величины Asf получалась в результате усреднения всех 100 рассчитанных СФ1п и представляла собой одно число для анализируемого отрезка ЭЭГ (эпохи анализа).
Можно отметить, что определенная выше СФ1, характеризует ЭЭГ-запись в целом, учитывая сигналы от всех 16-ти отведений, и представляет собой кривую, имеющую начальную восходящую ветвь, переходящую в горизонтальную асимптоту Asf, относительно которой наблюдаются осцилляции значений СФ1. В данной работе следует обратить внимание на значение СФ1(Δt) при минимальном временно́м масштабе Δt, величину Asf, а также значение горизонтальной асимптоты СФ1ш для гипотетической случайной (“шумовой”) ЭЭГш.
Значение СФ1ш вычислялось по известной аналитической формуле [28]. На основе СФ1(Δt), Asf и СФ1ш рассчитывали величины Ps = СФ1ш/Asf (0 ≤ Ps ≤ 1) и Pt = СФ1(Δt)/Asf (0 ≤ Pt ≤ 1).
Параметр Ps является мерой линейной корреляции. Значение Ps характеризует уровень пространственной взаимосвязи ЭЭГ между всеми отведениями, поскольку величина Asf связана с определителем выборочной корреляционной матрицы ЭЭГ [29].
При этом анализируемая СФ1 характеризует ЭЭГ не в каждом одном отведении и не в отдельных парах отведений ЭЭГ, а запись в целом, учитывая сигналы от всех 16-ти отведений. То есть нормированный интегральный параметр Рs может характеризовать обобщенный уровень пространственной (дистантной) синхронизации колебаний потенциалов многоканальной ЭЭГ. Анализируемые ЭЭГ-процессы не были разделены на отдельные физиологические диапазоны, анализ проводили в широкой частотной полосе от 1 до 30 Гц. Крайние значения параметра Рs (0 и 1) соответствуют абсолютной пространственной синхронизации (сугубо детерминированным, например, линейным процессам) и полному отсутствию пространственной синхронизации (“чисто” случайным процессам во всех отведениях).
Параметр Pt служит для оценки масштаба интегральной временно́й корреляции многоканальной ЭЭГ. Этот параметр характеризует скорость прироста обобщенной амплитуды многоканального ЭЭГ-сигнала на минимальном интервале времени (который соответствует величине интервала дискретизации). Величина этого прироста пропорциональна интервалу времени до достижения СФ1 горизонтальной асимптоты на графике. Если принять во внимание известную аналогию между автокорреляционной функцией и СФ2 [30], то и время первого пересечения на графике автокорреляционной функции нулевого уровня, и первого пересечения СФ1 своей асимптоты, определяет величину времени релаксации, интервала корреляции, который характеризует отрезок времени, в течение которого корреляционная связь исчезает или затухает, а, следовательно, также то, как долго система удерживает след памяти о своем предыдущем состоянии. То есть параметр Pt позволяет оценить масштаб обобщенной по всем отведениям временнóй связности ЭЭГ-процессов. Крайние значения (0 и 1) параметра Pt соответствуют абсолютно стабильной и “случайной” временно́й организации ЭЭГ в целом. Важно подчеркнуть, что временна́я связность относится здесь к минимальному временнóму масштабу Δt.
Оценки Ps, Pt были получены как для 4-секундных, так и для более длительных (порядка 20–50 с) чистых от артефактов эпох анализа ЭЭГ. Расчет СФ1, определение параметров Ps, Pt, а также спектральный анализ СФ1 проводили в среде MATLAB, причем для оценки спектральной плотности мощности (спектра) СФ1 использовали функцию fft. Прямое дискретное преобразование Фурье выполняли на интервале 8.192 с (2048 отсчетов) за пределами начальной восходящей ветви СФ1.
Статистическая обработка данных производилась при помощи пакета программ Statistica-10 и включала построение распределений, расчет индивидуальных и групповых средних значений и дисперсий показателей, а также оценку влияния фактора “гипоксия” на интегральные параметры Ps и Pt у каждого испытуемого в рамках рангового дисперсионного анализа (Friedman ANOVA by Ranks).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Из 41 участника исследования 7 испытуемых не выдержали запланированное время дыхания ГГС. У двух лиц на 3-ей мин, у трех лиц на 7, 8 и 12-й мин дыхания ГГС развилась коллаптоидная реакция, у двух лиц гипоксическое воздействие было прекращено на 8-й и 11-й мин по их просьбе в связи с резким ухудшением самочувствия. Из 34 испытуемых, выдержавших нагрузку, 21 испытуемый был отнесен к группе лиц с высокой и 13 – к группе лиц со сниженной устойчивостью к гипоксии. Первоначальными критериями сниженной устойчивости к гипоксии было падение кислородной сатурации гемоглобина более чем на 45% от исходного уровня и/или повышение ЧСС до значений, превышающих 110 ударов в минуту на 15-й мин экспозиции гипоксии (по [2]).
На рис. 1 представлены совместные распределения нормированных (в интервале [0, 1]) оценок Pt и Ps, полученных для последовательных 4-секундных эпох анализа ЭЭГ, у испытуемых с различной степенью устойчивости к острой гипоксии согласно приведенным выше критериям устойчивости.
Рис. 1.
Сочетанные изменения пространственного (Ps) и временнóго (Pt) интегрального параметра ЭЭГ у испытуемых с различной степенью устойчивости к острой гипоксии. По горизонтали – значение параметра Pt в отн. ед., по вертикали – значение параметра Ps в отн. ед. Символы – 4-секундные ЭЭГ, последовательные эпохи анализа соединены линиями; а – фон перед нагрузкой, б – гипоксическая нагрузка. А−В – испытуемые с различной устойчивостью к гипоксии: А – высокая устойчивость (Н.Ю-в), Б – сниженная устойчивость (И.В-в), В – коллаптоидная реакция (А.С-н).
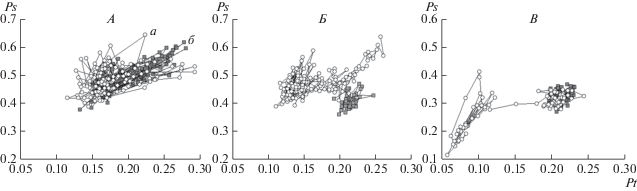
У испытуемого с высокой гипоксической устойчивостью облака точек на диаграммах рассеяния для интегральных ЭЭГ-параметров в фоне и при дыхании ГГС в значительной степени перекрываются, обнаруживается лишь небольшое смещение облака, характеризующего состояние гипоксии, в сторону уменьшения величины параметра Pt. У испытуемого со сниженной устойчивостью к гипоксии на первых минутах воздействия отмечается рост величины как параметра Ps, так и параметра Pt, но затем значительно левее исходного облака образуется новое, отражающее формирование нового функционального состояния ЦНС. При этом существенное число последовательных фрагментов ЭЭГ попадает в область величин параметра Ps меньше уровня 0.15 и даже 0.13 единиц. Наконец, в случае развития коллаптоидной реакции (В) на 5-й минуте дыхания ГГС видна резкая передислокация точек в область значений Pt левее уровня 0.10–0.12 с последующим снижением до 0.06 единиц и менее.
Групповые распределения значений параметров Pt и Ps у лиц с высокой и сниженной чувствительностью к гипоксии на 5, 10 и 15-й минутах дыхания ГГС в форме диаграмм размаха, представлены на рис. 2. Значения интегральных параметров для различных лиц в каждый последовательный одноминутный отрезок времени рассчитывали по 20–40-секундным фрагментам ЭЭГ.
Рис. 2.
Распределения величин временно́го (А) и пространственного (Б) интегрального параметров ЭЭГ в отн. ед. у лиц с высокой (I, n = 21) и сниженной (II, n = 13) устойчивостью к гипоксии в фоне (а), на 5-й (б), 10-й (в) и 15-й (г) мин дыхания ГГС.
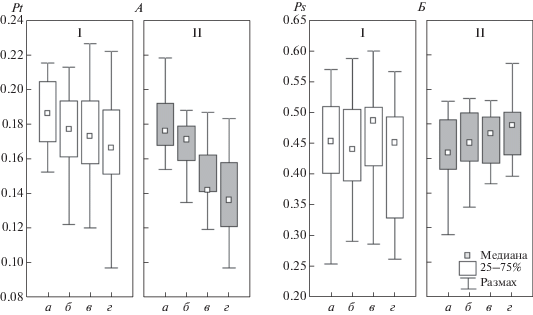
Величина параметра Pt последовательно снижалась от 5-й к 15-й минутам гипоксии по сравнению с фоном. Ранговый дисперсионный анализ показал, что изменение величины Pt значимо как в группе лиц с высокой устойчивостью к гипоксии (χ2 = 16.97, df = 3, p < 0.001), так и у лиц со сниженной устойчивостью (χ2 = 28.66, df = 3, p < < 0.0001). Уровень снижения величины Pt к 10-й и 15-й минутам гипоксии был выше у лиц со сниженной устойчивостью к гипоксии (различия между группами z = 2.96, p < 0.004 и z = 2.43, p < 0.016 на 10-й и 15-й минуте соответственно).
Величина параметра Ps значимо не менялась даже при 15-минутном дыхании ГГС, хотя у лиц из группы со сниженной устойчивостью к гипоксии наблюдалась тенденция к постепенному возрастанию среднего значения Ps от 5-й к 15-й минуте гипоксической нагрузки. Значимые различия величины Ps в фоне и на соответствующих минутах гипоксии между группами не выявлены.
Таким образом, при углублении гипоксического состояния происходит закономерное снижение величины Pt, характеризующее увеличение масштаба интегральной временнóй связности ЭЭГ-процессов (уменьшение среднего приращения амплитуды вектора Y(t) на минимальном временнóм масштабе Δt), что, в свою очередь, отражает уменьшение доли “стохастической”, “случайной” и возрастание доли детерминированной составляющей во временнóй организации ЭЭГ в целом. При этом у лиц со сниженной гипоксической устойчивостью уже к 10-й минуте дыхания ГГС эти изменения значимо более выражены, чем у лиц устойчивых к гипоксии.
Выраженность изменений временнóго интегрального параметра Pt и перестройки амплитудно-частотного спектра СФ1 ЭЭГ на продолжительное действие гипоксии были сугубо индивидуальными и различались не только у лиц с различной устойчивостью к воздействию гипоксии, но и у лиц одной группы, особенно в группе лиц со сниженной устойчивостью к гипоксии.
Применение интегральных параметров позволяет в наглядной форме показать динамику обобщенной многоканальной ЭЭГ, что позволяет подойти к решению проблемы оценки индивидуальной чувствительности или устойчивости к гипоксии.
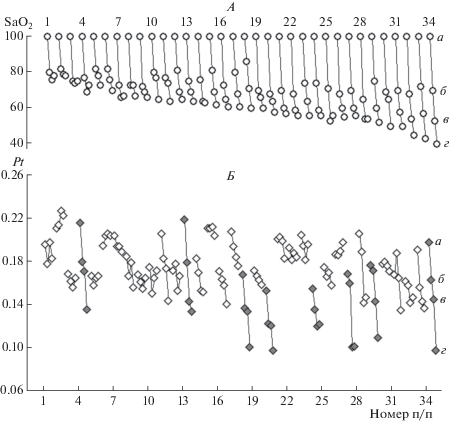
На рис. 3, Б представлены изменения величины временно́го (Pt) интегрального параметра ЭЭГ на 5, 10 и 15-й минутах гипоксии относительно его значения в исходном состоянии. Испытуемые ранжированы по величине снижения уровня кислородной сатурации гемоглобина на 15-й минуте гипоксии (рис. 3, А). В целом, видна тенденция к снижению величины Pt при снижении уровня кислородной сатурации. Однако лица, которым присвоены номера 4 и 13, несмотря на сравнительное небольшое падение уровня сатурации при 15-минутной гипоксии, демонстрируют весьма резкое снижение величины Pt. Напротив, у испытуемых под номерами 25, 26, 29–33, несмотря на низкие (ниже порогового уровня) значения кислородной сатурации, величина уменьшения Pt сравнительно невелика (и не достигает уровня 0.13). Следовательно, лица, упомянутые первыми (под номерами 4 и 13), отличаются повышенной чувствительностью к гипоксии (высокая реактивность уже при сравнительно небольшом снижении уровня сатурации), тогда как лица, упомянутые вторыми, отличаются более низкой чувствительностью к гипоксии (более низкая реактивность при сравнительно большом снижении уровня сатурации).
Рис. 3.
Изменения уровня кислородной сатурации гемоглобина (А) и величины временно́го интегрального параметра ЭЭГ (Б) на 5, 10 и 15-й мин гипоксии (индивидуальные данные). По горизонтали – номер испытуемого п/п, испытуемые ранжированы по величине кислородной сатурации гемоглобина на 15-й мин гипоксии; А – SaO2 (уровень кислородной сатурации гемоглобина) в процентах, за 100% принят уровень сатурации в исходном состоянии, Б – величина Pt, отн. ед. Каждому испытуемому соответствует группа из 4-х значков, соединенных линией; а – исходное состояние, б – 5-я, в – 10-я, г – 15-я мин дыхания ГГС. Залитые серым цветом символы выделяют испытуемых с наиболее выраженным по отношению к фону снижением Pt при гипоксии.
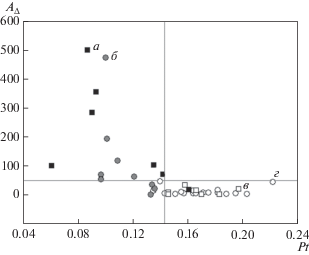
Одной из наиболее распространенных оценок чувствительности к гипоксии, по данным визуального анализа, является степень выраженности замедления ЭЭГ и повышения амплитуды Δ-волновой активности. На рис. 4 сопоставлены значения параметра Pt и суммарной спектральной амплитуды СФ1 в Δ-диапазоне частот ЭЭГ. Представленные значения показателей для лиц, выдержавших заданное время гипоксической нагрузки, соответствуют 15-й минуте гипоксии, для лиц, не выдержавших нагрузку, соответствуют предколлаптоидному состоянию. Все поле графика разделено на 4 части. Нижнее правое поле – значениям параметра Pt больше 0.143 отн. ед. соответствуют малые – до 50 отн. ед. величины суммарной спектральной амплитуды Δ-полосы частот. В эту область графика попали большинство (за исключением двух) лиц, устойчивых к гипоксии, и все лица, причисленные к группе со сниженной устойчивостью только по показателям тахикардии и/или уровню снижения кислородной сатурации гемоглобина. На левом верхнем поле графика, с малыми значениями параметра Pt и высокими величинами спектральной амплитуды Δ-диапазона частот – 6 из 9 лиц со сниженной устойчивостью к гипоксии (с учетом величины параметра Pt) и 6 из 7 лиц с коллаптоидной реакцией на нагрузку. Таким образом, в целом по группе испытуемых при значениях Pt выше 0.143 спектральная амплитуда Δ-диапазона частот невелика и не зависит от величины Pt. При значениях Pt ниже 0.143 спектральная амплитуда Δ-диапазона более или менее значительно растет по мере снижения величины Pt. Если принять это значение Pt за пороговое для оценки чувствительности к гипоксии, то обнаружатся два случая ложноположительного прогноза высокой чувствительности у лиц, устойчивых к гипоксии, и один ложноотрицательный прогноз у испытуемого, отказавшегося от дыхания ГГС в связи с ухудшением самочувствия.
Рис. 4.
Соотношение между величиной интегрального временно́го параметра СФ1 и суммарной амплитудой Δ-диапазона частот в спектре СФ1 многоканальной ЭЭГ у лиц с различной устойчивостью и чувствительностью к воздействию острой гипоксии. По горизонтали – значение параметра Pt, в отн. ед.; по вертикали – AΔ, суммарная амплитуда колебаний Δ-диапазона частот в спектре СФ1 ЭЭГ, в отн. ед. а – лица с коллаптоидной реакцией, б – лица со сниженной устойчивостью к гипоксии (не менее чем по двум показателям, включая Pt), в – лица со сниженной устойчивостью к гипоксии (по величине ЧСС и/или уровню снижения SaO2), г – лица, устойчивые к гипоксии. Горизонтальная и вертикальная линии – границы дискриминантных полей.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Важная особенность нашего подхода состоит в использовании обобщенных интегральных показателей ЭЭГ, относящихся ко всей совокупности ЭЭГ-процессов в различных отведениях. Следует отметить, что воздействие гипоксии, прежде всего, сказывается не на отдельных структурах с большей или меньшей чувствительностью к гипоксемии, а на деятельности мозга как целого, вызывая перестройки в его работе, которые характеризуются изменениями функционального состояния ЦНС. Параметры СФ1 многоканальной ЭЭГ позволяли количественно оценивать масштабы временно́й и пространственной связности колебаний потенциалов мозга [25] и описывать общие, системные реакции мозга без подробного описания локальных изменений. Такой подход позволил с использованием минимального набора параметров в наглядной форме представить индивидуальную динамику биоэлектрической активности мозга под влиянием гипоксии.
Согласно своему определению, нормированный интегральный параметр Рs может характеризовать обобщенный уровень пространственной (дистантной) синхронизации колебаний потенциалов многоканальной ЭЭГ. Его крайние значения 0 и 1 соответствуют абсолютной пространственной синхронизации и полному отсутствию пространственной синхронизации (“чисто” случайным процессам во всех отведениях). Сам термин “пространственная синхронизация” ввел М.Н. Ливанов [31]. В зарубежной литературе в настоящее время используют понятие “функциональная связность” (functional connectivity) [32], применяя термин “синхронизация” в качестве характеристики сугубо локального процесса. Возрастание показателя пространственной синхронизации (функциональной связности) между ЭЭГ-процессами в различных отведениях ЭЭГ может отражать повышение согласованности в работе отдельных корковых зон, что рассматривается как механизм, обеспечивающий образование функциональной системы для осуществления когнитивной или моторной деятельности. “Глобальные”, оцениваемые по всей совокупности отведений ЭЭГ, показатели пространственной синхронизации имеют свои оптимальные значения как для состояния “спокойного бодрствования” (оперативного покоя [33], resting state по [32]), так и при выполнении деятельности, выше которых функциональные свойства системы снижаются [34, 35]. По сравнению с бодрствованием уровень глобальной пространственной синхронизации ЭЭГ выше во время медленноволнового сна, когда сознание неактивно [36], и может повышаться при прогрессировании патологического процесса в ЦНС [37]. Уменьшение значений величины Ps (повышение уровня глобальной пространственной синхронизации ЭЭГ) у лиц, не выдержавших гипоксическую нагрузку, незадолго до отказа ее продолжать, либо в предколлаптоидном периоде, вероятно, отражает критическое снижение уровня бодрствования и сознания с развитием сумеречного состояния. В свою очередь, отсутствие значимых изменений Ps (по сравнению с Pt) в течение 15 мин гипоксического воздействия в двух группах лиц, выдержавших нагрузку, свидетельствует о большей устойчивости пространственно-корреляционных соотношений и более высокой изменчивости уровня внутренней временнóй связности в ЭЭГ в условиях нарастающей гипоксемии. При этом уменьшение величины параметра Ps может означать приближение к определенному критическому уровню изменения сознания.
Эффект гипоксии не был исследован за физиологически допустимыми пределами. Однако можно предположить, что на стадии угнетения ЦНС и депрессии электрической активности мозга значения параметра Ps сместятся в область высоких значений, приближаясь к единице, что будет характеризовать дезинтеграцию как пространственных соотношений между процессами, так и самих локальных процессов. Или, выражаясь другими словами, отражать нарушения как функциональной связности (functional connectivity), так и синхронизации (synchronization, по [32]).
Наблюдаемые нами изменения параметра Ps при гипоксической гипоксии у лиц с высокой чувствительностью к дефициту кислорода и характеризующие уменьшение доли стохастической и увеличение доли детерминированной (регулярной) составляющей ЭЭГ при углублении гипоксического состояния, соответствуют данным работы [17]. В этой работе была использована характеристика, применяемая для исследования процессов со свойствами детерминированного хаоса – аппроксимированная энтропия (Approximate Entropy), которая количественно определяет степень сложности сигнала: чем выше его регулярность, тем меньше значение данной величины. Уменьшение значения данного показателя энтропии при уменьшении барометрического давления (за счет снижения парциального давления О2) также свидетельствовала об увеличении доли детерминированной и снижения хаотической составляющей ЭЭГ-процесса в условиях гипоксии.
Полученные нами результаты продемонстрировали важную роль временно́го параметра Pt в оценке влияния острой гипоксии на электрическую активность и ФС мозга. У 30 испытуемых из 41 (рис. 3) выявлено уменьшение величины Pt по мере углубления гипоксии. Если разделить испытуемых на группы по уровню падения кислородной сатурации гемоглобина к 15-й минуте дыхания ГГС, то у лиц с повышенной чувствительностью к гипоксии (снижение сатурации более 45%) это уменьшение Pt было выражено значимо больше, чем у лиц, устойчивых к гипоксии (снижение сатурации менее 45%). Таким образом, при углублении гипоксического состояния выявлено закономерное снижение величины параметра Pt, характеризующее уменьшение доли “случайной” и возрастание доли детерминированной составляющей во временно́й организации ЭЭГ в целом.
В работе [27] мы предположили, что интервал времени до достижения СФ1 асимптоты, как и величина времени релаксации (интервала корреляции) автокорреляцинной функции (АКФ), характеризует масштабы внутренней (временно́й) связности ЭЭГ-процессов и может быть оценкой одного из основных свойств нервной системы – физиологической лабильности. Действительно, СФ2 второго порядка и АКФ связывают известные интегральные соотношения, по крайней мере для случайных стационарных процессов [30]. Интервал корреляции АКФ характеризует отрезок времени, в течение которого корреляционная связь исчезает или затухает. Таким образом, время достижения асимптоты СФ1 также может характеризовать, как долго система удерживает след памяти о своем предыдущем состоянии, а, следовательно, позволяет оценивать, насколько система инерционна. Можно полагать, что имеется содержательная связь между оценками инерционности – лабильности в смысле классической физиологии и мерой временно́й связности ЭЭГ-процессов.
А.А. Ухтомский определял лабильность как “скорость, с которой данный физиологический субстрат успевает переходить от состояния покоя к состоянию возбуждения и обратно … к состоянию физиологического покоя с готовностью к новой реакции” [33]. При этом “интервал возбуждения (продолжительность состояния возбуждения) характеризует степень инерционности субстрата” [33]. То есть, чем больше величина интервала корреляции АКФ и СФ1, тем больше инерционность системы и тем ниже уровень функциональной (физиологической) лабильности.
В настоящем исследовании в качестве меры подвижности нейродинамических процессов и физиологической лабильности была использована не величина интервала корреляции, а значение параметра Pt, определяемого как относительная величина прироста ординаты СФ1 на минимальном временнóм интервале (определяемом интервалом дискретизации ЭЭГ), которое характеризует скорость изменения обобщенной (по совокупности каналов) амплитуды ЭЭГ-сигнала за единицу времени. По своей сути, это производная, характеризующая наклон линейного участка СФ1. Чем этот прирост ординаты больше, тем быстрее СФ1 достигает асимптоты и, соответственно, меньше величина интервала корреляции. В связи с этим, величина Pt, отражающая скорость изменения или величину приращения амплитуды многомерного ЭЭГ-процесса за единицу времени Δt, более, чем интервал корреляции, соответствует определению физиологической лабильности как меры функциональной подвижности нервных процессов. Чем значение параметра Pt больше, тем выше функциональная подвижность нервных процессов, и наоборот, чем оно меньше, тем меньше эта функциональная подвижность.
Полученные нами результаты, как и проведенные ранее исследования [27], свидетельствуют о тенденции к снижению уровня функциональной подвижности нервных процессов (физиологической лабильности ЦНС) при пребывании в условиях острой гипоксии, более выраженной у лиц с повышенной чувствительностью к дефициту кислорода. Подобное снижение функциональной подвижности, повышение инерционности нервных процессов, по-видимому, и служит основой замедления (впоследствии и нарушения) процессов восприятия, когнитивных функций и целенаправленной деятельности.
В большинстве работ по изучению влияния гипоксической или гипобарической гипоксии на ЭЭГ изучались топические особенности изменения спектральной мощности основных ритмов ЭЭГ [3, 11, 12] либо взаимоотношения между локальными процессами, оцениваемые по уровню кросс-корреляции или когерентности [13, 14, 16] колебаний потенциалов. Эти анализируемые показатели характеризуют частотную и пространственную структуру ЭЭГ без учета ее временно́й организации.
В описании функциональной системы могут быть выделены статические и динамические характеристики. Главной из статических характеристик является структура системы как совокупность нервных образований и морфологических связей между ними, в описании которой важную роль играют пространственные отношения. Основным в описании динамических характеристик является понятие организации, представляющей собой процесс упорядочивания взаимосвязей между отдельными составляющими системы [35]. Существенным моментом в таком процессе упорядочивания является настройка временны́х соотношений между этими составляющими. В нейрофизиологических механизмах обеспечения текущей деятельности мозга (перцептивных, моторных, когнитивных процессов) можно обозначить несколько временны́х шкал, находящихся в отношениях соподчиненности и обладающих различным уровнем организации. Оценка отдельных временны́х шкал доступна в рамках различных методов ЭЭГ-анализа. Это методы анализа во “временно́й области” (time domain) в миллисекундном диапазоне, во временно́й и частотной (time- and frequency-domain) области в субсекундном диапазоне и частотной (frequency-domain) области в секундном диапазоне [38]. Основу одной из базовых шкал временно́й интеграции в нервной системе составляют процессы, связанные с пространственной и временно́й суммацией постсинаптических потенциалов на мембранах нейронов, интеграцией активности популяций нейронов, объединенных в коре в колонки (модули), а также интеграцией активности множества этих модулей. Эти вопросы синхронизации активности в нейронных сетях относятся собственно к физиологическим механизмам генерации ЭЭГ [39, 40]. По мнению авторов работы [38], анализ в этой временно́й области с характеристическими временами от единиц до десятков мс доступен с помощью подходов, которые базируются на методологии вызванных или связанных с событиями (event-related) потенциалов, поскольку в этих методиках присутствует точка отсчета, обеспечивающая оценку временны́х параметров активности, связанной со стимулом или ответной реакцией.
В большинстве случаев анализ в данной временно́й области переводится в плоскость изучения временны́х или фазовых отношений колебаний потенциалов в различных отведениях ЭЭГ. В клинических приложениях для локализации источника и распространения патологической активности используют измерения направления и величины временны́х сдвигов колебаний потенциалов в различных областях мозга по положению максимума кросс-корреляционной функции или по оценке кросс-спектральной фазы на основе Фурье-преобразования или авторегрессионной модели [41]. Для оценки пространственных временны́х соотношений между ЭЭГ-процессами и изменениями этих соотношений в ходе операторской, когнитивной или иной деятельности применяют мультивариативные статистические методы, основанные на анализе причинности Грейнджера (Granger causality) или на построении авторегрессионной модели прогнозирования, что позволяет выявлять направленные функциональные (“причинные”) взаимодействия активности в различных отведениях ЭЭГ [42].
Эти методы позволяют оценить величину временно́го сдвига или сдвига фаз между ЭЭГ-процессами в различных отведениях, тогда как применяемый нами анализ структурной функции многоканальной ЭЭГ дает обобщенную характеристику масштаба временно́й связности процессов во всех отведениях ЭЭГ. Аналогичный нашему подход был использован в работе [43], в которой на основе построения СФ2 второго порядка (по каждому отведению отдельно) было выявлено изменение автокорреляционных характеристик ЭЭГ (“индекса изменчивости автокорреляционной структуры ЭЭГ”) у пациентов с психопатологией в сравнении с психически здоровыми лицами. По сути дела, эти изменения были связаны с величиной угла наклона восходящей фазы СФ2, что обусловливало изменение длительности интервала корреляции, однако оценки этого временно́го параметра, характеризующего масштаб временнóй связности в ЭЭГ, не были приведены. В исследовании [44] на основе анализа автокорреляционной функции электрокортикограммы у крыс было показано более чем двукратное возрастание величины интервала корреляции при снижении температуры тела на 15°С, что характеризовало рост временно́й связности и инерционности в электрической активности мозга при угнетении ЦНС и, в целом, соответствовало направлению изменений временно́го параметра СФ1 у человека при гипоксии.
Из числа других подходов к оценке масштабов временно́й связности ЭЭГ в сопоставимом диапазоне можно отметить данные анализа временны́х рядов карт топического распределения потенциалов, составленных из значений амплитуд ЭЭГ, одновременно зарегистрированных в различных отведениях [45, 46]. Топография таких карт остается стабильной в течение приблизительно 100 мс, а затем очень быстро выстраивается в новую топографию, в которой она снова остается стабильной. D. Lehmann обозначил эти периоды стабильных конфигураций карты как функциональные микросостояния мозга и даже высказал предположение, что они составляют строительные блоки обработки информации, или “атомы мысли” [45].
Можно полагать, что здесь речь идет о шкале более крупного, с характеристическими временами в субсекундном диапазоне, временно́го масштаба, чем “базовая” шкала временно́й интеграции, на исследование которой нацелен анализ СФ1 многоканальной ЭЭГ. Применение интегральных параметров, характеризующих многоканальную ЭЭГ, позволило в наглядной форме показать динамику ЭЭГ-процессов и дало возможность подойти к решению проблемы оценки индивидуальной чувствительности к гипоксии. Одним из основных критериев оценки чувствительности/устойчивости к гипоксии служит величина снижения кислородной сатурации гемоглобина крови на заданной временно́й отметке от начала испытания [2] или время достижения определенного порогового уровня сатурации [7]. Здесь речь идет о звене, осуществляющем функцию доставки кислорода тканям организма, тогда как ведущими прогностическими критериями степени тяжести гипоксии и устойчивости к гипоксии оказываются показатели тканевого энергетического обмена. Установлены генотипически обусловленные различия кинетических свойств митохондриальных ферментных комплексов, определяющих особенности функционально-метаболического профиля устойчивых и неустойчивых к гипоксии животных и играющих ведущую роль в формировании резистентности организма к гипоксии [47].
Нами было выявлено определенное несоответствие оценок индивидуальной чувствительности к гипоксии по данным нормированных интегральных параметров ЭЭГ и уровню кислородной сатурации гемоглобина (SaO2). В целом, отмечена тенденция к уменьшению величины временно́го параметра Pt со снижением уровня сатурации как по индивидуальным показателям, так и по групповым данным. Однако если критерием чувствительности к гипоксии считать степень функциональных изменений (реактивность) ЭЭГ, находящих отражение в динамике параметра Pt, то из 34 испытуемых у двух лиц, несмотря на сравнительное небольшое падение уровня SaO2 при 15-минутной гипоксии, отмечено весьма резкое снижение величины Pt. Напротив, у 7 лиц, несмотря на низкие (ниже порогового уровня) значения SaO2, величина уменьшения Pt была сравнительно невелика. Можно предположить, что лица, упомянутые первыми, отличаются повышенной чувствительностью к гипоксии (высокая реактивность уже при сравнительно небольшом снижении уровня сатурации), тогда как другие 7 испытуемых отличаются более низкой чувствительностью к гипоксии (более низкая реактивность при сравнительно большом снижении уровня сатурации).
Уменьшение величины параметра Pt характеризует возрастание временно́й связности (степени детерминированности, инерционности) ЭЭГ-процессов, а, следовательно, и снижение уровня физиологической лабильности ЦНС при гипоксии. Одной из наиболее распространенных оценок чувствительности к гипоксии, по данным анализа ЭЭГ, является степень выраженности замедления ЭЭГ и повышения амплитуды или спектральной мощности колебаний в Δ-диапазоне частот ЭЭГ, что свидетельствует о снижении уровня функционального состояния мозга по мере углубления гипоксического состояния. Как показало наше исследование, в целом по группе испытуемых при значениях Pt выше 0.143 спектральная амплитуда в Δ-диапазоне частот невелика и не зависит от величины Pt. При значениях Pt ниже 0.143 спектральная амплитуда Δ-диапазона в большей или меньшей степени растет по мере снижения величины Pt. Двух испытуемых с исходно низкоамплитудной (“плоской”) ЭЭГ без доминирующего α-ритма по результатам оценки относительной представленности Δ-диапазона частот в обобщенном спектре мощности ЭЭГ можно было отнести к числу лиц со сниженной устойчивостью к гипоксии. Между тем, значения параметра Pt у них мало изменялись по отношению к исходному состоянию и на 15-й мин гипоксии не достигали “порогового” уровня (0.143), что характеризовало этих лиц как устойчивых к гипоксии. Нельзя исключить, что использование только спектральных оценок для распознавания опасного гипоксического состояния по эмпирически выведенным соотношениям различных диапазонов частот ЭЭГ (https://patents.google.com/ patent/RU2559414C1/ru) в определенных случаях может привести к ложноположительной оценке состояния.
ЗАКЛЮЧЕНИЕ
Таким образом, предложенный нами подход позволил с использованием минимального набора параметров в наглядной форме представить индивидуальную динамику биоэлектрической активности мозга под влиянием гипоксии, а также на базе численной оценки ЭЭГ оценить индивидуальную чувствительность и устойчивость к воздействию данного фактора. Важные особенности нашего подхода состояли в использовании обобщенных по всей совокупности отведений ЭЭГ интегральных показателей, а также в раздельной количественной оценке пространственного и временно́го параметров, характеризующих пространственно-временну́ю организацию электрической активности мозга в целом.
При углублении гипоксического состояния происходит закономерное снижение величины временно́го ЭЭГ-параметра Pt, характеризующее увеличение интегральной временно́й связности ЭЭГ-процессов, что, в свою очередь, отражает уменьшение доли “стохастической” (“случайной”) и возрастание доли детерминированной составляющей во временно́й организации ЭЭГ в целом. У лиц со сниженной гипоксической устойчивостью уже к 10-й мин дыхания ГГС эти изменения значимо более выражены, чем у лиц, устойчивых к гипоксии. Критерием повышенной чувствительности ЦНС к гипоксии может служить снижение величины параметра Pt к 15-й минуте дыхания ГГС или ранее до значений менее 0.14 отн. ед.
Величина пространственного ЭЭГ-параметра Ps значимо не менялась даже при 15-минутном дыхании ГГС у лиц, выдержавших запланированное время нагрузки. У большинства лиц, не выдержавших нагрузку, наблюдали снижение величины параметра Ps, характеризующее уменьшение доли стохастичности и возрастание степени пространственной детерминированности ЭЭГ, особенно у лиц с коллаптоидной реакцией, перед ее развитием.
Параметр Ps служит для оценки масштаба интегральной пространственной корреляции многоканальной ЭЭГ и характеризует уровень пространственной взаимосвязи ЭЭГ между всеми отведениями. Можно полагать, что параметр Pt как оценка интегральной временно́й корреляции ЭЭГ отражает изменения функциональной подвижности нервных процессов и физиологической лабильности ЦНС. Изменения временно́го ЭЭГ-параметра Pt по мере углубления гипоксии свидетельствовали о росте временно́й связности, инерционности в ЭЭГ, что характеризовало снижение физиологической лабильности и функционального состояния мозга. Величина пространственного ЭЭГ-параметра Ps оказалась менее чувствительной, чем параметра Pt, к воздействию гипоксии, сохраняясь на относительно устойчивом уровне у лиц, выдержавших нагрузку. Однако изменения параметра Ps у лиц, не выдержавших нагрузку, могут свидетельствовать о происходящих у них более глубоких изменениях механизмов межцентральной интеграции в ЦНС, что позволяет предположить более высокую информативность оценки динамики параметра Ps на поздних, в том числе критических стадиях воздействия гипоксии.
Выявлено частичное несоответствие оценок чувствительности к гипоксии по данным оценки интегральных параметров ЭЭГ и уровню SaO2. Использование нормированных интегральных параметров ЭЭГ позволяет классифицировать испытуемых по степени чувствительности к гипоксии и выявить лиц с высокой чувствительностью при относительно небольшом падении SaO2 и лиц, устойчивых к гипоксии даже при низких уровнях SaO2.
Предложенный подход к оценке функционального состояния мозга в динамике на основе представления образа ЭЭГ в пространстве двух переменных, одна из которых характеризует масштаб интегральной временно́й, а другая – пространственной связности колебаний потенциалов мозга, может быть использован при изучении воздействия на ЦНС нейротропных факторов для отбора лиц, работа которых связана с воздействием гипоксии, а также в клинике для мониторинга состояния пациентов с угрозой развития острой гипоксии.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены Комиссией по этике Ученого совета Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН (Санкт-Петербург).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено при поддержке Программы научных исследований президиума РАН № 18 (АААА-А18-118013190226-4).
Благодарности. Авторы выражают благодарность с. н. с. ИЭФБ РАН к. м. н. Э.А. Бурых за его важный вклад в проведение экспериментальных исследований.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Малкин В.Б., Гиппенрейтер Е.Б. Острая и хроническая гипоксия. Проблемы космической биологии. М.: Наука, 1977. 315 с.
Новиков В.С., Сороко С.И. Физиологические основы жизнедеятельности человека в экстремальных условиях. СПб.: Политехника-принт, 2017. 476 с.
Zhao J.-P., Zhang R., Yu Q., Zhang J.-X. Characteristics of EEG activity during high altitude hypoxia and lowland reoxygenation // Brain Res. 2016. V. 1648. Pt. A. P. 243.
Petrassi F.A., Hodkinson P.D., Walters P.L., Gaydos S.L. Hypoxic hypoxia at moderate altitudes: review of the state of the science // Aviat. Space Environ. Med. 2012. V. 83. № 10. P. 975.
Berger M.M., Grocott M.P.W. Facing acute hypoxia: from the mountains to critical care medicine // Br. J. Anaesth. 2017. V. 118. № 3. P. 283.
McMorris T., Hale B.J., Barwood M. et al. Effect of acute hypoxia on cognition: A systematic review and meta-regression analysis // Neurosci. Biobehav. Rev. 2017. V. 74. Pt. A. P. 225.
Кривощеков С.Г., Балиоз Н.В., Некипелова Н.В., Капилевич Л.В. Возрастные, гендерные и индивидуально-типологические особенности реагирования на острое гипоксическое воздействие // Физиология человека. 2014. Т. 40. № 6. С. 34. Krivoshchekov S.G., Balioz N.V., Nekipelova N.V., Kapilevich L.V. Age, gender, and individually-typological features of reaction to sharp hypoxic influence // Human Physiology. 2014. V. 40. № 6. P. 613.
Вётош А.Н., Шараев А.П. Особенности параметрического описания реакции организма человека на стабильный гипоксический стимул // Ульяновский медико-биологический журнал. 2016. № 4. С. 86.
Melnikov V.N., Divert V.E., Komlyagina T.G. et al. Baseline Values of Cardiovascular and Respiratory Parameters Predict Response to Acute Hypoxia in Young Healthy Men // Physiol. Res. 2017. V. 66. № 3. P. 467.
Шарова Е.В., Огурцова А.А., Лаптева К.Н. ЭЭГ у нейрохирургических больных в раннем послеоперационном периоде / Нейрофизиологические исследования в клинике. М.: ФГАУ НМИЦ нейрохирургии им. акад. Н.Н. Бурденко, 2019. С. 150.
Ozaki H., Watanabe S., Suzuki H. Topographic EEG changes due to hypobaric hypoxia at simulated high altitude // Electroencephalogr. Clin. Neurophysiol. 1995. V. 94. № 5. P. 349.
Schellart N.A., Reits D. Transient and maintained changes of the spontaneous occipital EEG during acute systemic hypoxia // Aviat. Space Environ. Med. 2001. V. 72. № 5. P. 462.
Ginsburg D.A., Pasternak E.B., Gurvitch A.M. Correlation analysis of delta activity generated in cerebral hypoxia // Electroencephalogr. Clin. Neurophysiol. 1990. V. 42. № 4. P. 445.
Сороко С.И., Бекшаев С.С., Рожков В.П. “ЭЭГ-маркеры” нарушения системной деятельности мозга при гипоксии // Физиология человека. 2007. Т. 33. № 5. С. 39. Soroko S.I., Bekshaev S.S., Rozhkov V.P. EEG Markers of the Disturbed Systemic Brain Activity in Hypoxia // Human Physiology. 2007. V. 33. № 5. P. 546.
Рожков В.П., Сороко С.И., Трифонов М.И. и др. Корково-подкорковые взаимодействия и регуляция функционального состояния мозга при острой гипоксии у человека // Рос. физиол. журн. им. И.М. Сеченова. 2008. Т. 94. № 5. С. 481. Rozhkov V.P., Soroko S.I., Trifonov M.I. et al. [Cortical-subcortical interactions and the brain functional state regulation under acute hypoxia in man] // Ross. Fiziol. Zh. Im. I.M. Sechenova. 2008. V. 94. № 5. P. 481.
Li G., Zhang T., Chen X. et al. Effect of intermittent hypoxic training on hypoxia tolerance based on brain functional connectivity // Physiol. Meas. 2016. V. 37. № 12. P. 2299.
Papadelis C., Kourtidou-Papadeli C., Bamidis P.D. et al. The effect of hypobaric hypoxia on multichannel EEG signal complexity // Clin. Neurophysiol. 2007. V. 118. № 1. P. 31.
Schwender D., Daunderer M., Mulzer S. et al. Spectral edge frequency of the electroencephalogram to monitor “depth” of anaesthesia with isoflurane or propofol // Br. J. Anaesth. 1996. V. 77. № 2. P. 179.
Medical Advisory Secretariat. Bispectral index monitor: an evidence-based analysis // Ont. Health Technol. Assess. Ser. 2004. V. 4. № 9. P. 1.
Диасамидзе К.Э., Юсупов Х.Э., Рыбка М.М. Мониторинг глубины наркоза в современной анестезиологии // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2017. Т. 18. № 3. С. 256.
Davies C., Katyayani K., Kunst G. et al. Comparing Bispectral Index and Narcotrend monitors in patients undergoing major hepatobiliary surgery: a case series // Clinical Audit. 2019. V. 11. P. 17.
Schneider S., Strüder H.K. Monitoring effects of acute hypoxia on brain cortical activity by using electromagnetic tomography // Behav. Brain Res. 2009. V. 197. № 2. P. 476.
Seghier M.L., Price C.J. Interpreting and Utilising Intersubject Variability in Brain Function // Trends Cogn. Sci. 2018. V. 22. № 6. P. 517.
Wei C.-S., Lin Y.-P., Wang Y.-T. et al. A subject-transfer framework for obviating inter- and intra-subject variability in EEG-based drowsiness detection // Neuroimage. 2018. V. 174. P. 407.
Трифонов М.И., Панасевич Е.А. Прогнозирование успешности когнитивной деятельности на основе интегральных характеристик ЭЭГ // Физиология человека. 2018. Т. 44. № 2. С. 103. Trifonov M.I., Panasevich E.A. Prediction of Successful Personal Cognitive Performance Based on Integrated Characteristics of Multichannel EEG // Human Physiology. 2018. V. 44. № 2. P. 208.
Балиоз Н.В., Кривощеков С.Г. Индивидуально-типологические особенности ЭЭГ спортсменов при остром гипоксическом воздействии // Физиология человека. 2012. Т. 38. № 5. С. 24. Balioz N.V., Krivoshchekov S.G. Individual typological features in the EEG of athletes after acute hypoxic treatment // Human Physiology. 2012. V. 38. № 5. P. 470.
Рожков В.П., Трифонов М.И., Бурых Э.А., Сороко С.И. Оценка индивидуальной устойчивости человека к острой гипоксии по интегральным характеристикам структурной функции многоканальной ЭЭГ // Рос. физиол. журн. им. И.М. Сеченова. 2019. Т. 105. № 7. С. 832.
Вадзинский Р.Н. Справочник по вероятностным распределениям. СПб.: Наука, 2001. 295 с.
Trifonov M. The structure function as new integral measure of spatial and temporal properties of multi-channel EEG // Brain Informatics. 2016. V. 3. № 4. P. 211.
Прохоров С.А., Графкин В.В. Структурно-спектральный анализ случайных процессов. Самара: СНЦ РАН, 2010. 128 с.
Ливанов М.Н. Пространственная организация процессов головного мозга. М.: Наука, 1972. 182 с.
Babiloni C., Barry R.J., Başar E. et al. International Federation of Clinical Neurophysiology (IFCN) – EEG research workgroup: Recommendations on frequency and topographic analysis of resting state EEG rhythms. Part 1: Applications in clinical research studies // Clin. Neurophysiol. 2020. V. 131. № 1. P. 285.
Ухтомский А.А. Собрание сочинений. Т. II. Парабиоз, физиологическая лабильность, усвоение ритма. Л.: Изд-во ЛГУ, 1951. 179 с.
Гриндель О.М. Оптимальный уровень когерентности ЭЭГ и его значение в оценке функционального состояния мозга человека // Журн. высш. нервн. деят. 1980. Т. 30. № 1. С. 62.
Цицерошин М.Н., Шеповальников А.Н. Становление интегративной функции мозга. СПб.: Наука, 2009. 249 с.
Шеповальников А.Н., Цицерошин М.Н., Рожков В.П. и др. Особенности межрегионального взаимодействия корковых полей при разных стадиях естественного и гипнотического сна (по данным ЭЭГ) // Физиология человека. 2005. Т. 31. № 2. С. 34. Shepovalnikov A.N., Tsitseroshin M.N., Rozhkov V.P. et al. Interregional cortical interactions at different stages of natural sleep and the hypnotic state: EEG evidence // Human Physiology. 2005. V. 31. № 2. P. 150.
Болдырева Г.Н. Электрическая активность мозга человека при поражениях диенцефальных и лимбических структур. М.: Наука, 2000. 181 с.
Koenig T., Studer D., Hubl D. et al. Brain connectivity at different time-scales measured with EEG // Phil. Trans. R. Soc. B. Biol. Sci. 2005. V. 360. № 1457. P. 1015.
Lopes da Silva F.H. Neural mechanisms underlying brain waves: from neural membranes to networks // Electroencephalogr. Clin. Neurophysiol. 1991. V. 79. № 2. P. 81.
Buzsaki G. Rhythms of the Brain. New York, N.Y.: Oxford University Press, 2006. 448 p.
Jiruška P., Prokš J., Drbal O. et al. Comparison of Different Methods of Time Shift Measurement in EEG // Physiol. Res. 2005. V. 54. № 4. P. 459.
Seth A.K., Barrett A.B., Barnett L. Granger causality analysis in neuroscience and neuroimaging // J. Neurosci. 2015. V. 35. № 8. P. 3293.
Бьен Дж.Г., Каплан А.Я., Тимашев С.Ф. и др. Изменчивость автокорреляционной структуры ЭЭГ у подростков при расстройствах шизофренического спектра // Физиология человека. 2007. Т. 33. № 1. С. 138. Byeon J.G., Kaplan A.Ya., Timashev S.F. et al. Variability of the EEG Autocorrelation Structure in Adolescents with Schizophrenia Spectrum Disorders // Human Physiology. 2007. V. 33. № 1. P. 122.
Абдурахманов Р.Г., Пиняскина Е.В., Пиняскина Е.В. Спектральный анализ электрокортикограммы крыс при гипотермии // Международный журн. прикладных и фундаментальных исследований. 2014. № 8-3. С. 90.
Lehmann D., Ozaki H., Pal I. EEG alpha map series: brain micro-states by space-oriented adaptive segmentation // Electroencephalogr. Clin. Neurophysiol. 1987. V. 67. № 3. P. 271.
Khanna A., Pascual-Leone A., Michel C.M., Farzan F. Microstates in Resting-State EEG: Current Status and Future Directions // Neurosci. Biobehav. Rev. 2015. V. 49. P. 105.
Лукьянова Л.Д. Молекулярные механизмы тканевой гипоксии и адаптация организма // Фiзiол. журн. 2003. Т. 49. № 3. С. 17.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


