Физиология человека, 2021, T. 47, № 3, стр. 52-59
Постактивационный эффект дельтовидной мышцы здорового молодого человека после краткосрочной “сухой” иммерсии
А. Ю. Мейгал 1, *, Л. И. Герасимова-Мейгал 1, А. Е. Пескова 1
1 ФГБОУ ВО Петрозаводский государственный университет
Петрозаводск, Россия
* E-mail: meigal@petrsu.ru
Поступила в редакцию 13.12.2020
После доработки 24.12.2020
Принята к публикации 24.12.2020
Аннотация
Целью данной работы являлась характеристика постактивационного эффекта (ПАЭ) дельтовидных мышц здоровых молодых испытуемых после 45-минутного однократного сеанса моделированной микрогравитации в виде “сухой” иммерсии (СИ), при помощи метода поверхностной электромиографии (ЭМГ). Согласно рабочей гипотезе, ПАЭ должен уменьшаться после воздействия СИ. Установлено, что, вопреки исходной гипотезе, ПАЭ в дельтовидных мышцах усилился после сеанса СИ в виде удлинения у 8 из 9 испытуемых, примерно в 2 раза, с 66 до 135 с, без статистически значимого влияния на амплитуду и среднюю частоту ЭМГ. Среди вероятных факторов, повлиявших на результат, обсуждены: 1) фактор биомеханической функции дельтовидных мышц и связанная с ним вероятность “сенсорного конфликта” между действием СИ и необходимостью участвовать в функции равновесия, 2) фактор условий применения СИ, 3) фактор сложности задания (вертикальной стойки) при индукции ПАЭ, 4) фактор участия системы внутреннего представления о теле в проявлении ПАЭ. Полученные данные нацелены на исследование влияния аналоговой микрогравитации на мышечный тонус и мышечную ригидность у больных паркинсонизмом и ее реабилитационный потенциал.
Мышечный тонус считается одним из наиболее интересных и информационно насыщенных феноменов двигательной активности. Мышечный тонус проявляет себя по-разному, в зависимости от того, как он оценивается. Например, мышечный тонус можно определить как сопротивление мышцы ее пассивному растяжению (при пассивном движении в суставе), а также как “состояние готовности” к движению [1], или как неосознанное слабое длительное сокращение мышцы в состоянии покоя [2]. Соответственно, имеется и несколько компонентов, из которых складывается мышечный тонус: 1) физическая инерция самой конечности, 2) механо-эластическое (не-рефлекторное) сопротивление движению, 3) рефлекторное сопротивление (рефлекс на растяжение) и 4) центральный компонент, связанный с настройкой активности мышц в ЦНС [2–4].
У здорового человека имеется нормальный мышечный тонус, например, позный тонус или терморегуляционный тонус, вызванный охлаждением организма [5]. Для некоторых заболеваний ЦНС характерен патологически усиленный мышечный тонус, например, мышечная ригидность при паркинсонизме [6], спастичность мышц после инсульта или при детском церебральном параличе и рассеянном склерозе [7]. При шизофрении встречается гипертонус в виде каталепсии [8], а при посттравматическом синдроме часто наблюдается “тоническая иммобилизация”, которая имеет поведенческое происхождение [9]. Для птиц также характерна “тоническая иммобилизация” (оцепенение), имеющая защитное поведенческое значение и конкурирующая с холодовой дрожью за мотонейронный пул [10].
Одним из наиболее просто вызываемых, однако не вполне понятных с точки зрения генерации, нормальных видов мышечного тонуса является постконтракционный (постактивационный) эффект (ПАЭ), также называемый “Kohnstammeffekt” по имени Оскара Конштамма, или “Katatonusversuch” (“опыт с кататонусом”), как его называл сам О. Конштамм [11]. Физически, ПАЭ представляет собой подъем конечности (обычно рук) под действием тонуса, непроизвольно возникающего в мышце, которая предварительно изометрически активно сокращалась в течение 30–60 с, примерно вполовину своей максимальной силы. Характерной особенностью ПАЭ является необычайная легкость при подъеме рук, ощущение их “всплывания”.
Большой интерес к ПАЭ в последнее десятилетие может быть связан с тем, что этот, на первый взгляд, “занятный” вид мышечного тонуса, вероятно, являет некие базовые механизмы организации движения и позы человека, например, автоматизмы, и идеомоторные аспекты движения [12–15]. На сегодняшний день представляется, что на первом этапе, при произвольном сокращении мышцы, идет “зарядка” некоего врéменнoго “генератора Конштамм-эффекта”, который располагается, вероятно, в ретикулярной формации. Затем, на втором этапе, при расслаблении мышцы, этот “Конштамм-генератор” производит активность, которая реализуется через моторную кору и проявляется как непроизвольный тонус скелетной мышцы. Фактически происходит непроизвольное сокращение мышцы [12]. Самое интересное свойство ПАЭ – он “очищен” от произвольных влияний, что делает его привлекательной моделью для изучения двигательных автоматизмов. Считается, что при ПАЭ не создается копия “моторной команды”, что и создает ощущения “легкости” и “всплывания” рук [13].
Многочисленные космические и наземные исследования показали, что невесомость, реальная или моделированная, быстро и сильно снижает мышечный тонус вплоть до полной атонии [16], а сверхкороткое (45 мин) пребывание в условиях такой модели микрогравитации как “сухая” иммерсия (СИ) снижает даже такой стойкий мышечный гипертонус, как ригидность при паркинсонизме [17]. Интересно исследовать, как модифицируется ПАЭ после краткосрочного пребывания в состоянии СИ. Рабочая гипотеза заключается в том, что после СИ мышечный тонус в виде ПАЭ должен снижаться. Цель настоящей работы – исследовать характер ПАЭ дельтовидных мышц здорового человека после краткосрочной СИ. Это исследование является разведочным для последующего сравнения с влиянием СИ на ПАЭ у больных паркинсонизмом.
МЕТОДИКА
В исследовании принимали участие 9 здоровых молодых испытуемых в возрасте 19–20 лет (4 мужчины и 5 женщин). Принципы отбора, критерии включения и невключения, и клинико-неврологическое обследование представлены в работе [17]. Испытуемые (участники исследования [18]) проходили однократное короткое воздействие СИ. Исследование проводили в 2019 г. в Институте высоких биомедицинских технологий Петрозаводского государственного университета (ИВБМТ ПетрГУ, г. Петрозаводск).
Процедура активации ПАЭ. Предварительно, кандидата на включение в исследование тестировали на наличие и длительность ПАЭ. Для активации ПАЭ испытуемый активно отводил прямые руки, свободно свисающие вниз, строго в обе стороны против препятствия в виде ленты из крепкого материала, которая была обернута вокруг испытуемого на уровне большого вертела бедра. При этом сокращались дельтовидные мышцы. На ленту испытуемые нажимали при помощи тыльной стороны кисти. По инструкции, сила отведения не должна была быть большой, но существенной (субъективно – примерно в половину максимального сокращения), чтобы дельтовидные мышц не утомились во время сокращения. Произвольное сокращение дельтовидных мышц длилось 60 с, по прошествии которых испытуемый прекращал сокращение, лента отпускалась экспериментатором, и руки испытуемого освобождались. После этого начинался ПАЭ. Испытуемых, у которых наблюдали ПАЭ в виде длительного (>20 с) и выраженного (>45°С) отведения рук в стороны, допускали к СИ.
Процедура СИ. Детальное описание наземной модели микрогравитации в виде СИ представлено в работе [17]. Для погружения человека в состояние СИ использовали комплекс искусственной невесомости “МЕДСИМ” (ГНЦ РФ – ИМБП, г. Москва), которая представляет собой ванну с теплой (Тв = 32–33°С, 2 м2) пресной водой, которая периодически фильтруется и аэрируется. Перед погружением испытуемого укладывали на ложемент, покрытый тонкой прорезиненной пленкой большой площади, что позволяло заворачивать испытуемого в складки этой пленки. Также, для большего комфорта испытуемых обертывали индивидуальной хлопчатобумажной простыней. После 5 мин спокойного лежания для привыкания к обстановке, измерений артериального давления (АД) и записи электрокардиограммы (ЭКГ), ложемент при помощи электромотора опускали в воду и испытуемый оказывался в состоянии СИ, т.е. погруженным в воду, завернутым в складки пленки, но без прямого контакта с водой. Над уровнем воды оставались лицо и верхняя часть груди. Руки испытуемый держал удобно для себя (скрещенными на груди или вытянутыми вдоль туловища). Процедура СИ длилась 45 мин, в течение которых на 15, 30 и 45-й мин измеряли АД и записывали ЭКГ.
Процедура электромиографии (ЭМГ). Оценку ПАЭ производили при помощи поверхностной ЭМГ и визуально. Два одноразовых самоклеящихся электрода (Medicotest, M-00-S, Дания) прикрепляли прямо над средним пучком дельтовидной мышцы, билатерально. Заземляющий электрод укрепляли в области локтя. Кожу предварительно обезжиривали при помощи тампона, смоченного раствором этилового спирта (70%). Для ЭМГ использовали аппарат Нейро-МВП-8 (ООО “Нейрософт”, Россия). Полоса пропускания частот была 10–1000 Гц, фильтр сетевой наводки не был включен. В качестве метрик ЭМГ использовали среднюю частоту (MNF, Гц) и среднюю амплитуду (мВ), которые вычисляли в программной среде самого электромиографа по фрагментам длительностью 5 с, которые выбирали в наиболее стационарных участках ЭМГ в середине произвольной активности (примерно на 30-й с) и в начале ПАЭ (примерно на 5–10-й с), чтобы избежать эффекта утомления на ЭМГ при длительном сокращении дельтовидных мышц. При помощи ЭМГ визуально определяли начало и окончание ПАЭ, которое было видно как исчезновение ЭМГ. Окончание ПАЭ не всегда было отчетливым, что требовало внимательного рассмотрения записи ЭМГ.
Статистический анализ данных. Использовали лицензионную программу IBM SPSS Statistics 21.0 (IBM, США). Так как число испытуемых было ограниченным, а распределение переменных не было нормальным (тест Шапиро–Уилка), для парных связанных сравнений между состояниями “до СИ” и “после СИ” использовали непараметрический критерий Уилкоксона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У 3 испытуемых получен паттерн ПАЭ в виде длительного (>60 с) подъема рук до горизонтальной линии с медленным нечетким окончанием, у 4 испытуемых – в виде более короткого (до 60 с) подъема с резким окончанием (опусканием рук), у 2 испытуемых – в виде периодического подъема рук до горизонтальной линии (2–3 периода ПАЭ). Примеры ЭМГ при ПАЭ представлены на рис. 1. Длительность ПАЭ в обеих руках была одинаковой, т.е. ПАЭ прекращалась в обеих дельтовидных мышцах практически одновременно. Перед сеансом CИ длительность ПАЭ составила 66 с (44–103 с), а после сеанса СИ статистически значимо (p < 0.05) увеличилась у 8 испытуемых из 9 в среднем примерно в 2 раза – до 138 с (88–216 с). В целом, паттерн ПАЭ после сеанса СИ оставался примерно таким же, как и до СИ, поэтому увеличение длительности ПАЭ могло происходить за счет увеличения количества отдельных волн ПАЭ (с двух до трех) или за счет появления дополнительной длительной волны ПАЭ после опускания рук, которой не было до сеанса СИ. Также, происходило простое увеличение длительности ПАЭ в виде единственного периода активности (рис. 1).
Рис. 1.
Электромиограмма (ЭМГ) произвольной активности и постактивационного эффекта (ПАЭ) до и после сеанса “сухой” иммерсии (СИ) у двух разных испытуемых (А и Б). а – произвольная активность дельтовидной мышцы, б – ПАЭ. Калибровка времени – 5 c. Калибровка амплитуды – 400 мкВ.
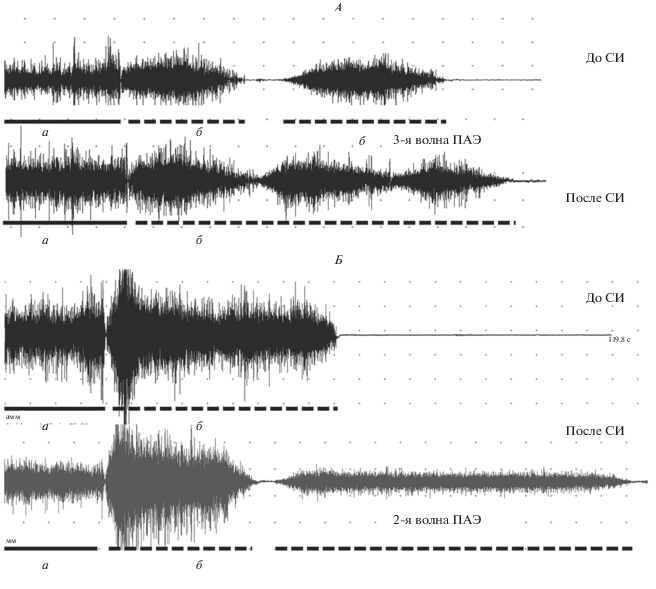
Средняя частота ЭМГ во время ПАЭ была в среднем на 8–9 Гц больше (p < 0.01), по сравнению с таковой во время произвольной активности, хотя их амплитуда была примерно одинаковой (табл. 1). После сеанса СИ средняя частота ЭМГ показала тенденцию к увеличению в правой дельтовидной мышце, как во время произвольной активности, так и во время ПАЭ, что, однако, было статистически незначимо. Амплитуда ЭМГ не изменилась под действием сеанса СИ (табл. 2).
Таблица 1.
Средняя частота ЭМГ (MNF, Гц) во время ПАЭ и произвольной активности в дельтовидных мышцах
| Сторона | Мышечная активность | До СИ | После СИ | p |
|---|---|---|---|---|
| Правая рука | Произвольная | 62 (58.3–70.1) | 68 (58–73.7) | 0.123 |
| ПАЭ | 71.7 (66.2–85.1)* | 77.2 (67.7–85)* | >0.5 | |
| Левая рука | Произвольная | 64.8 (56.4–70.9) | 65.1 (59.8–69.4) | 0.139 |
| ПАЭ | 82.5 (67.5–85.9)* | 82 (68.6–91.3)* | 0.139 |
Таблица 2.
Средняя амплитуда ЭМГ (мкВ) во время ПАЭ и произвольной активности в дельтовидных мышцах
| Сторона | Мышечная активность | До СИ | После СИ | p |
|---|---|---|---|---|
| Правая рука | Произвольная | 399 (234–445) | 309 (232–328) | >0.5 |
| ПАЭ | 281 (204–391) | 305 (229–391) | >0.5 | |
| Левая рука | Произвольная | 306 (229–470) | 269 (237–423) | >0.5 |
| ПАЭ | 310 (237–381) | 278 (219–403) | >0.5 |
Примечание: обозначения см. табл. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе исследовано влияние однократного сеанса СИ на длительность, амплитуду и среднюю частоту ЭМГ при произвольной активности дельтовидных мышц и ПАЭ. Согласно рабочей гипотезе, после кратковременного воздействия моделированной микрогравитации, индуцированной при помощи СИ, мышечный тонус в виде ПАЭ должен был снижаться.
Установлено, что наиболее заметным и статистически значимым эффектом СИ на ПАЭ стало увеличение его длительности примерно в два раза, наблюдавшееся у 8 из 9 испытуемых. Амплитуда ЭМГ, характеризующая амплитуду ПАЭ, практически не изменились после сеанса СИ. Таким образом, влияние СИ, на такой специфический вид мышечного тонуса как ПАЭ, проявилось только в виде его удлинения, что можно считать усилением ПАЭ. Также, средняя частота поверхностной ЭМГ, характеризующая организацию мышечного сокращения на уровне двигательных единиц [19] не претерпела изменений. Таким образом, полученные данные свидетельствуют об усилении (удлинении) ПАЭ дельтовидных мышц после применения краткосрочной СИ. Это противоречит исходной рабочей гипотезе о вероятном уменьшения ПАЭ после действия СИ, что требует критического анализа результатов.
Возможно несколько вариантов объяснения полученного противоречия. Во-первых, на полученный результат могла повлиять сама биомеханическая функция дельтовидной мышцы, в которой изучался ПАЭ. Функцией дельтовидных мышц является отведение рук от тела, т.е. подъем в стороны, до горизонтального уровня. Действительно, наши предыдущие работы показали, что в различных мышцах ПАЭ модифицируется температурными стимулами по-разному. В частности, было показано, что в двуглавых мышцах плеча охлаждение усиливает [20], а согревание уменьшает ПАЭ [21]. Это могло быть связано со сгибательной функцией двуглавой мышцы, которая в силу своего действия могла уменьшать площадь теплоотдачи организма, участвуя, таким образом, в функции терморегуляции. В дельтовидных же мышцах охлаждение не вызывало усиление ПАЭ, и это могло быть связано с ее биомеханической функцией отведения рук от тела, что невыгодно с точки зрения терморегуляции [21]. Таким образом, в дельтовидных мышцах, вероятно, актуализировались конкурентные отношения между функциями терморегуляции и равновесия, что хорошо соответствует концепции “сенсорного конфликта” [22]. Поэтому, ПАЭ в настоящем исследовании вполне могла находиться под управлением противоположных по действию факторов, что требовало их учета и интеграции в ЦНС для наиболее функционально выгодного проявления в конкретной мышце, причем с учетом контекстных условий среды. Большое значение в таких сложных сенсорных и контекстных условиях приобретает концепция “системы внутреннего представления” организма [22, 23]. Возможность модификации ПАЭ при помощи положения тела и даже “переключение” ПАЭ с одной мышцы на другую былa показанa в работе В.С. Гурфинкеля и др. [24].
В связи с этим, в данной работе мы могли столкнуться с ситуацией, когда в силу необходимости участия дельтовидных мышц в осуществлении функции равновесия при помощи отведения рук во время вертикальной стойки, их активность после СИ могла усилиться вместо того, чтобы уменьшится. Испытуемые после сеанса СИ могли испытывать состояние неустойчивости, связанное с длительным горизонтальным положением и ортостатической реакцией. Также, условия СИ сами обладают специфическим действием снижать АД [16]. Вместе с тем, испытуемые в нашем исследовании после СИ поднимались с ложемента с восстановившимся артериальным давлением, а обследование этой же группы испытуемых не выявило у них статистически значимых изменений стабилометрических параметров – длины траектории общего центра давления, скорости и площади его перемещения [18]. Это указывает на то, что у здоровых молодых испытуемых фактор равновесия/ортостатической реакции не мог внести решающий вклад в удлинение ПАЭ после сеанса СИ. В сумме, это требует дальнейшего поиска факторов, влияющих на ПАЭ в дельтовидных мышцах. Возможным кандидатом на роль фактора, повышающего активность дельтовидных мышц, может послужить снижение уровня бодрствования после СИ. Так, нами было ранее отмечено, что многие испытуемые – больные паркинсонизмом – засыпают во время процедуры СИ [17]. В настоящем исследовании испытуемые также сообщали о сильном релаксирующем эффекте сеанса СИ.
Во-вторых, нами не было учтено состояние мышечного тонуса в мышцах нижних конечностей, например, в камбаловидной и икроножной мышцах, в которых, вероятнее всего, произошло снижение тонуса под действием СИ. Снижение мышечного тонуса в мышцах голени могло вызвать усиление неустойчивости испытуемого при вертикальной стойке и необходимость усилить вовлечение дельтовидных мышц в функцию статического равновесия. В частности в работе [25] было показано увеличение всех стабилометрических параметров примерно на 20% после СИ. Вместе с тем, в данной работе применялся более длительный сеанс СИ (3 дня), что и определило столь сильное изменение стабилометрических параметров. Тем не менее, в будущих исследованиях по данной проблеме следует применять ЭМГ-контроль и, возможно, исследовать вязко-эластические аспекты тонуса мышц голени [25].
В-третьих, на результат могло повлиять то, что ПАЭ исследовался нами не во время самой СИ, а после нее, поэтому прямой эффект СИ на ПАЭ вполне мог остаться незамеченным. Вместе с тем, нами ранее было показано, что эффект снижения такого вида гипертонуса, как мышечная ригидность при паркинсонизме, длится по крайней мере несколько часов после СИ [18]. В связи с этим, в будущих исследованиях следует сконструировать условия, которые позволят оценивать ПАЭ в условиях, приближенных к условиям СИ, или другим способам моделирования микрогравитации. Например, вместо условий СИ можно использовать условия “флотации”, т.е. положение испытуемого “лежа на воде”, а не погружения (иммерсии) в воду. Условия флотации, конечно же, не идентичны таковым при СИ, но частично несут в себе ее эффекты. Также, возможно использование систем разгрузки веса тела человека, которые применяются для моделирования микрогравитации.
Перспективы исследования. Возможные пути решения задачи о влиянии моделированной микрогравитации на ПАЭ человека могут быть следующими. Во-первых, так как биомеханическая функция дельтовидных мышц в виде отведения рук и участие этих мышц в реакциях равновесия могла повлиять на полученный результат, в дальнейших исследованиях представляется правильным оценить ПАЭ после СИ также и в сгибательной мускулатуре. Например, в двуглавых мышцах плеча ПАЭ вызывается достаточно часто, хотя и не на столь продолжительное время, как дельтовидных мышцах [21], поэтому в двуглавой мышце ПАЭ может быть исследован в более естественных, не нагруженных антигравитационной функцией, условиях.
Во-вторых, могут быть использованы виды тонуса, которые связаны с вибрационным воздействием – вибрационно-тонический рефлекс, а также поствибрационный эффект, аналогичный ПАЭ. Эти виды тонуса более стандартны в своем проявлении и удобны в применении, так как задаются внешним стимулом.
В-третьих, ПАЭ может быть оценен в условиях более сложного межсенсорного взаимодействия. Известно, что сенсорные системы, принимающие участие в осуществлении вертикальной стойки (вестибулярная, зрительная и проприоцептивная) задают собственные опорные системы координат, соответственно, гравитационную, алло- и эгоцентрическую, [26], что позволяет изменять соотношение весовых коэффициентов (феномен re-weighting) этих сенсорных систем в регуляции позы в меняющихся условиях [27]. В связи с этим, феномен ПАЭ может быть оценен после СИ в разных сенсорных условиях – с закрытыми глазами, в условиях виртуальной реальности, на податливой основе, при вестибулярных стимулах, при стоянии на одной ноге [27, 28]. В частности, известно, что у пожилых людей весовой коэффициент зрительного сенсорного канала увеличен за счет снижения проприоцептивного канала, по сравнению с молодыми людьми [27, 29]. Поскольку данная работа является разведочной для последующего изучения ПАЭ у больных паркинсонизмом, исследование ПАЭ у пожилых людей также следует провести для понимания вклада фактора возраста в проявление ПАЭ при болезни Паркинсона.
ЗАКЛЮЧЕНИЕ
В настоящей работе, вопреки исходной гипотезе, были получены данные об усилении (удлинении) ПАЭ в дельтовидных мышцах здоровых молодых людей после 45-минутного сеанса моделированной при помощи СИ микрогравитации. Данная работа является разведочной для последующего применения такого феномена, как ПАЭ, в исследовании влияния наземных моделей микрогравитации на мышечный тонус и ригидность у больных паркинсонизмом. Цель такого исследования – оценка реабилитационного потенциала микрогравитации СИ в отношении паркинсонизма. Полученный результат заставляет модифицировать подход к исследованию влияния СИ на больных паркинсонизмом в следующих направлениях: 1) необходимо оценивать ПАЭ не только в тех мышцах, в которых ПАЭ легко вызывается, но и в тех мышцах, в которых состояние “сенсорного конфликта” между реакцией на условия СИ и их участием в движении (равновесии) не столь выражено или отсутствует; 2) потребуется усложнить условия исполнения двигательной задачи при помощи межсенсорной интеграции, которая особенно страдает у пожилых людей, которые и составляют огромное большинство больных паркинсонизмом; 3) следует найти возможность оценки ПАЭ непосредственно во время условий СИ.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом (объединенный этический комитет Петрозаводского государственного университета и Министерства здравоохранения Республики Карелия, Петрозаводск, протокол № 31, 18.02.2015).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках государственного задания Министерства науки и высшего образования РФ (тема № 0752-2020-0007).
Благодарности. Авторы выражают благодарность добровольцам-испытуемым, которые согласились участвовать в исследовании.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Davis J.R., Horslen B.C., Nishikawa K. et al. Human proprioceptive adaptations during states of height-induced fear and anxiety // J. Neurophysiol. 2011. V. 106. № 6. P. 3082.
Needle A.R., Baumeister J., Kaminski T.W. et al. Neuromechanical coupling in the regulation of muscle tone and joint stiffness // Scand. J. Med. Sci. Sports. 2014. V. 24. № 5. P. 737.
Katz R.T., Rymer W.Z. Spastic hypertonia: mechanisms and measurement // Arch. Phys. Med. Rehabil. 1989. V. 70. № 2. P. 144.
Ward A.B. Assessment of muscle tone // Age Ageing. 2000. V. 29. № 5. P. 385.
Meigal A.Y., Lupandin Y.V., Hänninen O. Head and body positions affect thermoregulatory tonus in deltoid muscles // J. Appl. Physiol. 1996. V. 80. № 4. P. 1397.
Baradaran N., Tan S.N., Liu A. et al. Parkinson’s disease rigidity: relation to brain connectivity and motor performance // Front. Neurol. 2013. V. 4. P. 67.
Trompetto C., Marinelli L., Mori L. et al. Pathophysiology of spasticity: implications for neurorehabilitation // Biomed. Res. Int. 2014. V. 2014. P. 354906.
Benarous X., Raffin M., Ferrafiat V. et al. Catatonia in children and adolescents: New perspectives // Schizophr. Res. 2018. V. 200. P. 56.
Hagenaars M.A., Hagenaars J.A.P. Tonic immobility predicts poorer recovery from posttraumatic stress disorder // J. Affect Disord. 2020. V. 264. P. 365.
Hohtola E. Tonic immobility and shivering in birds: evolutionary implications // Physiol. Behav. 1981. V. 27. № 3. P. 475.
Kohnstamm O. Demonstration einer katatoneartigen erscheinung beim gesunden (Katatonusuersuch) // Neurol. Central. 1915. V. 34. P. 290.
De Havas J., Ghosh A., Gomi H., Haggard P. Sensorimotor organization of a sustained involuntary movement // Front. Behav. Neurosci. 2015. V. 9. P. 185.
De Havas J., Gomi H., Haggard P. Experimental investigations of control principles of involuntary movement: a comprehensive review of the Kohnstamm phenomenon // Exp. Brain Res. 2017. V. 235. № 7. P. 1953.
Duclos C., Roll R., Kavounoudias A., Roll J.P. Cerebral correlates of the “Kohnstamm phenomenon”: an fMRI study // Neuroimage. 2007. V. 34. № 2. P. 774.
Solopova I.A., Selionov V.A., Zhvansky D.S. et al. Human cervical spinal cord circuitry activated by tonic input can generate rhythmic arm movements // J. Neurophysiol. 2016. V. 115. № 2. P. 1018.
Tomilovskaya E., Shigueva T., Sayenko D. et al. Dry immersion as a ground-based model of microgravity physiological effects // Front. Physiol. 2019. V. 10. P. 284.
Meigal A., Gerasimova-Meigal L., Saenko I., Subbotina N. Dry immersion as a novel physical therapeutic intervention for rehabilitation of Parkinson’s disease patients: A feasibility study // Phys. Med. Rehab. Kuror. 2018. V. 28. № 5. P. 275.
Мейгал А.Ю., Третьякова О.Г., Герасимова-Мейгал Л.И., Саенко И.В. Вертикальная ориентация в пространстве у больных паркинсонизмом при воздействии однократной “сухой” иммерсии и курса иммерсий // Физиология человека. 2021. Т. 47. № 2. С. 72. Meigal A.Yu., Tretjakova O.G., Gerasimova-Meigal L.I., Sayenko I.V. Vertical Spatial Orientation in Patients with Parkinsonism under the State of a Single “Dry” Immersion and a Course of Immersions // Human Physiology. 2021. V. 47. № 2. P. 183.
Del Vecchio A., Negro F., Felici F., Farina D. Associations between motor unit action potential parameters and surface EMG features // J. Appl. Physiol. 2017. V. 123. № 4. P. 835.
Meigal A.Y., Lupandin Y.V., Hänninen O. Influence of cold and hot conditions on postactivation in human skeletal muscles // Pflugers Arch. 1996. V. 432. № 1. P. 121.
Мейгал А.Ю., Письменный К.Н. Влияние общего согревания и охлаждения организма организма на постактивационный эффект в мышцах верхних конечностей // Физиология человека. 2009. Т. 35. № 1. С. 60. Meigal A.Yu., Pis’mennyi K.N. The influence of whole body heating and cooling on the aftercontraction effect in the upper limb muscles // Human Physiology. 2009. V. 35. № 1. P. 51.
Левик Ю.С. Н.А. Бернштейн и смена парадигмы в физиологии движений: от рефлексов к управлению на основе системы внутреннего представления. М.: Издательский дом КДУ, 2019. С. 35.
Левик Ю.С. Исследования в космосе и новые концепции в физиологии движений // Авиакосмическая и экологическая медицина. 2020. Т. 54. № 6. С. 80. Levik Y.S. [Space researches and new concepts in the physiology of motion] // Aviakosm. Ekolog. Med. 2020. V. 54. № 6. P. 80.
Гурфинкель В.С. Левик Ю.С., Лебедев М.А. Ближние и отдаленные постактивационные эффекты в двигательной системе человек // Нейрофизиология. 1989. Т. 21. № 3. С. 343. Gurfinkel V.S., Levik Y.S., Lebedev M.A. Immediate and remote postactivation effects in the human motor system // Neurophysiology. 1989. V. 21. № 3. P. 247.
Treffel L., Dmitrieva L., Gauquelin-Koch G. et al. Craniomandibular system and postural balance after 3-Day dry immersion // PLoS One. 2016. V. 11. № 2. P. e0150052.
Foisy A., Kapoula Z. Plantar cutaneous afferents influence the perception of Subjective Visual Vertical in quiet stance // Sci. Rep. 2018. V. 8. № 1. P. 14939.
Feller K.J., Peterka R.J., Horak F.B. Sensory re-weighting for postural control in parkinson’s disease // Front. Hum. Neurosci. 2019. V. 13. P. 126.
Сметанин Б.Н., Кожина Г.В., Попов А.К., Левик Ю.С. Спектральный анализ колебаний тела человека при стоянии на твердой и податливой опорах в разных зрительных условиях // Физиология человека. 2016. Т. 42. № 6. С. 49. Smetanin B.N., Kozhina G.V., Popov A.K., Levik Y.S. Spectral analysis of the human body sway during standing on firm and compliant surfaces under different visual conditions // Human Physiology. 2016. V. 42. № 6. P. 626.
Riva D., Fani M., Benedetti M.G. et al. Effects of high-frequency proprioceptive training on single stance stability in older adults: implications for fall prevention // Biomed. Res. Int. 2019. V. 2019. P. 2382747.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


