Физиология человека, 2021, T. 47, № 3, стр. 60-71
Динамика показателей состава тела и некоторых биохимических параметров у участников 21-суточной “сухой” иммерсии без применения средств профилактики
Г. Ю. Васильева 1, *, К. В. Гордиенко 1, Д. П. Сидоренко 1, С. П. Щелыкалина 2, 3, Е. В. Баталова 1, Е. С. Томиловская 1, Р. Р. Гимадиев 4, А. М. Носовский 1, И. М. Ларина 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 ФГАОУ ВО РНИМУ имени Н.И. Пирогова Минздрава России
Москва, Россия
3 ООО Научно-технический центр “МЕДАСС”
Москва, Россия
4 ФГАО ВО Российский университет дружбы народов (РУДН)
Москва, Россия
* E-mail: galvassilieva@mail.ru
Поступила в редакцию 09.10.2020
После доработки 11.11.2020
Принята к публикации 24.12.2020
Аннотация
В статье представлены результаты исследования временнóй динамики компонентного состава тела и уровней содержания гормонов, участвующих в регуляции энергетического обмена и пищевого поведения, у здоровых добровольцев, находившихся в условиях “сухой” иммерсии (СИ) в течение 21 сут без применения средств профилактики неблагоприятных эффектов экспериментальных условий. Состав тела испытуемых исследовали с помощью биоимпедансного анализа (БИА). Показано, что влияние факторов модельного эксперимента с 21-суточной СИ на состав тела 10 участников выражалось в уменьшении доли тощей массы при одновременном увеличении жировой компоненты. С помощью кластерного анализа были выделены две равные по числу участников однородные группы, со сниженной групповой вариабельностью параметров состава тела и параметров системной регуляции энергетического обмена. При более высокой относительной жировой массе тела (ЖМ), но более низкой – безжировой (БЖМ), с более высоким уровнем основного обмена – воздействие факторов 21-суточной иммерсии сказывалось в достоверном снижении (p < 0.05) доли скелетно-мышечной массы (СММ%) тела. При более низкой относительной ЖМ, но более высокой – БЖМ, с более низким уровнем основного обмена – во время 21-суточной иммерсии отмечена стабильность доли скелетно-мышечной массы, при повышении показателя СММ% (p < 0.05) по завершению СИ. Во время СИ в данной группе отмечено значимое увеличение уровня инсулина крови. Концентрации лептина, триглециридов различались между группами в разные периоды эксперимента.
Актуальность исследования влияния экстремальных факторов на компонентный состав тела человека, в том числе в космическом полете (КП) и при наземном моделировании его эффектов, обусловлена отражением в составе тела признаков метаболической адаптации, затрагивающей различные стороны обмена веществ, в частности жировой обмен. Изучение происходящих во время КП метаболических изменений ограничено методическими возможностями и, в аспекте последующего обобщения, длительным периодом сбора данных. Проводимые в Институте медико-биологических проблем РАН (г. Москва) эксперименты, моделирующие воздействие на организм человека различных факторов КП, позволяют в контролируемых условиях получить достаточный объем наблюдений с использованием широкого набора методов.
Исследования в клинической и спортивной медицине убедительно показывают важное значение анализа и мониторинга изменений компонентного состава как всего тела, так и его отдельных регионов. Мониторинг состава тела показал свою значимость в наблюдении ранних признаков гипертензии, связанной как с генетической предопределенностью, так и с условиями жизнедеятельности и питания человека, а также c процессом старения [1–5]. Одним из очевидных направлений таких исследований, дающих объективную информацию при различных функциональных состояниях организма человека, является поиск связи изменений в составе тела с гиподинамией [6, 7]. В то же время множество работ адресовано поискам биологических маркеров патогенеза метаболических нарушений при увеличении жировой компоненты массы тела [8–15], и состояниях, индуцирующих оксидативный стресс [16, 17].
Для гравитационной физиологии и медицины важное практическое значение имеет определение нутритивного статуса, для оценки адекватности поступления с пищей энергии во время длительного воздействия на организм факторов КП. Другим аспектом, важным для космической медицины, является исследование взаимосвязи параметров состава тела с показателями физической работоспособности человека [18], для разработки методов оценки особенностей индивидуальной адаптации к силовым нагрузкам [19]. В алгоритме FRAX® (fracture risk assessment tool), разработанном ВОЗ для определения 10-летнего риска костных переломов [20], используется тесная связь между минеральной плотностью кости (МПК) и индексом массы тела (ИМТ), что свидетельствует о влиянии модификаций жирового обмена на процессы костного метаболизма.
Проведенные ранее исследования методом двухэнергетической рентгеновской абсорбциометрии после КП различной продолжительности на орбитальных станциях “Мир” и Международной космической станции (МКС), показали достоверные изменения жировой и тощей массы тела космонавтов [21, 22]. В космическом эксперименте “СПРУТ-2”, проведенном на борту МКС с участием 15 космонавтов, при ежемесячном обследовании с использованием метода биоимпедансного анализа, были получены данные, выявляющие достоверное однонаправленное снижение массы тела за время орбитального полета с одновременной убылью мышечной массы и увеличением жировой компоненты [23].
Гормональная регуляция энергетического и жирового обмена связана с поддержанием баланса процессов потребления, производства и расхода энергии организмом. Субстраты жирового обмена служат источником производства энергии в организме и, в определенных условиях, в том числе, связанных со снижением физической активности – их удельный вклад может изменяться.
Таким образом, анализ компонентного состава тела и изучение этих параметров одновременно с показателями гормональной регуляции энергетического обмена в модельных условиях и в КП может дать объективную информацию о характере метаболической трансформации в организме, и использоваться для оценки как медицинских рисков, так и эффективности профилактических мероприятий.
Целью данной работы стало изучение динамики параметров состава тела и уровней гормонов, регулирующих энергетический обмен, у здоровых добровольцев, принимавших участие в 21-суточном модельном эксперименте с “сухой” иммерсией (СИ21) без средств и методов профилактики развития неблагоприятных эффектов (“контрольная группа”).
МЕТОДИКА
В экспериментальном исследовании “Состояние физиологических систем организма человека при моделировании отдельных факторов КП в условиях 21-суточной СИ без средств профилактики и с использованием искусственной силы тяжести, создаваемой при помощи центрифуги короткого радиуса. Этап 1”, проходящем в ГНЦ РФ – ИМБП РАН (г. Москва), принимали участие 10 здоровых мужчин (средний возраст 29.3 ± ± 3.56 года, рост 176.2 ± 3.8 см, масса тела 72.5 ± 11.4 кг, M ± SD). Испытуемые круглосуточно находились в иммерсионной ванне (рис. 1) в течение 21 сут, погруженные в воду с температурой 32.5 ± 2°С и изолированные от нее специальной гидроизолирующей тканью. Для проведения гигиенических процедур ежедневно на 15–20 мин проводили выемку из ванны, в положении обследуемого лежа на каталке. Условия проведения СИ21, описание участников и принципы организации питания подробно рассмотрены в работе Е.С. Томиловской и др. [24].
Рис. 1.
Схема, показывающая положение тела испытателя, находящегося в условиях “сухой” иммерсии (СИ).

Обследование каждого из участников осуществляли в фоновый период (за 7 сут до начала экспериментального периода), 2 раза во время СИ21 (на 7 и 14 сут проведения эксперимента), в день выхода из иммерсии (0 сут) и 1 раз после окончания СИ21 (+7 сут).
Для исследования динамики состава тела методом биоимпедансного анализа (БИА) использовали биоимпедансометр ABC-02 (“НТЦ “МЕДАСС”, Россия). Массу тела, длину тела стоя, обхват талии, бедер и запястья оценивали с помощью стандартного антропометрического оборудования [25]. Антропометрические измерения (окружность талии, бедер и запястья) и БИА проводили последовательно в утренние часы, до взятия венозной крови и завтрака, определение массы и длины тела – вечером предыдущего дня. До и после окончания СИ21 измерения методом БИА проводили в положении лежа на спине на кушетке. В период СИ21 (на 7, 14 и 21 сут), подготовительные операции, предшествующие БИА – подкладывание антистатических материалов, наложение электродов, подключение прибора и т.п., для сохранения эффектов перераспределения жидкостных сред, проводили с испытуемыми, находящимся в иммерсионной ванне в условиях безопорности. Верхнее положение подъемника иммерсионной ванны, при котором испытуемый находился в положении лежа на спине на ровной поверхности в течение 30 с, использовали непосредственно в момент измерения. При этом плечи обеих рук были разведены под углом 45° к продольной оси тела, предплечья располагались параллельно корпусу; ноги разведены относительно продольной оси так, чтобы они не касались друг друга. Измерение электрического сопротивления тела выполняли с использованием одноразовых кардиографических электродов FIAB F9049 (FIAB, Италия), наложенных в области лучезапястных и голеностопных суставов. С помощью расширенного программного обеспечения АВС01-0454 были получены значения следующих показателей тканевого состава тела: жировая (ЖМ), тощая (БЖМ), активная клеточная (АКМ) и скелетно-мышечная массы (СММ) тела и их доля от общей массы (выражены в %).
Для исследования динамики содержания инсулина, адипонектина, лептина, грелина, глюкозы и триглицеридов у всех участников эксперимента натощак в утренние часы, в положении лежа (нижнее положение подъемника иммерсионной ванны для забора во время СИ) из кубитальной вены проводили взятие проб венозной крови. После взятия кровь обрабатывали с соблюдением требований по первичной подготовке проб крови и центрифугировали при режимах, рекомендованных для исследуемых показателей. Для получения плазмы (консервант K2ЭДТА и гепарин) кровь центрифугировали при 4°С со скоростью 3000 об./мин в течение 15 мин, для получения сыворотки (с активатором свертывания) кровь центрифугировали при 21°С со скоростью 2500 об./мин в течение 10 мин.
Аликвоты образцов сыворотки и плазмы замораживали и сохраняли при температуре –80°С до проведения одномоментного анализа содержания гормонов в собранных образцах крови. Концентрации глюкозы, триглицеридов, холестерина и инсулина были измерены электрохемилюминесцентным методом на модульной платформе Cobas-6000 (Roche, Германия). Концентрации адипонектина, лептина и грелина (ацилированный, биологически активная форма) определяли методом ИФА на микропланшетном ридере Anthos 2010 (Biochrom Ltd., Великобритания) с использованием коммерческих тест-систем BCM Diagnostics (Канада), Bio Vendor (Чешская Республика).
Значения анализируемых параметров представлены как среднее и 95% доверительный интервал, а так же как среднее ± стандартное отклонение. Сравнение значений параметров в разные сутки наблюдения включало дисперсионный анализ повторных наблюдений с уровнем значимости 0.05 с последующим апостериорным анализом с использованием критерия Фишера. Все статистические тесты проводили с использованием программного обеспечения STATISTICA 10. Для выявления однородных групп (с учетом всех показателей) применяли кластерный анализ, метод Варда [26].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Среднегрупповые изменения массы тела испытуемых во время наблюдения были статистически достоверны: они были ниже фоновых значений на протяжении всего периода СИ21. Через неделю после окончания эксперимента показатель среднегрупповой массы тела добровольцев не вернулся к фоновым значениям (рис. 2).
Рис. 2.
Изменение массы тела участников эксперимента СИ21 без средств профилактики относительно фоновых значений, % (фон – ноль). Данные представлены в виде диаграммы размаха, где точка в середине линии — среднее значение. Отрезок, сформированный разбросом, – 95% доверительный интервал среднего значения.

БИА показал, что снижение общей массы тела в основном связано с уменьшением доли его тощей массы при одновременном увеличении жировой (табл. 1, рис. 3). Были выявлены достоверные изменения абсолютных и относительных величин БЖМ, ЖМ, АКМ и СММ на разных этапах эксперимента.
Таблица 1.
Изменение показателей биоимпедансного анализа (БИА) в течение СИ21 без средств профилактики
| Показатель | СИ –7 | СИ7 | СИ14 | СИ21 | СИ +7 |
|---|---|---|---|---|---|
| БЖМ, кг | 57.79 (53.23–62.35) |
54.32 (50.45–58.19) |
53.94 (49.68–58.19) |
53.6 (49.73–57.48) |
58.55 (54.58–62.53) |
| БЖМ, % | 80.34 (76.68–83.99) |
77.75 (73.17–82.32) |
77.35 (73.36–81.34) |
77.07 (72.82–81.32) |
82.61 (77.98–87.25) |
| ЖМ, кг | 14.71 (10.71–18.71) |
16.36 (11.47–21.25) |
16.5 (11.93–21.07) |
16.72 (11.93–21.5) |
13.04 (8.43–17.65) |
| ЖМ, % | 19.66 (16.01–23.32) |
22.25 (17.68–26.83) |
22.65 (18.66–26.64) |
22.93 (18.68–27.18) |
17.39 (12.75–22.02) |
| СММ, кг | 30.63 (28.29–32.96) |
28.32 (26.54–30.1) |
28.07 (26.05–30.1) |
27.84 (26.06–29.62) |
31.37 (29.43–33.3) |
| СММ, % | 53.02 (52.54–53.5) |
52.19 (51.52–52.87) |
52.09 (51.63–52.56) |
52 (51.41–52.58) |
53.61 (52.93–54.29) |
| АКМ, кг | 34.73 (31.48–37.98) |
34.67 (31.38–37.97) |
33.85 (30.39–37.3) |
33.32 (30.27–36.36) |
33.34 (30.49–36.2) |
| АКМ, % | 59.98 (58.93–61.03) |
63.66 (61.91–65.4) |
62.56 (61.04–64.09) |
62.01 (60.49–63.53) |
56.83 (55.73–57.94) |
Из-за высокой групповой вариабельности показателей БИА состава тела (табл. 1) была рассмотрена гипотеза об однородности группы обследуемых, которым предъявляли данное воздействие. С целью выявления однородных совокупностей был выполнен кластерный анализ, показавший достоверное наличие двух равных подгрупп (по 5 чел.), различающихся по массе тела и всех относительных параметров состава тела (табл. 2). Деление на группы велось по абсолютным показателям состава тела, биохимическим и гормональным параметрам крови.
Таблица 2.
Показатели биоимпедансометрии по группам добровольцев (M ± SD)
| Показатель | Точки | Группа I | Группа II | ||
|---|---|---|---|---|---|
| Mean | StDev | Mean | StDev | ||
| Масса, кг | 1 | 82.8 | 3.42 | 62.2 | 4.15 |
| 2 | 81.48 | 3.21 | 59.88 | 3.94 | |
| 3 | 81.3 | 3.87 | 59.58 | 3.82 | |
| 4 | 81.1 | 3.05 | 59.54 | 3.48 | |
| 5 | 81.7 | 4.09 | 61.48 | 3.68 | |
| БЖМ, кг | 1 | 63.24 | 3.61 | 52.344 | 2.078 |
| 2 | 59.06 | 2.49 | 49.584 | 1.868 | |
| 3 | 59.08 | 2.96 | 48.794 | 2.156 | |
| 4 | 58.42 | 2.41 | 48.784 | 1.414 | |
| 5 | 62.99 | 3.48 | 54.12 | 2.88 | |
| ЖМ, кг | 1 | 19.563 | 1.951 | 9.86 | 2.78 |
| 2 | 22.417 | 1.218 | 10.3 | 3.44 | |
| 3 | 22.217 | 1.855 | 10.79 | 2.61 | |
| 4 | 22.68 | 2.3 | 10.76 | 2.57 | |
| 5 | 18.71 | 2.94 | 7.362 | 2.076 | |
| АКМ, кг | 1 | 38.6 | 2.4 | 30.863 | 1.791 |
| 2 | 38.53 | 2.9 | 30.812 | 1.434 | |
| 3 | 37.86 | 3.09 | 29.833 | 1.596 | |
| 4 | 37.042 | 2.122 | 29.588 | 1.268 | |
| 5 | 36.63 | 2.51 | 30.06 | 1.615 | |
| СММ, кг | 1 | 33.326 | 2.14 | 27.927 | 1.088 |
| 2 | 30.426 | 1.317 | 26.218 | 1.067 | |
| 3 | 30.466 | 1.594 | 25.676 | 1.075 | |
| 4 | 30.008 | 1.367 | 25.675 | 0.61 | |
| 5 | 33.301 | 2.064 | 29.43 | 1.694 | |
| БЖМ, % | 1 | 76.36 | 2.45 | 84.32 | 3.63 |
| 2 | 72.488 | 1.075 | 83.01 | 4.66 | |
| 3 | 72.683 | 1.769 | 82.03 | 3.51 | |
| 4 | 72.06 | 2.4 | 82.07 | 3.31 | |
| 5 | 77.13 | 3.23 | 88.09 | 3.01 | |
| ЖМ, % | 1 | 23.64 | 2.45 | 15.68 | 3.63 |
| 2 | 27.512 | 1.075 | 16.99 | 4.66 | |
| 3 | 27.317 | 1.769 | 17.97 | 3.51 | |
| 4 | 27.94 | 2.4 | 17.93 | 3.31 | |
| 5 | 22.87 | 3.23 | 11.91 | 3.01 | |
| АКМ, % | 1 | 61.033 | 0.799 | 58.93 | 1.201 |
| 2 | 65.172 | 2.2 | 62.138 | 1.651 | |
| 3 | 64.007 | 2.082 | 61.123 | 0.861 | |
| 4 | 63.38 | 1.7 | 60.645 | 1.6 | |
| 5 | 58.119 | 0.881 | 55.548 | 0.695 | |
| СММ, % | 1 | 52.683 | 0.463 | 53.357 | 0.729 |
| 2 | 51.512 | 0.184 | 52.877 | 0.904 | |
| 3 | 51.561 | 0.147 | 52.627 | 0.474 | |
| 4 | 51.355 | 0.355 | 52.638 | 0.589 | |
| 5 | 52.854 | 0.523 | 54.373 | 0.57 | |
Примечание: периоды сбора данных (колонка “точки”): 1 – за 7 сут перед СИ (фон); 2 – на 7-е сут СИ; 3 – на 14-е сут СИ; 4 – в день завершения СИ; 5 – через 7 сут после окончания СИ; жирным шрифтом выделены показатели, достоверно различающиеся (значимо меньше) между группами в соответствующих точках исследования.
При сравнении выделенных однородных подгрупп наибольший интерес вызывал вопрос – различается ли динамика относительных показателей состава тела в подгруппах, в течение воздействия. Оказалось, что I группа характеризуется достоверно более низкой относительной БЖМ, но значимо более высокой относительной ЖМ, чем II группа. В то же время, динамика в течение эксперимента этих параметров в каждой из подгрупп отсутствовала. По относительным показателям АКМ и СММ подгруппы не различались. Тем не менее, удалось установить, что относительные параметры АКМ в обеих подгруппах претерпевали сходную динамику под влиянием факторов эксперимента, характеризующуюся тенденцией к повышению во время СИ и достоверным снижением показателя после эксперимента (рис. 4, А).
Рис. 4.
Относительные параметры АКМ, % (А) и СММ, % (Б) в группах I и II на разных этапах СИ21 (точки по оси Х). 1 – за 7 сут до начала СИ (фон); 2 – на 7-е сут СИ; 3 – на 14-е сут СИ; 4 – в день завершения СИ; 5 – через 7 сут после окончания СИ. * – p < 0.05 от фона (95% интервал для среднего).

В то же время, динамика относительных показателей СММ в подгруппах различалась (рис. 4, Б). Было выявлено, во-первых, достоверное снижение относительных параметров СММ на протяжении всей иммерсии в I группе, в отличие от II группы, прошедшей эксперимент без отклонений в СММ. Кроме того, в обеих подгруппах регистрировался значимый подъем относительных показателей СММ после завершения эксперимента (через 7 сут после окончания СИ).
Анализ среднегрупповых данных ИМТ не выявил достоверного изменения показателя, относительно фона, чрез 1, 2 и 3 нед. пребывания добровольцев в СИ. Показатели индекса Рорера (индекс упитанности, или плотности тела) также не имели статистически значимых различий на протяжении СИ21. Не отмечалось достоверных различий по ИМТ ни между I и II группами, ни в динамике наблюдения внутри групп. Данный параметр колебался в группе I от 22.9 ± 3.0 до 21.8 ± 3.1 (NS), и в группе II – от 23.6 ± 2.9 до 22.4 ± 3.1 (NS). Аналогично, не было выявлено достоверных различий в показателях индекса Рорера, ни между группами, ни по ходу исследования в СИ: в группе I показатель изменялся в диапазоне от 13.1 ± 1.6 до 12.2 ± 1.6 (NS) и в группе II – от 13.4 ± 1.6 до 12.6 ± 1.7 (NS).
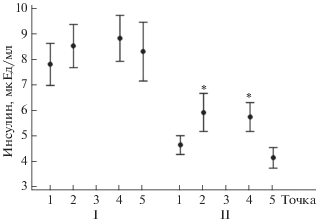
Анализ гормональных и биохимических показателей, отражающих концентрации веществ, активно участвующих в энергетическом обмене, был выполнен как с целью выявления различий в стратегии адаптации к экспериментальным условиям между подгруппами добровольцев, разделенными в предшествовавшем разделе, так и для регистрации возможной динамики по ходу эксперимента (табл. 3). Оказалось, что группа I характеризовалась более высоким уровнем инсулина, чем группа II, без изменений по ходу воздействия. Но в группе II отмечена выраженная динамика в ответ на факторы иммерсии, отразившаяся в подъеме уровня гормона в крови. Была отмечена тенденция к снижению среднегрупповых показателей содержания глюкозы в крови при достоверном увеличении уровня инсулина в момент окончания экспериментального воздействия (рис. 5). По индексу НОМА-IR (Homeostasis Model Assessment of Insulin Resistance, расчетное значение инсулинорезистентности = Глюкоза, ммоль/л × Инсулин, мкЕд/мл/22.5) статистических различий не выявлено.
Таблица 3.
Биохимические параметры крови по группам добровольцев (M ± SD)
| Показатель | Точки | Группа I | Группа II | ||
|---|---|---|---|---|---|
| Mean | StDev | Mean | StDev | ||
| Основной обмен, ккал/сут | 1 | 1835.5 | 75.8 | 1591 | 56.6 |
| 2 | 1833.4 | 91.6 | 1589.3 | 45.3 | |
| 3 | 1812.1 | 97.8 | 1558.4 | 50.4 | |
| 4 | 1786.2 | 67 | 1550.7 | 40.1 | |
| 5 | 1773.1 | 79.3 | 1565.6 | 51 | |
| Глюкоза, ммоль/л | 1 | 4.412 | 0.341 | 4.636 | 0.814 |
| 2 | 4.38 | 0.485 | 3.994 | 0.528 | |
| 3 | |||||
| 4 | 4.15 | 0.779 | 3.936 | 0.651 | |
| 5 | 4.612 | 0.734 | 4.71 | 0.825 | |
| Инсулин, мкЕд/мл | 1 | 7.8 | 1.84 | 4.64 | 0.82 |
| 2 | 8.52 | 1.891 | 5.92 | 1.663 | |
| 3 | – | – | – | – | |
| 4 | 8.82 | 2.01 | 5.74 | 1.262 | |
| 5 | 8.3 | 2.58 | 4.14 | 0.902 | |
| Лептин, нг/мл | 1 | 4.34 | 2.33 | 1.758 | 1.219 |
| 2 | 5.51 | 4.98 | 1.28 | 1.343 | |
| 3 | 6.61 | 5.35 | 1.996 | 1.689 | |
| 4 | 7.8 | 4.79 | 2.038 | 1.759 | |
| 5 | 5.24 | 2.81 | 1.643 | 1.497 | |
| Адипонектин, мкг/мл | 1 | 1.03 | 0.41 | 1.004 | 0.475 |
| 2 | 0.8467 | 0.1626 | 0.81 | 0.445 | |
| 3 | 0.8433 | 0.1069 | 0.91 | 0.343 | |
| 4 | 0.9033 | 0.1258 | 0.87 | 0.354 | |
| 5 | 1.123 | 0.344 | 0.933 | 0.337 | |
| Грелин, фмоль/мл | 1 | 41.1 | 28.9 | 41.6 | 30.3 |
| 2 | 45.7 | 20.8 | 29.85 | 20.54 | |
| 3 | 66.3 | 33.5 | 62.5 | 98 | |
| 4 | 50.3 | 53.7 | 74.2 | 94.7 | |
| 5 | 34.9 | 35.4 | 51.8 | 40.2 | |
| Триглицериды, ммоль/л | 1 | 0.904 | 0.37 | 0.676 | 0.1539 |
| 2 | 1.264 | 0.289 | 0.978 | 0.2111 | |
| 3 | – | – | – | – | |
| 4 | 1.434 | 0.2063 | 0.896 | 0.314 | |
| 5 | 1.2 | 0.659 | 0.672 | 0.0936 | |
| Холестерин общ., ммоль/л | 1 | 4.53 | 0.767 | 4.102 | 0.496 |
| 2 | 4.546 | 0.971 | 4.424 | 0.695 | |
| 3 | – | – | – | – | |
| 4 | 5.134 | 0.901 | 4.43 | 0.839 | |
| 5 | 4.442 | 0.694 | 3.978 | 0.548 | |
Примечание: жирный курсив – тенденция к уменьшению показателя в группе II по сравнению с группой I. Остальные обозначения см. табл. 2.
Рис. 5.
Изменение значений концентраций инсулина в группах на разных этапах СИ21. Остальные обозначения см. рис. 4.
Различия между группами отмечались также по уровню лептина (выше в группе I), без динамики по ходу эксперимента.
Однотипную динамику удалось наблюдать в обеих подгруппах по уровню триглицеридов крови – достоверное повышение через 1 и 3 нед. СИ (рис. 6). В то же время, между группами уровень триглицеридов различался только в день завершения эксперимента (табл. 3).
Рис. 6.
Изменение концентраций триглицеридов в группах I и II на разных этапах СИ21. Остальные обозначения см. рис. 4.

Концентрации в крови общего холестерина, адипонектина (противоспалительного цитокина, синтезируемого адипоцитами), грелина не различались между подгруппами и не имели динамики по ходу эксперимента в выделенных подгруппах.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
“Сухая” иммерсия общепризнанна в качестве наземной модели, воспроизводящей у здорового человека физиологические эффекты, наблюдающиеся в КП. Данную модель используют, в основном, для изучения начальных этапов изменений, происходящих в основных функциональных системах организма. В остром периоде адаптации организма человека к комплексу факторов данной модели (в т.ч. – к снижению двигательной активности) начинается и трансформация метаболизма и его регуляции. Изучению изменений показателей системной регуляции при снижении физической активности и изменении ИМТ, опасного в плане риска развития метаболического синдрома, а также роли индукции оксидативного стресса в метаболической трансформации посвящено большое число исследований [10–15, 27]. Жировая ткань, секретирующая большое число биологически активных соединений (адипокинов и адипоцитокинов), участвует в метаболической трансформации, сопровождающей многие клинические ситуации [28–30], а также в сигнальных путях стресс-реакций [31]. Результаты, публикуемые в данном направлении, свидетельствуют, в частности, о том, что уровни лептина, антиген-ассоциированного рецептора лейкоцитов (LAR), ингибитора активатора плазминогена-1, мочевой кислоты, IL-6, TNF-α и окисленных липопротеинов низкой плотности (ЛПНП) повышаются при метаболическом синдроме и коррелируют с количеством присутствующих его компонентов. С другой стороны, отмечено, что адипонектин, грелин, IL-10 и параоксоназа-1 при этом уменьшаются [32–36].
Лептин секретируется белыми адипоцитами в кровоток и играет важную роль в регуляции энергетического гомеостаза. Циркулирующий лептин связывается с рецептором лептина в мозге, который активирует нижестоящие сигнальные пути, которые подавляют питание и способствуют расходу энергии. Этот белок также выполняет несколько эндокринных функций и участвует в регуляции иммунных и воспалительных реакций, кроветворении, ангиогенезе, остеогенезе и заживлении ран. Считают, что адипоциты продуцируют лептин, адипонектин и IL-6, которые потенциально модулируют метаболизм костей и мышц [37] и, что уровень циркулирующего лептина повышается с последующим снижением концентрации адипонектина [38]. В нашем исследовании отмечены положительные корреляции концентраций лептина и параметров АКМ через 1 и 3 нед. СИ, соответственно: r = 0.71, p < < 0.05; r = 0.76, p < 0.03; что показывало сохранение взаимоотношения данных параметров в фоне. Аналогичным образом сохранялись, свойственные предэкспериментальному периоду, корреляции уровня лептина и параметров БМЖ, через 3 нед. СИ – r = 0.79, p < 0.03. Но взаимосвязи лептин-ЖМ, лептин-инсулин, лептин-СММ, характеризовавшиеся в фоне высокими достоверными коэффициентами корреляции (в фоне, соответственно: r = 0.79, p < 0.02; r = 0.74, p < 0.04; r = 0.69, p < 0.05), утрачивались на протяжении СИ, и восстанавливались только к концу эксперимента или через неделю после его окончания (при завершении воздействия, соответственно: r = 0.81, p < 0.02; r = 0.89, p < 0.007; r = 0.79, p < < 0.02). Связь уровня циркулирующего лептина с концентрацией адипонектина не выявлялась.
Грелин синтезируется в составе препропротеина грелин-обестатин, который затем расщепляется с образованием этих двух пептидов, грелина и обестатина. Грелин является мощным стимулятором аппетита и играет важную роль в энергетическом гомеостазе. Его секреция начинается, когда желудок пуст, после чего он стимулирует секрецию соматотропина. Считается, что грелин регулирует множество функций, включая голод, восприятие вкуса через мезолимбический путь, секрецию желудочной кислоты, моторику желудочно-кишечного тракта и стимулированную глюкозой секрецию инсулина в поджелудочной железе. Недавние результаты исследований, обобщенные в обзоре H. Cui et al. [39], содержат данные о множественных метаболических ролях обестатина, грелина и лептина, включая регуляцию функции адипоцитов и метаболизм глюкозы. В СИ, ввиду трансформации характера энергетических субстратов мышечной ткани, используемых в энергопродукции, ожидаемо изменение метаболизма глюкозы и его регуляции.
Высказывается гипотеза, что грелин метаболически более активен при отрицательном энергетическом балансе, чем при положительном [39, 40]. Отмечают также, что грелин имеет обратную связь с ИМТ: его уровень повышен при снижении потребления пищи и понижен в состояниях положительного энергетического баланса [41–43]. Нам удалось выявить достоверную корреляцию уровня грелина в крови добровольцев и параметров АКМ% через 2 нед. СИ: r = 0.74, p < 0.05. Также установлена положительная корреляция уровней грелина и адипонектина через неделю пребывания добровольцев в СИ (r = 0.86, p < 0.006). Связь концентрации грелина с ИМТ не определена.
В настоящем исследовании, выполненном во время 21-суточной СИ 10 здоровых добровольцев, анализировался большой набор показателей состава тела, субстратов и регуляторов энергетического обмена, в том числе секретируемых адипоцитами. Выделение однородных и достоверно отличных друг от друга подгрупп обследуемых (по 5 молодых мужчин в каждой) было проведено по параметрам состава тела и в дальнейшем сохранено при анализе биохимических показателей. Первая подгруппа характеризовалась более высокими показателями массы тела, основного обмена (в абсолютных величинах), относительной жировой массы (ЖМ%), но – достоверно более низкими показателями относительной безжировой массы (БЖМ%). Выделение однородных по параметрам состава тела подгрупп участников СИ позволило показать наличие и характер внутри экспериментальной динамики уровней биохимических показателей в крови. Этому способствовали различия в вариабельности данных: вариабельность данных, полученная при обследовании группы II была ниже, чем в группе I. Можно отметить, что поскольку показатели ИМТ в группах I и II не были достоверно отличны, невозможно, даже условно, характеризовать добровольцев этих групп как “толстых” или “тонких”.
Более низкая относительная жировая масса, свойственная обследуемым группы II, по-видимому, позволила выявить особенности механизмов регуляции жирового и энергетического обмена, активированных под действием иммерсии. Прежде всего, надо отметить, что на всем протяжении эксперимента группа II сохраняла неизменными показатели относительной ЖМ и БМЖ, но после СИ в ней регистрировалось снижение АКМ% и повышение над последними измерениями во время иммерсии, доли скелетно-мышечной массы, СММ% (p < 0.05). Очевидно, это связано с уровнем гипотрофии мышечной ткани при гиподинамии в эксперименте. Значимое увеличение во время СИ отмечено в данной группе в показателях инсулина, триглицеридов в крови. Стабильность уровня лептина в эксперименте подтверждена с низкой вариабельностью. Следовательно, в группе со сниженной относительной ЖМ и уровнем основного обмена, на протяжении 21 сут иммерсии не выявляется признаков активации секреции лептина из адипоцитов.
Более высокая относительная ЖМ, но более низкая – БЖМ, а также более высокий уровень основного обмена были свойственны обследуемым группы I. В течение всего экспериментального периода не удалось зарегистрировать изменений в упомянутых показателях состава тела данной подгруппы, возможно, в виду высокой межиндивидуальной вариабельности. Однако отмечалась сходная с группой II динамика АКМ%, но противоположная – СММ% (p < 0.05). Доля скелетно-мышечной массы (СММ%) тела у добровольцев данной подгруппы была достоверно снижена при трех измерениях во время СИ (через 1, 2 и 3 нед., относительно фона). Выявлялась сходная с группой II динамика показателей триглециридов крови (p < 0.05), однако изменений уровня инсулина не выявлялось. По-видимому, это свидетельствует о менее активном переходе энергетического обмена мышечной ткани с жировых на углеводные субстраты, ожидаемом под действием факторов СИ.
Изменения в доле скелетно-мышечной массы (СММ%) тела у добровольцев данной подгруппы, достоверно сниженной при трех измерениях во время СИ, служат определенным сигналом как о выраженной потере мышечной массы, так и о возможном начальном этапе снижении массы костной ткани, за счет потери кальция из депо. Интересно отметить, что это выявилось в СИ только у лиц с более высокой относительной ЖМ, но низкой – БЖМ.
Признаки метаболической трансформации, отмеченные авторами настоящей статьи, согласуются с представлениями об особенностях перестройки энергетического обмена в условиях гиподинамии, снижения основного обмена, гипотрофии наиболее крупной ткани организма – мышечной, в ответ на факторы СИ. Изучение изменений параметров состава тела во время СИ, в сопоставлении их с биохимическими показателями в однородных по параметрам состава тела подгруппах участников СИ, позволило показать не участие активации секреции из адипоцитов (адипокинов и адипоцитокинов) в метаболической трансформации, вызванной факторами СИ на протяжении 3-х нед. Возможно для проявления на биохимическом уровне столь инерционного процесса – данный срок недостаточен. Показано, что выбор однородной по составу тела группы добровольцев для модельного воздействия позволяет решать различные исследовательские задачи. Так, составляя группу добровольцев из лиц с высокой относительной ЖМ, высоким уровнем основного обмена можно более явно исследовать динамику изменений скелетно-мышечной составляющей массы тела, но метаболические признаки трансформации энергетического обмена практически не выявляются. Напротив, в группе добровольцев в модельном исследовании в условиях СИ с низкой относительной ЖМ, низким уровнем основного обмена предпочтительно изучать особенности метаболической трансформации и ее механизмов, в том числе, зависящие от участия адипоцитов. Полученные данные не позволяют сделать заключение о возможно существующих разных механизмах адаптации к условиям СИ у участников с различными показателями состава тела. Однако можно полагать, что подбор однородной по составу тела группы дает возможность выявить, “заметить” отдельные механизмы адаптации в ответ на действующие факторы эксперимента.
ВЫВОДЫ
1. Влияние факторов модельного эксперимента с 21-суточной “сухой” иммерсией на состав тела 10 участников выражалось в уменьшении доли тощей массы при одновременном увеличении жировой компоненты.
2. При более высокой массе тела, относительной ЖМ, но более низкой – БЖМ, с более высоким уровнем абсолютной величины основного обмена – воздействие факторов 21-суточной иммерсии сказывается в достоверном снижении доли скелетно-мышечной массы (СММ%) тела. Динамики уровня инсулина в эксперименте не выявлялось.
3. При более низкой массе тела, относительной ЖМ, но более высокой – БЖМ, с более низким абсолютным уровнем основного обмена – воздействие факторов 21-суточной иммерсии проявляется в стабильности во время и повышении по завершению СИ доли скелетно-мышечной массы, СММ% (p < 0.05). Во время СИ в данной группе отмечено значимое увеличение уровня инсулина крови.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва), протокол № 483 от 03.08.2018 г.
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Комплексные иммерсионные исследования поддержаны РАН (тема 65.1), проектом РНФ (19-15-00435) и программой научных исследований Президиума РАН “Фундаментальные исследования для биомедицинских технологий” (проект “Фундаментальные исследования для технологии профилактики заболеваний, реабилитации человека и целевого повышения устойчивости к неблагоприятным факторам”).
Благодарности. Авторы статьи выражают искреннюю благодарность добровольцам, принимавшим участие в исследовании.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Markus M.R., Stritzke J., Siewert U. et al. Variation in body composition determines long-term blood pressure changes in pre-hypertension: the MONICA/KORA (Monitoring Trends and Determinants on Cardiovascular Diseases/Cooperative Research in the Region of Augsburg) cohort study. MONICA/KORA Investigators // J. Am. Coll. Cardiol. 2010. V. 56. № 1. P. 65.
Stritzke J., Markus M.R., Duderstadt S. et al. The aging process of the heart: obesity is the main risk factor for left atrial enlargement during aging the MONICA/KORA (monitoring of trends and determinations in cardiovascular disease/cooperative research in the region of Augsburg) study // J. Am. Coll. Cardiol. 2009. V. 54. № 21. P. 1982.
Saladino Ch.F. The efficacy of Bioelectrical Impedance Analysis (BIA) in monitoring body composition changes during treatment of restrictive eating disorder patients // J. Eat. Disord. 2014. V. 2. № 1. P. 34.
Pludowski P., Jaworski M., Niemirska A. et al. Vitamin D status, body composition and hypertensive target organ damage in primary hypertension // J. Steroid Biochem. Mol. Biol. 2014. V. 144. Pt A. P. 180.
Allemann Y., Hutter D., Aeschbacher B.C. et al. Increased central body fat deposition precedes a significant rise in resting blood pressure in male offspring of essential hypertensive parents: a 5 year follow-up study // J. Hypertens. 2001. V. 19. № 12. P. 2143.
Parker T.J., Sampson D.L., Broszczak D. et al. A fragment of the LG3 peptide of endorepellin is present in the urine of physically active mining workers: a potential marker of physical activity // PLoS One. 2012. V. 7. № 3. P. e33714.
Miyazaki Y., DeFronzo R.A. Visceral fat dominant distribution in male type 2 diabetic patients is closely related to hepatic insulin resistance, irrespective of body type // Cardiovasc. Diabetol. 2009. V. 8. P. 44.
Bodinham C.L., Smith L., Wright J. et al. Dietary fibre improves first-phase insulin secretion in overweight individuals // PLoS One. 2012. V. 7. № 7. P. e40834.
Sonnenburg J.L., Bäckhed F. Diet-microbiota interactions as moderators of human metabolism // Nature. 2016. V. 535. P. 56.
Deng Y., Scherer P.E. Adipokines as novel biomarkers and regulators of the metabolic syndrome // Ann. N.Y. Acad. Sci. 2010. V. 1212. P. E1.
Marseglia L., Manti S., D’Angelo G. et al. Oxidative stress in obesity: a critical component in human diseases // Int. J. Mol. Sci. 2014. V. 16. № 1. P. 378.
Han H.J., Jung U.J., Kim H.J. et al. Dual effects of a mixture of grape pomace (Campbell Early) and Omija fruit ethanol extracts on lipid metabolism and the antioxidant defense system in diet-induced obese mice // Nutr. Res. Pract. 2015. V. 9. № 3. P. 227.
Rodríguez A. Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks, 1990−2015: a systematic analysis for the Global Burden of Disease Study 2015 / GBD 2015 Risk Factors Collaborators // Lancet. 2016. V. 388. № 10053. P. 1659.
Di Stefano M.T., Roth Flach R.J., Senol-Cosar O. et al. Adipocyte-specific Hypoxia-inducible gene 2 promotes fat deposition and diet-induced insulin resistance // Mol. Metab. 2016. V. 5. № 12. P. 1149.
Padmanabha Das K.M., Wechselberger L., Liziczai M. et al. Hypoxia-inducible lipid droplet-associated protein inhibits adipose triglyceride lipase // J. Lipid. Res. 2018. V. 59. № 3. P. 531.
Fernández-Sánchez A., Madrigal-Santillán E., Bautista M. et al. Inflammation, oxidative stress, and obesity // Int. J. Mol. Sci. 2011. V. 12. № 5. P. 3117.
Furukawa S., Fujita T., Shimabukuro M. et al. Increased oxidative stress in obesity and its impact on metabolic syndrome // J. Clin. Invest. 2004. V. 114. № 12. P. 1752.
Мартиросов Э.Г., Руднев С.Г., Николаев Д.В. Применение антропологических методов в спорте, спортивной медицине и фитнесе: учебное пособие для студентов вузов. М.: Физическая культура, 2010. 119 с.
Николаев Д.В., Смирнов А.В., Бобринская И.Г., Руднев С.Г. Биоимпедансный анализ состава тела человека. М.: Наука, 2009. 392 с.
Kanis J.A., Oden A., Johansson H. et al. FRAX – a new tool for the assessment of fracture risk: applifation in clinical practice and thresholds for intervention // Osteoporosis and Bone Diseases. 2012. V. 15. № 2. P. 38.
Lane H.W., Bourland C., Barrett A. et al. The Role of Nutritional Research in the Success of Human Space Flight // Adv. Nutr. 2013. V. 4. № 5. P. 521.
Оганов В.С. Костная система, невесомость и остеопороз. М.: Слово, 2003. 260 с.
Носков В.Б., Ничипорук И.А., Васильева Г.Ю., Смирнов Ю.И. Состав тела человека при длительном пребывании в невесомости // Авиакосмическая и экологическая медицина. 2015. Т. 49. № 1. С. 19.
Томиловская Е.С., Рукавишников И.В., Амирова Л.Е. и др. 21-Суточная “сухая” иммерсия: особенности проведения и основные итоги // Авиакосмическая и экологическая медицина. 2020. Т. 54. № 4. С. 5.
Пашкова И.Г., Гайвороновский И.В., Никитюк Д.Б. Соматотип и компонентный состав тела взрослого человека. СПб.: СпецЛит, 2019. 159 с.
Ward J.H. Hierarchical grouping to optimize an objective function // J. Am. Statist. Assoc. 1963. V. 58. № 301. P. 236.
Tao Xu, Bin Wang, Limin Cao et al. Associations of Gain in Weight-Related Anthropometric Indices with a Marker of Lipid Peroxidation: A Cohort Study Among Urban Adults in China // Diabetes Metab. Syndr. Obes. 2020. V. 13. P. 2877.
Jung U.J., Choi M.S. Obesity and its metabolic complications: the role of adipokines and the relationship between obesity, inflammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease // Int. J. Mol. Sci. 2014. V. 15. № 4. P. 6184.
Maury E., Brichard S.M. Adipokine dysregulation, adipose tissue inflammation and metabolic syndrome // Mol. Cell. Endocrinol. 2010. V. 314. № 1. P. 1.
Yang J., Kang J., Guan Y. The mechanisms linking adiposopathy to type 2 diabetes // Front. Med. 2013. V. 7. № 4. P. 433.
Sabio G., Das M., Mora A. et al. A stress signaling pathway in adipose tissue regulates hepatic insulin resistance // Sci. 2008. V. 322. № 5907. P. 1539.
Srikanthan K., Feyh A., Visweshwar H. et al. Systematic Review of Metabolic Syndrome Biomarkers: A Panel for Early Detection, Management, and Risk Stratification in the West Virginian Population // Int. J. Med. Sci. 2016. V. 13. № 1. P. 25.
Martinelli N., Traglia M., Campostrini N. et al. Increased serum hepcidin levels in subjects with the metabolic syndrome // PLoS One. 2012. V. 7. № 10. P. e48250.
Njajou O.T., Kanaya A.M., Holvoet P. et al. Health ABC Study. Association between oxidized LDL, obesity and type 2 diabetes in a population-based cohort, the Health, Aging and Body Composition Study // Diabetes Metab. Res. Rev. 2009. V. 25. № 8. P. 733.
Palomäki A., Pohjantähti-Maaroos H., Wallenius M. et al. Effects of dietary cold-pressed turnip rapeseed oil and butter on serum lipids, oxidized LDL and arterial elasticity in men with metabolic syndrome // Lipids Health Dis. 2010. V. 1. № 9. P. 137.
Krzystek-Korpacka M., Patryn E., Hotowy K. et al. Paraoxonase (PON)-1 activity in overweight and obese children and adolescents: association with obesity-related inflammation and oxidative stress // Adv. Clin. Exp. Med. 2013. V. 22. № 2. P. 229.
Tagliaferri C., Wittrant Y., Davicco M.J. et al. Muscle and bone, two interconnected tissues // Ageing. Res. Rev. 2015. V. 21. P. 55.
Mongraw-Chaffin M., Foster M.C., Kalyani R.R. et al. Obesity severity and duration are associated with incident metabolic syndrome: Evidence against metabolically healthy obesity from the multi-ethnic study of atherosclerosis // J. Clin. Endocrinol. Metab. 2016. V. 101. P. 4117.
Cui H., López M., Rahmouni K. The cellular and molecular bases of leptin and ghrelin resistance in obesity // Nat. Rev. Endocrinol. 2017. V. 13. № 6. P. 338.
Shigehisa Yanagi, Takahiro Sato, Kenji Kangawa, Masamitsu Nakazato The Homeostatic Force of Ghrelin // Cell. Metab. 2018. V. 27. № 4. P. 786.
Castañeda T.R., Tong J., Datta R. et al. Ghrelin in the regulation of body weight and metabolism // Front. Neuroendocrinol. 2010. V. 31. № 1. P. 44.
Sun Y., Asnicar M., Smith R.G. et al. Central and peripheral roles of ghrelin on glucose homeostasis // Neuroendocrinology. 2007. V. 86. № 3. P. 215.
Varela L., Vázquez M.J., Cordido F. et al. Ghrelin and lipid metabolism: key partners in energy balance // J. Mol. Endocrinol. 2011. V. 46. № 2. P. R43.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека



