Физиология человека, 2021, T. 47, № 4, стр. 44-50
Увеличение синхронизации барорефлекторных волн артериального давления и частоты сердечных сокращений при воздействии отрицательного давления на нижнюю часть тела
В. О. Негуляев 1, 2, Е. А. Орлова 1, А. П. Шарова 1, О. С. Тарасова 1, 2, О. Л. Виноградова 1, 2, А. С. Боровик 1, *
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 Московский государственный университет имени М.В. Ломоносова
Москва, Россия
* E-mail: asbor@mail.ru
Поступила в редакцию 02.02.2021
После доработки 09.03.2021
Принята к публикации 23.03.2021
Аннотация
Исследовали влияние отрицательного давления вокруг нижней части тела (ОДНТ) на фазовую сопряженность спонтанных колебаний артериального давления (АД) и частоты сердечных сокращений (ЧСС). ОДНТ (–30 мм рт. ст.) создавалось с помощью комплекса “Чибис-М”, который используется в целях тренировки сердечно-сосудистой системы космонавтов на борту Международной космической станции для предотвращения послеполетной ортостатической неустойчивости. Во время измерений испытуемые (7 молодых мужчин) находились в горизонтальном положении лежа на спине. Показано, что, как и ортостатический стресс, ОДНТ ведет к усилению фазовой синхронизации спонтанных колебаний АД и ЧСС в частотном диапазоне барорефлекторных волн (около 0.1 Гц).
Барорефлекс является одним из ключевых механизмов нервной регуляции гемодинамики, работающим по принципу отрицательной обратной связи (feedback). Барорефлекс-опосредованные изменения частоты сердечных сокращений (ЧСС) и сосудистого сопротивления в ответ на изменение артериального давления (АД) имеют решающее значение для поддержания сердечно-сосудистого гомеостаза, у человека ключевую роль в такой регуляции играют барорецепторы синокаротидных зон [1]. Работа барорефлекса модулируется множеством факторов, оказывающих “прямые” (feedforward) активирующие или ингибирующие влияния на сердечно-сосудистый центр продолговатого мозга, где замыкается барорефлекторная дуга. Такими факторами могут быть: центральная команда, которая осуществляет запуск гемодинамических изменений при физической нагрузке, сигналы от рецепторов работающих скелетных мышц [2], хеморецепторов [3], рецепторов вестибулярного аппарата [4] и др.
Кардиохронотропное действие барорефлекса, по которому наиболее часто оценивают его активность, играет важную роль при переходе человека из горизонтального положения в вертикальное: увеличение ЧСС частично компенсирует эффект снижения ударного объема (УО) левого желудочка, обусловленного перераспределением крови в нижнюю часть тела, и тем самым способствует поддержанию минутного объема (МО) сердца. Исследование изменений гемодинамики при вертикализации тела (ортостатическая проба) часто используют в экспериментальной и клинической практике для оценки функционального состояния механизмов барорефлекторной регуляции [5–7]. Следует однако отметить, что гемодинамические сдвиги при переходе в положение ортостаза обусловлены изменением активности не только артериальных барорецепторов, но и кардиопульмонарных рецепторов “низкого давления” [5], а также могут быть связаны с влиянием мышечного механорефлекса (в том числе при пассивной ортопробе, если ортостол снабжен опорой для ног) или вестибулокардиальными реакциями [8].
В космической медицине для тестирования состояния сердечно-сосудистой системы, а также в целях профилактики нарушений, связанных с влиянием микрогравитации, активно используется создание отрицательного давления в нижней части тела (ОДНТ) с помощью комплекса “Чибис-М” [9–11]. Подобно ортостазу, создание отрицательного давления вокруг нижней части тела также ведет к перераспределению крови и уменьшению венозного возврата [12–14]. Однако, в отличие от ортостаза, при неизменном положении тела и умеренном уровне ОДНТ (снижении давления на 20–30 мм рт. ст.) происходит активация преимущественно кардиопульмонарных рецепторов [12, 15]. Таким образом, ОДНТ частично имитирует эффекты ортостатического стресса, но механизмы этих двух реакций отличаются. Следует отметить, что вопрос о взаимодействии механизмов рефлекторной регуляции гемодинамики у человека при ортостазе исследован мало.
В связи с наличием временнóй задержки, которая в основном обусловлена медленной реакций сосудов на нервное влияние, в барорефлекторной петле обратной связи возникают периодические изменения активности, которые проявляются в виде низкочастотных колебаний показателей системной гемодинамики (у человека – с частотой около 0.1 Гц) [16]. Нарушение работы барорефлекса в результате хирургической денервации барорецепторных зон у животных [17] или опухолевого поражения ядер ствола мозга у человека [18], ведет к исчезновению низкочастотных колебаний системного АД и ЧСС. Поэтому взаимосвязь низкочастотных колебаний АД и ЧСС может служить показателем барорефлекторной активности. В опубликованных исследованиях влияния ОДНТ на активность барорефлекса были получены неоднозначные результаты. При использовании кросс-спектрального анализа в тесте ОДНТ было показано снижение амплитуды передаточной функции между АД и ЧСС на частоте барорефлекторных волн, аналогично ее снижению при ортопробе [19, 20], хотя когерентность барорефлекторных колебаний АД и ЧСС при ОДНТ существенно не изменялась [19]. Вместе с тем, путем анализа причинно-следственных связей (causality analysis) было показано, что влияние колебаний АД на колебания длительности R–R интервала в частотном диапазоне барорефлекторных волн усиливается при снижении уровня ОДНТ [21].
Информативным методом оценки барорефлекторной активности является исследование фазовой синхронизации спонтанных колебаний АД и ЧСС на частоте барорефлекторных волн, применявшееся нами ранее для изучения изменений барорефлекторной регуляции сердечного ритма вследствие пребывания в условиях моделируемой микрогравитации [22], у больных, страдающих обмороками вазовагальной природы [7], у здоровых людей в зависимости от возраста [23]. Целью данной работы являлась оценка изменения фазовой синхронизации колебаний АД и ЧСС на частоте барорефлекторных волн при создании отрицательного давления вокруг нижней части тела.
МЕТОДИКА
В эксперименте принимали участие 7 здоровых молодых мужчин (возраст – 24 ± 2 года; рост – 185 ± 8 см; масса тела – 81 ± 4 кг). Испытуемые не имели заболеваний сердечно-сосудистой системы, не курили и не принимали никаких фармакологических препаратов. Перед исследованием испытуемые воздерживались от тяжелых физических нагрузок в течение 24 ч, от употребления алкогольных и содержащих кофеин напитков – в течение 12 ч. Ни один из испытуемых не испытывал признаков предобморочного или обморочного состояния в течение выполнения теста.
Измерение показателей гемодинамики. В ходе эксперимента у каждого испытуемого непрерывно регистрировали:
1) АД – фотокомпенсационным методом с использованием прибора Finometer (Finapres Medical System, Нидерланды), манжету с датчиком располагали на среднем пальце левой руки. На левое плечо испытуемых накладывали манжету для измерения системного АД, величина которого используется для калибровки данных, зарегистрированных в пальцевой манжете;
2) УО – также с помощью прибора Finometer, этот показатель рассчитывается в приборе для каждого сердечного цикла по алгоритму Model Flow [24];
3) ЭКГ – с использованием комплекса PneumoCard (МКС, Россия). На передней поверхности торса испытуемого закрепляли три одноразовых электрода, расположение электродов соответствовало II стандартному отведению;
4) частоту дыхания – с помощью назального термисторного датчика комплекса PneumoCard. Для каждого испытуемого перед началом измерений определяли комфортную частоту дыхания, значение которой было выше частоты барорефлекторных волн. Во время эксперимента ритм дыхания (12–15 циклов в минуту, что соответствует частоте 0.2–0.25 Гц) задавали с помощью голосовой команды с компьютера.
Все регистрируемые сигналы оцифровывали с частотой 1000 Гц с помощью аналого-цифрового преобразователя E14-140 (L-CARD, Россия). Запись экспериментальных данных проводили с помощью программного обеспечения PowerGraph 3.3 (ДИСофт, Россия).
Тест с созданием отрицательного давления вокруг нижней части тела (ОДНТ). Отрицательное давление вокруг нижней части тела создавали с помощью комплекса “Чибис-М” [9]. Комплекс состоит из штанов, изготовленных из жесткой гофрированной воздухонепроницаемой ткани, мини-насоса и системы управления, в состав которой входят встроенный в корпус комплекса измерительный блок и планшетный компьютер с управляющей программой. Предельное давление, которое возможно создать с помощью данного комплекса, составляет –65 мм рт. ст.
На время измерений испытуемого помещали в “Чибис-М” и укладывали на кушетку в положении лежа на спине. Далее проверяли герметичность, наклеивали ЭКГ-электроды, надевали манжеты для измерения давления и устанавливали датчик дыхания. После проведения калибровки приборов и адаптации испытуемого (не менее 10 мин) в течение 12 мин проводили фоновое измерение показателей гемодинамики. Затем запускали насос комплекса “Чибис-М” и создавали отрицательное давление равное –30 мм рт. ст. Измерения проводили также в течение 12 мин, после чего давление возвращали к атмосферному и заканчивали тест.
Обработка экспериментальных данных. Обработку экспериментальных данных проводили с помощью специальных программ, работающих в среде программирования MATLAB (Math Works Inc., США). Для каждого сердечного цикла вычисляли среднее АД (АДср) и длительность R–R интервала (для вычисления ЧСС). По значениям УО и ЧСС вычисляли минутный объем левого желудочка (МО), а по значениям АДср и МО – величину общего периферического сопротивления сосудов (ОПСС).
В качестве количественной меры уровня фазовой синхронизации спонтанных колебаний АД и ЧСС в различных частотных диапазонах использовали индекс фазовой синхронизации (ИФС) [25]. Для вычисления ИФС временны́е ряды АДср и ЧСС с помощью линейной интерполяции преобразовывали в ряды равноотстоящих по шкале времени значений (частота ресэмплирования 4 Гц). Путем цифровой фильтрации из этих рядов выделяли узкополосные составляющие, частота которых находилась в частотном диапазоне от 0.02 до 0.5 Гц. Используя преобразование Гильберта, каждую из частотных составляющих АДср и ЧСС представляли в форме аналитического сигнала, по которому определяли их фазы. Затем для каждой частоты строили гистограмму распределения нормированной разности фаз. По полученным гистограммам вычисляли ИФС с использованием энтропии Шеннона, затем строили спектр ИФС – зависимость ИФС от частоты. Подробное описание методики обработки показателей гемодинамики и вычисления ИФС приведено в работе [26]. Барорефлекторную активность оценивали по среднему значению ИФС в частотном диапазоне от 0.07 до 0.13 Гц.
Статистический анализ данных. Статистическую обработку результатов проводили в программе GraphPad Prism 7 (GraphPad Software, США). Данные представлены в виде среднего и стандартного отклонения. Нормальное распределение данных в выборках было подтверждено с использованием теста Шапиро-Уилка. В качестве критерия при сравнении данных использовали парный t-тест Стьюдента. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В табл. 1 представлены средние значения гемодинамических показателей при атмосферном давлении и при ОДНТ, равном –30 мм рт. ст. Можно видеть, что воздействие отрицательного давления приводит к повышению ЧСС (на 15 ± 7%) и незначительному снижению АДср (на 6 ± 5%). Наиболее значительное изменение было выявлено для УО (снижение на 25 ± 5%). В силу повышения ЧСС снижение МО было менее выраженным (всего 14 ± 6%). ОППС во время теста ОДНТ повышалось на 10 ± 7%.
Таблица 1.
Показатели системной гемодинамики, зарегистрированные в тесте ОДНТ
| Показатели | Давление воздуха в костюме “Чибис-М” | |
|---|---|---|
| 0 мм рт. ст. | –30 мм рт. ст. | |
| Среднее артериальное давление, мм рт. ст. | 94.3 ± 3.3 | 88.9 ± 6.1* |
| Частота сердечных сокращений, уд./мин | 69.1 ± 5.5 | 79.4 ± 5.7* |
| Ударный объем левого желудочка, мл | 96.1 ± 13.7 | 71.6 ± 9.2* |
| Минутный объем левого желудочка, л/мин | 6.6 ± 0.7 | 5.7 ± 0.8* |
| Общее периферическое сопротивление, (мм рт. ст. мин)/мл | 14.4 ± 1.1 | 15.9 ± 2.0* |
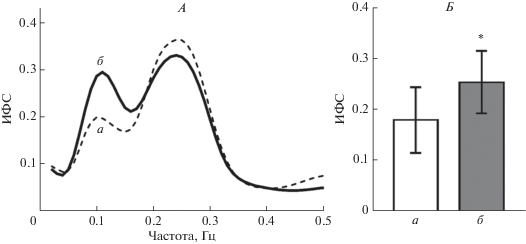
На рис. 1, А представлены усредненные по группе испытуемых спектры ИФС, вычисленные по данным, которые были зарегистрированы при атмосферном давлении и при ОДНТ (–30 мм рт. ст.) в положении лежа на спине. На спектрах ИФС видны два отчетливых пика. Высокочастотный пик на частоте около 0.25 Гц, показывает степень фазовой синхронизации дыхательных волн АД и ЧСС. Амплитуда этого пика не изменялась при создании ОДНТ, поскольку паттерн дыхания оставался постоянным. Низкочастотный пик на спектрах имеет максимум на частоте 0.1 Гц, т.е. лежит в области барорефлекторных волн АД и ЧСС. При создании ОДНТ амплитуда этого пика заметно увеличивается (рис. 1, А), а среднее значение ИФС в частотном диапазоне 0.07–0.13 Гц статистически значимо возрастает (рис. 1, Б), что свидетельствует об усилении кардиохронотропного влияния барорефлекса.
Рис. 1.
Влияние отрицательного давления вокруг нижней части тела (ОДНТ) на фазовую синхронизацию спонтанных колебаний АД и ЧСС. А – спектры индекса фазовой синхронизации (ИФС) в тесте ОДНТ при двух уровнях давления воздуха в костюме: а – 0 мм рт. ст., б – минус 30 мм рт. ст. (приведены спектры, усредненные по группе испытуемых). Б – средние значения ИФС в частотном диапазоне 0.07–0.13 Гц в тесте ОДНТ при двух уровнях давления воздуха в костюме: а – 0 мм рт. ст., б – минус 30 мм рт. ст. Данные представлены в виде среднего и стандартного отклонения; n = 7; * – р < 0.05 по сравнению со значением при давлении 0 мм рт. ст., парный t-тест Стьюдента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование изменений барорефлекторной активности при различных физиологических воздействиях позволяет раскрывать новые аспекты функционирования барорефлекса и его взаимодействия с другими регуляторными механизмами. Тест с созданием ОДНТ применяется для изучения реакции сердечно-сосудистой системы на стресс, сходный с ортостатическим [12, 15], однако использование ОДНТ при горизонтальном положении тела испытуемого не подразумевает изменения гравитационного фактора и, как следствие, изменения градиента гидростатического давления между барорецепторами каротидных синусов и сердцем. Поэтому этот тест может быть использован для изучения вклада регуляторных механизмов, которые помимо артериального барорефлекса участвуют в поддержании сердечно-сосудистого гомеостаза, в первую очередь, роли рефлексов от кардиопульмонарных рецепторов.
Уровень ОДНТ, использованный в наших экспериментах, обеспечивал примерно такое же уменьшение УО левого желудочка, как при переходе в положение 60° ортостаза, как было показано ранее [22]. Причиной снижения УО при ОДНТ, как и при ортостазе, служит перераспределение крови в нижнюю часть тела и, как следствие, уменьшение венозного возврата крови к сердцу [12]. В целом, паттерн изменений показателей системной гемодинамики при создании ОДНТ был сходным с таковым при ортостатическом стрессе, что согласуется с данными литературы [27]. Вместе с тем, в тесте ОДНТ (–30 мм рт. ст.) у практически здоровых молодых мужчин наблюдалось некоторое снижение уровня АДср, тогда как при ортостатическом стрессе такое изменение для них не характерно [15, 22]. Возможно, это объясняется тем, что при изменении положения тела происходит более комплексная активация механизмов, “отслеживающих” состояние сердечно-сосудистой системы: при ортостазе активируются как кардиопульмонарные рецепторы, так и артериальные барорецепторы, тогда как при ОДНТ – преимущественно кардиопульмонарные рецепторы. В связи с этим активация симпатической нервной системы и ее влияние на сосуды и сердце при ОДНТ могут быть менее выраженными, чем при ортостазе, что должно затруднять компенсацию падения давления вследствие уменьшения УО.
Мы использовали ОДНТ для изучения влияния рефлексов от кардиопульмонарных рецепторов на синхронизацию спонтанных колебаний АД и ЧСС, для количественной оценки степени сопряженности колебаний показателей гемодинамики был впервые применен анализ их фазовой синхронизации. Эксперименты показали, что изменение спектра ИФС при создании ОДНТ наблюдается лишь в низкочастотной области (в районе 0.1 Гц). Таким образом, разгрузка кардиопульмонарных рецепторов при создании ОДНТ в горизонтальном положении тела ведет к усилению фазовой синхронизации колебаний АД и ЧСС на частоте барорефлекторных волн, как и во время проведения ортопробы [7, 22]. Такое изменение синхронизации колебаний АД и ЧСС во время ОДНТ происходит, несмотря на ожидаемое отсутствие воздействия на артериальные барорецепторы при неизменном горизонтальном положении тела.
Изменение фазовой синхронизации барорефлекторных волн АД и ЧСС при ОДНТ может иметь сходный механизм с ее изменением при умеренной кровопотере, так как эти воздействия близки по регуляторным процессам [13, 28]. Ранее мы показали, что у крыс при уменьшение объема крови, которое еще не сопровождается заметным снижением АД, также происходит постепенное увеличение обеспечиваемой активностью барорефлекса синхронизации АД и ЧСС [26]. Следует отметить, что центральные пути рефлекса от кардиопульмонарных рецепторов весьма сходны с путями рефлекса от артериальных барорецепторов, и эти рефлексы похожи по влиянию на активность автономной нервной системы: в обоих случаях разгрузка рецепторов ведет к повышению симпатической активности и, напротив, к снижению парасимпатической активности [29]. В связи с этим можно предположить, что влияние кардиопульмонарного рефлекса облегчает осуществляемую барорефлексом регуляцию системной гемодинамики, в том числе синхронизацию низкочастотных колебаний АД и ЧСС.
ЗАКЛЮЧЕНИЕ
Создание отрицательного давления вокруг нижней части тела приводит к повышению фазовой синхронизации АД и ЧСС на частоте барорефлекторных волн (~0.1 Гц). Изменение активности кардиопульмонарного рефлекса вследствие уменьшения центрального объема крови может модулировать работу барорефлекса, вероятнее всего на уровне сердечно-сосудистого центра продолговатого мозга, где “сходятся” пути этих двух важных рефлексов, обеспечивающих поддержание гомеостаза в сердечно-сосудистой системе. Предложенный способ исследования кардиохронотропной барорефлекторной регуляции может оказаться полезным для оценки эффективности использования метода ОДНТ как средства профилактики ортостатической неустойчивости в послеполетном периоде.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены Комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено по Программе фундаментальных научных исследований (тема 64.1) и поддержано грантом РФФИ (№ 20-015-00536).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Smit A.A.J., Timmers H.J.L.M., Wieling W. et al. Long-term effects of carotid sinus denervation on arterial blood pressure in humans // Circulation. 2002. V. 105. № 11. P. 1329.
Michelini L.C., O’Leary D.S., Raven P.B., Nóbrega A.C.L. Neural control of circulation and exercise: a translational approach disclosing interactions between central command, arterial baroreflex, and muscle metaboreflex // Am. J. Physiol. Heart Circ. Physiol. 2015. V. 309. № 3. P. H381.
Mateika J.H., Demeersman R.E., Kim J. Effects of lung volume and chemoreceptor activity on blood pressure and R-R interval during the Valsalva maneuver // Clin. Auton. Res. 2002. V. 12. № 1. P. 24.
Hammam E., Macefield V.G. Vestibular modulation of sympathetic nerve activity to muscle and skin in humans // Front. Neurol. 2017. V. 8. P. 334.
Stewart J.M. Mechanisms of sympathetic regulation in orthostatic intolerance // J. Appl. Physiol. 2012. V. 113. № 10. P. 1659.
Cooke W.H., Hoag J.B., Crossman A.A. et al. Human responses to upright tilt: a window on central autonomic integration // J. Physiol. 1999. V. 517. Pt. 2. P. 617.
Боровик А.С., Негуляев В.О., Тарасова О.С. и др. Нарушение барорефлекторной синхронизации артериального давления и сердечного ритма при ортостазе предшествует развитию вазовагального обморока // Физиология человека. 2019. Т. 45. № 4. С. 71. Borovik A.S., Negulyaev V.O., Tarasova O.S. et al. Disorders of synchronization of blood pressure and heart rate precede the development of vasovagal syncope during orthostasis // Human Physiology. 2019. V. 45. № 4. P. 405.
Parati G., DiRienzo M., Mancia G. How to measure baroreflex sensitivity: From the cardiovascular laboratory to daily life // J. Hypertens. 2000. V. 18. № 1. P. 7.
Yarmanova E.N., Kozlovskaya I.B., Khimoroda N.N. et al. Evolution of Russian microgravity countermeasures // Aerosp. Med. Hum. Perform. 2015. V. 86. № 12 Suppl. P. A32.
Kozlovskaya I.B., Grigoriev A.I., Stepantzov V.I. Countermeasure of the negative effects of weightlessness on physical systems in long-term space flights // Acta Astronaut. 1995. V. 36. № 8–12. P. 661.
Котовская А.Р., Фомина Г.А. Особенности адаптации и дезадаптации сердечно-сосудистой системы человека в условиях космического полета // Физиология человека. 2010. Т. 36. № 2. С. 78. Kotovskaya A.R., Fomina G.A. Characteristics of adaptation and maladaptation of human cardiovascular system under space flight conditions // Human Physiology. 2010. V. 36. № 2. P. 190.
Goswami N., Loeppky J.A., Hinghofer-Szalkay H. LBNP: Past protocols and technical considerations for experimental design // Aviat. Space Envir. Med. 2008. V. 79. № 5. P. 459.
Cooke W.H., Ryan K.L., Convertino V.A. Lower body negative pressure as a model to study progression to acute hemorrhagic shock in humans // J. Appl. Physiol. 2004. V. 96. № 4. P. 1249.
Goswami N., Blaber A.P., Hinghofer-Szalkay H., Convertinoet V.F. Lower body negative pressure: Physiological effects, applications, and implementation // Physiol. Rev. 2019. V. 99. № 1. P. 807.
Furlan R., Jacob G., Palazzolo L. et al. Sequential modulation of cardiac autonomic control induced by cardiopulmonary and arterial baroreflex mechanisms // Circulation. 2001. V. 104. № 24. P. 2932.
Julien C. The enigma of Mayer waves: Facts and models // Cardiovasc. Res. 2006. V. 70. № 1. P. 12.
Cerutti C., Barres C., Paultre C. Baroreflex modulation of blood pressure and heart rate variabilities in rats: assessment by spectral analysis // Am. J. Physiol. Circ. Physiol. 1994. V. 266. № 5. P. H1993.
Guasti L., Mainardi L.T., Baselli G. et al. Components of arterial systolic pressure and RR-interval oscillation spectra in a case of baroreflex failure, a human open-loop model of vascular control // J. Hum. Hypertens. 2010. V. 24. № 6. P. 417.
Laurin A., Lloyd M.G., Hachiya T. et al. New indices from microneurography to investigate the arterial baroreflex // Physiol. Rep. 2017. V. 5. № 12. P. e13220.
Wyller V.B., Barbieri R., Saul J.P. Blood pressure variability and closed-loop baroreflex assessment in adolescent chronic fatigue syndrome during supine rest and orthostatic stress // Eur. J. Appl. Physiol. 2011. V. 111. № 3. P. 497.
Verma A.K., Xu D., Garg A. et al. Non-linear heart rate and blood pressure interaction in response to lower-body negative pressure // Front. Physiol. 2017. V. 8. P. 767.
Borovik A.S., Orlova E.A., Tomilovskaya E.S. et al. Phase coupling between baroreflex oscillations of blood pressure and heart rate changes in 21-day dry immersion // Front. Physiol. 2020. V. 11. P. 455.
Орлова Е.А., Тарасова О.С., Сонькин В.Д., Боровик А.С. Влияние возраста на барорефлекторную синхронизацию артериального давления и частоты сердечных сокращений при пассивной ортопробе // Авиакосмическая и экологическая медицина. 2021. Т. 55. № 1. С. 46. Orlova Е.А., Tarasova О.S., Son’kin V.D., Borovik А.S. [Influence of the age on baroreflex synchronization of arterial pressure and heart rate during the passive standing test] // Aviakosm. Ekolog. Med. 2021. V. 55. № 1. P. 46.
Wesseling K.H., Jansen J.R., Settels J.J., Schreuder J.J. Computation of aortic flow from pressure in humans using a nonlinear, three-element model // J. Appl. Physiol. 1993. V. 74. № 5. P. 2566.
Tass P., Rosenblum M.G., Weule J. et al. Detection of n:m phase locking from noisy data: application to magnetoencephalography // Phys. Rev. Lett. 1998. V. 81. P. 3291.
Negulyaev V.O., Tarasova O.S., Tarasova N.V. et al. Phase synchronization of baroreflex oscillations of blood pressure and pulse interval in rats: the effects of cardiac autonomic blockade and gradual blood loss // Physiol. Meas. 2019. V. 40. № 5. P. 054003.
Convertino V.A. Neurohumoral mechanisms associated with orthostasis: reaffirmation of the significant contribution of the heart rate response // Front. Physiol. 2014. V. 5. P. 236.
Johnson B.D., Van Helmond N., Curry T.B. et al. Reductions in central venous pressure by lower body negative pressure or blood loss elicit similar hemodynamic responses // J. Appl. Physiol. 2014. V. 117. № 2. P. 131.
Dampney R.A.L. Central neural control of the cardiovascular system: current perspectives // Adv. Physiol. Educ. 2016. V. 40. № 3. P. 283.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


