Физиология человека, 2021, T. 47, № 5, стр. 67-76
Индивидуально-типологические особенности реактивности ЭЭГ-ритмов, сердечно-сосудистой системы и уровня лактоферрина в условиях общего воздушного охлаждения человека
Е. В. Кривоногова 1, *, О. В. Кривоногова 1, Л. В. Поскотинова 1
1 ФГБУН Федеральный исследовательский центр комплексного изучения Арктики
имени академика Н.П. Лавёрова УрО РАН
Архангельск, Россия
* E-mail: elena200280@mail.ru
Поступила в редакцию 16.03.2020
После доработки 17.08.2020
Принята к публикации 02.02.2021
Аннотация
Исследована комплексная реакция нервной, сердечно-сосудистой и иммунной систем (на примере лактоферрина) в ответ на кратковременное общее воздушное охлаждение организма мужчин в возрасте 18–21 года, в зависимости от их индивидуально-типологических особенностей. Проведено сравнение 3 состояний – до, во время и после охлаждения. Изменение электроэнцефалограммы (ЭЭГ), гемодинамических параметров (артериальное давление – АД), вариабельности ритма сердца (ВРС) и уровня лактоферрина в слюне при охлаждении позволило выделить две различные реакции. Группа I характеризовалась исходными средними значениями спектральной мощности (СМ) θ-, α-активности ЭЭГ, характеризующие сбалансированное влияние активирующих и тормозных воздействий на кору головного мозга и сбалансированной вегетативной регуляцией ритма сердца. При охлаждении в данной группе отмечалось снижение температуры поверхности тела (Тк, Тсл), повышение АД, снижение частоты сердечных сокращений (ЧСС), повышение характеристик ВРС (RMSSD, SDNN, TP, HF), десинхронизации в теменных отделах и повышение в передневисочных отделах α-активности, увеличение θ-активности во всех отделах справа, а также в передневисочном слева и без изменения уровня лактоферрина в слюне. Группа II отличалась исходными высокими значениями СМ θ-, α-диапазона ЭЭГ, отражающие активность гипоталамо-диэнцефальных структур, по параметрам ВРС более низким значением ТР и высоким SI. При воздействии холода отмечалось более выраженное снижение Тк, Тсл, повышение ТР, абсолютных значений мощностей HF, LF, VLF, содержание лактоферрина в слюне и медленное восстановление систолического АД после холода. Приспособительная реакция на холод в данной группе проходила с напряжением адаптационных механизмов, что может привести к риску снижения функциональных резервов организма. Таким образом, при воздействии холода у лиц в зависимости от индивидуально-типологических особенностей включаются разные нейрофизиологические механизмы мобилизации функциональных систем.
Сохранение и укрепление здоровья населения Арктики является одним из приоритетных направлений в связи с возрождением роли Арктики в социально-экономическом развитии России. Проживание на Севере под воздействием неблагоприятных факторов, в том числе и низких температур, связано с напряжением регуляторных механизмов, сокращением резервных возможностей защиты организма [1]. Многолетними наблюдениями подтверждается связь между снижением адаптационных возможностей организма и развитием заболеваний. Для обеспечения адекватного реагирования организма на изменения окружающей среды тесно взаимодействуют нервная система с иммунной. Воздействие холода вызывает изменения во многих функциональных системах организма человека. Поддержание гомеостаза и динамические перестройки в организме при воздействии окружающей среды, осуществляются с участием всех основных систем, и сдвиг каких-либо параметров в одной из них сопровождается изменениями в сопряженных с ней системах регуляции [2]. Несмотря на проводимые исследования, еще не до конца понятны различия в реакциях регуляторных систем и их взаимодействие в ответ на холод в зависимости от индивидуальных свойств организма, и в полной мере не установлены четкие принципы, на основе которых можно провести подготовку людей к длительному пребыванию в условиях низких температур на работе и для профилактики заболеваний. Особенности развития холодовой реакции зависят от многих факторов, в частности, индивидуальных реакций периферических сосудов [3], микроциркуляции [4], иммунных реакций [5], от индивидуальных характеристик, включая пол, возраст, эмоциональное и физическое состояние. Характер взаимодействия между нервной и иммунной системами будет определять разные варианты приспособительных реакций при воздействии холода, и в ряде случаев может приводить к риску развития заболеваний. В литературе представлены результаты изучения холодового воздействия на организм, но существуют противоречивые результаты в исследованиях по изменению характеристик ЭЭГ, параметров вариабельности ритма сердца (ВРС) [6–9] и мало известно об интегральном взаимодействии с другими функциональными системами. Считается, что ВРС косвенно отражает сложные паттерны активации мозга и представляет информацию о функциональной организации центральной нервной системы [10]. Под нейрогормональным контролем, в частности под вегетативным, находятся секреторные белки слюны, которые являются частью врожденной иммунной системы и составляют первую линию защиты от инфекционных болезней. Слюна содержит антимикробные белки, которые находятся и в других тканях, что делает слюну репрезентативной моделью исследования [11]. Одним из активно изучаемых гликопротеидов, который входит в состав слюны, является лактоферрин, участвующий во многих физиологических функциях, включая регуляцию всасывания железа и иммунных реакций [12], обладает антиоксидантными, противовоспалительными свойствами [13]. По литературным данным изменение баланса вегетативной нервной системы на стресс отражается по-разному на уровне лактоферрина в слюне [11].
В связи с вышеизложенным, целью исследования является выявление индивидуально-типологических особенностей изменения биоэлектрической активности головного мозга, сердечно-сосудистых показателей и уровня лактоферрина в слюне при холодовом воздействии.
МЕТОДИКА
В исследовании принимали участие 18 здоровых мужчин в возрасте 18–21 года (г. Архангельск). Исследование проводили в январе, феврале в первой половине дня. В процессе обследования все молодые люди были в однотипной одежде – кроссовки, хлопчатобумажные брюки, футболка и медицинский халат. Индекс массы тела обследуемых не выходил за границы нормальных значений (от 18.5 до 24.9 кг/м2).
При проведении исследования регистрировали параметры синхронной записи электроэнцефалограммы (ЭЭГ) и ВРС (5 мин), систолическое и диастолическое артериальное давление (САД и ДАД), температуру кожного покрова кисти (Тк), в слуховом проходе (Тсл) и проводили забор слюны в помещении при комнатной температуре (ФОН), с 5 по 10 мин нахождения в холодовой камере “УШЗ-25Н” (–20°С) оценивали ЭЭГ, ВРС; на 10 мин пребывания в холоде – Тк и Тсл и сразу после выхода из холодовой камеры проводили забор слюны и измеряли артериальное давление (АД) (ХОЛОД), через 10 мин после выхода из холодовой камеры регистрировали САД, ДАД, ЭЭГ, ВРС, Тк, Тсл, проводили забор слюны (ТЕПЛО через 10 мин). Все измерения проводились у молодых людей в положении сидя.
Анализ ЭЭГ осуществляли по спектральной мощности (СМ) – α (8–13 Гц)-, β1 (14–24 Гц)- и θ (4–7 Гц)-активности. Использовали 16 канальную запись ЭЭГ (Fp1, Fp2, F3, F4, F7, F8, C3, C4, P3, P4, T3, T4, T5, T6, O1, O2) по международной системе “10–20%” наложения электродов на поверхность головы в состоянии спокойного бодрствования с закрытыми глазами. Регистрацию ЭЭГ проводили с помощью портативного электроэнцефалографа (Нейрон-Спектр-СМ “Нейрософт”, Россия). В качестве референтных использовали ушные электроды.
Оценку состояния вегетативной нервной системы (ВНС) осуществляли по показателям ВРС, которые оценивались с помощью АПК “Варикард” (Россия). Использовали временной и спектральный виды анализа: частота сердечных сокращений (ЧСС, уд./мин), среднее квадратичное отклонение (SDNN, мс), которое отражает суммарный эффект вегетативной регуляции кровообращения; квадратный корень из суммы квадратов разности величин последовательных пар RR-интервалов (RMSSD, мс) и процент количества пар последовательных кардиоинтервалов в кардиограмме, отличающиеся более чем на 50 мс (PNN50%), отражают активность парасимпатического звена вегетативной регуляции, индекс напряжения регуляторных систем (SI, усл. ед.), мощность спектра ВРС в диапазоне высоких частот (HF, мc2, HF, %, 0.4–0.15 Гц), в низкочастотном диапазоне (LF, мс2, LF, %, 0.04–0.15 Гц) и в сверхнизкочастотном диапазоне (VLF, мс2, VLF, %, 0.04–0.015 Гц); ТР, мс2 (суммарная мощность спектра ВРС) – суммарный уровень активности регуляторных систем. АД регистрировали осциллометрическим методом с помощью прибора A&D (Япония). Тк, Тсл измеряли электронным инфракрасным термометром B. Well WF – 1000 (Швейцария). Отобранные образцы слюны хранились в эппендорфах при –20°С, перед анализом они разморожены и центрифугированы при 3000 rpm в течение 15 мин. Уровень лактоферрина в слюне (нг/мл) определяли иммуноферментным методом с помощью автоматического планшетного анализатора “Elisys Uno” (Human, Германия) и коммерческого тест-набора от “Hycultbiotechnologyb.v.” (Нидерланды) с 20-кратным разведением при помощи раствора (Sample Dilution buffer). Статистическую обработку данных проводили в программе Statistica 6.0. Проверку распределения количественных данных на нормальность осуществляли с помощью критерия Shapiro-Wilk. Данные представлены в виде медианы (Ме (25р; 75р)). Для упорядочивания и классификации полученных результатов использовали кластерный анализ методом к-средних. Для кластерного анализа было проведено z-преобразование данных с целью уменьшения асимметрии при распределении переменных. В кластерный анализ для выделения групп были включены: СМ α-активности ЭЭГ в отведениях F3, F4, F7, F8, C3, C4, P3, P4, T3, T4, T5, T6, O1, O2, показатели ВРС (ТР, мс2, SI) в фоне. Сравнения количественных данных для двух независимых групп проводили c помощью критерия Манна-Уитни, критический уровень значимости менее 0.05. Для сравнения количественных признаков трех связанных выборок использовали непараметрический критерий Фридмана. Для проведения апостериорных сравнений использовали критерий Вилкоксона, критический уровень статистической значимости при сравнении попарно три группы между собой составил менее 0.017. Корреляционный анализ был выполнен с использованием критерия Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
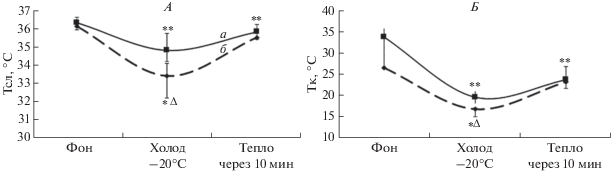
Методом кластерного анализа выделено два кластера, различающихся по исходным значениям (рис. 1) и направленности срочной приспособительной реакции на холод. Измеряемая Тк и Тсл в фоне не различалась у молодых людей между кластерами (рис. 2). При охлаждении Тк у лиц кластера I понижалась до 20°C, а у лиц кластера II до 16°С, что статистически ниже (р = 0.03). При холодовом воздействии Тсл снижалась, и у лиц кластера II была статистически ниже (р = 0.01). Полагаем, что у лиц кластера II более выраженное снижение Тк и Тсл регистрировалась из-за большей констрикции поверхностных сосудов в ответ на холод. По данным литературы, усиление вазоконстрикции в ответ на холод может свидетельствовать о напряжении адаптационных систем [14]. Через 10 мин после холода у молодых людей кластера II Тк и Тсл возвращалась к фоновым значениям, в отличие от кластера I, где она оставалась более низкой по сравнению с фоном.
Рис. 1.
Результаты кластерного анализа по спектральной мощности α-активности ЭЭГ и параметров вариабельности ритма сердца (ВРС) в фоне у молодых людей. а – кластер I, б – кластер II, по оси ординат z-преобразованные значения, по оси абсцисс – спектральная мощность α-активности, параметры ВРС (SI, TP) в фоне у молодых людей, уровень статистической значимости между кластерами, Δ – р < 0.05.
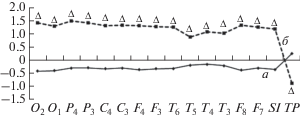
Рис. 2.
Изменение температуры в слуховом проходе (А) и кожного покрова кисти (Б) у молодых людей. а – кластер I, б – кластер II, уровень статистической значимости между кластерами, Δ – р < 0.05, уровень статистической значимости по сравнению с фоном, * – р < 0.05, ** – р < 0.01.
По параметрам ВРС лица кластера II отличались в фоне более низкими значениями SDNN, RMSSD, TP, LF, мс2, VLF, мс2 и высокими значениями SI, по сравнению с кластером I (табл. 1), что отражает повышение активности симпатической нервной системы в регуляции ритма сердца и напряжение адаптационных механизмов [15]. У лиц кластера I значения SI в фоне не выходили за интервал 50–150 усл. ед., что свидетельствует о сбалансированном влиянии парасимпатической и симпатической систем [16]. В ответ на холод повышались значения RMSSD (p < 0.01), SDNN (р < < 0.01), ТР (p < 0.01) и снижался SI (p < 0.01) у лиц в обоих кластерах. У молодых людей кластера I при охлаждении наблюдалось повышение активности парасимпатической нервной системы, что отражалось в увеличении показателей HF, мс2 (p = = 0.003) и HF, % (p = 0.01). Усиление тонуса блуждающего нерва в ответ на общее воздушное охлаждение, вероятно, опосредуется через тройничный нерв, кожные рецепторы которого наиболее чувствительны к охлаждению и увеличивают активность парасимпатической нервной системы [17]. Повышение парасимпатического звена способствует поддержанию лучшего кровообращения в периферических тканях, более высокой температуры поверхности кожи, что препятствует обморожению в условиях низких температур. Так, у людей, проживающих в Арктике и приезжих, при развитии адаптации на повторяющееся воздействия холода, отмечалось увеличение активности парасимпатической нервной системы [18]. Направленность изменений параметров вегетативной регуляции у лиц кластера II при охлаждении характеризовалась повышением всех частотных составляющих спектра ВРС (HF, мс2, (p = 0.015), LF, мс2, (p = 0.013), VLF, мс2 (p = 0.01)), что отражает увеличение активности как парасимпатической нервной системы, так и симпатической, в том числе, и за счет влияния центральных механизмов регуляции. В кластере II отмечалось повышение показателя VLF, мс2, по данным литературы это связывают с активацией церебральных эрготропных структур [15].
Таблица 1.
Параметры вариабельности ритма сердца у молодых людей, Ме (25р; 75р)
| Показатель | Кластер I (n = 11) | Кластер II (n = 7) | ||||||
|---|---|---|---|---|---|---|---|---|
| ФОН | ХОЛОД –20°С | ТЕПЛО через 10 мин |
р, по Фридману | ФОН | ХОЛОД –20°С | ТЕПЛО через 10 мин |
р, по Фридману | |
| ЧСС, уд./мин | 73.4(67.1; 75.1) | 67.1(63.4; 71.5) | 63.4(60.5; 68.9)** | 0.005 | 77.1(69.9; 86.9) | 77.8(73.8; 79.3) | 69.9(67.1; 79.4)** | 0.041 |
| RMSSD, мс | 45.4(24.5; 53.7) | 59.5(47.9; 93.9)** | 52.8(34.4; 74.9) | 0.011 | 22.7(18.6; 28.4)Δ | 53.4(40.8; 68.7)** | 30.6(18.9; 40.3) | 0.043 |
| SDNN, мс | 58.3(51.2; 68.3) | 82.8(60.0; 131.4)** | 61.2(44.5; 76.6) | 0.001 | 35.5(29.3; 42.5)Δ | 76.3(71.8; 86.6)** | 38.1(36.4; 51.8) | 0.041 |
| pNN50% | 23.6(10.5; 41.0) | 32.4(20.7; 51.8)** | 26.8(13.3; 53.9) | 0.001 | 5.9(2.5; 11.5) | 26.9(16.3; 38.1) | 13.5(7.7; 22.1) | 0.173 |
| TP, мс2 × 1000 | 3.8(2.5; 3.9) | 4.9(2.9; 13.9)** | 3.7(2.1; 5.1) | 0.028 | 1.2 (0.8; 1.5)Δ | 5.4 (3.5; 6.7)** | 1.4(1.1; 2.8) | 0.042 |
| SI, усл. ед. | 80.4(50.9; 91.9) | 37.2(17.6; 71.8)** | 52.7(34.8; 129.3) | 0.008 | 171.3(119.2; 338.2)Δ | 51.2(39.2; 56.2)** | 154.1(76.3; 196.2) | 0.015 |
| HF, мс2 × 1000 | 0.8(0.2; 0.9) | 1.7(0.9; 2.8)** | 0.9(0.4; 2.1) | 0.001 | 0.3(0.2; 0.3) | 1.2(0.8; 2.1)* | 0.4(0.2; 0.8) | 0.015 |
| LF, мс2 × 1000 | 1.3(0.9; 1.8) | 1.5(0.8; 5.1) | 1.4(0.9; 2.1) | 0.306 | 0.5(0.4; 0.6)Δ | 1.5(1.1; 3.2)** | 0.7(0.3; 1.2) | 0.042 |
| VLF, мс2 × 1000 | 0.6(0.4; 0.9) | 0.7(0.5; 2.8) | 0.7(0.6; 0.8) | 0.177 | 0.2(0.1; 0.3)ΔΔ | 0.6(0.4; 1.1)** | 0.3(0.2; 0.5) | 0.031 |
| HF, % | 24.9(12.4; 31.6) | 34.4(22.7; 51.5)** | 27.3(20.8; 43.7) | 0.008 | 26.7(14.7; 28.9) | 29.3(18.9; 45.4) | 25.3(17.8; 34.5) | 0.311 |
| LF, % | 53.1(42.4; 60.2) | 41.6(31.4; 55.2) | 44.9(35.0; 51.8) | 0.085 | 58.9(39.7; 68.7) | 45.4(30.9; 54.5) | 55.9(48.5; 61.9) | 0.846 |
| VLF, % | 23.7(14.6; 31.3) | 17.7(16.4; 24.5) | 20.9(17.3; 38.8) | 0.233 | 19.1(10.6; 23.1) | 20.9(9.4; 24.3) | 19.4(14.4; 21.4) | 0.846 |
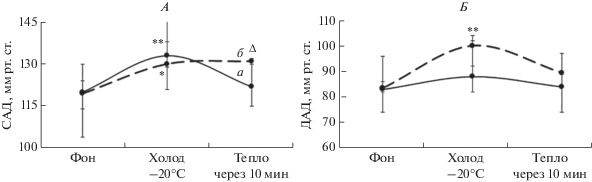
Анализ гемодинамических показателей выявил, что у молодых людей обоих кластеров фоновые значения не различались (рис. 3). У лиц кластера I в ответ на холод повышалось АД (р < < 0.01) и рефлекторно снижалась частота сердечных сокращений (ЧСС) (p = 0.01), в период согревания через 10 мин АД восстанавливалось до исходных значений. У лиц кластера II повышалось ДАД (р = 0.01) во время воздействия холода, что указывает на увеличение периферического сопротивления сосудов, а также увеличивалось САД (р = 0.016) при этом ЧСС изменялась незначительно. Через 10 мин после холода снижалось ДАД и ЧСС (р = 0.016), а САД сохранялось на том же уровне, что обеспечивает достаточный кровоток тканей после охлаждения и способствует более быстрому восстановление температуры поверхности тела у лиц кластера II. У молодых людей кластера I температура поверхности тела после воздействия холода более медленно восстанавливалась и не достигала уровня фоновых значений, при этом АД снижалось к значениям до воздействия холода.
Рис. 3.
Изменение систолического артериального давления (А) и диастолического артериального давления (Б) у молодых людей. Обозначения см. рис. 2.
Оценка биоэлектрической активности головного мозга выявила различия у молодых людей в зависимости от кластера (табл. 2). У лиц кластера II, в отличие от кластера I, в фоне отмечались достоверные различия в виде больших значений мощности α-активности практически во всех отделах головного мозга (O1, O2, P4, P3, C4, C3, F4, F3, T6, T5, T3, F8, F7). Также наблюдались значимо большие значения мощности в θ-диапазоне в отделах (O1, O2, P4, P3, C4, C3, F4, F3, T6, T4, F8). По СМ β1-диапазона ЭЭГ не было выявлено различий между кластерами. Таким образом, лица кластера II отличались более высокими значениями СМ ЭЭГ α- и θ-активности в фоне, что может отражать снижение тормозного контроля со стороны коры на подкорковые структуры и, следовательно, в механизмах саморегуляции мозга будут преобладать гипоталамо-диэнцефальные влияния [19]. В кластер I вошли молодые люди со средними значениями СМ α- и θ-активности ЭЭГ, что свидетельствует о сбалансированных восходящих активирующих и тормозных влияний на кору головного мозга. При нахождении в холодовой камере, биоэлектрическая активность головного мозга у лиц кластера I изменялась в направлении снижения СМ α-активности в теменных отделах головного мозга (P4, p = 0.009, P3, p = 0.004),увеличения в передневисочных (F8, p = 0.004, F7, p = = 0.004). Повышение СМ θ-активности наблюдалась справа во фронтальных (F4, p = 0.004), центральных (С4, p = 0.01), теменных (Р4, p = 0.016), затылочных (О2, p = 0.01), передневисочных (F8, p = 0.003), средневисочных (Т4, p = 0.007) и задневисочных (T6, p = 0.006) отделах головного мозга и слева в передневисочном (F7, p = 0.003) в ответ на холод. СМ β1-активности при холодовом воздействии увеличивалась в височных отделах головного мозга (T6, p = 0.003, T4, p = 0.003, F8, p = = 0.004), центральном (С4, p = 0.003), лобных (F4, p = 0.004, F3, p = 0.003) и в передневисочном слева (F7, p = 0.003). По литературным данным, технологии нейровизуализации позволили выявить участки мозга, включая медиальную префронтальную кору, инсулу, переднюю поясную извилину, миндалину и гиппокамп, которые связаны с сердечно-сосудистыми изменениями, под действием многих стрессоров [20]. В коре полушарий особое значение придается вентро-медиальной префронтальной коре, она оказывает влияние на гипоталамо-гипофизарную ось, влияя на температуру кожи, ЧСС, АД [21]. Островок вовлечен в мониторинг интероцептивной информации, формирование эфферентного потока сигналов, и может участвовать в реакциях на изменения температуры. Инсульты головного мозга, когда вовлечены инсула, прилежащие к ней области префронтальной коры и височной доли, могут приводить к нарушениям терморегуляции [22]. Инфаркты головного мозга, затрагивающие островок, сопровождаются повышением концентрации катехоламинов в крови, вызывая повышение АД и ЧСС [21]. Влияние инсулярной коры на кардиоваскулярную систему опосредованы структурами латерального гипоталамуса путем модуляции рефлекторных реакций, реализующихся на бульбарном уровне [22]. В исследованиях с использованием 18F-фтордезоксиглюкозы-ПЭТ-КТ, поглощение ее уменьшалось в правой островковой доле, а увеличение в стволе мозга и мозжечке во время охлаждения [23]. Авторы интерпретировали этот результат как высвобождение от тормозного контроля, вызванного участками мозга более высокого порядка на вегетативные центры, расположенные в стволе мозга. Установлено, что левый островок контролирует преимущественно парасимпатическую регуляцию, а правый – симпатическую [21]. Это подтверждается при введении амитала во внутреннюю сонную артерию каждого полушария с развитием вегетативных эффектов противоположной стороны [21]. В литературе указывается, что инсульты могут приводить к снижению эфферентных влияний коры и растормаживанию вегетативных структур, участвующих в обеспечении сердечно-сосудистой деятельности [21]. У лиц кластера I десинхронизация α-активности ЭЭГ в теменных отделах, куда подходят афферентные пути кожной чувствительности связана с восприятием и анализом информации с кожных рецепторов. С позиции W. Klimesch [24] колебания α-активности выполняют две роли – торможение и синхронизацию, которые тесно связаны с двумя функциями как подавление и отбор информации, следовательно, повышение α-активности в передневисочных отделах головного мозга, можно полагать, что отражает процессы избирательного торможения в структурах островкой доли и связанной с ней участками префронтальной и височной коры для регуляции сердечно-сосудистой деятельности и терморегуляции. Повышении СМ ЭЭГ θ-активности в отделах F7, F8, C4, P4, O2, T6, T4 в ответ на холод свидетельствует о повышение активности гипоталамо-диэнцефальных структур, снижение ингибирующего влияния со стороны коры головного мозга на подкорковые структуры [19] справа и при сохранении этого влияния коры слева. В литературе показано, что активность, наблюдаемая с левой стороны в соматосенсорной коре, предклинье, в передней поясной извилине, передней части островка, связана с увеличением активности парасимпатического отдела ВНС [25] и согласуется с нашим исследованием, что у лиц кластера I повышается активность парасимпатического звена по параметрам ВРС в ответ на холод. У лиц кластера II при охлаждении не было обнаружено изменений СМ в α- и θ-диапазоне ЭЭГ по сравнению с фоном. Повышалась СМ β1-активности при холодовом воздействии справа в затылочном (О2, p = 0.016), теменном (Р4, p = 0.016), центральном (С4, p = 0.016), лобном (F4, p = 0.016), задневисочном (Т6, p = 0.016) и в обоих отделах головного мозга в средневисочных (Т4, p = 0.016, Т3, p = 0.016) и передневисочных (F8, p = 0.016, F7, p = 0.016). Повышение СМ β1-активности в ответ на холод требует дополнительно изучения. Некоторые авторы полагают, что это связано с напряжением мышц в области головы, а другие – с тонической болью [26].
Таблица 2.
Спектральная мощность ЭЭГ-ритмов у молодых людей, мкВ2
| Кластер I (n = 11) | Кластер II (n = 7) | |||||||
|---|---|---|---|---|---|---|---|---|
| Спектральная мощность θ-активности ЭЭГ | ||||||||
| отведение | ФОН | ХОЛОД –20°С | ТЕПЛО через 10 мин |
р, по Фридману | ФОН | ХОЛОД –20°С | ТЕПЛО через 10 мин |
р, по Фридману |
| O2 | 14.4(12.1; 21.9) | 24.5(19.7; 32.5)** | 14.1(10.2; 20.8) | 0.011 | 35.6(24.9; 52.2)Δ | 44.2(41.7; 45.9) | 39.4(28.7; 55.1) | 0.311 |
| O1 | 14.5(11.3; 19.1) | 14.4(9.7; 21.5) | 13.7(8.8; 26.8) | 0.761 | 28.9(23.9; 33.1)Δ | 29.1(24.5; 85.6) | 24.8(19.6; 27.4) | 0.311 |
| P4 | 19.7(13.6; 27.5) | 31.5(20.5; 48.7)** | 18.7(12.9; 42.4) | 0.011 | 37.7(31.1; 45.7)Δ | 46.1(39.2; 50.1) | 38.7(35.2; 48.6) | 0.223 |
| P3 | 18.7(15.6; 25.2) | 26.3(14.1; 35.3) | 18.2(16.1; 37.1) | 0.913 | 34.3(28.6; 40.2)Δ | 34.1(26.7; 43.4) | 35.7(26.7; 45.1) | 0.606 |
| C4 | 26.8(14.4; 29.7) | 32.7(22.8; 40.1)** | 20.7(13.9; 29.6) | 0.034 | 37.1(31.5; 44.7)Δ | 47.9(42.8; 64.3) | 38.8(32.7; 39.8) | 0.135 |
| C3 | 22.7(17.1; 29.3) | 30.1(22.1; 40.3) | 20.4(17.9; 34.5) | 0.307 | 35.6(28.8; 39.7)Δ | 37.7(34.3; 40.2) | 34.6(29.6; 42.1) | 0.606 |
| F4 | 22.9(16.7; 31.1) | 35.5(21.9; 42.8)** | 21.7(14.6; 32.7) | 0.003 | 39.1(32.3; 53.3)Δ | 50.8(44.6; 71.3) | 40.6(38.9; 47.3) | 0.311 |
| F3 | 22.7(18.5; 31.2) | 34.1(21.6; 41.8) | 21.9(16.8; 34.6) | 0.233 | 30.9(25.3; 48.2)Δ | 37.6(30.8; 62.5) | 38.3(27.1; 41.8) | 0.135 |
| T6 | 10.6(7.1; 19.6) | 21.2(14.4; 41.2)** | 8.9(5.8; 16.7) | 0.001 | 21.4(18.6; 28.4)Δ | 30.1(25.7; 31.8) | 19.1(15.3; 23.5) | 0.606 |
| T5 | 9.4(6.5; 18.7) | 19.8(10.1; 31.0) | 9.2(6.4; 21.9) | 0.307 | 13.7(11.6; 20.1) | 16.9(14.9; 18.2) | 12.4(10.9; 15.8) | 0.311 |
| T4 | 11.5(8.5; 19.6) | 21.9(13.1; 41.4)** | 9.9(8.1; 12.5) | 0.004 | 17.1(11.1; 19.5)Δ | 29.6(20.7; 41.3) | 14.3(13.7; 21.4) | 0.135 |
| T3 | 8.2(7.2; 13.1) | 14.1(9.9; 27.5) | 8.5(7.1; 15.7) | 0.148 | 11.7(10.7; 12.2) | 14.2(13.1; 14.9) | 11.9(9.8; 12.3) | 0.081 |
| F8 | 11.4(10.3; 14.1) | 22.7(14.4; 34.9)** | 7.9(6.8; 10.7) | 0.001 | 20.1(15.7; 21.5)Δ | 33.3(25.2; 35.6) | 17.1(14.1; 33.2) | 0.114 |
| F7 | 10.4(6.2; 12.9) | 18.6(10.8; 28.2)** | 10.3(6.2; 11.6) | 0.001 | 12.5(9.6; 14.2) | 14.5(12.6; 41.3) | 11.1(10.2; 13.1) | 0.135 |
| Спектральная мощность α-активности ЭЭГ | ||||||||
| отведение | ФОН | ХОЛОД –20°С | ТЕПЛО через 10 мин |
р, по Фридману | ФОН | ХОЛОД –20°С | ТЕПЛО через 10 мин |
р, по Фридману |
| O2 | 97.2(45.3; 159.6) | 92.8(48.9; 132.2) | 92.7(54.3; 200.9) | 0.529 | 370.8(321.3; 541.9)Δ | 489.4(416.3; 518.1) | 409.5(341.8; 437.5) | 0.606 |
| O1 | 62.0(44.4; 169.6) | 84.7(46.1; 127.5) | 72.3(51.3; 179.1) | 0.523 | 280.7(245.2; 353.7)Δ | 364.3(248.1; 476.9) | 262.4(244.9; 306.6) | 0.513 |
| P4 | 101.6(80.9; 175.9) | 75.1(49.3; 128.1) | 119.7(63.2; 184.6) | 0.028 | 348.4(183.6; 465.1)Δ | 289.2(273.2; 322.9) | 276.8(240.7; 494.9) | 0.846 |
| P3 | 86.9(84.1; 138.1) | 68.8(53.2; 116.9) | 121.4(75.2; 200.1) | 0.011 | 334.8(210.8; 416.1)Δ | 328.4(229.9; 413.7) | 350.1(274.6; 425.7) | 0.606 |
| C4 | 61.1(35.5; 78.9) | 55.5(40.3; 72.8) | 71.1(32.4; 92.4) | 0.117 | 124.7(69.7; 213.5)Δ | 142.1(84.9; 209.1) | 127.7(96.9; 163.1) | 0.846 |
| C3 | 60.4(33.9; 82.3) | 62.6(38.2; 81.4) | 70.7(34.2; 105.2) | 0.085 | 134.1(91.9; 285.6)Δ | 184.1(102.8; 215.3) | 134.9(131.3; 230.2) | 0.513 |
| F4 | 41.5(22.1; 53.4) | 47.3(29.6; 60.8) | 52.3(22.3; 62.6) | 0.061 | 104.0(67.7; 176.2)Δ | 113.1(77.1; 187.4) | 104.9(84.3; 132.5) | 0.135 |
| F3 | 40.3(22.8; 57.6) | 47.8(33.9; 59.5) | 50.8(24.1; 70.4) | 0.061 | 88.1(48.1; 176.2)Δ | 117.4(58.4; 146.8) | 90.5(67.5; 158.6) | 0.513 |
| T6 | 51.2(25.1; 78.1) | 44.2(29.7; 78.1) | 64.9(19.5; 109.5) | 0.336 | 120.7(95.2; 153.8)Δ | 160.6(113.6; 192.7) | 137.2(120.4; 161.9) | 0.846 |
| T5 | 41.9(24.1; 75.1) | 35.8(25.1; 61.2) | 49.4(29.2; 72.3) | 0.078 | 83.9(64.2; 108.9)Δ | 90.8(83.4; 94.7) | 104.8(65.5; 110.1) | 0.223 |
| T4 | 37.3(22.9; 45.2) | 40.1(21.6; 44.1) | 30.5(14.1; 44.3) | 0.529 | 49.6(38.4; 64.3)Δ | 65.7(34.3; 75.9) | 49.9(40.2; 52.2) | 0.513 |
| T3 | 26.3(15.3; 31.7) | 27.8(22.1; 35.8) | 31.5(13.2; 34.6) | 0.529 | 46.8(36.5; 54.7)Δ | 49.8(42.5; 57.4) | 49.3(33.1; 60.1) | 0.311 |
| F8 | 19.9(10.6; 28.1) | 33.3(21.3; 43.8)** | 21.9(9.5; 30.2) | 0.002 | 56.9(30.1; 63.5)Δ | 59.2(37.1; 80.8) | 48.9(34.7; 54.4) | 0.846 |
| F7 | 14.3(8.1; 23.6) | 25.1(16.6; 29.5)** | 17.6(8.1; 28.6) | 0.011 | 31.9(20.3; 50.1)Δ | 41.6(24.3; 51.9) | 31.1(24.1; 45.9) | 0.846 |
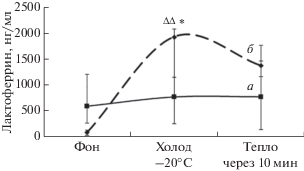
Анализ содержания лактоферрина в фоне не выявил различия между кластерами (рис. 4), но в кластере I имелась тенденция более больших его значений по сравнению с кластером II. В ответ на холод у молодых людей кластера I изменений уровня лактоферрина, по сравнению с фоном, не было. Индивидуальный анализ уровня лактоферрина в данном кластере выявил разнонаправленные его изменения в ответ на холод. Слюнные железы иннервируются ВНС. Парасимпатические нервы выделяют ацетилхолин, который активирует мускариновые рецепторы, стимулирующие секрецию жидкости. Симпатические нервы контролируют секрецию с высоким содержанием белка [27]. У лиц кластера I в ответ на холод отмечалось повышение активности парасимпатической нервной системы, которая стимулирует секрецию жидкости, где концентрация белка минимальная, так как секреция жидкости с высоким содержанием белка находится под контролем симпатической нервной системы. Корреляционный анализ выявил отрицательные корреляционные связи уровня лактоферрина с Тк (r = –0.69, p = 0.02). Усиление вазоконстрикции кожи, которая сопровождается снижением температуры поверхности тела, опосредована симпатическим влиянием. Вероятно, разнонаправленные изменения содержания лактоферрина в слюне в этом кластере будут определяться под воздействием симпатической нервной системы. У лиц кластера II на холодовое воздействие отмечалось однонаправленное повышение лактоферрина. Выявлены положительные корреляции уровня лактоферрина с показателями, отражающими активность парасимпатической нервной системы SDNN (r = 0.82, p = 0.02), RMSSD (r = 0.75, p = 0.04), ТР (r = 0.85, p = 0.01) при холоде. В данном кластере при охлаждении активировались обе ветви ВНС – симпатическая и парасимпатическая. Согласно представлениям о синергетическом воздействии двух ветвей ВНС [28] на деятельность секреторных желез, активация симпатической нервной системы, являющейся одним из основных стимулов для секреции этого белка, будет усиливаться парасимпатической активностью и уровень лактоферрина в слюне будет повышаться. Также парасимпатическая нервная система участвует в регулирование скорости слюнного тока, увеличивая его [11].
ЗАКЛЮЧЕНИЕ
При воздействии холода скоординировано взаимодействуют сердечно-сосудистая, нервная и иммунная системы для обеспечения компенсаторно-приспособительных реакций. У молодых людей кластера II отмечалось в фоне большая СМ θ-, α-активности ЭЭГ, отражающие активизацию гипоталамо-диэнцефальных структур в механизмах саморегуляции головного мозга, и по параметрам ВРС повышение симпатических влияний в регуляции ритма сердца, что позволяет судить о напряжение адаптационных механизмов. В этом кластере, по сравнению с кластером I, под влиянием холода регистрировалось более выраженное снижение Тк, Тсл, что свидетельствует о большей вазоконстрикции, обусловленной симпатическим влиянием, направленной на ограничение потерь тепла. При сохранении высокой активности гипоталамо-диэнцефальных структур с недостаточным ингибирующим влиянием коры головного мозга на подкорковые образования повышается активность парасимпатической, симпатической нервной системы, центральных механизмов вегетативной регуляции при воздействии холода. Лактоферрин, как фактор иммунной защиты, его высокое содержание в слюне в ответ на холод обеспечивается коактивацией парасимпатического и симпатического отделов ВНС, что отражает быструю приспособительную реакцию на холод. Однако в кластере II отмеченные приспособительные реакции регуляторных систем в ответ на холод отражают напряжение приспособительных механизмов и риск снижения функциональных резервов организма. В ответ на холод у молодых людей кластера I наблюдались изменения корково-подкорковых взаимоотношений, отражающих уменьшение ингибирующего влияния со стороны коры головного мозга справа на подкорковые образования и сохранением активности коры слева, что сочеталось с повышением активности парасимпатического отдела ВНС. Повышение парасимпатического звена сопровождалось менее выраженным снижением температуры поверхности кожи при воздействии холода по сравнению с кластером II, и уровень лактоферрина в слюне оставался без изменений, что может рассматриваться как более экономичный и эффективный режим функционирования систем организма при холоде в кластере I.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены Этическим комитетом Федерального исследовательского центра комплексного изучения Арктики имени академика Н.П. Лавёрова УрО РАН (г. Архангельск), протокол № 2 от 28.03.2018.
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена по программе ФНИР ФГБУН ФИЦКИА УрО РАН, № AAAA-A19-119120990083-9.
Благодарности. Авторы выражают благодарность коллективу лаборатории эндокринологии им. А.В. Ткачева (зав. лаб. д. б. н. Е.В. Типисова, н. с. И.Н. Молодовская, с. н. с., к. б. н. А.Э. Елфимова, с. н. с., к. б. н. В.А. Аликина) за помощь оценки содержания лактоферрина в слюне. Благодарность зав. лаб. регуляторных механизмов иммунитета к. б. н. А.В. Самодовой за возможность использования в исследовании холодовой камеры.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Доршакова Н.В., Карапетян Т.А. Особенности патологии жителей севера // Экология человека. 2004. № 6. С. 48.
Сороко С.И., Трубачев В.В. Нейрофизиологические и психофизиологические основы адаптивного биоуправления. СПб.: Политехника-сервис, 2010. 607 с.
Бочаров М.И. Терморегуляция организма при холодовых воздействиях // Вестник Северного (Арктического) федерального университета. Серия: Медико-биологические науки. 2015. № 1. С. 5.
Максимов А.Л., Аверьянова И.В., Харин А.В. Перестройки кардиогемодинамики, кардиоинтервалографии и микроциркуляции крови при локальной холодовой пробе у юношей уроженцев севера // Физиология человека. 2017. Т. 43. № 4. С. 114. Maksimov A.L., Averyanova I.V., Kharin A.V. Changes in cardiohemodynamic parameters, cardiointervalography, and microcirculation observed in local cold test in young men born in northern regions // Human Physiology. 2017. V. 43. № 4. P. 455.
Самодова А.В., Добродеева Л.К. Взаимосвязь эритроцитарных, тромбоцитарных показателей и гематокрита в крови с характером иммунной реакции человека на кратковременное общее охлаждение // Журн. медико-биологических исследований. 2019. Т. 7. № 4. С. 427.
Hakimi M.H., Salleh S.M., Ainul H.M.Y. et al. Ice bath therapy on athletes recovery response using EEG // Int. J. Eng.Technol. 2018. V. 7. № 4. P. 438.
Tiago-Costa E., Quelhas-Costa E., Santos-Baptista J. Changes in EEG amplitude (alpha and beta waves) with thermal environment // Dyna. 2016. V. 83. № 197. P. 87.
Hintsala H., Kenttä T.V., Tulppo M. et al. Cardiac repolarization and autonomic regulation during short-term cold exposure in hypertensive men: an experimental study // PLoS One. 2014. V. 9. № 7. P. e99973.
Roberto C., Giuseppe D.I., Attilio C. Heart rate variability: An overview and a few immediate/short-term assessments // Heart Mind. 2018. V. 2. P. 111.
Riganello F., Larroque S.K., Di Perri C. et al. Measures of CNS-autonomic interaction and responsiveness in disorder of consciousness // Front. Neurosci. 2019. V. 13. P. 530.
Bosch J.A., de Geus E.J., Veerman E.C. et al. Innate secretory immunity in response to laboratory stressors that evoke distinct patterns of cardiac autonomic activity // Psychosom Med. 2003. V. 65. № 2. P. 245.
Martorell P., Llopis S., Gonzalez N. et al. A nutritional supplement containing lactoferrin stimulates the immune system, extends lifespan, and reduces amyloid β peptide toxicity in Caenorhabditis elegans // Food. Sci. Nutr. 2016. V. 5. № 2. P. 255.
Safaeian L., Javanmard S.H., Mollanoori Y., Dana N. Cytoprotective and antioxidant effects of human lactoferrin against H2O2-induced oxidative stress in human umbilical vein endothelial cells // Adv. Biomed. Res. 2015. V. 4. P. 188.
Герасимова Л.И., Федосова А.А. Особенности вегетативной регуляции у лиц с различной восприимчивостью к холоду // Физиология человека. 2016. Т. 42. № 2. С. 127. Gerasimova L.I., Fedosova A.A. Characteristics of the autonomic regulation in humans with different susceptibility to cold // Human Physiology. 2016. V. 42. № 2. P. 228.
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В., Гаврилушкин А.П. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем // Вестник аритмологии. 2011. № 24. С. 75.
Баевский Р.М., Кириллов О.И., Кляцкин С.З. Математический анализ изменения сердечного ритма при стрессе. М.: Наука, 1984. 222 с.
Hausswirth C., Schaal K., Le Meur Y. et al. Parasympathetic activity and blood catecholamine responses following a single partial-body cryostimulation and a whole-body cryostimulation // PLoS One. 2013. V. 8. № 8. P. e72658.
Mäkinen T.M., Mäntysaari M., Pääkkönen T. et al. Autonomic nervous function during whole-body cold exposure before and after cold acclimation // Aviat. Space Environ. Med. 2008. V. 79. № 9. P. 875.
Сороко С.И., Андреева С.С., Бекшаев С.С. Перестройки параметров электроэнцефалограммы у детей – жителей о. Новая Земля // Вестник Северо-Восточного научного центра ДВО РАН. 2009. № 2. С. 49.
Palma J.A., Benarroch E.E. Neural control of the heart: recent concepts and clinical correlations // Neurology. 2014. V. 83. № 3. P. 261.
Басанцова Н.Ю., Тибекина Л.М., Шишкин А.Н. Роль вегетативной нервной системы в развитии цереброкардиальных нарушений // Журн. неврологии и психиатрии им. C.C. Корсакова. 2017. Т. 117. № 11. С. 153. Basantsova N.Yu., Tibekina L.M., Shishkin A.N. [A role of the autonomic nervous system in cerebro-cardiac disorders] // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. 2017. V. 117. № 11. P. 153.
Александров В.Г., Александрова Н.П. Роль инсулярной коры в управлении функциями висцеральных систем // Физиология человека. 2015. Т. 41. № 5. С. 114. Aleksandrov V.G., Aleksandrova N.P. The role of the insular cortex in the control of visceral functions // Human Physiology. 2015. V. 41. № 5. P. 553.
Fechir M., Klega A., Buchholz H.G. et al. Cortical control of thermoregulatory sympathetic activation // Eur. J. Neurosci. 2010. V. 31. № 11. P. 2101.
Klimesch W. α-Band oscillations, attention, and controlled access to stored information // Trends Cogn Sci. 2012. V. 16. № 12. P. 606.
Critchley H.D., Mathias C.J., Josephs O. Human cingulate cortex and autonomic control: converging neuroimaging and clinical evidence // Brain. 2003. V. 26. P. 2139.
Reinert A., Treede R., Bromm B. The pain inhibiting pain effect: an electrophysiological study in humans // Brain Res. 2000. V. 862. № 1–2. P. 103.
Porcheri C., Thimios A. Mitsiadis physiology, pathology and regeneration of salivary glands // Cells. 2019. V. 8. № 9. P. 976.
Лычкова А.Е. Механизмы синергизма отделов вегетативной нервной системы // Успехи физиологических наук. 2006. Т. 37. № 1. С. 50. Lychkova A.E. [Mechanisms of synergism of the autonomic nervous system compartments] // Usp. Fiziol. Nauk. 2006. V. 37. № 1. P. 50.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека