Физиология человека, 2021, T. 47, № 5, стр. 48-60
Контрастная чувствительность зрительной системы и когнитивные функции при шизофрении и депрессии
И. И. Шошина 1, 2, *, Ю. В. Мухитова 3, И. А. Трегубенко 3, С. В. Пронин 1, Е. Р. Исаева 3
1 ФГБУН Институт физиологии имени И.П. Павлова РАН
Санкт-Петербург, Россия
2 ФГБОУ ВО Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Первый Санкт-Петербургский государственный медицинский университет
имени академика И.П. Павлова
Санкт-Петербург, Россия
* E-mail: shoshinaii@mail.ru
Поступила в редакцию 28.12.2020
После доработки 03.04.2021
Принята к публикации 26.05.2021
Аннотация
Объективизация диагностики – одна из актуальных проблем психиатрии. Цель данной статьи – исследование взаимосвязи изменений контрастной чувствительности и когнитивных нарушений при шизофрении и депрессии. Показатели контрастной чувствительности рассматривали, как свидетельства функционального состояния и характера взаимодействия магноцеллюлярной и парвоцеллюлярной зрительных систем, обеспечивающих механизмы глобального и локального анализа информации. Установлена взаимосвязь особенностей их взаимодействия с процессами памяти, внимания и мышления при шизофрении и депрессии. При шизофрении наблюдается рассогласование в функционировании магноцеллюлярной и парвоцеллюлярной нейронных систем, со снижением активности обеих систем. При депрессии сохраняется уровень активности магносистемы, тогда как активность парвоцеллюлярной системы достоверно снижается. Таким образом, при депрессии наблюдается иной характер рассогласования взаимодействия магно- и парвоцеллюлярной систем, чем при шизофрении. Показана взаимосвязь активности магноцеллюлярной системы с особенностями рабочей памяти и свойствами внимания. Смещение баланса в сторону активности магноцеллюлярной системы сопровождается нарушением избирательности внимания, снижением произвольной регуляции. Относительно мышления показана взаимосвязь магноцеллюлярной системы с процессами абстрагирования и категоризации, парвоцеллюлярной системы – отбором и оценкой значимых признаков.
Исследование нейрокогнитивного дефицита, как одного из ведущих симптомов психотических расстройств является актуальной задачей медицинской психодиагностики в психиатрии. Это обусловлено важным дифференциально-диагностическим значением параметров познавательной деятельности для принятия клинических решений, особенно в сравнительных исследованиях, а также для оценки успешности лечения. Шизофрения и депрессия долгое время рассматривались как отдельные расстройства, основанные на различных клинических проявлениях [1], однако есть существенные доказательства того, что эти расстройства имеют общие патофизиологические и клинические проявления [2], общие нейробиологические и нейропсихологические особенности [3, 4] и перекрывающиеся синдромы. Нейрокогнитивный дефицит описан при обоих типах расстройств [4, 5] и, как предполагается, отражает лежащую в их основе нейробиологическую дисфункцию, однако результаты исследований неоднозначны [6]. В связи с этим, представляет интерес поиск взаимосвязи когнитивных нарушений с биологическими особенностями работы мозга. Становится все более очевидным, что многие нейродегенеративные [7, 8] и психотические расстройства [9–11] сопровождаются изменениями зрительного восприятия. Актуальным остается вопрос о возможности их использования в качестве маркеров психотического состояния, признаков дифференциальной диагностики схожих по симптоматике нозологий, в частности шизофрении и депрессии. Среди изменений зрительного восприятия, наблюдающихся при шизофрении [12–25] и депрессии [26–30], – изменения в остроте зрения, контрастной чувствительности, восприятии движения, лицевой экспрессии, зрительных иллюзий и т.д.
Гипотеза исследований состоит в том, что когнитивные дисфункции опосредованы изменениями процессов обработки информации на ранних уровнях восприятия. Основанием тому послужили результаты исследований, демонстрирующих, что изменения низкоуровневых зрительных функций связаны с более высокоуровневыми нарушениями [10, 31, 32]. Показано, в частности, что при шизофрении имеет место рассогласование в работе магно- и парвоцеллюлярной нейронных систем, берущих начало от рецепторов сетчатки и формирующих дорзальный и вентральный зрительные пути [12, 14, 16, 17, 33].
Представление о магно- и парвоцеллюлярной нейронных системах берет начало от работ нобелевских лауреатов 1981 г. D. Hubel и Т. Wiesel, продемонстрировавших наличие двух типов клеток латерального коленчатого тела таламуса, отличающихся не только морфологически, но и по своим физиологическим свойствам [34], а также выполненных примерно в то же время работ F. Campbel и J. Robson [35], С. Blakemore и F. Campbel [36], сформулировавших теорию пространственно-частотного анализа изображений. В соответствии с теорией зрительная система представлена множеством относительно “узких” фильтров (каналов) – нейронных комплексов, обрабатывающих различные пространственно-временны́е характеристики зрительных стимулов. Основные из них магно- и парвоцеллюлярные каналы, работа которых может рассматриваться как частный случай механизмов глобального и локального анализа [17].
Данные экспериментальных исследований свидетельствуют, что магно- и парвосистема (M- и P-системы) не являются полностью независимыми, как это предполагали D. Hubel и Т. Wiesel [34]. Результаты исследований, предпринятых, например, E.H.F. de Haan et al. и E. Freud et al. [37, 38], свидетельствуют о том, что Р-система представлена в коре двумя субпотоками: чисто цветовым каналом и каналом восприятия формы. Относительно каналов восприятия формы показано наличие канала обработки информации о форме, связанного с P-системой, имеющего отношение к системе анализа формы с учетом цвета, и канала, связанного с M-системой, имеющего отношение к системе восприятия формы в движении. Кроме того, имеется канал восприятия движения, связанный только с M-системой. Показано, что при патологических состояниях происходит изменение активности М- и Р-систем, что приводит к изменению характера их взаимодействия, рассогласованию и повышению уровня внутреннего шума [17, 21–25].
Магноцеллюлярная система берет начало от крупных ганглиозных клеток (ГК) сетчатки с большими рецептивными полями [39, 40], передающих широкополосный, преимущественно ахроматический сигнал на M-слои латерального коленчатого тела таламуса и далее на слои 4Cα и 6 первичной зрительной коры. Они составляют примерно 10% от общей популяции ГК сетчатки [34, 41]. Нейроны этой системы отвечают за периферическое зрение, более чувствительны к низким пространственным и высоким временны́м частотам [42], поэтому обеспечивают быструю передачу информации и преимущественно к нейронам дорзального пути, пролегающего через теменную кору [40, 43–47]. Дорзальный поток в свою очередь дает проекции в префронтальную кору [48]. Магноцеллюлярные нейроны играют ведущую роль в обработке информации о глобальной организации стимула, процессах “предвнимания” [46, 49], анализе положения в пространстве, движении и направлении движения зрительного объекта, стереопсисе, контуре [42, 50, 51].
Парвоцеллюлярная система берет начало от мелких ганглиозных клеток центра сетчатки с мелкими рецептивными полями [39], которые составляют примерно 70% от общей популяции клеток, передают информацию о красно-зеленой части спектра к парвоцеллюлярным слоям латерального коленчатого тела и затем слою 4Сβ первичной зрительной коры, а также слоям 4A и 6A. Нейроны этой системы более чувствительны к высоким пространственным (выше 7 цикл/град) и низким временны́м частотам [40, 51], обеспечивают медленное, по сравнению с магноцеллюлярными нейронами, проведение информации преимущественно к нейронам вентрального пути, пролегающего через нижневисочную кору [43–47]. Парвоцеллюлярная система играет ведущую роль в процессах выделения отдельных объектов и деталей объектов, т.е. локального анализа зрительного поля, обеспечивает “объектное зрение” [42, 51].
Нейроны магноцеллюлярной и парвоцеллюлярной систем обладают разной контрастной чувствительностью. На низких уровнях контраста (до 16%) высокую чувствительность демонстрируют магноцеллюлярные нейроны. Парвоцеллюлярные нейроны активируются при достижении контраста порядка 10% и продолжают отвечать до полного насыщения [42]. Это свойство преимущественно используется для изучения функционального состояния магно- и парвоцеллюлярной систем и характера их взаимодействия [12–14, 17, 21–24, 33].
Контрастная чувствительность – характеристика рецептивного поля, регистрируемая в ответ на паттерны из чередующихся светлых и темных полос с размытыми краями (синусоидальные решетки), с распределением света, интенсивность которого изменяется в соответствии с синусоидальной функцией. Контраст – отношение яркости между светлой и темной фазами паттерна. Контраст (K) определяют по Майкельсону:
(1)
${\text{K}} = {{L{\text{max}} - L{\text{min}}} \mathord{\left/ {\vphantom {{L{\text{max}} - L{\text{min}}} {L{\text{max}} + L{\text{min}},}}} \right. \kern-0em} {L{\text{max}} + L{\text{min}},}}$Исследования контрастной чувствительности зрительной системы могут предоставить важную информацию о дисфункции механизмов работы мозга, когнитивных нарушениях при шизофрении и депрессии, а также при других заболеваниях. Так показано, например, что изменения контрастной чувствительности связаны с когнитивным дефицитом при болезни Паркинсона [52].
Цель данной статьи – исследование взаимосвязи изменений контрастной чувствительности зрительной системы и когнитивных нарушений при шизофрении и эндогенной депрессии.
Учитывая взаимопроникновение процессов переработки когнитивной информации, нами была предпринята попытка описания связей психофизиологических показателей визуального восприятия с характеристиками “сквозных” процессов (памяти, внимания) и мышления, что позволяет продвинуться в понимании биологических основ особенностей когнитивного функционирования при шизофрении и депрессии.
МЕТОДИКА
Исследование было выполнено на базе отделений СПб ГБУЗ “Психиатрическая больница № 1 им. П.П. Кащенко” (г. Санкт-Петербург). В исследовании принимали участие: 30 психически здоровых, 68 пациентов с диагнозом параноидная шизофрения и 25 пациентов с диагнозом эндогенная депрессия, установленными в соответствии с диагностическими критериями МКБ-10. Средний возраст участников исследования составил: в группе здоровых – 34.0 ± 12.5 лет, больных шизофренией – 36.0 ± 12.0 лет, с диагнозом депрессия – 38.0 ± 13.6 лет.
Все участвовавшие в исследовании пациенты находились в состоянии медикаментозной ремиссии, принимали лекарственную терапию, не имели выраженного интеллектуального снижения. Острота зрения испытуемых соответствовала норме или была скорректирована до нормы. Критериями включения в исследование были: возраст от 18 до 55 лет, отсутствие тяжелых хронических заболеваний (сердечно-сосудистых заболеваний, туберкулеза, диабета, офтальмопатологий), алкогольной и наркотической зависимости.
Регистрировали контрастную чувствительность зрительной системы с помощью компьютерной программы, разработанной С.В. Прониным в Институте физиологии им. И.П. Павлова РАН (г. Санкт-Петербург), позволяющей формировать тестовые изображения на мониторе любого типа без предварительной его калибровки. Для передачи яркостного профиля тестовых изображений в ней использовали вариации плотности белых точек, случайно расположенных на черном фоне. Для измерения порогового контраста в программе использовали адаптивную “лестничную” процедуру (adaptive staircase procedure). Измерение начинали с контраста 0.5, при котором трижды выполняли измерение видимости. В случае, если испытуемый три раза давал правильный ответ, в какой половине экрана демонстрировали изображение – программа снижала контраст на 20%. Если была сделана хотя бы одна ошибка, контраст повышался на 20%. Далее этот цикл повторяли с шагом изменения контраста 20%. В результате контраст тестового изображения постепенно понижали до порогового уровня, при котором испытуемый с вероятностью 0.5 делал хотя бы одну ошибку. Измерение завершали, когда значение контраста совершало заданное число таких колебаний – “реверсий”. В настоящем исследовании количество реверсий для каждой тестовой пространственной частоты равнялось 8. Порог вычисляли программно, как среднее значение контрастов в точках “реверсий”, он равнялся значению контраста, при котором испытуемый дал правильный ответ с вероятностью p = = 0.794 (так как вероятность трех правильных ответов подряд равна p × p × p = 0.5, то p = 3√0.5 ≈ ≈ 0.794).
Стимулы предъявляли на экране монитора ноутбука (Toshiba Satellite A200-1M8; Intel® Core™2 Duo – T7100 1800 MГц/1024 Мб; дисплей 15.4″ TFT WXGA активная матрица повышенной яркости Toshiba TruBrite, при разрешении 1024 × × 600 пикселей, частоте обновления 60 Гц, Япония). В качестве стимулов использовали элементы Габора с пространственной частотой 0.4, 0.6, 1.0, 4.0 и 10.0 цикл/град, которые в случайном порядке выводили слева или справа от центра экрана (рис. 1).
Задача испытуемого состояла в том, чтобы нажать на правую кнопку мыши, если он видит изображение справа, левую кнопку – если слева. Выбор просили делать и тогда, когда испытуемый не был уверен, что видит тестовое изображение. После объяснения инструкции в ходе пробной серии убеждались в том, что испытуемый понял задание и приступали к процедуре исследования. При анализе полученных данных к низким пространственным частотам относили частоты – 0.4, 0.6, цикл/град, средним 1.0 и 4.0 цикл/град, к высоким – 10 цикл/град.
Испытуемый находился на расстоянии 1.5 м от монитора, уровень его взора примерно соответствовал середине экрана, положение головы фиксировали с помощью лицевого упора. Наблюдение осуществляли бинокулярно. Измерения проводили в темноте, источником освещения был только экран монитора.
Для исследования когнитивных функций использовали методы патопсихологической диагностики: методики “Исключение 4-го лишнего” и “Сравнение понятий” [53] – для оценки способности осуществлять операции анализа и синтеза, обобщения, абстрагирования, умение выделять главные, существенные признаки предмета или понятия на образном уровне; “Тест заучивание 10 слов” [53] и тест беглости речевых ответов (Verbal fluency test, VFT) [54] – для оценки характеристик кратковременной и долговременной памяти; методика последовательности соединений “ТМТ” (TMT, Trail making test) [55], где субтест А – оценка пространственной ориентации, моторной координации, особенностей темпа психической деятельности, субтест Б – управляющих функций, переключения внимания, рабочей памяти; “фигуры Поппельрейтера” [53] позволили оценить зрительный гнозис, способность выделить фигуру из фона; методика “Недорисованные изображения” [53] для оценки константности восприятия, сохранности зрительного образа объекта, наличия фрагментарности восприятия.
Расчет математико-статистических данных выполняли в программе STATISTICA 10 с использованием критерия Манна-Уитни, корреляционного анализа по Спирмену и регрессионного анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ данных контрастной чувствительности показал следующее. Контрастная чувствительность в группе психически здоровых испытуемых в диапазоне низких пространственных частот составила 17.8 ± 5.3, средних частот – 21.4 ± 8.1, высоких пространственных частот – 7.9 ± 4.6 (рис. 2); в группе лиц, страдающих депрессией, соответственно, 14.9 ± 4.2, 16.8 ± 4.8 и 4.6 ± 3.2; при шизофрении – в диапазоне низких пространственных частот контрастная чувствительность составила 12.06 ± 5.3, средних частот – 12.6 ± 5.5, высоких пространственных частот – 4.2 ± 2.9. Сравнительный статистический анализ показателей свидетельствует о достоверном снижении при депрессии чувствительности в диапазоне средних (р = 0.01) и высоких пространственных частот (р = 0.05), по сравнению с группой условно здоровых. При шизофрении, относительно здорового контроля, снижение контрастной чувствительности наблюдается во всех исследуемых диапазонах пространственных частот (р = 0.01). Между собой больные шизофренией и депрессией отличались контрастной чувствительностью в диапазоне низких (р = 0.03) и средних пространственных частот (р = 0.005).
Рис. 2.
Контрастная чувствительность в разных диапазонах пространственных частот у здоровых и при психопатологии. Контрастная чувствительность – величина, обратная пороговому значению контраста, а – здоровые испытуемые, б – больные депрессией, в – больные шизофренией. Вертикальные линии у каждой точки – величина относительной ошибки.
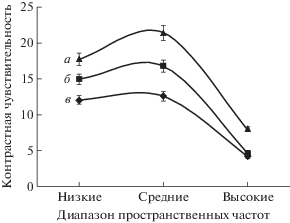
Таким образом, результаты исследования свидетельствуют о рассогласовании в работе магно- и парвоцеллюлярной систем при психопатологии и разном характере этого рассогласования при шизофрении и депрессии. При депрессии характер рассогласования отличается снижением активности парвоцеллюлярной системы при сохранении уровня активности магносистемы. Другими словами, отмечается смещение баланса в их взаимодействии в сторону активности магноцеллюлярной системы.
Мерой рассогласования в работе исследуемых нейронных систем рассматривается контрастная чувствительность в диапазоне средних пространственных частот, которые обрабатываются обеими нейронными системами [17, 21–24]. При шизофрении контрастная чувствительность в диапазоне средних пространственных частот достоверно ниже, чем при депрессии. Таким образом, степень рассогласования в работе магноцеллюлярной и парвоцеллюлярной нейронных систем при шизофрении более выражена, чем при эндогенной депрессии, что связано преимущественно с изменением функционального состояния магноцеллюлярной системы.
Результаты анализа показателей когнитивных функций у пациентов с шизофрений и пациентов с депрессией представлены в табл. 1. Из табл. 1 видно, что наблюдается значительное количество различий между группами. Статистически значимые различия связаны с процессом запоминания (3, 4 и 5 предъявления). При шизофрении сохранение материала происходит значительно хуже, чем в случае депрессии. Снижен и показатель роста запоминания слов. Таким образом, у пациентов, страдающих шизофренией, кривая запоминания неустойчива, тогда как у больных депрессией сохранение следов памяти имеет вид неубывающей функции (рис. 3). Подобные различия можно объяснить мотивационными искажениями и нарушениями процесса селективности внимания при шизофрении.
Таблица 1.
Сравнительный анализ показателей памяти, внимания и восприятия больных шизофренией и пациентов с депрессией
| Показатель | Шизофрения | Депрессия | Значение U-критерия | Z-преобразованный критерий | Уровень значимости различий, р |
|---|---|---|---|---|---|
| Методика “10 слов” | |||||
| 1 предъявление | 4.85 | 5.40 | 258.00 | –1.15 | 0.25 |
| 2 предъявление | 6.44 | 7.00 | 277.50 | –0.82 | 0.41 |
| 3 предъявление | 7.05 | 8.70 | 165.50 | –2.54 | 0.01 |
| 4 предъявление | 7.40 | 9.00 | 134.00 | –2.85 | <0.001 |
| 5 предъявление | 7.50 | 9.40 | 116.00 | –3.07 | <0.001 |
| 6 ретенция | 4.69 | 9.00 | 40.00 | –4.47 | <0.001 |
| Конфабуляции | 2.88 | 0.10 | 102.00 | 3.58 | <0.001 |
| Показатель роста запоминания слов | 0.66 | 0.86 | 99.00 | –2.16 | 0.03 |
| Среднее по 5 пробам | 6.31 | 7.90 | 127.00 | –3.13 | <0.001 |
| Методика ТМТ (внимание) | |||||
| Время, с. А | 52.68 | 33.17 | 165.00 | 2.54 | 0.01 |
| Кол-во ошибок | 1.55 | 0.00 | 190.00 | 2.45 | 0.01 |
| Время, с. Б | 140.26 | 128.40 | 295.00 | 0.54 | 0.59 |
| Восприятие (Фигуры Поппельрейтера) | |||||
| Кол-во узнанных изображений | 9.26 | 10.00 | 155.00 | –2.95 | <0.001 |
| Кол-во неузнанных изображений | 0.09 | 0.00 | 315.00 | 0.56 | 0.58 |
| Искажение (кол-во) | 0.69 | 0.00 | 160.00 | 2.88 | <0.001 |
| Методика “Неоконченные изображения” | |||||
| Кол-во узнанных изображений | 9.54 | 9.60 | 323.50 | 0.02 | 0.98 |
| Кол-во неузнанных изображений | 1.78 | 1.60 | 324.00 | –0.02 | 0.99 |
| Искажение в восприятии (кол-во) | 1.57 | 0.80 | 220.00 | 1.69 | 0.09 |
| Методика БРО | |||||
| Семантическая память | 11.02 | 40.70 | 0.00 | –5.07 | <0.0001 |
| Фонематическая память | 7.83 | 30.20 | 7.00 | –4.97 | <0.0001 |
Рис. 3.
Сравнительный анализ показателей методики “10 слов” у больных шизофренией и больных с эндогенной депрессией. а – больные шизофренией, б – больные депрессией. Вертикальные линии у каждой точки – величина относительной ошибки.
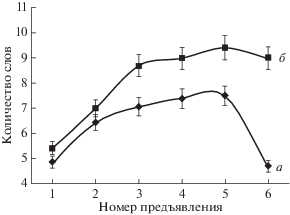
Следует обратить внимание и тот факт, что конфабуляции (замещения одного слова другим) достоверно чаще встречаются у пациентов, страдающих шизофренией, чем депрессией.
Показатель количества конфабуляций связан с селективностью внимания. Различия между группами наблюдаются не только в процессе запоминания, но и в длительности сохранения информации, о чем свидетельствует показатель ретенции. Значения показателей долговременной памяти у больных депрессией укладываются в пределы нормы. Таким образом, можно заключить, что у пациентов с шизофренией наблюдается снижение эффективности и скорости запоминания, неустойчивость мнестических процессов, нарушения селективности внимания.
Результаты диагностики внимания с помощью методики ТМТ свидетельствуют о том, что скорость аттентивных процессов находится в пределах нормы в обеих группах (табл. 1). Однако у больных шизофренией достоверно снижены устойчивость внимания и эффективность работы, нежели при депрессии. Пациенты, страдающие шизофренией, часто совершали 1–2 ошибки, тогда как пациенты с депрессией выполняли задание безошибочно. То есть при шизофрении наблюдается достоверно более выраженное снижение концентрации внимания, чем при депрессии. Переключаемость внимания при шизофрении снижена статистически более значимо. Здесь можно наблюдать незавершенное переключение, которое связано с высокой отвлекаемостью, которая проявляется в снижении темпа работы и увеличении количества ошибок.
При выполнении задания методики “Фигуры Поппельрейтера” пациенты, страдающие депрессией, распознают все фигуры и не совершают ошибок, т.е. зрительный гнозис соответствует норме (табл. 1). Тогда как при шизофрении наблюдается искажение образов, спутанность. Можно предположить, что это связано со сложностью сравнения образа с эталоном, который извлекается из памяти в связи с перцептивным опытом. Поскольку здесь нарушаются такие свойства перцепта, как категориальность и апперцептивность, данные свойства связаны с процессами памяти и мышления.
Показатели семантической и фонематической памяти по результатам методики “Быстрота речевых ответов” достоверно различались в обеих группах (табл. 1). Семантическая память пациентов с депрессией соответствует нормативным значениям, тогда как у пациентов с шизофренией значительно снижена. Однако фонематическая память снижена в обеих группах, только при шизофрении трудности достоверно более выражены.
Сравнительный анализ состояния мыслительной функции у больных с эндогенной депрессией и больных шизофренией выявил ряд существенных различий, представленных в табл. 2. Отмечается снижение относительно нормативных показателей уровня обобщения в обеих группах, однако на невербальном стимульном материале больные шизофренией достоверно чаще обнаруживают недостаточность процесса обобщения в виде обобщения на конкретно-ситуативном и предметно-ситуативном уровне. На вербальном стимульном материале больные шизофренией достоверно чаще производят обобщения на формальном уровне, чем больные эндогенной депрессией.
Таблица 2.
Сравнительный анализ показателей мышления больных шизофренией и пациентов с депрессией
| Показатель | Депрессия | Шизофрения | Значение U-критерия | Z-преобразованный критерий | Уровень значимости различий, р |
|---|---|---|---|---|---|
| Методика “Исключение предметов” | |||||
| Уровень обобщения | 57.47 | 60.52 | 376.5 | –2.43 | 0.01 |
| Искажения | 2.11 | 3.49 | 383.5 | –2.35 | 0.01 |
| Мотивационные нарушения | 1.16 | 13.49 | 308 | –3.18 | 0.001 |
| Субъективизм | 1.00 | 0.92 | 506.5 | 1.00 | 0.31 |
| Методика “Сравнение понятий” | |||||
| Уровень обобщения | 42.95 | 46.32 | 474.50 | 1.27 | 0.20 |
| Искажения | 4.08 | 2.84 | 434.00 | –1.72 | 0.09 |
| Мотивационные нарушения | 4.08 | 1.37 | 488.00 | –1.12 | 0.26 |
| Субъективизм | 0.35 | 0.95 | 360.50 | 2.54 | 0.01 |
На вербальном и невербальном стимульном материале больные шизофренией достоверно чаще обнаруживают случаи искажения процесса обобщения по типу актуализации латентных признаков, а также проявляют снижение мотивационно-личностного компонента мышления, по сравнению с больными эндогенной депрессией. Случаи обобщения по неадекватному признаку были выявлены только в группе больных шизофренией. В целом можно заключить, что скорость обработки информации, извлечение из долговременной памяти, свойство категоризации (восприятия, памяти и мышления) значительно более нарушено при шизофрении.
Корреляционный анализ контрастной чувствительности в разных диапазонах пространственных частот как физиологических показателей функционального состояния магно- и парвоцеллюлярной систем и психологических параметров исследования процессов памяти, восприятия, внимания и мышления показал следующее. Наибольшее количество корреляций характеристик памяти установлено с контрастной чувствительностью в диапазоне низких пространственных частот (рис. 4).
Рис. 4.
Корреляционная плеяда физиологических показателей с характеристиками памяти. 1 – 1 предъявление, 2 – 4 предъявление, 3 – 5 предъявление, 4 – ретенция, 5 – среднее по пяти пробам, 13 – контрастная чувствительность в диапазоне низких пространственных частот (магносистема), 14 – контрастная чувствительность в диапазоне средних пространственных частот, 15 – контрастная чувствительность в диапазоне высоких пространственных частот (парвосистема).
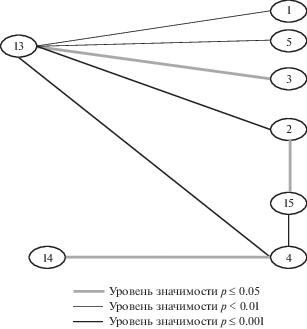
Показатель долговременной памяти (ретенция) имеет выраженные корреляции с контрастной чувствительностью как в диапазоне низких, так и высоких пространственных частот. Участие обеих систем в процессах памяти и важность согласованности их взаимодействия отражается во взаимосвязи показателя долговременной памяти с контрастной чувствительностью в диапазоне средних пространственных частот.
Результаты регрессионного анализа подтверждают результаты корреляционного анализа и свидетельствуют о высоком коэффициенте детерминации показателей памяти контрастной чувствительностью в диапазоне низких и высоких пространственных частот (табл. 3). При этом наибольший вклад в эффективность отсроченного воспроизведения вносит контрастная чувствительность в диапазоне высоких пространственных частот, связанная с работой парвоцеллюлярной системы. Кратковременная память в большей степени детерминирована контрастной чувствительностью в диапазоне низких пространственных частот, к восприятию которых наиболее специфична магноцеллюлярная система.
Таблица 3.
Результаты регрессионного анализа зависимости показателей памяти и контрастной чувствительности
| Уравнение множественной регрессии | F-критерий | Коэффициент детерминации (R2) | |
|---|---|---|---|
| Ретенция (долговременная память) | 0.25 | F(3,37) = 8.2581 p < 0.00025 |
54% |
| Низкие частоты | + 0.40** | ||
| Высокие частоты | + 0.16 | ||
| Помехоустойчивость | – 4.16 | ||
| Кратковременная память (предъявление слов) | 0.53** | F(4,34) = 4.5655 p < 0.005 |
35% |
| Низкие частоты | + 0.29 | ||
| Высокие частоты | + 0.14 | ||
| Помехоустойчивость | + 4.8 | ||
Корреляционный анализ контрастной чувствительности в разных диапазонах пространственных частот и характеристик восприятия и внимания свидетельствует о выраженной прямой зависимости между контрастной чувствительностью в диапазоне низких, средних и высоких пространственных частот с количеством правильно достроенных образов в методике “Незавершенные изображения” и, соответственно, обратной зависимости с количеством неверно достроенных образов (рис. 5).
Рис. 5.
Корреляционная плеяда физиологических показателей с характеристиками восприятия и внимания. 9 – Количество узнанных изображений (фигуры Поппельрейтера), 10 – количество узнанных изображений (Незавершенные изображения), 11 – количество неузнанных изображений (Незавершенные изображения), 13 – контрастная чувствительность в диапазоне низких пространственных частот (магносистема), 14 – контрастная чувствительность в диапазоне средних пространственных частот (взаимодействие обеих систем), 15 – контрастная чувствительность в диапазоне высоких пространственных частот (парвосистема).
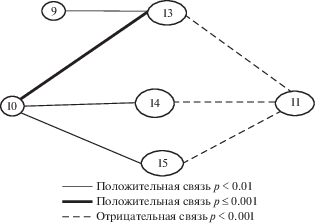
Кроме того, относительно контрастной чувствительности в диапазоне низких пространственных частот показана выраженная прямая зависимость с количеством узнанных изображений в методике “Фигуры Поппельрейтера”. Полученные результаты свидетельствуют о роли каждой из нейронных систем и их взаимодействия в задаче достраивания образа и обеспечении целостного восприятия.
На заключительном этапе был проведен анализ взаимосвязей физиологических показателей с характеристиками мышления. Установлена прямая корреляционная связь между параметром “уровень обобщения” (абстрагирования и категоризации) и контрастной чувствительностью во всех диапазонах пространственных частот (рис. 6). Отрицательная связь отмечена между параметром “искажение процесса обобщения” по методике “Исключение 4-го лишнего”, отражающего процесс анализа и селекции существенных, релевантных признаков предметов и явлений при формировании суждений, и контрастной чувствительностью в диапазоне средних и высоких пространственных частот. Таким образом, согласованность в работе магноцеллюлярной и парвоцеллюлярной нейронных систем обеспечивает эффективность процессов абстрагирования и категоризации.
Рис. 6.
Корреляционная плеяда физиологических показателей с параметрами уровня обобщения характеристик мышления. 1 – Контрастная чувствительность в диапазоне низких пространственных частот, 2 – контрастная чувствительность в диапазоне средних пространственных частот, 3 – контрастная чувствительность в диапазоне высоких пространственных частот, 5 – уровень обобщения, 6 – искажения процесса обобщения.
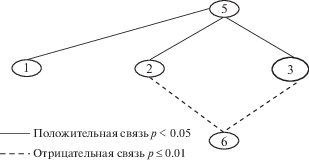
Установлена прямая корреляционная связь между показателем контрастной чувствительности в диапазоне низких и средних пространственных частот и с такими показателями мышления, как “Снижение мотивационного компонента мышления” и “Обобщение по формальному признаку”. Показатель контрастной чувствительности в диапазоне высоких пространственных частот, свидетельствующий об уровне активности парвоцеллюлярной нейронной системы, имеет обратную корреляционную связь с показателем “обобщение по латентному и неадекватному признакам”. То есть, чем выше уровень активности парвоцеллюлярной системы, тем меньше актуализации латентных признаков допускает пациент. Активность парвоцеллюлярной системы также отрицательно коррелирует с количеством нарушений мышления, что свидетельствует о вкладе системы в целенаправленный, упорядоченный, детализированный и последовательный анализ, отбор признаков при решении задач.
Результаты исследования также свидетельствуют о том, что использование методики “Исключение 4-го лишнего” (невербальный стимульный материал) является более информативным с точки зрения анализа особенностей мышления во взаимосвязи с нейронными системами зрительного восприятия, чем использование методики “Сравнение понятий” (вербальный тест).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании было обнаружено рассогласование во взаимодействии магно- и парвоцеллюлярной нейронных систем, как при шизофрении, так и при депрессии. Однако характер рассогласования имеет определенную специфику. При депрессии наблюдается выраженное снижение активности парвоцеллюлярной системы, тогда как активность магноцеллюлярной системы остается относительно сохранной, достоверно не отличается от нормы. В результате баланс во взаимодействии двух нейронных систем смещается в сторону доминирования магносистемы, которая формирует дорзальный поток, обеспечивает периферическое зрение, зрительно-пространственное восприятие, предвнимание, анализ движения, восприятие контуров и др. [42, 46, 49–51]. При шизофрении наблюдается снижение чувствительности обеих систем и более выраженное, чем при депрессии повышение уровня внутреннего шума зрительной системы, о чем свидетельствует снижение контрастной чувствительности в диапазоне средних пространственных частот. Восприятие этих частот обеспечивается в результате взаимодействия магно- и парвоцеллюлярной систем, поэтому выраженность снижения чувствительности в данном диапазоне пространственных частот рассматривается нами, как свидетельство степени рассогласования систем [17, 21–24].
Исходя из представлений D. Hubel и T. Wiesel о магноцеллюлярной и парвоцеллюлярной нейронных системах [34], теории многоканальной организации системы зрительного восприятия и пространственно-частотной фильтрации информации [35, 36], согласованной фильтрации [56], зрительное восприятие обеспечивается в результате взаимодействия двух основных механизмов – глобального и локального анализа информации [17, 57–59]. Названные механизмы представляют собой и рассматриваются нами, как частный случай работы магно- и парвоцеллюлярной нейронных систем, формирующих дорзальный и вентральный потоки информации из каудальных во фронтальные зоны коры головного мозга. С точки зрения теории двух потоков, предложенной М. Goodale и А. Milner [60, 61], это система “где” для действия и система “что” для восприятия формы и деталей объекта. Вентральный поток, проходящий от первичной зрительной коры (V1) к нижним частям височной доли, опосредует преобразование содержимого визуального сигнала в ментальную модель, которая направляет память, распознавание и сознательное восприятие [61]. По сути, механизм глобального анализа обеспечивает анализ информации от общего к частному, тогда как локального анализа – от частного к общему [17]. Механизм глобального анализа обеспечивает восприятие статистических характеристик изображения, контуров, тогда как локального анализа – восприятие границ и деталей объекта. Взаимодействие этих механизмов на разных уровнях анализа информации обеспечивает целостность зрительного восприятия, благодаря которому мозг имеет возможность строить более объективную внутреннюю картину внешнего мира, определяющую особенности поведения.
В соответствии с полученными нами данными при депрессии и шизофрении происходит нарушение процессов зрительного восприятия в результате рассогласования взаимодействия магно- и парвоцеллюлярной систем, соответственно, механизмов глобального и локального анализа. При этом изменения фильтрации информации на ранних уровнях восприятия и взаимодействия этих систем, и механизмов приводят к нарушениям более высокоуровневых познавательных процессов и мышления. Характер рассогласования определяет особенности когнитивных нарушений наблюдающихся при депрессии и шизофрении и может служить маркером дифференциальной диагностики.
Установлено, что все показатели памяти, включая отсроченное воспроизведение, имеют выраженную прямую корреляционную связь с контрастной чувствительностью в диапазоне низких пространственных частот, к которым специфична магноцеллюлярная нейронная система, обеспечивающая глобальный механизм анализа зрительного поля [17]. При этом отсроченное воспроизведение, как параметр долговременной памяти, имеет выраженную корреляционную связь с контрастной чувствительностью в диапазоне высоких пространственных частот, к которым специфична парвоцеллюлярная нейронная система, обеспечивающая локальный (детальный) анализ зрительного поля [17]. Таким образом, получены свидетельства участия обеих систем в обеспечении функции памяти, при этом с определенным вкладом каждой из систем.
Полученные данные свидетельствуют также о роли каждой из нейронных систем и их взаимодействия в задаче достраивания образа и обеспечении целостного восприятия, извлечении фигуры из фона. Показано участие, как магно-, так и парвоцеллюлярной систем (глобального и локального анализа) в осуществлении процессов мышления (абстрагирования и категоризации), роли парвоцеллюлярной системы (локального анализа) в оценке и отборе существенной информации, что является основой построения полноценной и реалистичной картины мира, планирования и регуляции социального поведения и выбора адекватных стратегий поведения в ситуациях социального взаимодействия.
Результаты исследования согласуются с данными литературы о нарушениях зрительного восприятия и когнитивных функций при шизофрении и депрессии [26, 62, 63]. Контрастная чувствительность в диапазоне низких пространственных частот значительно снижена и при выраженной шизотипии у лиц с высокими баллами по субшкалам O-Life необычных переживаний и когнитивной дезорганизации [64]. Снижение контрастной чувствительности имеет место даже при отсутствии заметного ухудшения остроты зрения [65], что обеспечивает чувствительную клиническую оценку зрительной функции и может выявить аномалии обработки зрительной информации на уровне сетчатки, а также в корковых и подкорковых зрительных путях [9, 10, 66].
Таким образом, исследования нарушений зрительных функций, в частности контрастной чувствительности, важны, так как могут быть обнаружены на самых ранних этапах заболевания, служить маркерами эндофенотипа, признака или эпизода, в зависимости от типа аномалии [9–13, 17, 18, 20–23, 26, 29, 30, 66, 67].
ЗАКЛЮЧЕНИЕ
Дисфункции внимания, познания и исполнительного контроля неоднократно показаны при шизофрении, депрессии и других расстройствах, однако объяснения этих особенностей с точки зрения функционального состояния магно- и парвоцеллюлярной систем, механизмов глобального и локального анализа и характера их взаимодействия при психопатологии прежде предпринято не было. Полученные данные свидетельствуют об особенностях нейрокогнитивной дисфункции при шизофрении и депрессии, позволяют объяснить особенности когнитивного функционирования с точки зрения механизмов зрительного восприятия.
Результаты исследования могут быть использованы для изучения вклада дефицита контрастной чувствительности в когнитивные функции более высокого уровня и функциональные нарушения при шизофрении, депрессии и других расстройствах, разработки технологии объективной диагностики нарушений мышления и восприятия, развития направления сенсорной реабилитации.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Первого Санкт-Петербургского медицинского университета им. И.П. Павлова (Санкт-Петербург).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при поддержке РФФИ (грант № 18-013-01245).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Fischer B.A. A review of American psychiatry through its diagnoses: the history and development of the diagnostic and statistical manual of mental disorders // J. Nerv. Ment. Dis. 2012. V. 200. № 12. P. 1022.
Lee R.S., Hermens D.F., Naismith S.L. et al. Neuropsychological and functional outcomes in recent-onset major depression, bipolar disorder and schizophrenia-spectrum disorders: a longitudinal cohort study // Transl. Psychiatry. 2015. V. 5. № 4. P. e555.
Goodkind M., Eickhoff S.B., Oathes D.J. et al. Identification of a common neurobiological substrate for mental illness // JAMA Psychiatry. 2015. V. 72. № 4. P. 305.
Zhu Y., Womer F.Y., Leng H. et al. The Relationship between Cognitive Dysfunction and Symptom Dimensions across Schizophrenia, Bipolar Disorder, and Major Depressive Disorder // Front. Psychiatry. 2019. V. 10. P. 253.
Bakkour N., Samp J., Akhras K. et al. Systematic review of appropriate cognitive assessment instruments used in clinical trials of schizophrenia, major depressive disorder and bipolar disorder // Psychiatry Res. 2014. V. 216. № 3. P. 291.
Barch D.M. Neuropsychological abnormalities in schizophrenia and major mood disorders: similarities and differences // Curr. Psychiatry Rep. 2009. V. 11. № 4. P. 313.
Polo V., Rodrigo M.J., Garcia-Martin E. et al. Visual dysfunction and its correlation with retinal changes in patients with Alzheimer’s disease // Eye (Lond). 2017. V. 31. № 7. P. 1034.
Feitosa-Santana C., Costa M.F., Ferraz H.B. et al. Visual losses in early-onset and late-onset Parkinson’s disease // J. Opt. Soc. Am. 2020. V. 37. № 5. P. A285.
Jurišiü D., Ûavar I., Sesar A. et al. New insights into schizophrenia: a look at the eye and related structures // Psychiatria Danubina. 2020. V. 32. № 1. P. 60.
Silverstein S.M., Keane B.P., Demmin D.L., Fradkin S.I. Visual impairments in schizophrenia: their significance and unrealized clinical potential // Psychiatria Danubina. 2020a. V. 32. № 1. P. 72.
Friedel E., Bach M., van Elst T. et al. Retinal dysfunction of contrast processing in depressive disorder // Pharmacopsychiatry. 2017. V. 50. № 5. P. 213.
Butler P.D., Silverstein S.M., Dakin S.C. Visual perception and its impairment in schizophrenia // Biol. Psychiatry. 2008. V. 64. № 1. P. 40.
Silverstein S.M., Keane B.P., Papathomas T.V. et al. Processing of spatial-frequency altered faces in schizophrenia: Effects of illness phase and duration // PLoS One. 2014. V. 9. № 12. P. e114642.
Silverstein S.M., Keane B.P. Perceptual organization impairment in schizophrenia and associated brain mechanisms: review of research from 2005 to 2010 // Schizophr. Bull. 2011. V. 37. № 4. P. 690.
Silverstein S.M., Keane B.P., Barch D.M. et al. Optimization and validation of a visual integration test for schizophrenia research // Schizophr. Bull. 2012. V. 38. № 1. P. 125.
Keane B.P., Silverstein S.M., Wang Y., Papathomas T.V. Reduced depth inversion illusions in schizophrenia are state-specific and occur for multiple object types and viewing conditions // J. Abnorm. Psychol. 2013. V. 122. № 2. P. 506.
Шошина И.И., Шелепин Ю.Е. Механизмы глобального и локального анализа зрительной информации при шизофрении. СПб.: Изд-во ВВМ, 2016. 300 с.
Keane B.P., Cruz L.N., Paterno D., Silverstein S.M. Self reported visual perceptual abnormalities are strongly associated with core clinical features in psychotic disorders // Front. Psychiatry. 2018. V. 9. P. 69.
Kogata T., Iidaka T. A review of impaired visual processing and the daily visual world in patients with schizophrenia // Nagoya J. Med. Sci. 2018. V. 80. № 3. P. 317.
Silverstein S.M., Seitz A.R., Ahmed A.O. et al. Development and Evaluation of a Visual Remediation Intervention for People with Schizophrenia // J. Psychiatr. Brain Sci. 2020. V. 5. https://doi.org/10.20900/jpbs.20200017
Шошина И.И., Шелепин Ю.Е., Вершинина Е.А., Новикова К.О. Пространственно-частотная характеристика зрительной системы при шизофрении // Физиология человека. 2015. Т. 41. № 3. С. 29. Shoshina I.I., Shelepin Y.E., Vershinina E.A., Novikova K.O. The spatial-frequency characteristics of the visual system in schizophrenia // Human Physiology. 2015. V. 41. № 3. P. 251.
Шошина И.И., Шелепин Ю.Е., Семенова Н.Б. Контрастно-частотная чувствительность у больных шизофренией при терапии атипичными и типичными нейролептиками // Физиология человека. 2014. Т. 40. № 1. С. 43. Shoshina I.I., Shelepin Yu.E., Semenova N.B. Frequency-contrast sensitivity of visual stimulus perception in patients with schizophrenia treated with atypical and typical antipsychotics // Human Physiology. 2014. V. 40. № 1. P. 35.
Шошина И.И., Шелепин Ю.Е. Контрастная чувствительность у больных шизофренией с разной длительностью заболевания // Рос. физиол. журн. им. И.М. Сеченова. 2013. Т. 99. № 8. С. 928. Shoshina I.I., Shelepin Y.E. Contrast Sensitivity in Patients with Schizophrenia of Different Durations of Illness // Neurosci. Behav. Physi. 2015. V. 45. № 5. P. 512.
Шошина И.И., Шелепин Ю.Е., Конкина С.А. и др. Исследование парвоцеллюлярных и магноцеллюлярных зрительных каналов в норме и при психопатологии // Рос. физиол. журн. им. И.М. Сеченова. 2012. Т. 98. № 5. С. 657. Shoshina I.I., Shelepin Y.E., Konkina S.A. et al. Studies of the Parvocellular and Magnocellular Visual Channels in Health and Psychopathology // Neurosci. Behav. Physi. 2014. V. 44. № 2. P. 244.
Shoshina I., Isajeva E., Mukhitova Y. et al. The internal noise of the visual system and cognitive functions in schizophrenia // Procedia Computer Science. 2020. V. 169. P. 813.
Fam J., Rush A.J., Haaland B. et al. Visual contrast sensitivity in major depressive disorder // J. Psychosom. Res. 2013. V. 75. № 1. P. 83.
Bubl E., Tebartz van E., Gondan M. et al. Vision in depressive disorder // World J. Biol. Psychiatry. 2009. V. 10. № 4. P. 377.
Bubl E., Kern E., Ebert D. et al. Seeing gray when feeling blue? Depression can be measured in the eye of the diseased // Biol. Psychiatry. 2010. V. 68. № 2. P. 205.
Bubl E., Ebert D., Kern E. et al. Effect of antidepressive therapy on retinal contrast processing in depressive disorder // British J. Psychiatry. 2012. V. 201. № 2. P. 151.
Bubl E., Kern E., Ebert D. et al. Retinal dysfunction of contrast processing in major depression also apparent in cortical activity // Eur. Arch. Psychiatry Clin. Neurosci. 2015. V. 265. № 4. P. 343.
Revheim N., Corcoran C.M., Dias E. et al. Reading deficits in schizophrenia and individuals at high clinical risk: relationship to sensory function, course of illness, and psychosocial outcome // Am. J. Psychiatry. 2014. V. 171. № 9. P. 949.
Graticelli C.P.B., Abe R.Y., Diniz-Filho A. et al. Ophthalmology issues in schizophrenia // Curr. Psychiatry Rep. 2015. V. 17. № 5. P. 28.
Zemon V., Herrera S., Gordon J. et al. Contrast Sensitivity Deficits in Schizophrenia: A Psychophysical Investigation // Eur. J. Neurosci. 2021. V. 53. № 4. P. 1155.
Hubel D.H., Wiesel T.N. Laminar and columnar distribution of geniculo-cortical fibers in the macaque monkey // J. Comp. Neurol. 1972. V. 146. № 4. P. 421.
Campbell F.W., Robson J.G. Application of Fourier Analyses to the Visibility of Gratings // J. Physiol. 1968. V. 197. № 3. P. 551.
Blakemore C., Campbell F. On the existence of neurons in the human visual system selectivity sensitive to the orientation and size of retinal images // J. Physiol. 1969. V. 203. № 1. P. 237.
de Haan E.H.F., Jackson S.R., Schenk T. Where are we now with ‘What’ and ‘How’? // Cortex. 2018. V. 98. P. 1.
Freud E., Behrmann M., Snow J.C. What Does Dorsal Cortex Contribute to Perception? // Open Mind (Camb). 2020. V. 4. P. 40.
Croner L.J., Kaplan E. Receptive fields of P and M ganglion cells across the primate retina // Vision Res. 1995. V. 35. № 1. P. 7.
Nassi J.J., Callaway E.M. Parallel Processing Strategies of the Primate Visual System // Nat. Rev. Neurosci. 2009. V. 10. № 5. P. 360.
Merigan W.H., Katz L.M., Maunsell J.H. The effects of parvocellular lateral geniculate lesions on the acuity and contrast sensitivity of macaque monkeys // J. Neurosci. 1991. V. 11. № 4. P. 994.
Kaplan E., Shapley R.M. The primate retina contains two types of ganglion cells, with high and low contrast sensitivity // Proc. Natl. Acad. Sci. U.S.A. 1986. V. 83. № 8. P. 2755.
Ungerleider L.G., Mishkin M. Two cortical visual systems / Analysis of visual behavior // Eds. Ingle D.J., Goodale M.A., Mansfield R.J.W. Cambridge: MIT Press, 1982. P. 549.
Shapley R. Visual sensitivity and parallel retinocortical channels // Annu Rev. Psychol. 1990. V. 41. P. 635.
Maunsell J.H.R., Nealey T.A., DePriest D.D. Magnocellular and parvocellular contributions to responses in the middle temporal visual area (MT) of the macaque monkey // J. Neuroscience. 1990. V. 10. № 4. P. 3323.
Merigan W.H., Maunsell J.H.R. How parallel are the primate visual pathways? // Annu. Rev. Neurosci. 1993. V. 16. P. 369.
Perry V.H., Oehler R., Cowey A. Retinal ganglion cells that project to the dorsal lateral geniculate nucleus in the macaque monkey // Neurosci. 1984. V. 12. № 4. P. 1101.
Saron C.D., Schroeder C.E., Foxe J.J., Vaughan H.G. Visual activation of frontal cortex: segregation from occipital activity // Cogn. Brain Res. 2001. V. 12. № 1. P. 75.
Keґi S., Antal A., Szekeres G., Benedek G., Janka Z. Spatiotemporal visual processing in schizophrenia // J. Neuropsychiatry Clin. Neurosci. 2002. V. 14. № 2. P. 190.
De Souza J.F.X., Dukelow S.P., Gati J.S. et al. Eye position signal modulates a human parietal pointing region during memory-guided movements // J. Neurosci. 2000. V. 20. № 15. P. 5835.
Calderone D.J., Hoptman M.J., Martinez A. et al. Contributions of low and high spatial frequency processing to impaired object recognition circuitry in schizophrenia // Cereb. Cortex. 2013. V. 23. № 8. P. 1849.
Ridder A., Müller M.L., Kotagal V. et al. Impaired contrast sensitivity is associated with more severe cognitive impairment in Parkinson disease // Parkinsonism Relat. Disord. 2017. V. 34. № 15. P. 19.
Рубинштейн С.Я. Экспериментальные методики патопсихологии и опыт применения их в клинике. М.: Институт Психотерапии, 2010. 384 с.
Lezak M.D., Lezak M.D., Howieson D.B. et al. Neuropsychological assessment. N.Y.: Oxford University Press, 2004. P. 536.
Reitan R.M., Wolfson D. The Halstead-Reitan Neuropsychological Test Battery: Theory and Clinical Interpretation. 2nd ed. South Tucson: Neuropsychology Press, 1993. 912 p.
Красильников Н.Н., Шелепин Ю.Е. Функциональная модель зрения // Оптический журн. 1997. Т. 64. № 2. С. 72.
Шелепин Ю.Е., Чихман В.Н., Хараузов А.К. и др. Восприятие фрагментированных изображений // Рос. физиол. журн. им. И.М. Сеченова. 2004. Т. 90. № 8. С. 355.
Шелепин Ю.Е., Чихман В.Н., Фореман Н. Анализ исследований восприятия фрагментированных изображений: целостное восприятие и восприятие по локальным признакам // Физиологический журн. 2008. Т. 94. № 7. С. 758.
Шелепин Ю.Е. Локальный и глобальный анализ в зрительной системе / Современная психофизика // Под ред. Барабанщикова В.А. М.: Институт психологии РАН, 2009. С. 310.
Goodale M.A., Milner A.D. Separate visual pathways for perception and action // Trends Neurosci. 1992. V. 15. № 1. P. 20.
Milner A.D. How do the two visual streams interact with each other? // Exp. Brain Res. 2017. V. 235. № 5. P. 1297.
Barch D.M., Ceaser A. Cognition in schizophrenia core psychological and neural mechanisms // Trends Cogn. Sci. 2012. V. 16. № 1. P. 27.
Guo J.Y., Ragland J.D., Carter C.S. Memory and cognition in schizophrenia // Mol. Psychiatry. 2019. V. 24. № 5. P. 633.
Harper L., Spencer E., Davidson C. et al. Selectively reduced contrast sensitivity in high schizotypy // Exp. Brain Res. 2020. V. 238. № 1. P. 51.
Owsley C. Contrast sensitivity // Ophthalmol. Clin. North Am. 2003. V. 16. № 2. P. 171.
Silverstein S.M. Visual perception disturbances in schizophrenia: A unified model // Nebr. Symp. Motiv. 2016. V. 63. P. 77.
Keґi S., Kelemen O., Janka Z., Benedek G. Visual perceptual dysfunctions are possible endophenotypes of schizophrenia: Evidence from the psychophysical investigation of magnocellular and parvocellular pathways // Neuropsychology. 2005. V. 19. № 5. P. 649.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека



