Физиология человека, 2021, T. 47, № 6, стр. 88-94
Взаимосвязь уровня экспрессии кальций-транспортирующих белков саркоплазматического ретикулума кардиомиоцитов и структурно-функционального состояния сердца пациентов с постоянной формой фибрилляции предсердий
Д. С. Кондратьева 1, *, Е. А. Арчаков 1, Э. Ф. Муслимова 1, С. А. Афанасьев 1, С. В. Попов 1
1 Научно-исследовательский институт кардиологии,
Томский национальный медицинский центр РАН
Томск, Россия
* E-mail: dina@cardio-tomsk.ru
Поступила в редакцию 08.07.2020
После доработки 19.03.2021
Принята к публикации 10.04.2021
Аннотация
Цель данной работы – исследовать связь уровня экспрессии Са2+-АТФ-азы (SERCA2a) и кальсеквестрина (CASQ2) со структурно-функциональными характеристиками сердца пациентов, имеющих постоянную форму фибрилляции предсердий (ФП). В исследование включено 40 пациентов с длительно персистирующей формой ФП. Пациентам была выполнена радиочастотная аблация (РЧА), во время которой была взята биопсия ткани миокарда из левого желудочка. Показатели внутрисердечной гемодинамики регистрировали из стандартных эхокардиографических позиций. Определение содержания белков SERCA2a и CASQ2 в миокарде проводили методом иммуноблоттинга. Выявлена корреляционная связь между уровнем экспрессии SERCА2a и CASQ2 в кардиомиоцитах с размером левого предсердия. У пациентов, имевших более высокие величины конечно-диастолического и конечно-систолического объемов сердца, наблюдался более высокий уровень экспрессии SERCА2a. Низкие скорости раннего (пик Е) и позднего диастолического наполнения (пик А) левого желудочка были ассоциированы с высоким уровнем экспрессии SERCА2a. В кардиомиоцитах уровень экспрессии кальций-транспортирующих белков (Са2+-АТФ-азы и кальсеквестрина) ассоциирован со структурными и функциональными показателями сердца пациентов, имеющих постоянную форму ФП.
Фибрилляция предсердий (ФП) является одной из тяжелых и часто встречаемых нарушений ритма сердца, которая неблагоприятно влияет на внутрисердечную и общую гемодинамику [1]. Наличие ФП ухудшает качество жизни пациентов, повышает частоту смерти в 2–2.5 раза, а также увеличивает риск развития тромбоэмболических осложнений и сердечной недостаточности (СН) [1–3]. Механизмы развития ФП, связанные с триггерной активностью миокарда, опосредованы перегрузкой ионами Са2+ вследствие нарушения функций саркоплазматического ретикулума (СР) [4, 5]. Ремоделирование этой структуры в патологических условиях во многом определяется состоянием его кальций-транспортирующих белков, ответственных как за обратный захват ионов кальция Са2+-АТФ-азой (SERCA2a), так и за удержание этих ионов во внутриклеточном депо во время диастолы кальсеквестрином (CASQ2). Экспрессия кальций-транспортирующих белков может влиять на формирование субстрата, обеспечивающего генерацию и поддержание ФП. Однако данные об изменении экспрессии этих белков у пациентов с ФП в литературе в настоящее время имеют противоречивый характер. Показано, что при сердечной недостаточности (СН), характеризующейся низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) и ФП, содержание белка SERCA2a в миокарде правого предсердия выше, чем у пациентов с СН с нормальной фракцией выброса ЛЖ и без нарушений ритма [6]. В то же время у пациентов с сохраненной фракцией выброса и ФП содержание SERCA2a в миокарде правого предсердия было значимо ниже по сравнению с больными без нарушений ритма [7]. В экспериментальных исследованиях показано, что моделирование как острой, так и хронической ФП приводит к снижению экспрессии SERCA2a, при этом сверхэкспрессия этого белка снижает частоту возникновения ФП [8–10]. Кроме того, поскольку функционирование SERCA2a связано со значительными энергозатратами [11], то в условиях высокой частоты сокращения предсердий кардиомиоциты могут испытывать недостаток в энергообеспеченности, что может приводить к снижению как активности, так и экспрессии этого белка. Как известно, кальсеквестрин играет роль не только в связывании ионов кальция в СР, но и способствует стабилизации структуры рианодиновых рецепторов [12, 13]. Получены данные о том, что при отсутствии кальсеквестрина у нокаутированных мышей формируется аритмогенный субстрат в миокарде [14] в результате нарушения внутриклеточного гомеостаза ионов кальция и увеличения Сa2+ в миоплазме во время диастолы [15]. Эти данные подтверждают значимую роль кальций-транспортирующих белков СР в формировании предсердных нарушений ритма, однако сведений о взаимозависимости экспрессии этих белков с состоянием сердца при длительных эпизодах наджелудочковых аритмиях изучено недостаточно.
Цель работы – исследовать связь уровня экспрессии Са2+-АТФ-азы (SERCA2a) и кальсеквестрина (CASQ2) со структурно-функциональными характеристиками сердца пациентов, имеющих постоянную форму ФП.
МЕТОДИКА
В исследование было включено 40 пациентов в возрасте 29–60 лет с длительно персистирующей формой ФП, поступивших на лечение в специализированное отделение НИИ кардиологии (г. Томск).
Диагноз ФП был установлен на основании результатов холтеровского мониторирования электрокардиограммы (ЭКГ). Форма ФП определена согласно Национальным рекомендациям по диагностике и лечению ФП (РКО/ВНОА/АССХ, 2012). Всем пациентам проводили радиочастотную аблацию (РЧА), во время которой взяли биопсию миокарда левого желудочка для исключения миокардита вирусной природы. Критериями исключения были: ХСН III–IV функционального класса (NYHA), патология клапанов сердца, а также системные, онкологические, острые и хронические воспалительные заболевания. В соответствие с рекомендациями Американской Ассоциации Эхокардиографии (ASE), пациентам было выполнено эхокардиографическое (ЭХО-КГ) исследование в М и 2D режимах на аппарате En Visor CHD Philips (Нидерланды). ЭХО-КГ выполняли на фоне восстановленного синусового ритма перед РЧА. Показатели внутрисердечной гемодинамики регистрировали из стандартных ЭХО-КГ позиций. Оценивали следующие параметры: размеры левого предсердия (ЛП), ФВ ЛЖ, индекс массы миокарда ЛЖ, толщину межжелудочковой перегородки и задней стенки ЛЖ, конечно-систолические и конечно-диастолические объемы и размеры (КСО, КДО, КСР, КДР).
Определение содержания SERCA2a и CASQ2 проводили методом иммуноблоттинга. Образцы ткани (1–3 мг) гомогенизировали в лизирующем буфере (в мМ: 50 Tris-Cl (pH 7.4), 150 NaCl, 1% CHAPS, 20 NaF, 1 Na3VO4, ингибиторы протеаз и фосфатаз) шариковым гомогенизатором (Next Advance Inc., США). Мембраны кардиомиоцитов разрушали при помощи ультразвукового гомогенизатора (Sonopuls, Bandelin, Германия). Гомогенаты центрифугировали в условиях 16 000 g и 4°С 25 мин. Белки разделяли электрофоретически в полиакриламидном геле (ПААГ). Перенос белков на нитроцеллюлозную мембрану выполняли методом полусухого электроблоттинга, и затем инкубировали с первичными моноклональными антителами для SERCA2a (1 : 2000) и CASQ2 (1 : 2000). В качестве вторичных антител использовали антитела, конъюгированные с пероксидазой хрена. Для детекции белков использовали BCIP/NBT. Количество общего белка определяли в ультрафиолетовом свете (280 нм) на спектрофотометре (NanoVue TM, Thermo Fisher Scientific, США). Расчет содержания SERCA2a и CASQ2 проводили относительно экспрессии референсного белка β-актина. Все реактивы использовали фирмы Sigma (США).
Статистический анализ проводили с использованием программы STATISTICA 10.0. Количественные показатели выборки пациентов оценивали на нормальность распределения с помощью критерия Shapiro–Wilks. Количественные данные представлены как медиана и интерквантильные интервалы Me [Q1; Q3]. Статистически значимые различия между группами оценивали по непараметрическому критерию U Манна-Уитни. Качественные данные представлены частотой встречаемости и ее процентом. Статистическую значимость различий качественных данных оценивали с помощью χ2 Пирсона или точного теста Фишера. Методом кластерного анализа выявляли однородные данные. Результаты считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При исследовании экспрессии белков SERCА2a и CASQ2 оказалось, что их уровень у пациентов, включенных в исследование, сильно различался. При этом между экспрессией этих белков выявилась значимая (r = 0.490) прямая корреляционная связь. Методом кластерного анализа общая выборка пациентов была разделена по уровню белков SERCА2a и CASQ2 на 2 группы: 1 группа – пациенты с условно “низким” содержанием белков; 2 группа – пациенты с условно “высоким” содержанием белков (рис. 1). Сформированные группы статистически значимо различались по содержанию SERCА2a. При этом у пациентов с “низким” содержанием SERCА2a статистически значимо чаще наблюдался и “низкий” уровень CASQ2. Кроме того, экспрессия и SERCА2a, и CASQ2 имела положительную корреляционную связь с размером левого предсердия пациентов (r = 0.424; r = 0.379 соответственно).
Рис. 1.
Экспрессия кальций-транспортирующих белков саркоплазматического ретикулума в миокарде пациентов с фибрилляцией предсердий. SERCA2a–1 – группа пациентов с низким уровнем экспрессии белка, SERCA2a–2 – группа пациентов с высоким уровнем экспрессии белка, CASQ2–1 – группа пациентов с низким уровнем экспрессии белка, CASQ2–2 – группа пациентов с высоким уровнем экспрессии белка; 1 – экспрессия белка в миокарде пациентов 1 группы, 2 – экспрессия белка в миокарде пациентов 2 группы. * – р < 0.05 статистически значимое различие между группами с низким и высоким уровнем экспрессии соответствующего белка.
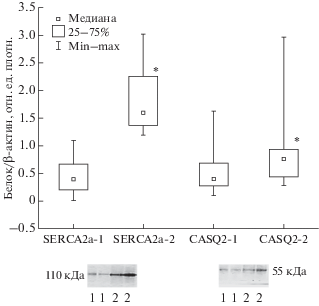
При формировании групп по содержанию CASQ2 не было обнаружено статистически значимых различий по показателям ЭХО-КГ-исследования сердца. Напротив, распределение пациентов по группам, в зависимости от уровня экспрессии SERCА2a, позволило выявить значимые различия по структурным и функциональным параметрам сердца. При этом по клинико-анамнестическим показателям пациенты отобранных групп оказались практически однородны (табл. 1). Так, сформированные группы не различались по частоте встречаемости ИБС и гипертонической болезни (ГБ), при этом все пациенты имели сохраненную ФВ. Пациенты обеих групп получали сходную антиаритмическую терапию, однако в 1-й группе больным чаще назначали антикоагулянты, а пациентам 2-й группы антиагреганты (табл. 2).
Таблица 1.
Клинико-анамнестические показатели групп пациентов с низкой и высокой экспрессией SERCA2a в миокарде
| Показатели | Пациенты | |
|---|---|---|
| 1-я группа (n = 26) | 2-я группа (n = 14) | |
| Возраст, лет | 45 (40; 51) | 42 (38; 48) |
| Пол, M/Ж (n) | 19/7 | 12/2 |
| Гипертоническая болезнь, n (%) | 10 (39%) | 4 (29%) |
| ИБС, n (%) | 2 (8%) | 2 (14%) |
| Индекс массы тела, Me (Q1; Q3) | 29.4 (25.3; 32.6) | 26.9 (24.5; 28.3) |
| Давность ФП, года (Q1; Q3) | 2 (2; 4.25) | 3 (3; 4) |
| Рост, см (Q1; Q3) | 174 (169; 178) | 176 (173; 185) |
| ЧСС (Q1; Q3) | 115 (102; 131) | 100 (70; 115) |
| Артериальное давление, САД/ДАД (Q1; Q3) | 123 (120; 131)/80 (70; 80) | 133 (121; 139)/75 (71; 80) |
| Терапия | ||
| Статины (n, %) | 2 (8%) | 0 |
| Антиагреганты (n, %) | 2 (8%) | 4 (28%)* |
| Антикоагулянты (n, %) | 12 (46%) | 2 (14%)* |
| Блокаторы РААС (n, %) | 9 (35%) | 3 (21%) |
| Антиаритмические препараты | ||
| Амиодарон (n, %) | 6 (23%) | 5 (36%) |
| Аллапенин (n, %) | 1 (4%) | 1 (7%) |
| Пропафенон (n, %) | 9 (35%) | 2 (14%) |
| Соталол (n, %) | 4 (15%) | 2 (14%) |
| Бисопролол (n, %) | 3 (12%) | – |
| Метопролол (n, %) | 2 (8%) | 2 (14%) |
Таблица 2.
Показатели ультразвукового исследования сердца пациентов в группах с низкой и высокой экспрессией SERCA2a
| Показатели | 1 группа (n = 26) | 2 группа (n = 14) |
|---|---|---|
| Фракция выброса, % | 65 (62; 68) | 63 (60; 66) |
| КДО | 104 (97, 114) | 115 (96, 127)* |
| КСО | 36 (34, 42) | 42 (39, 48)* |
| Пик_Е, см/с | 82 (72, 88) | 69 (62, 80)* |
| Пик_А, см/с | 61 (59, 66) | 47 (44, 52)* |
| E/A | 1.28 (1.26; 1.51) | 1.27 (1.19; 1.55) |
| ЛП, мм | 37 (35, 42) | 42 (39, 45)* |
| КДР, мм | 49 (48, 50) | 49.8 (45, 52) |
| КСР, мм | 31 (30, 34) | 32 (29, 37) |
| Индекс сферичности ЛЖ | 0.54 (0.52; 0.59) | 0.58 (0.52; 0.63) |
| Ударный объем, мл | 69.5 (63, 78) | 71.5 (59, 79) |
| ММ, г | 174 (157, 186) | 173 (138, 211) |
| ИММ, г/м2 | 86.5 (80, 93) | 83.5 (71, 95) |
| грТК регур, мм рт. ст. | 22 (19, 23) | 22 (18, 23) |
Примечание: КСО – конечно-систолический объем, КДО – конечно-диастолический объем, ЛП – левое предсердие, КДР – конечно-диастолический размер, КСР – конечно-систолический размер, ЛЖ – левый желудочек, ММ – масса миокарда, ИММ – индекс массы миокарда. * – р < 0.05 статистически значимое различие между группами.
В соответствии с тем, что размер ЛП имеет прямую корреляционную связь с уровнем экспрессии SERCА2a, во 2-й группе с “высоким” уровнем экспрессии этого белка размер ЛП у пациентов статистически значимо оказался больше (42 (39, 45) мм), чем у больных сравниваемой группы (37 (35, 42) мм) (табл. 2). Несмотря на то, что в нашем исследовании ФВ ЛЖ не имела межгрупповых различий, у пациентов 2-й группы величины КДО и КСО статистически значимо были больше, чем таковые у больных 1-й группы. Однако гемодинамические показатели сердца – скорости раннего (пик Е) (82 (72, 88) см/с и 69 (62, 80) см/м, 1 и 2 группы соответственно) и позднего диастолического наполнения (пик А) (61 (59, 66) см/м и 47 (44, 52), 1 и 2 группы соответственно) ЛЖ были статистически значимо ниже во 2 группе, хотя соотношение этих показателей (пик Е/пик А) не имело значимых различий между группами.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты, полученные в настоящем исследовании, показали, что уровень экспрессии кальций-транспортирующих белков SERCА2a и CASQ2 ассоциирован со структурными и функциональными показателями сердца пациентов, имеющих постоянную форму ФП. Более высокие значения содержания белков связаны с более высокими значениями КДО и КСО, а также с меньшей скоростью раннего и позднего диастолического наполнения ЛЖ.
К числу молекулярных механизмов возникновения ФП уверенно относят нарушение внутриклеточного гомеостаза ионов кальция [16, 17]. Так, перегрузка ионами кальция саркоплазмы кардиомиоцитов приводит к снижению электрической стабильности их сарколеммальной мембраны и появлению эктопических очагов возбудимости [18, 19]. Соответственно, меняются электрофизиологические свойства предсердий, происходит так называемое электрофизиологическое ремоделирование [20, 21]. Возможной причиной таких нарушений может явиться дисбаланс вегетативной нервной системы и, соответственно, изменение сигнальных влияний на функциональное состояние ионных каналов клеточных мембран и внутриклеточных органелл. Как показывают исследования, высокая частота предсердных сокращений может приводить к усилению метаболических процессов в клетке и, как результат, истощать запасы макроэргических фосфатов [16, 17]. Снижение энерго-обеспеченности внутриклеточных энергозависимых процессов может приводить к нарушению регуляции транспорта ионов кальция кардиомиоцитов. Известно, что процесс сокращение-расслабление кардиомиоцитов потребляет до 70% синтезируемой энергии и большая доля этой энергии расходуется на работу Са2+-АТФ-азы (SERCA2a), осуществляющей транспорт ионов кальция против градиента концентрации [11, 22]. Этот процесс обеспечивает активное расслабление миокарда. Поступившие в СР ионы кальция связываются с CАSQ2, который взаимодействует с триадином, рианодиновыми рецепторами и джанктином с образованием высокомолекулярного тетрамерного комплекса в СР [23, 24]. При этом показано, что CАSQ2 стабилизирует рианодиновые рецепторы в их закрытом состоянии во время диастолы [25, 26]. Учитывая, что нормальное функционирование CАSQ2 препятствует току утечки ионов кальция из СР, можно ожидать, что более высокий уровень экспрессии этого белка будет являться благоприятным фактором для сохранения сократительной функции миокарда.
В настоящем исследовании пациенты с персистирующей формой ФП, по данным ЭХО-КГ, не имели патологически выраженных функциональных и структурных изменений миокарда. Однако уровень экспрессии кальций-транспортирующих белков у этих пациентов значительно различался. При этом оказалось, что показатели величины КДО имели прямую ассоциацию с количеством SERCA2a. Поскольку величина КДО отражает преднагрузку, или степень растяжения сердца во время диастолы, то, соответственно, у этих пациентов сердечная мышца способна обеспечивать большую длину саркомеров перед сокращением. При этом в систолу, согласно механизму Франка–Старлинга, сердце будет способно вытолкнуть больший объем крови во время сердечного выброса. Это представление согласуется с тем, что в нашем исследовании группа пациентов с высокой экспрессией SERCA2a имела более высокие величины КСО. Большое значение этот показатель имеет в диастолической функции желудочков, поскольку более эластичный желудочек адекватно заполняется кровью и последующее сокращение мышечных волокон оказывается эффективным [27]. К основным параметрам диастолической функции сердца относится и структура диастолического наполнения желудочков. Выделяют период раннего диастолического наполнения желудочка, который происходит в две фазы: в фазу быстрого (активного) наполнения – раннюю диастолу и в фазу медленного (пассивного) наполнения – позднюю диастолу и период позднего диастолического наполнения левого желудочка, совпадающий с систолой левого предсердия [28]. Фаза быстрого наполнения ЛЖ характеризует активный процесс расслабления, или удаление ионов кальция из миоплазмы кардиомиоцитов. По результатам нашего исследования оказалось, что пациенты с высоким уровнем экспрессии SERCA2a, в отличие от пациентов с низкой экспрессией этого белка, имеют меньшую скорость как быстрого наполнения в раннюю диастолу, так и медленного наполнения в позднюю фазу диастолы. Эти результаты согласуются с более высокой величиной КДО, что соответствует увеличению времени изгнания большего объема крови из ЛЖ. Вместе с тем, у пациентов с высоким уровнем экспрессии SERCA2a размеры ЛП несколько увеличены. Вероятно, в данном случае имеет место эффект компенсаторного увеличения.
ЗАКЛЮЧЕНИЕ
Внутриклеточный дисбаланс транспорта ионов кальция, связанный с дисфункцией СР, во многом определяет формирование нарушений ритма сердца, в том числе и ФП. При постоянной форме фибрилляции предсердий уровень экспрессии кальций-транспортирующих белков СР (Са2+-АТФ-азы и кальсеквестрина) имеет значимую роль не только в генезе аритмий, но и ассоциирован со структурными и функциональными показателями сердца. Обнаруженные закономерности подтверждают перспективность оценки уровня кальций-транспортирующих белков СР в качестве прогностического фактора при персонифицированном лечении пациентов с персистирующей формой ФП.
Этические нормы. Работа проведена в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрена комитетом по биомедицинской этики НИИ кардиологии Томского НИМЦ РАН (Томск), протокол № 139 от 18 ноября 2015 г.
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование проведено в рамках выполнения темы фундаментальных исследований № АААА-А15-115123110026-3 НИИ кардиологии Томского НИМЦ.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Бокерия Л.А., Филатов А.Г., Ковалев С.А., Ковалев А.С. Лечение фибрилляции предсердий: данные рандомизированных исследований // Вестник экспериментальной и клинической хирургии. 2012. Т. 5. № 2. С. 448. Bokeria L.A., Filatov A.G., Kovalev S.A., Kovalev A.S. [Treatment of atrial fibrillation: data from randomized trials] // Vestn. Eksp. Klin. Khir. 2012. V. 5. № 2. P. 448.
Борисова Е.В., Плеханов И.Г., Попов С.В. Качество жизни пациентов после создания полной атриовентрикулярной блокады и имплантации частотно-адаптивного электрокардиостимулятора // Сибирский медицинский журн. 2013. Т. 28. № 2. С. 74. Borisova E.V., Plekhanov I.G., Popov S.V. [Quality of life of patients after the creation of a complete atrioventricular block and implantation of a frequency-adaptive pacemaker] // Sib. Med. Zh. (Tomsk). 2013. V. 28. № 2. P. 74.
Proietti M., Farcomeni A., Romiti G.F. et al. Association between clinical risk scores and mortality in atrial fibrillation: Systematic review and network meta-regression of 669.000 patients // Eur. J. Preven. Cardiol. 2020. V. 27. № 6. P. 633.
Frommeyer G., Eckardt L., Milberg P. Calcium handling and ventricular tachyarrhythmias // Wien. Medizin. Wochen. 2012. V. 162. № 13–14. P. 283.
Schlotthauer K., Bers D.M. Sarcoplasmic reticulum Ca(2+) release causes myocyte depolarization. Underlying mechanism and threshold for triggered action potentials // Circ. Res. 2000. V. 87. № 9. P. 774.
Molina C.E., Abu-Taha I.H., Wang Q. et al. Profibrotic, electrical, and calcium-handling remodeling of the atria in heart failure patients with and without atrial fibrillation // Front. Physiol. 2018. V. 9. P. 1383.
Voigt N., Heijman J., Wang Q. et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation // Circ. 2014. V. 129. № 2. P. 145.
Kuken B.N., Aikemu A.N., Xiang S.Y., Wulasihan M.H. Effect of SERCA2a overexpression in the pericardium mediated by the AAV1 gene transfer on rapid atrial pacing in rabbits // Genet. Mol. Res. 2015. V. 14. № 4. P. 13625.
Sun J., Ailiman M. Regulation of calcium pump through Notch/Jagged/Hes signaling pathway in canine model of chronic atrial fibrillation // Int. J. Clin. Exp. Pathol. 2019. V. 12. № 11. P. 4034.
Wang H., Zhou X.H., Li Z.Q. et al. Prevention of atrial fibrillation by using sarcoplasmic reticulum calcium ATPase pump overexpression in a rabbit model of rapid atrial pacing // Med. Sci. Monit. 2017. V. 23. P. 3952.
Kuum M., Kaasik A., Joubert F. et al. Energetic state is a strong regulator of sarcoplasmic reticulum Ca2+ loss in cardiac muscle: different efficiencies of different energy sources // Cardiovasc. Res. 2009. V. 83. № 1. P. 89.
Faggioni M., Knollmann B.C. Calsequestrin 2 and arrhythmias // Am. J. Physiol. Heart Circ. Physiol. 2012. V. 302. № 6. P. H1250.
Gergs U., Fahrion C.M., Bock P. et al. Evidence for a functional role of calsequestrin 2 in mouse atrium // Acta Physiology (Oxf). 2017. V. 219. № 3. P. 669.
Faggioni M., Savio-Galimberti E., Venkataraman R. et al. Suppression of spontaneous ca elevations prevents atrial fibrillation in calsequestrin 2-null hearts // Circ. Arrhythm. Electrophysiol. 2014. V. 7. № 2. P. 313.
Glukhov A.V., Kalyanasundaram A., Lou Q. et al. Calsequestrin 2 deletion causes sinoatrial node dysfunction and atrial arrhythmias associated with altered sarcoplasmic reticulum calcium cycling and degenerative fibrosis within the mouse atrial pacemaker complex // Eur. Heart J. 2015. V. 36. № 11. P. 686.
Dobrev D., Wehrens X.H.T. Calcium-mediated cellular triggered activity in atrial fibrillation // J. Physiol. 2017. V. 595. № 12. P. 4001.
Lugenbiel P., Wenz F., Govorov K. et al. Atrial fibrillation complicated by heart failure induces distinct remodeling of calcium cycling proteins // PLoS One. 2015. V. 10. № 3. P. e0116395.
Brandenburg S., Arakel E.C., Schwappach B., Lehnart S.E. The molecular and functional identities of atrial cardiomyocytes in health and disease // Biochim. Biophys. Acta. 2016. V. 1863 (7 Pt B). P. 1882.
Denham N.C., Pearman C.M., Caldwell J.L. et al. Calcium in the Pathophysiology of Atrial Fibrillation and Heart Failure // Front. Physiol. 2018. V. 9. P. 1380.
Kalifa J., Maixent J.M., Chalvidan T. et al. Energetic metabolism during acute stretch-related atrial fibrillation // Mol. Cell. Biochem. 2008. V. 317. № 1–2. P. 69.
Tu T., Zhou S., Liu Z. et al. Quantitative proteomics of changes in energy metabolism-related proteins in atrial tissue from valvular disease patients with permanent atrial fibrillation // Circ. J. 2014. V. 78. № 4. P. 993.
Zhang G.X., Obata K., Takeshita D. et al. Evaluation of left ventricular mechanical work and energetics of normal hearts in SERCA2a transgenic rats // J. Physiol. Sci. 2012. V. 62. № 3. P. 221.
Terentyev D., Viatchenko-Karpinski S., Györke I. et al. Calsequestrin determines the functional size and stability of cardiac intracellular calcium stores: Mechanism for hereditary arrhythmia // Proc. Natl Acad. Sci. USA. 2003. V. 100. № 20. P. 11759.
Kubalova Z., Györke I., Terentyeva R. et al. Modulation of cytosolic and intra-sarcoplasmic reticulum calcium waves by calsequestrin in rat cardiac myocytes // J. Physiol. 2004. V. 561. № 2. P. 515.
Liu B., Ho H.T., Brunello L. et al. Ablation of HRC alleviates cardiac arrhythmia and improves abnormal Ca handling in CASQ2 knockout mice prone to CPVT // Cardiovasc. Res. 2015. V. 108. № 2. P. 299.
Lou Q., Belevych A.E., Radwański P.B. et al. Alternating membrane potential/calcium interplay underlies repetitive focal activity in a genetic model of calcium-dependent atrial arrhythmias // J. Physiol. 2015. V. 593. № 6. P. 1443.
Беленков Ю.Н., Агманова Э.Т. Диастолическая функция сердца у больных с хронической сердечной недостаточностью и методы диагностики ее нарушений с помощью тканевой миокардиальной допплерэхографии // Кардиология. 2003. № 11. С. 58. Belenkov Yu.N., Agmanova E.T. Diastolic heart function in patients with chronic heart failure and methods for diagnosing its disorders using tissue myocardial dopplerography // Cardiology. 2003. № 11. P. 58.
Nagueh S.F., Smiseth O.A., Appleton C.P. et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the american society of echocardiography and the european association of cardiovascular imaging // J. Am. Soc. Echocardiogr. 2016. V. 29. № 4. P. 277.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


