Физиология человека, 2021, T. 47, № 6, стр. 100-114
Сезонная динамика массы тела у здоровых людей: мета-анализ
Н. В. Кузьменко 1, 2, *, В. А. Цырлин 1, М. Г. Плисс 1, 2, М. М. Галагудза 1
1 ФГБУ Национальный медицинский исследовательский центр имени В.А. Алмазова МЗ РФ
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет
имени академика И.П. Павлова МЗ РФ
Санкт-Петербург, Россия
* E-mail: nat.kuzmencko2011@yandex.ru
Поступила в редакцию 29.09.2020
После доработки 24.11.2020
Принята к публикации 21.12.2020
Аннотация
Известно, что большинство видов млекопитающих накапливают жировые отложения летом. Поскольку среднестатистический современный человек активно использует искусственное освещение, отопление, кондиционирование, а также обычно не испытывает периодов нехватки пищи, сезонные адаптационные стратегии людей могут существенно отличаться от других млекопитающих. Цель данного мета-анализа – исследовать сезонную динамику массы тела у здоровых взрослых людей в регионах с разным типом климата. Был проведен мета-анализ 20 панельных и 5 кросс-секциональных исследований, которые сообщали о сезонной динамике показателей массы тела у здоровых людей, проживающих в регионах с различным типом климата (от субарктического до тропического). По результатам мета-анализа индекс массы тела (ИМТ) людей подвержен сезонной динамике с максимумом зимой и надиром летом. Не было выявлено зависимости сезонной динамики массы тела от пола и возраста. Географическая широта и амплитуда цирканнуальных колебаний метеорологических факторов не оказывали значимого влияния на сезонную динамику ИМТ. Наиболее возможная причина сезонной динамики ИМТ заключается в сезонных колебаниях физической активности, которая максимальна летом и минимальна зимой.
Для большинства видов млекопитающих, проживающих в климате отличном от экваториального, характерна сезонная динамика в функционировании организма, обеспечивающая соответствие общего метаболизма и репродуктивной функции внешним условиям. Несмотря на то, что в зависимости от сезона размножения млекопитающих можно разделить на производителей длинного и короткого дня, большинство видов накапливают жировые отложения летом и многие используют такие стратегии, как снижение метаболизма и зимняя спячка, для сохранения энергии зимой [1].
Сезонные изменения в общем метаболизме млекопитающих основаны на мелатонин-зависимом высвобождении тиреотропного гормона (ТТГ) в pars tuberalis гипофиза, а также цирканнуальными колебаниями активности дейодиназ. Так, уменьшение светлого времени суток сопровождается у большинства млекопитающих снижением экспрессии β-субъединицы ТТГ в pars tuberalis и гена DIO2 в тканях, а также увеличением экспрессии гена DIO3, в результате чего снижается уровень активного трийодтиронина (Т3) и повышается концентрация неактивного реверсивного Т3 [2–4]. А при увеличении длины дня уровень ТТГ, активность дейодиназы 2 и тиреоидных гормонов возрастает.
Помимо мелатонина уровень тиреоидных гормонов зависит от количества и качества кормов, а также от температуры окружающей среды. Уменьшение калорийности питания способствует снижению концентрации циркулирующего Т3 [5], понижение температуры воздуха стимулирует выработку гормонов щитовидной железы [6–9], а длительное воздействие умеренного тепла вызывает уменьшение уровня тиреоидных гормонов [10].
Также важным гормоном, влияющим на общий метаболизм, является кортизол. Усиление выработки кортизола ассоциировано со стрессом. Наблюдения за животными показали, что ограничение в пище, понижение и повышение амбиентной температуры сопровождаются увеличением уровня кортизола. Особенно сильно повышается уровень кортизола на острый кратковременный стресс (24 ч и менее), а не на продолжительный [11]. В течение года у животных повышение уровня кортизола сопряжено часто с периодом размножения [12]. Во многих исследованиях была показана роль кортизола в отложении висцерального жира вследствие гипертрофии адипоцитов [13].
Кроме тиреоидных гормонов и кортизола на метаболизм млекопитающих влияют нейропептид Y и лептин. Нейропептид Y, концентрация которого увеличивается при воздействии холода, вызывает, с одной стороны, гиперфагию, а с другой стороны, подавляет любое повышение скорости метаболизма [14, 15]. Лептин увеличивает скорость метаболизма. Уменьшение калорийности пищи и холод способствуют снижению уровня лептина, а длинный день, по некоторым данным, вызывает резистентность к лептину [1, 16]. Известно, что уровень лептина существенно выше у женщин, чем у мужчин [17].
Особый интерес представляют эксперименты на крысах, которые, как и человек, являются млекопитающими без четко выраженной сезонности в функционировании организма. Исследования показали, что содержание молодых крыс линии Wistar при длинном дне увеличивает скорость их роста [18]. Аналогично у детей летом ускоряется рост и набор массы тела [19]. Длительная непрерывная экспозиция крыс при низкой температуре вызывает у них повышенное потребление пищи, воды и кислорода, а также увеличивает диурез и локомоторную активность [20–23]. Наоборот, при длительной непрерывной умеренной гипертермии наблюдается снижение аппетита и локомоторной активности [24, 25]. Содержание крыс в гипер- и гипотермических условиях приводит к снижению массы тела, по сравнению с нормотермическим контролем даже при достаточной калорийности пищи [22, 24–26], в то же время при длительном охлаждении увеличивается масса бурого жира [22, 27]. Однако снижение веса животных можно предотвратить, если постепенно адаптировать их к температуре [27]. А ежедневное прерывистое охлаждение в течение продолжительного времени, наоборот, способствует увеличению массы тела крыс [28].
Поскольку среднестатистический современный человек активно использует искусственное освещение, отопление, кондиционирование, а также обычно не испытывает периодов нехватки пищи, сезонные адаптационные стратегии людей могут существенно отличаться от других млекопитающих. Тем не менее, некоторые исследователи наблюдали активацию бурого жира и термогенных генов белого жира у людей в холодный сезон [29–33]. В ряде исследований была установлена сезонная динамика трийодтиронина и кортизола с максимальными значениями зимой и минимальными летом [34–37]. D. Kanikowska et al. [38] наблюдали у здоровых молодых мужчин некоторое повышение лептина зимой. Есть сообщения об увеличении зимой уровня холестерина без существенного изменения уровня триглицеридов [38–42]. Уровень глюкозы по результатам одних исследований не изменялся в течение года [41], по результатам других – был выше зимой, чем летом [40]. Изменения в общем метаболизме могут повлечь изменения в массе тела. Цель данного мета-анализа – исследовать сезонную динамику массы тела у здоровых взрослых людей в регионах с разным типом климата.
МЕТОДИКА
Отбор публикаций. Мета-анализ был выполнен в соответствии с рекомендациями PRISMA (http:// www.prisma-statement.org). Поиск публикаций осуществляли независимо двумя исследователями в базах PubMed, Scopus, Google Scholar. Поиск публикаций проходил в июне–июле 2020 г. на английском и русском языках и не был ограничен годами публикаций. При поиске использовали следующие ключевые слова: “масса тела”, “вес”, “индекс массы тела”, “сезон”. Был применен фильтр “исследования на людях”. Для мета-анализа отбирали панельные и крупные кросс-секциональные исследования. Дизайн работы устанавливали из описания методики.
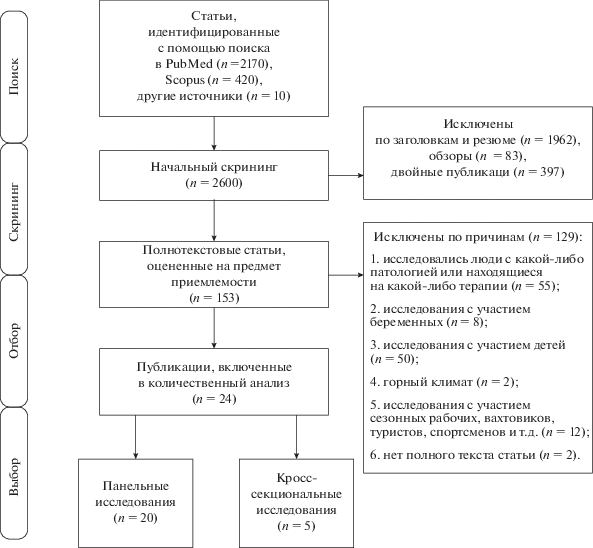
Отбирали только исследования, проведенные на людях без серьезных патологий. Пол и возраст людей, участвующих в исследованиях, при отборе публикаций не учитывали, но исключали работы с участием беременных женщин и детей. Также не использовали исследования с участием сезонных рабочих, вахтовиков, полярников и других случаев временнóго нахождения людей в климатических условиях, отличных от региона их постоянного проживания. Не включали исследования с участием спортсменов, поскольку сезон тренировок и соревнований мог оказать существенное влияние на массу тела. Были исключены исследования, проведенные в горном климате (рис. 1).
Рис. 1.
Блок-схема в соответствии с рекомендационными предписаниями для системных обзоров и мета-анализов (http://prisma-statement.org/).
Из работ извлекали данные по массе тела в кг, содержанию жира (пересчитывали в процентное содержание от общей массы тела) и индексу массы тела (ИМТ в кг/м2), измеренные в разные сезоны. Статистический анализ был проведен с учетом и без учета пола и возраста. Для выяснения влияния пола и возраста на сезонную динамику массы тела были отобраны публикации, в которых описаны исследования с участием людей разного пола или возраста, и данные представлены отдельно для каждой гендерной или возрастной группы. Это условие минимизировало возможные этнические и климатические влияния на результаты исследования.
Обработка метеорологических данных. Если в статье были представлены метеорологические данные, то использовали их. В противном случае, используя архивные данные с сайтов https:// www.gismeteo.ru/ и https://www.wunderground.com/, проводили сами расчеты средних значений температуры воздуха, атмосферного давления на уровне местности, относительной влажности воздуха и парциальной плотности кислорода в воздухе. Парциальную плотность кислорода в воздухе (ρO2 в г/м3) рассчитывали по формуле Менделеева-Клайперона:
где 0.232 – массовая доля кислорода в воздухе, Р – атмосферное давление в Па, е – парциальное давление водяного пара в Па, R – удельная газовая постоянная сухого воздуха 287 Дж/(кг К), Т – температура воздуха в К.Парциальное давление водяного пара рассчитывалось по формуле:
где φ – относительная влажность воздуха в %, Pv – давление насыщенного водяного пара при данной среднемесячной температуре воздуха в Па.Расчет метеорологических параметров проводили за период исследования, указанный в публикации или за 10 лет, если в архиве не было данных за этот период или период был неизвестен. Важно было установить сезонные климатические тенденции для конкретного региона. В зависимости от цирканнуальной амплитуды изменения метеорологического фактора в регионе исследования публикации при проведения мета-анализа делились на две субгруппы: с макимальной и минимальной амлитудой изменения метеофактора. При этом во избежание статистического перекоса кросс-секциональные исследования не были включены в субгруппы.
Статистика. Мета-анализ результатов исследований проводили с помощью статистической программы Review Manager 5.3 (Cochrane Library). Для анализа использовали inverse variance тест (Mean Difference). Гетерогенность, включенных в мета-анализ исследований, устанавливали по критерию I 2. При низкой степени гетерогенности (I 2 ≤ 25%) рекомендуется использовать модель фиксированных эффектов (fixed-effect model), при высокой гетерогенности (I 2 ≥ 75%) – модель случайных эффектов (random-effect model). Chi2 использовали в модели фиксированных эффектов, Tau2 оценивал связь между дисперсией в модели случайных эффектов. Для оценки статистической значимости суммарных результатов применяли Z-тест. Доверительный интервал – 95%. Различия считали статистически значимыми при р < 0.05. Наличие предвзятости при отборе публикаций оценивали с помощью графика-воронки.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
По теме исследования в базах PubMed, Scopus, GoogleScholar было найдено 2600 публикаций, из них 88 обзоров. Для мета-анализа было отобрано 24 публикации. Из 25 исследований, отобранных для мета-анализа, 20 представляли собой панельные исследования, 5 – кросс-секциональные (рис. 1). В табл. 1 и 2 представлены основные характеристики публикаций, включенных в мета-анализ. Исследования проходили в регионах с различным типом климата от субарктического до тропического. В публикацию [56] включено два панельных исследования в Сыктывкаре и Магадане.
Таблица 1.
Панельные исследования, включенные в мета-анализ
| Публикация | Период исследования | ИФ | Параметры | Общая выборка | Средний возраст | Пол, % мужчин | Сезоны | Место исследования, географические координаты |
|---|---|---|---|---|---|---|---|---|
| Chiriboga D.E. et al., 2009 [43] | 1994–1998 | 5 | ИМТ | 534 | 48 | 52** | З, В, Л, О | Вустер, Массачусетс, США, 42°16′ с.ш. 71°47′ з.д., 146 м н/м |
| Clemes S. et al., 2011 [44] | 2005–2006 | 2 | ИМТ, М, Ж | 45 | 39 | 42 | З, Л | Графства Корнуолл и Лестершир, Великобритания |
| Cizza G. et al., 2005 [45] | – | 2.5 | ИМТ, М | 28 | 42 | 29 | З, Л | Бетесда (Мэриленд), США, 38°58′ с.ш. 77°з.д., 97 м н/м |
| Fuse S. et al., 2020 [29] | 2016–2017 | 4.5 | ИМТ, М, Ж | 46 | 41 | 50** | З, Л | Токио, Япония, 35°42′ с.ш., 139°36′ в.д., 46 м н/м |
| Goodwin J. et al., 2001 [46] | 3 года | 5 | ИМТ, М, Ж | 45 | 24 и 74* | 100 | З, Л | Эксетер, Великобритания, 50°43′ с.ш. 3°32′ з.д., 7 м н/м |
| Haggarty P. et al., 1994 [47] | – | 4 | М, Ж | 9 | 38 | 100 | З, Л | Абердин, Великобритания, 57° с.ш., 2° з.д., 13 м н/м |
| Hassi J. et al., 2001 [48] | – | 4.8 | М | 20 | 33 | 100 | З, В, Л, О | Колари, Финляндия, 67° с.ш., 25° в.д., 155 м н/м |
| Hattori T. et al., 2015 [41] | 2010–2011 | 1.5 | ИМТ, М, Ж | 79 | 38 | 100 | З, Л | Сендай, Япония, 38°16′ с.ш. 140°52′ в.д., 57 м н/м |
| Kanikowska D. et al., 2013 [38] | 2010–2011 | 2.5 | ИМТ | 5 | 24 | 100 | З, Л | Нагакуте, Япония, 35°1′ с.ш., 137° в.д., 139 м н/м |
| Koon N., 1980 [36] | 1978–1979 | 2.2 | М | 15 | 42 | 100 | З, Л | Саппоро, Япония, 43° с.ш., 141°2′ в.д., 17 м н/м |
| Kristal-Boneh E. et al., 2000 [49] | – | 5.5 | ИМТ | 120 | 45 | 100 | З, Л | Раанана, Израиль, 32° с.ш., 34°52′ в.д., 40 м н/м |
| Leonard W.R. et al., 2014 [50] | 2009–2011 | 1.7 | ИМТ, М, Ж | 94 | 19 и старше* | 37** | З, Л | Бердигестях, Саха, Россия, 62° с.ш., 126°40′ в.д., 212 м н/м |
| Martinez-Nicolas A. et al., 2015 [51] | 2011–2013 | 2.7 | ИМТ | 60 | 25 | 0 | З, Л | Базель, Швейцария, 47°33′ с.ш. 07°37′ в.д., 317 м н/м |
| Mitsui T. et al., 2010 [52] | 2008–2009 | 2 | ИМТ, М | 51 | 44 | 100 | З, Л | Хасиками, Япония, 40°27′ с.ш., 141°37′ в.д., 46 м н/м |
| O’Connell S.E. et al., 2014 [53] | 2009–2010 | 1.5 | ИМТ, М, Ж | 46 | 42 | 28** | З, В, Л, О | Ньюкасл, Великобритания, 54°58′ с.ш. 1°36′ з.д., 30 м н/м |
| Pasquali R. et al., 1984 [54] | 1979–1980 | 5 | М | 24 | 28 | 58 | З, В, Л, О | Болонья, Италия, 44°30′ с.ш. 11°21′ в.д., 54 м н/м |
| Plasqui G. et al., 2003 [17] | – | 4.2 | М, Ж | 25 | 25 | 40** | З, В, Л, О | Маастрихт, Нидерланды, 50°52′ с.ш., 5°41′ в.д., 49 м н/м |
| Sinha P. et al., 2010 [55] | 2004–2005 | 1.5 | ИМТ | 132 | 28 | 0 | З, Л | Нью-Дели, Индия, 28°42′ с.ш. 77°12′ в.д., 216 м н/м |
| Sukhanova I.V. et al., 2014 (1) [56] | 2007–2011 | 0.4 | ИМТ, М | 17 | 37 | 100 | З, В, Л, О | Сыктывкар, Россия, 61°40′ с.ш. 50°49′ в.д., 172 м н/м |
| Sukhanova I.V. et al., 2014 (2) [56] | 2007–2011 | 0.4 | ИМТ, М | 18 | 38 | 100 | З, В, Л, О | Магадан, Россия, 59°34′ с.ш. 150°48′ в.д., 70 м н/м |
Примечание: ИФ – импакт фактор журнала по https://www.scimagojr.com, ИМТ – индекс массы тела, М – масса тела, Ж – процентное содержание жира, З – зима, В – весна, Л – лето, О – осень, * – отдельно исследовались люди разных возрастных групп, ** – отдельно исследовались мужчины и женщины.
Таблица 2.
Кросс-секциональные исследования, включенные в мета-анализ
| Публикация | Период исследования | ИФ | Параметры | Возраст | Пол, % мужчин | Объем выборки | Место исследования, географические координаты | |||
|---|---|---|---|---|---|---|---|---|---|---|
| зима | весна | лето | осень | |||||||
| Anthanont P. et al., 2017 [42] | 1995–2012 | 2.5 | ИМТ, М, Ж | 41 | 54 | 220 | – | 214 | – | Рочестер, Миннесота, США, 40° с.ш. 92°27′ з.д., 312 м н/м |
| Nakayama K. et al., 2013 [57] | 2009–2011 | 3 | ИМТ | 52 | 54 | 1080 | – | 979 | – | Симоцуке, Япония, 36°23′ с.ш., 139°50′ в.д., 200 м н/м |
| Pham D. et al., 2020 [58] | 2009–2017 | 6 | ИМТ, М, Ж | 38 | 44** | 169 | 330 | 148 | 220 | Сеул, Южная Корея, 37°35′ с.ш., 127° в.д., 38 м н/м |
| Sung K.C. et al., 2006 [39] | 2002–2003 | 2.2 | ИМТ | 47 | 65 | 2631 | 2177 | 3445 | 3632 | Сеул, Южная Корея, 37°35′ с.ш., 127° в.д., 38 м н/м |
| Visscher T.L.S. et al., 2004 [59] | 1993–1997 | 5 | ИМТ, М | 40 | 46** | 17 824 | 17 824 | 17 824 | 17 824 | Амстердам, Нидерланды, 52°23′ с.ш., 4°54′ в.д., –2 м н/м |
Примечание: обозначения см. табл. 1.
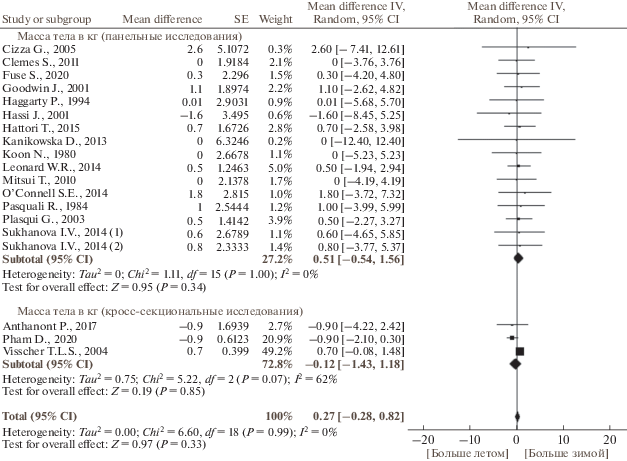
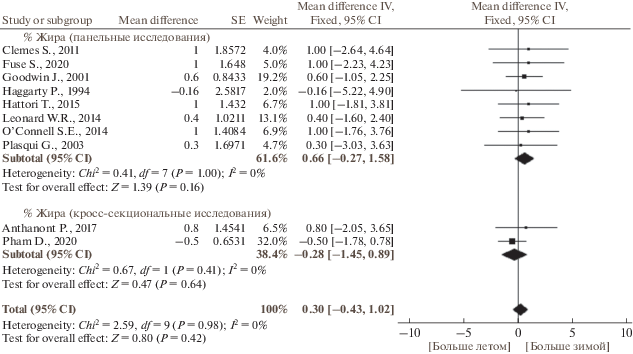
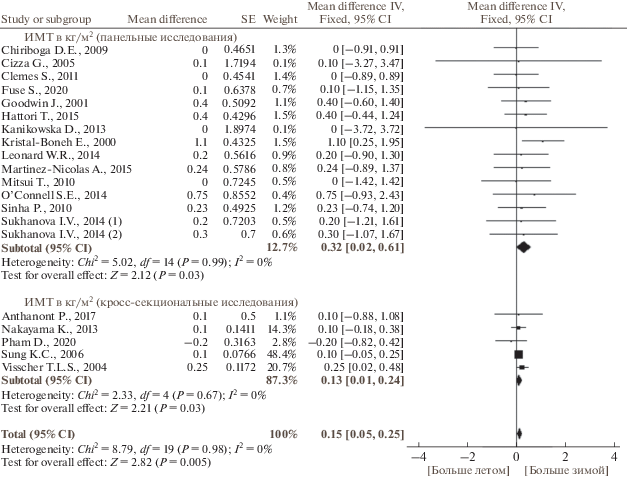
По данным публикаций, включенных в наш мета-анализ, в исследуемых группах людей масса тела была 60–80 кг, содержание жира – 21–32%, ИМТ составлял 22–27 кг/м2. Сезонные изменения массы тела, содержания жира и ИМТ отличались гомогенностью. Масса тела и процентное содержание жира не имели выраженной сезонной динамики (рис. 2 и 3, табл. 3). Хотя большинство исследований не выявили связанных с сезоном существенных изменений ИМТ, по результатам мета-анализа панельных и кросс-секциональных исследований ИМТ был больше зимой, чем летом (р = 0.005) (рис. 4, табл. 3). Не было выявлено зависимости сезонной динамики массы тела, содержания жира и ИМТ от пола и возраста (рис. 5 и 6). Географическая широта и амплитуда цирканнуальных колебаний метеорологических факторов не оказывали значимого влияния на сезонную динамику ИМТ (рис. 7). Сезонная динамика погодных условий в исследуемых регионах представлена в табл. 4.
Таблица 3.
Сезонная динамика массы тела, содержания жира и индекса массы тела (ИМТ) по результатам панельных и кросс-секциональных исследований
| Сравниваемые сезоны | Кол-во исследований | Средняя разница | I 2% | Тест на общий эффект | |||
|---|---|---|---|---|---|---|---|
| 1 сезон/выборка | 2 сезон/выборка | Rand. или Fix. | Z | P | |||
| Масса тела, кг | |||||||
| Зима/18 769 | Лето/18 748 | 18 | 0.27 [–0.28, 0.82] | 0 | F | 0.97 | 0.33 |
| Зима/18 143 | Весна/18 304 | 8 | 0.02 [–0.55, 0.59] | 0 | F | 0.07 | 0.94 |
| Зима/18 143 | Осень/18 194 | 8 | –0.03 [–0.55, 0.50] | 0 | F | 0.10 | 0.92 |
| Осень/18 194 | Лето/18 122 | 8 | 0.33 [–0.25, 0.91] | 0 | F | 1.10 | 0.27 |
| Весна/18 304 | Лето/18 122 | 8 | 0.13 [–0.49, 0.76] | 0 | F | 0.42 | 0.67 |
| Весна/18 304 | Осень/18 194 | 8 | –0.10 [–0.64, 0.44] | 0 | F | 0.36 | 0.72 |
| % Жира | |||||||
| Зима/772 | Лето/751 | 10 | 0.30 [–0.43, 1.02] | 0 | F | 0.80 | 0.42 |
| Зима/240 | Весна/401 | 3 | 0.24 [–0.72, 1.21] | 0 | F | 0.49 | 0.62 |
| Зима/240 | Осень/291 | 3 | 0.23 [–0.83, 1.29] | 0 | F | 0.42 | 0.67 |
| Осень/291 | Лето/219 | 3 | –0.41 [–1.48, 0.65] | 0 | F | 0.76 | 0.45 |
| Весна/401 | Лето/219 | 3 | –0.48 [–1.45, 0.50] | 0 | F | 0.96 | 0.34 |
| Весна/401 | Осень/291 | 3 | –0.04 [–0.97, 0.89] | 0 | F | 0.09 | 0.93 |
| ИМТ, кг/м2 | |||||||
| Зима/23 230 | Лето/23 922 | 20 | 0.15 [0.05, 0.25] | 0 | F | 2.82 | 0.005 |
| Зима/21 239 | Весна/20 946 | 7 | 0.10 [–0.03, 0.23] | 0 | F | 1.56 | 0.12 |
| Зима/21 239 | Осень/22 291 | 7 | 0.04 [–0.08, 0.17] | 0 | F | 0.68 | 0.50 |
| Осень/22 291 | Лето/22 032 | 7 | 0.11 [0.00, 0.21] | 0 | F | 2.0 | 0.05 |
| Весна/20 946 | Лето/22 032 | 7 | 0.09 [–0.01, 0.20] | 0 | F | 1.78 | 0.08 |
| Весна/20 946 | Осень/22 291 | 7 | –0.04 [–0.15, 0.08] | 0 | F | 0.62 | 0.54 |
Рис. 5.
Зависимость от пола сезонной динамики (зима против лета) массы тела, содержания жира и индекса массы тела (ИМТ).
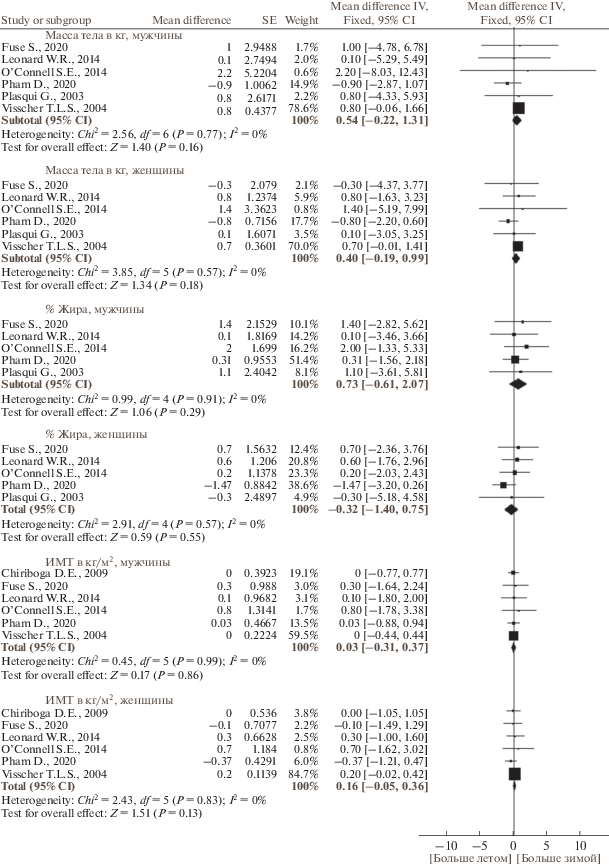
Рис. 6.
Зависимость от возраста сезонной динамики (зима против лета) массы тела, содержания жира и индекса массы тела (ИМТ).
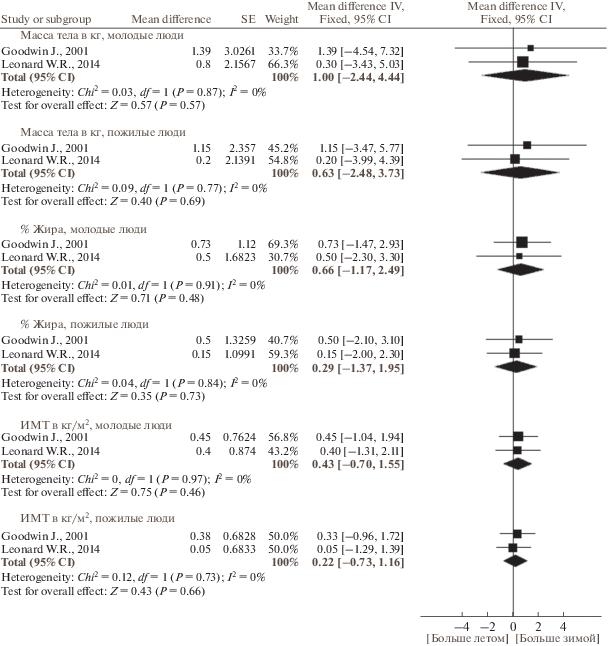
Рис. 7.
Зависимость от климата региона сезонной динамики (зима против лета) индекса массы тела (ИМТ в кг/м2).
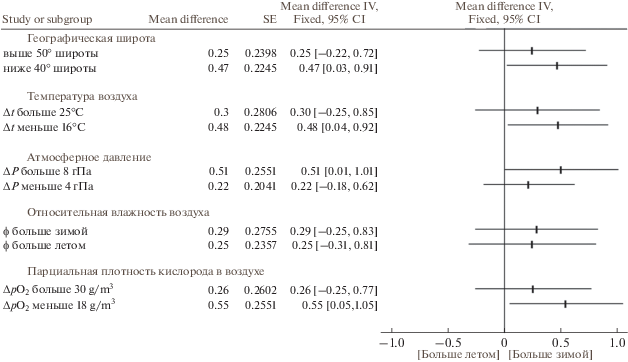
Таблица 4.
Сезонная динамика метеорологических факторов в исследуемых регионах (регионы расположены в порядке убывания географической широты)
| Регион | Температура воздуха, °С | Атмосферное давление, гПа | Относительная влажность, % | ρО2, г/м3 | ||||
|---|---|---|---|---|---|---|---|---|
| зима | лето | зима | лето | зима | лето | зима | лето | |
| Колари, Финляндия | –10.6 | 15.9 | 983 | 989 | 83 | 66 | 302 | 273 |
| Бердигестях, Саха, Россия | –33.6 | 19.5 | 993 | 976 | 68 | 61 | 335 | 266 |
| Сыктывкар, Россия | –10.8 | 16.9 | 1000 | 992 | 83 | 72 | 308 | 273 |
| Магадан, Россия | –14.5 | 11.9 | 993 | 992 | 64 | 82 | 310 | 278 |
| Абердин, Великобритания | 2.9 | 14.7 | 999 | 1002 | 88 | 85 | 291 | 278 |
| Ньюкасл, Великобритания | 2 | 14.7 | 989 | 993 | 85 | 77 | 289 | 276 |
| Амстердам, Нидерланды | 5 | 17 | 1012 | 1012 | 81 | 71 | 292 | 279 |
| Маастрихт, Нидерланды | 11.0 | 21.0 | 999 | 999 | 84 | 73 | 289 | 273 |
| Эксетер, Великобритания | 5.6 | 14.9 | 1013 | 1012 | 85 | 75 | 292 | 281 |
| Графства Корнуолл и Лестершир, Великобритания | 4.0 | 16.5 | 1004 | 1003 | 89 | 81 | 291 | 276 |
| Базель, Швейцария | 3.2 | 22.3 | 979 | 977 | 83 | 73 | 285 | 262 |
| Болонья, Италия | 8.2 | 26.5 | 1011 | 1006 | 77 | 67 | 288 | 265 |
| Вустер, Массачусетс, США | 0.1 | 23.1 | 997 | 998 | 66 | 73 | 294 | 267 |
| Саппоро, Япония | –3.6 | 22.9 | 1007 | 1003 | 70 | 77 | 301 | 264 |
| Рочестер, Миннесота, США | –4.6 | 23.0 | 965 | 965 | 78 | 78 | 290 | 258 |
| Хасиками, Япония | 0 | 22.6 | 1012 | 1006 | 73 | 87 | 298 | 268 |
| Бетесда (Мэриленд), США | 4.1 | 26.1 | 1004 | 1001 | 65 | 67 | 291 | 264 |
| Сендай, Япония | 3 | 28 | 1008 | 1006 | 59 | 77 | 294 | 262 |
| Сеул, Южная Корея | 1 | 24 | 1009 | 993 | 60 | 73 | 295 | 264 |
| Симоцуке, Япония | 2.4 | 22.3 | 1006 | 1001 | 74 | 85 | 294 | 268 |
| Токио, Япония | 7.8 | 25.0 | 1011 | 1003 | 55 | 81 | 289 | 265 |
| Нагакуте, Япония | 3 | 29 | 1007 | 1001 | 66 | 80 | 288 | 261 |
| Раанана, Израиль | 16.7 | 29 | 1011 | 1002 | 73 | 68 | 278 | 261 |
| Нью-Дели, Индия | 17.8 | 33.2 | 987 | 971 | 69 | 55 | 273 | 249 |
Физическая активность и диета могут оказать существенное влияние на массу тела. Хотя сезонные изменения физической активности будут зависеть от климатических условий, возраста [46], профессии, участия в сезонных работах [60], занятий сезонными видами спорта, во многих исследованиях было показано, что обычно летом среднестатистический человек делает больше шагов, чем зимой [61]. Некоторые работы, включенные в наш мета-анализ, сообщают о существенном увеличении физической активности летом по сравнению с зимой [43, 44, 46, 52, 53].
Цирканнуальные колебания погодных условий оказывают влияние на доступность различных продуктов питания, а культурные традиции, связанные с праздниками и постами, могут внести дополнительные коррективы в состав и калорийность диеты. Мета-анализ сезонной динамики изменений диеты в различных регионах [62] выявил определенные тенденции: фрукты чаще потребляли осенью; яйца, алкогольные напитки чаще включали в рацион весной и летом, а овощи и продукты из мяса – летом; крупы и зерновые продукты чаще ели осенью и весной; максимально калорийной диета была весной. Работа американских ученых [63] показала, что процент калорий, поступающих в организм от потребления насыщенных жиров, максимален в октябре–январе; от потребления ненасыщенных жиров – в августе–сентябре; от потребления углеводов – весной; а потребление протеинов одинаково в течение всего года. Согласно исследованиям, проведенным в Шотландии, калорийность диеты существенно не различалась между сезонами, но поступление в организм витаминов зависело от сезона. Пища была максимально насыщена витамином А весной, витамином С – летом и осенью, витамином Е – летом [64]. В некоторых исследованиях, включенных в наш мета-анализ сообщается об отсутствии различий между зимой и летом в калорийности питания [42, 43, 53, 54]. Также не было различий между мужчинами и женщинами в сезонной динамике количества потребляемых калорий [43, 53].
Следует отметить, что скорость общего метаболизма и общий расход энергии у людей по данным большинства работ также существенно не изменялись зимой по сравнению с летом [40, 42, 47, 50, 65, 66]. Однако в исследовании в Австралии наблюдали в культуре человеческих лейкоцитов увеличение клеточного дыхания и гликолитической активности зимой по сравнению с летом [40].
В итоге, несмотря на то, что масса тела и процентное содержание жира по результатам мета-анализа не показали сезонной динамики, ИМТ здоровых людей был больше зимой, чем летом. Хотя нельзя полностью исключить влияния связанных с сезоном изменений в общем метаболизме и диете, наиболее вероятная причина этой динамики заключается в сезонных колебаниях физической активности, которая максимальна летом и минимальна зимой.
ВЫВОДЫ
1. Масса тела и процентное содержание жира не имели выраженной сезонной динамики.
2. По результатам мета-анализа панельных и кросс-секциональных исследований ИМТ был больше зимой, чем летом.
3. Не было выявлено зависимости сезонной динамики массы тела, содержания жира и ИМТ от пола и возраста.
4. Географическая широта и амплитуда цирканнуальных колебаний метеорологических факторов не оказывали значимого влияния на сезонную динамику ИМТ.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Ebling F.J. On the value of seasonal mammals for identifying mechanisms underlying the control of food intake and body weight // Horm. Behav. 2014. V. 66. № 1. P. 56.
Arrojo E., Drigo R., Bianco A.C. Type 2 deiodinase at the crossroads of thyroid hormone action // Int. J. Biochem. Cell Biol. 2011. V. 43. № 10. P. 1432.
Dardente H., Hazlerigg D.G., Ebling F.J. Thyroid hormone and seasonal rhythmicity // Front. Endocrinol. (Lausanne). 2014. V. 5. P. 19.
Ostrowska Z., Kos-Kudla B., Marek B., Kajdaniuk D. Influence of lighting conditions on daily rhythm of bone metabolism in rats and possible involvement of melatonin and other hormones in this process // Endocr. Regul. 2003. V. 37. № 3. P. 163.
Sarne D. Effects of the Environment, Chemicals and Drugs on Thyroid Function / Eds. Feingold K.R., Anawalt B., Boyce A., Chrousos G., de Herder W.W., Dungan K., Grossman A., Hershman J.M., Hofland J., Kaltsas G., Koch C., Kopp P., Korbonits M., McLachlan R., Morley J.E., New M., Purnell J., Singer F., Stratakis C.A., Trence D.L., Wilson D.P. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc. 2000–. 2016 Sep. 27. PMID: 25 905 415.
Arancibia S., Rage F., Astier H., Tapia-Arancibia L. Neuroendocrine and autonomous mechanisms underlying thermoregulation in cold environment // Neuroendocrinology. 1996. V. 64. № 4. P. 257.
Louzada R.A., Santos M.C., Cavalcanti-de-Albuquerque J.P. et al. Type 2 iodothyronine deiodinase is upregulated in rat slow- and fast-twitch skeletal muscle during cold exposure // Am. J. Physiol. Endocrinol. Metab. 2014. V. 307. № 11. P. E1020.
O’Malley B.P., Cook N., Richardson A. et al. Circulating catecholamine, thyrotrophin, thyroid hormone and prolactin responses of normal subjects to acute cold exposure // Clin. Endocrinol. (Oxf). 1984. V. 21. № 3. P. 285.
Tsibulnikov S., Maslov L., Voronkov N., Oeltgen P. Thyroid hormones and the mechanisms of adaptation to cold // Hormones. 2020. V. 19. № 3. P. 329.
Mirit E., Palmon A., Hasin Y., Horowitz M. Heat acclimation induces changes in cardiac mechanical performance: the role of thyroid hormone // Am. J. Physiol. 1999. V. 276. № 2. P. R550.
de Bruijn R., Romero L.M. The role of glucocorticoids in the vertebrate response to weather // Gen. Comp. Endocrinol. 2018. V. 269. P. 11.
Romero L.M. Seasonal changes in plasma glucocorticoid concentrations in free-living vertebrates // Gen. Comp. Endocrinol. 2002. V. 128. № 1. P. 1.
Lee M.J., Pramyothin P., Karastergiou K., Fried S.K. Deconstructing the roles of glucocorticoids in adipose tissue biology and the development of central obesity // Biochim. Biophys. Acta. 2014. V. 1842. № 3. P. 473.
McCarthy H.D., Kilpatrick A.P., Trayhurn P., Williams G. Widespread increases in regional hypothalamic neuropeptide Y evels in acute cold-exposed rats // Neuroscience. 1993. V. 54. № 1. P. 127.
Pétervári E., Balaskó M., Uzsoki B., Székely M. Effects of neuropeptide Y antagonists on food intake in rats: differences with cold-adaptation // Peptides. 2006. V. 27. № 1. P. 150.
Farkas V., Kelenyi G., Sandor A. A dramatic accumulation of glycogen in the brown adipose tissue of rats following recovery from cold exposure // Arch. Biochem. Biophys. 1999. V. 365. № 1. P. 54.
Plasqui G., Kester A.D., Westerterp K.R. Seasonal variation in sleeping metabolic rate, thyroid activity, and leptin // Am. J. Physiol. Endocrinol. Metab. 2003. V. 285. № 2. P. E338.
Boon P., Visser H., Daan S. Effect of photoperiod on body mass, and daily energy intake and energy expenditure in young rats // Physiol. Behav. 1997. V. 62. № 4. P. 913.
Moreno J.P., Crowley S.J., Alfano C.A. et al. Potential circadian and circannual rhythm contributions to the obesity epidemic in elementary school age children // Int. J. Behav. Nutr. Phys Act. 2019. V. 16. № 1. P. 25.
Chambers J.B., Williams T.D., Nakamura A. et al. Cardiovascular and metabolic responses of hypertensive and normotensive rats to one week of cold exposure // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2000. V. 279. № 4. P. R1486.
Evans S.A., Parsons A.D., Overton J.M. Homeostatic responses to caloric restriction: influence of background metabolic rate // J. Appl. Physiol. (1985). 2005. V. 99. № 4. P. 1336.
Shechtman O., Fregly M.J., van Bergen P., Papanek P.E. Prevention of cold-induced increase in blood pressure of rats by captopril // Hypertension. 1991. V. 17. № 6. Pt. 1. P. 763.
Sun Z. Genetic AVP deficiency abolishes cold-induced diuresis but does not attenuate cold-induced hypertension // Am. J. Physiol. Renal Physiol. 2006. V. 290. № 6. P. F1472.
Horowitz M. From molecular and cellular to integrative heat defense during exposure to chronic heat // Comp. Biochem. Physiol A Mol. Integr. Physiol. 2002. V. 131. № 3. P. 475.
Matthew C.B. Heat acclimation in telemetry equipped rat // J. Therm. Biol. 1997. V. 22. № 4–5. P. 275.
Knight W.D., Witte M.M., Parsons A.D. et al. Long-term caloric restriction reduces metabolic rate and heart rate under cool and thermoneutral conditions in FBNF1 rats // Mech. Ageing Dev. 2011. V. 132. № 5. P. 220.
Deveci D., Egginton S. Effects of acute and chronic cooling on cardiorespiratory depression in rodents // J. Physiol. Sci. 2007. V. 57. № 1. P. 73.
Цибульнико С.Ю., Маслов Л.Н., Нарыжная Н.В., Иванов В.В. Хроническое периодическое воздействие холода не влияет на артериальное давление и устойчивость сердца к действию ишемии и реперфузии // Патол. физиол. и эксперим. терапия. 2018. Т. 62. № 1. С. 17. Tsibulnikov S.Y., Maslov L.N., Naryzhnaya N.V., Ivanov V.V. Chronic Periodic Cold Exposure Had No Affect the Blood Pressure and Stability of Heart to Action Ischemia and Reperfusion // Pathological Physiology and Experimental Therapy. 2018. V. 62. № 1. P. 17.
Fuse S., Sugimoto M., Kurosawa Y. et al. Relationships between plasma lipidomic profiles and brown adipose tissue density in humans // Int. J. Obes. (Lond). 2020. V. 44. № 6. P. 1387.
Au-Yong I.T., Thorn N., Ganatra R. et al. Brown adipose tissue and seasonal variation in humans // Diabetes. 2009. V. 58. № 11. P. 2583.
Kern P.A., Finlin B.S., Zhu B. et al. The effects of temperature and seasons on subcutaneous white adipose tissue in humans: evidence for thermogenic gene induction // J. Clin. Endocrinol. Metab. 2014. V. 99. № 12. P. E2772.
Nirengi S., Sakane N., Amagasa S. et al. Seasonal differences in brown adipose tissue density and pulse rate variability in a thermoneutral environment // J. Physiol. Anthropol. 2018. V. 37. № 1. P. 6.
Saito M., Okamatsu-Ogura Y., Matsushita M. et al. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity // Diabetes. 2009. V. 58. № 7. P. 1526.
Kuzmenko N.V., Tsyrlin V.A., Pliss M.G., Galagud-za M.M. Seasonal variations in levels of human thyroid-stimulating hormone and thyroid hormones: a meta-analysis // Chronobiol. Int. 2021. V. 38. № 3. Р. 301.
Holdaway I.M., Mason B.H., Gibbs E.E. et al. Seasonal variation in the secretion of mammotrophic hormones in normal women and women with previous breast cancer // Breast Cancer Res. Treat. 1997. V. 42. № 1. P. 15.
Koono N. Reciprocal changes in serum concentrations of triiodothyronine and reverse triiodothyronine between summer and winter in normal adult men // Endocrinol. Jpn. 1980. V. 27. № 4. P. 471.
Van Cauter E.W., Virasoro E., Leclercq R., Copinschi G. Seasonal, circadian and episodic variations of human immunoreactive beta-MSH, ACTH and cortisol // Int. J. Pept. Protein Res. 1981. V. 17. № 1. P. 3.
Kanikowska D., Sato M., Iwase S. et al. Effects of living at two ambient temperatures on 24-h blood pressure and neuroendocrine function among obese and non-obese humans: a pilot study // Int. J. Biometeorol. 2013. V. 57. № 3. P. 475.
Sung K.C. Seasonal variation of C-reactive protein in apparently healthy Koreans // Int. J. Cardiol. 2006. V. 107. № 3. P. 338.
Calton E.K., Keane K.N., Raizel R. et al. Winter to summer change in vitamin D status reduces systemic inflammation and bioenergetic activity of human peripheral blood mononuclear cells // Redox Biol. 2017. V. 12. P. 814.
Hattori T., Munakata M. Blood pressure measurement under standardized indoor condition may mask seasonal blood pressure variation in men with mildly elevated blood pressure // Clin. Exp. Hypertens. 2015. V. 37. № 4. P. 317.
Anthanont P., Levine J.A., McCrady-Spitzer S.K., Jensen M.D. Lack of Seasonal Differences in Basal Metabolic Rate in Humans: A Cross-Sectional Study // Horm. Metab. Res. 2017. V. 49. № 1. P. 30.
Chiriboga D.E., Ma Y., Li W. et al. Seasonal and sex variation of high-sensitivity C-reactive protein in healthy adults: a longitudinal study // Clin. Chem. 2009. V. 55. № 2. P. 313.
Clemes S.A., Hamilton S.L., Griffiths P.L. Summer to winter variability in the step counts of normal weight and overweight adults living in the UK // J. Phys. Act. Health. 2011. V. 8. № 1. P. 36.
Cizza G., Romagni P., Lotsikas A. et al. Plasma leptin in men and women with seasonal affective disorder and in healthy matched controls // Horm. Metab. Res. 2005. V. 37. № 1. P. 45.
Goodwin J., Pearce V.R., Taylor R.S. et al. Seasonal cold and circadian changes in blood pressure and physical activity in young and elderly people // Age Ageing. 2001. V. 30. № 4. P. 311.
Haggarty P., McNeill G., Manneh M.K. et al. The influence of exercise on the energy requirements of adult males in the UK // Br. J. Nutr. 1994. V. 72. № 6. P. 799.
Hassi J., Sikkilä K., Ruokonen A., Leppäluoto J. The pituitary-thyroid axis in healthy men living under subarctic climatological conditions // J. Endocrinol. 2001. V. 169. № 1. P. 195.
Kristal-Boneh E., Froom P., Harari G. et al. Summer-winter differences in 24 h variability of heart rate // J. Cardiovasc. Risk. 2000. V. 7. № 2. P. 141.
Leonard W.R., Levy S.B., Tarskaia L.A. et al. Seasonal variation in basal metabolic rates among the Yakut (Sakha) of Northeastern Siberia // Am. J. Hum. Biol. 2014. V. 26. № 4. P. 437.
Martinez-Nicolas A., Meyer M., Hunkler S. et al. Daytime variation in ambient temperature affects skin temperatures and blood pressure: Ambulatory winter/summer comparison in healthy young women // Physiol. Behav. 2015. V. 149. P. 203.
Mitsui T., Barajima T., Kanachi M., Shimaoka K. Daily walking activity among male office workers in a rural town in northern Japan // J. Physiol. Anthropol. 2010. V. 29. № 1. P. 43.
O’Connell S.E., Griffiths P.L., Clemes S.A. Seasonal variation in physical activity, sedentary behaviour and sleep in a sample of UK adults // Ann. Hum. Biol. 2014. V. 41. № 1. P. 1.
Pasquali R., Baraldi G., Casimirri F. et al. Seasonal variations of total and free thyroid hormones in healthy men: a chronobiological study // Acta Endocrinol. (Copenh). 1984. V. 107. № 1. P. 42.
Sinha P., Taneja Davender Kumar, Narender Pal Singh, Saha R. Seasonal Variation of Blood Pressure in Normotensive Females Aged 18 to 40 Years in an Urban Slum of Delhi, India // Asia Pacific J. Public Health. 2010. V. 22. № 1. P. 134.
Суханова И.В., Вдовенко С.И., Максимов А.Л. и др. Сравнительный анализ морфофункциональных показателей у жителей Европейского Севера и Северо-Востока России // Экология человека. 2014. № 10. С. 3. Sukhanova I.V., Vdovenko C.I., Maximov A.L. et al. Comparative analysis of morphofunctional indices in residents of European North and Russia North-East // Human Ecology. 2014. № 10. P. 3.
Nakayama K., Miyashita H., Yanagisawa Y., Iwamoto S. Seasonal effects of UCP1 gene polymorphism on visceral fat accumulation in Japanese adults // PLoS One. 2013. V. 8. № 9. P. e74720.
Pham D.D., Lee J.H., Hong K.H. et al. Seasonal effects on resting energy expenditure are dependent on age and percent body fat // Clin. Nutr. 2020. V. 39. № 4. P. 1276.
Visscher T.L., Seidell J.C. Time trends (1993–1997) and seasonal variation in body mass index and waist circumference in the Netherlands // Int. J. Obes. Relat. Metab. Disord. 2004. V. 28. № 10. P. 1309.
Sabbağ C. Seasonal BMI changes of rural women living in Anatolia // Int. J. Environ. Res. Public Health. 2012. V. 9. № 4. P. 1159.
Shephard R.J., Aoyagi Y. Seasonal variations in physical activity and implications for human health // Eur. J. Appl. Physiol. 2009. V. 107. № 3. P. 251.
Stelmach-Mardas M., Kleiser C., Uzhova I. et al. Seasonality of food groups and total energy intake: a systematic review and meta-analysis // Eur. J. Clin. Nutr. 2016. V. 70. № 6. P. 700.
Ma Y., Olendzki B.C., Li W. et al. Seasonal variation in food intake, physical activity, and body weight in a predominantly overweight population // Eur. J. Clin. Nutr. 2006. V. 60. № 4. P. 519.
Fyfe C.L., Stewart J., Murison S.D. et al. Evaluating energy intake measurement in free-living subjects: when to record and for how long? // Public Health Nutr. 2010. V. 13. № 2. P. 172.
Plasqui G., Westerterp K.R. Seasonal variation in total energy expenditure and physical activity in Dutch young adults // Obes. Res. 2004. V. 12. № 4. P. 688.
Buchowski M.S., Choi L., Majchrzak K.M. et al. Seasonal changes in amount and patterns of physical activity in women // J. Phys. Act. Health. 2009. V. 6. № 2. P. 252.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека