Физиология человека, 2022, T. 48, № 1, стр. 97-105
Ацетазоламид в терапии дыхания чейна–стокса у больных с хронической сердечной недостаточностью: рандомизированное исследование
К. В. Сорокина 1, *, М. Г. Полтавская 1, А. Д. Пальман 1, М. Д. Куклина 1, К. Ю. Харкевич 1, А. Д. Андреев 1, В. М. Куликов 1, В. П. Седов 1
1 ФГАОУ ВО Первый Московский государственный университет
имени И.М. Сеченова МЗ России (Сеченовский университет)
Москва, Россия
* E-mail: sorkl@bk.ru
Поступила в редакцию 28.05.2021
После доработки 11.06.2021
Принята к публикации 17.06.2021
- EDN: OBSSTD
- DOI: 10.31857/S0131164621060114
Аннотация
Проведена оценка долгосрочной эффективности диуретика ацетазоламида в терапии дыхания Чейна–Стокса у больных с хронической сердечной недостаточностью (ХСН) и низкой фракцией выброса левого желудочка (ФВЛЖ). В исследование был включен 21 пациент со стабильной сердечной недостаточностью II–IV функционального класса (NYHA) и дыханием Чейна–Стокса. Всем пациентам были проведены стандартное клинико-лабораторное обследование, анализ газов артериальной крови и кардиореспираторное мониторирование во время сна. Пациенты случайным образом были распределены в 2 группы. В основной группе (n = 10) больные получали стандартное медикаментозное лечение и ацетазоламид по 250 мг 1 раз в сутки, в контрольной группе (n = 11) – только “стандартное” медикаментозное лечение. Период наблюдения составлял 12 мес. Через 3 мес. терапии средний индекс апноэ/гипопноэ в основной группе на фоне терапии ацетазоламидом достоверно снизился с 32 до 13 (р = 0.005). Достоверных изменений индекса апноэ/гипопноэ в контрольной группе не наблюдалось. В группе ацетазоламида отмечено статистически значимое снижение рН крови (с 7.43 до 7.39; р = 0.007). В течение дальнейшего наблюдения в группе ацетазоламида умер 1 пациент (10%), а в контрольной группе – 4 пациента (36.4%) (различие недостоверно). Лечение ацетазоламидом 250 мг в сутки достоверно уменьшает выраженность дыхания Чейна–Стокса у больных с ХСН. Ацетазоламид можно рекомендовать для терапии дыхания Чейна–Стокса у пациентов с ХСН.
Несмотря на успехи, достигнутые в лечении хронической сердечной недостаточности (ХСН), прогноз при этом состоянии остается неблагоприятным [1, 2]. Частой находкой у больных ХСН с низкой фракцией выброса левого желудочка (ФВЛЖ) является периодическое дыхание Чейна–Стокса во время сна, наблюдающееся у 15–37% таких пациентов [3, 4]. Периодическое дыхание представляет собой специфическую респираторную патологию, которая является частным случаем синдрома центрального апноэ сна [5]. В ряде исследований показано, что дыхание Чейна–Стокса является независимым фактором риска смерти от сердечно-сосудистых заболеваний (ССЗ) у этих больных, и вероятность летального исхода напрямую коррелирует с тяжестью дыхательных нарушений во время сна [6, 7].
Тем не менее, подходы к терапии Чейна–Стокса у пациентов с ХСН до настоящего времени остаются предметом дискуссий. Так, в исследовании CANPAP было установлено, что неинвазивная вентиляция с постоянным положительным давлением (СИПАП11) потенциально может уменьшать тяжесть центрального апноэ во сне при ХСН [8]. Однако конечный эффект лечения значительно различается в зависимости от первичного ответа на терапию положительным давлением. В то время как выживаемость пациентов, у которых СИПАП эффективно устраняет дыхание Чейна–Стокса, достоверно выше, чем в контроле, продолжение этого лечения при сохраняющемся на фоне СИПАП-терапии центральном апноэ сна приводит к увеличению риска смерти от ССЗ [9]. Адаптивная сервовентиляция как еще один вариант неинвазивной респираторной поддержки показала более высокую эффективность и лучшую переносимость по сравнению с СИПАП-терапией [10]. Однако в результате исследования SERVE-HF было установлено, что, эффективно устраняя нарушения дыхания во время сна, адаптивная сервовентиляция у этих больных ведет к достоверному возрастанию сердечно-сосудистой смертности, а значит, им противопоказана [11].
Таким образом, вопрос об эффективном и при этом безопасном методе лечения дыхания Чейна–Стокса у пациентов с ХСН остается открытым, в том числе практически не исследованы возможности медикаментозной терапии. В небольшом числе работ зарубежных авторов было показано, что диуретический препарат ацетазоламид может уменьшать тяжесть центрального апноэ сна [12–15], в том числе у пациентов с ХСН и дыханием Чейна−Стокса [16, 17]. Однако эти исследования носили краткосрочный характер и проводились на небольшом числе пациентов, что не позволяет оценить долговременную эффективность и безопасность такого лечения. Тем не менее, препарат ацетазоламид длительно применяется в рамках диуретической терапии при ХСН [1, 18–20].
В связи с этим целью настоящего исследования была оценка долгосрочной эффективности диуретика ацетазоламида в терапии дыхания Чейна–Стокса у больных с ХСН.
МЕТОДИКА
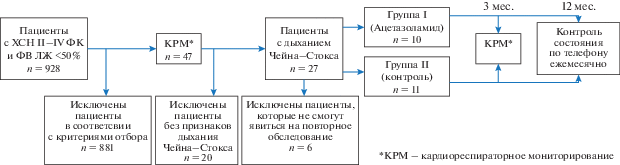
На этапе скрининга обследовали 928 пациентов – мужчин и женщин старше 18 лет с ХСН II–IV функционального класса (ФК) по классификации NYHA (критерии Европейского общества кардиологов 2016 г. [21]), госпитализированных в 2016–2019 гг. в отделение кардиологии Университетской клинической больницы № 1 Сеченовского университета (г. Москва), у которых на фоне терапии была достигнута стабилизация состояния. Из них были исключены пациенты с ФВЛЖ ≥ ≥ 50%, с индексом массы тела (ИМТ) более 30 кг/м2, уровнем гемоглобина крови менее 110 г/л, хронической болезнью почек (ХБП) 3Б стадии и выше, с хроническими заболеваниями легких, осложнившимися хронической дыхательной недостаточностью, больные с указаниями на регулярный храп, с активным онкологическим заболеванием, острым нарушением мозгового кровообращения (ОНМК) в анамнезе, с психическими нарушениями, препятствующими проведению исследования, а также с планирующимися хирургическими или электрофизиологическими вмешательствами, способными существенно повлиять на течение ХСН.
На основании этих критериев отобрали 47 пациентов. После подбора оптимальной терапии включенным пациентам проводили кардиореспираторное мониторирование во время сна (КРМ) с регистрацией назального воздушного потока, храпа, дыхательных движений грудной клетки, насыщения артериальной крови кислородом (SpO2) при помощи пульсоксиметрии, пульса и положения тела в постели [2].
Центральное апноэ определяли как дыхательную паузу во время сна, характеризующуюся отсутствием как носового воздушного потока, так и дыхательных движений грудной клетки длительностью 10 с и более, а гипопноэ – как уменьшение носового воздушного потока на 30% и более по сравнению с исходным в течение не менее 10 с в сочетании со снижением SpO2 на 3% и более. Выраженность дыхательных расстройств оценивали на основании индекса апноэ/гипопноэ (ИАГ), т.е. среднего числа эпизодов апноэ и гипопноэ за час исследования [22].
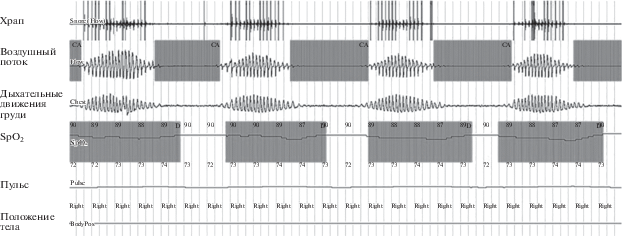
Под дыханием Чейна–Стокса понимали специфический паттерн дыхания с характерным чередованием циклов, состоящих из периода нарастания легочной вентиляции и последующего ее убывания вплоть до центрального апноэ или гипопноэ (рис. 1). Пациентами с синдромом центрального апноэ сна по типу дыхания Чейна–Стокса считали больных с ИАГ более 5, с преобладанием центральных нарушений дыхания над обструктивными и наличием периодов типичного “веретенообразного” дыхательного рисунка [23].
Рис. 1.
Кардиореспираторное мониторирование во время сна у больного с ХСН и дыханием Чейна–Стокса [собственное наблюдение]. Регистрируется специфический “веретенообразный” дыхательный рисунок с характерным чередованием периодов гипервентиляции, гиповентиляции и апноэ. Отсутствие дыхательных движений во время эпизодов апноэ свидетельствует об их центральном характере. ХСН – хроническая сердечная недостаточность; SpO2 – насыщение артериальной крови кислородом.
При КРМ центральное апноэ сна (ЦАС) с дыханием Чейна–Стокса выявили у 27 пациентов, из них 21 пациент (20 мужчин и 1 женщина) был включен в дальнейшее исследование. Остальные пациенты не были включены в связи с отдаленным местом проживания и невозможностью проведения повторного исследования. Затем пациентов рандомизировали на две группы – группу ацетазоламида и группу обычного лечения (контроль) в соотношении один к одному. Рандомизацию производили методом конвертов. Дизайн исследования представлен на рис. 2.
Всем пациентам проводили клинико-лабораторное и инструментальное обследование в рамках актуальных медико-экономических стандартов, включая эхокардиографию, а также исследовали парциальное давление углекислого газа в артериальной крови (РаСО2) и водородный показатель крови (рН) на основании анализа состава артериальной крови как основные показатели, имеющие отношение к регуляции дыхания. Выполняли тест с 6-минутной ходьбой (ТШХ) с оценкой пройденного расстояния. Кроме того, проводили анкетирование с целью оценки качества жизни с помощью Канзасского опросника для больных кардиомиопатией (Kansas City Cardiomyopathy Questionnaire, KCCQ, США) [24], Миннесотского опросника качества жизни больных хронической сердечной недостаточностью (Minnesota Living with Heart Failure Questionnaire, MLHFQ, США) [25]. Для субъективной оценки общего самочувствия применяли Визуальную аналоговую шкалу (ВАШ): пациенту предлагали провести вертикальную линию, соответствующую его самочувствию на данный момент, на горизонтальной шкале с градацией от 0 до 10, где 0 – наихудшее, а 10 – наилучшее самочувствие в представлении пациента. Применяли также разработанный нами опросник качества сна и бодрствования (пациент оценивал в баллах качество сна и вероятность уснуть в различных повседневных ситуациях) [26].
Пациенты в 1-й группе (n = 10) получали стандартную медикаментозную терапию согласно текущим национальным рекомендациям по лечению ХСН [27], а также ацетазоламид в дозе 250 мг за 1 ч до сна ежедневно; во 2-й (контрольной) группе (n = 11) пациентам назначали только стандартную медикаментозную терапию.
Через 3 мес. пациентов приглашали для контрольного обследования, при котором проводили повторно все перечисленные исследования, чтобы оценить динамику общего состояния и возможные изменения тяжести центральных нарушений дыхания во время сна. В дальнейшем в течение 12 мес. ежемесячно проводили регулярный телефонный контакт с больными, контроль состояния и приверженности к лечению.
Для статистического анализа данных использовали непараметрические критерии. Для описания количественных признаков рассчитывали медиану (Ме), нижний и верхний квартили [LQ; UQ], минимальное и максимальное значения. Достоверность различий количественных показателей в независимых выборках определяли с помощью критерия Манна–Уитни, качественных показателей – с помощью точного двухстороннего теста Фишера. Для оценки достоверности разницы показателей до и после терапии использовали критерий Вилкоксона. Результаты считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристики пациентов, вошедших в исследование, представлены в табл. 1. При сравнении двух групп пациентов не было выявлено статистически значимых различий по полу, возрасту, ИМТ, коморбидным состояниям, функциональному классу ХСН, показателям качества жизни и субъективной оценки самочувствия, тяжести систолической дисфункции ЛЖ, а также показателям рН и РаСО2 в состоянии бодрствования. Толерантность к физической нагрузке по данным ТШХ в группе сравнения была несколько выше, но эти различия не достигали статистической значимости. В группу терапии ацетазоламидом оказались распределены пациенты с более высокими значениями Е/e', большей тяжестью нарушений дыхания во время сна, несколько большей степенью ночной гипоксемии по сравнению с контролем и большей степенью дневной сонливости.
Таблица 1.
Сравнительная характеристика пациентов
| Параметр | 1-я группа (ацетазоламид), n = 10 | 2-я группа (контроль), n = 11 | p |
|---|---|---|---|
| Пол: М/ Ж | 10/0 | 10/1 | н/д |
| Возраст, годы | 72.5 [64.8; 80.5] | 72.0 [68.5; 76.0] | н/д |
| Индекс массы тела, кг/м2 | 24.9 [24.2; 26.5 ] | 25.9 [24.7; 27.9 ] | н/д |
| ФК ХСН: | |||
| II | 3 | 3 | |
| III | 6 | 4 | н/д |
| IV | 1 | 4 | |
| ИБС (n) | 10 | 9 | н/д |
| Гипертоническая болезнь (n) | 7 | 8 | н/д |
| Фибрилляция предсердий (n) | 4 | 6 | н/д |
| ХБП < 3Б стадии (n) | 3 | 4 | н/д |
| Сахарный диабет (n) | 1 | 2 | н/д |
| ИАПФ/БРА (n) | 8 | 10 | н/д |
| Бета-адреноблокаторы (n) | 9 | 11 | н/д |
| Диуретики (n) | 10 | 11 | н/д |
| АМКР (n) | 8 | 9 | н/д |
| Дигоксин (n) | 2 | 3 | н/д |
| Статины (n) | 8 | 10 | н/д |
| ФВ ЛЖ, % | 38 [28; 43 ] | 34 [27; 39 ] | н/д |
| Е/е' | 21.9 [14.4; 24.1 ] | 10.2 [8.4; 14.0] | 0.006 |
| VTI, см | 11.2 [9.1; 13.6 ] | 13.0 [11.8; 16.6 ] | н/д |
| dP/dt, мм рт. ст. | 699 [495; 862] | 714 [625; 1010] | н/д |
| СДЛА, мм рт. ст. | 40 [36; 53 ] | 49 [35; 57 ] | н/д |
| ИАГ, в час | 32 [26; 41 ] | 24 [20, 27] | 0.016 |
| SpO2 ср., % | 92 [92; 94] | 94 [93; 95] | 0.020 |
| рН | 7.43 [7.42; 7.46 ] | 7.45 [7.44; 7.46 ] | н/д |
| РаСО2, мм рт. ст. | 34.1 [32.3; 34.9 ] | 34.6 [33.7; 36.8 ] | н/д |
| ТШХ, м (1) | 249 [197; 328] | 347 [260; 390] | н/д |
| KCCQ: СКП (баллы) | 685 [455; 758] | 721 [594; 962] | н/д |
| KCCQ: ПФС (баллы) | 387 [275; 446] | 410 [335; 459] | н/д |
| Анкета качества сна, баллы | 4.5 [3; 6] | 3 [3; 5] | н/д |
| Анкета бодрствования, баллы | 7 [5.8; 8.3 ] | 3 [3; 5] | 0.048 |
| MLHFQ, баллы | 38 [29; 47 ] | 41 [18; 53 ] | н/д |
| ВАШ самочувствия | 3.4 [2.9; 5.0] | 3.5 [1.5; 5.0] | н/д |
Примечание: (1) – учтены данные 8 пациентов из 1-й группы (ацетазоламид) и 7 из 2-й группы (контроль) (остальные не выполнили ТШХ в связи патологией суставов); dP/dt – скорость изменения давления в левом желудочке во время его изоволюмического сокращения; Е – скорость раннего диастолического наполнения левого желудочка, е' – скорость подъема основания левого желудочка в раннюю диастолу; KCCQ – Канзасский опросник пациентов с кардиомиопатией, MLHFQ – Миннесотский опросник качества жизни больных с сердечной недостаточностью; РаСО2 – парциальное давление углекислого газа в артериальной крови; SpO2 – насыщение артериальной крови кислородом, измеренное при помощи пульсоксиметрии; VTI – интеграл линейной скорости потока в выносящем тракте левого желудочка; АМКР – антагонисты минералокортикоидных рецепторов; БРА – блокаторы рецепторов ангиотензина; ВАШ – визуальная аналоговая шкала; ИАГ – индекс апноэ/гипопноэ; ИАПФ – ингибиторы ангиотензинпревращающего фермента; ИБС – ишемическая болезнь сердца, ПФС – показатель функционального статуса, СДЛА – систолическое давление в легочной артерии; СКП – суммарный клинический показатель, ТШХ – тест с 6-минутной ходьбой; ФВ ЛЖ – фракция выброса левого желудочка; ХБП – хроническая болезнь почек; жирным шрифтом выделены значимые различия между группами.
При повторном обследовании (табл. 2) у пациентов 1-й группы на фоне терапии ацетазоламидом отмечалось статистически значимое снижение ИАГ и в соответствии с этим – значимое повышение средних значений SpO2 во время сна, тогда как во 2-й группе изменения этих показателей не достигли степени статистической достоверности. У пациентов, принимавших ацетазоламид, наблюдалось статистически достоверное увеличения пройденного расстояния при ТШХ. В контрольной группе прирост дистанции ТШХ оказался статистически незначимым. В 1-й группе значимо снижался рН крови, в то время как РаCO2 недостоверно снизилось. В группе контроля как рН крови, так и РаСО2 остались без существенных изменений. При эхокардиографии в группе ацетазоламида практически нормализовался средний показатель E/e', хоть это изменение оказалось статистически недостоверным, ФВЛЖ и другие показатели систолической функции в обеих группах изменились несущественно.
Таблица 2.
Изменение показателей через 3 мес. терапии
| Параметр | 1-я группа (ацетазоламид) | р | 2-я группа (контроль) | р | ||
|---|---|---|---|---|---|---|
| исходно | через 3 мес. терапии | исходно | через 3 мес. терапии | |||
| ФВ ЛЖ, % | 38 [28; 43 ] | 40 [33; 51 ] | н/д | 34 [27; 39 ] | 34 [29; 35] | н/д |
| Е/е' | 21.9 [17.1; 23.2 ] | 13.8 [11.3; 15.6 ] | н/д | 10.2 [9.2; 14 ] | 13.5 [9; 14] | н/д |
| VTI, см | 11.2 [10.3; 13.1 ] | 13.9 [12.2; 14.0] | н/д | 13.0 [12; 13.7 ] | 12.0 [9.5; 13.0] | н/д |
| СДЛА, мм рт. ст. | 40 [37; 50 ] | 38 [28; 42 ] | н/д | 49 [38; 56 ] | 55 [34; 57] | н/д |
| ИАГ, в час | 32 [26; 41 ] | 13 [10; 23] | 0.005 | 24 [20; 27] | 20 [14; 27] | н/д |
| SpO2 ср., % | 92 [92; 94] | 94 [93; 94] | 0.022 | 94 [93; 95] | 94 [93; 95] | н/д |
| рН крови | 7.43 [7.42; 7.46 ] | 7.39 [7.37; 7.40 ] | 0.007 | 7.45 [7.44; 7.46 ] | 7.43 [7.42; 7.44 ] | н/д |
| РаСО2, мм рт. ст. | 34.1 [32.3; 34.9 ] | 31.4 [29.1; 32.9 ] | н/д | 34.6 [33.7; 36.8 ] | 34.5 [33.8; 35.3 ] | н/д |
| ТШХ, м (1) | 249 [197; 328] | 285 [263; 418] | 0.035 | 347 [260; 390] | 390 [288; 408] | н/д |
| KCCQ: СКП (баллы) | 685 [526; 740] | 803 [714; 912] | 0.037 | 721 [637; 889] | 731 [694; 756] | н/д |
| KCCQ: ПФС (баллы) | 387 [323; 429] | 462 [372; 547] | н/д | 410 [343; 458] | 395 [378; 415] | н/д |
| Анкета качества сна, баллы | 5 [3; 6] | 3 [1; 4] | 0.048 | 3 [3; 5] | 3 [2; 3] | н/д |
| Анкета бодрствования, баллы | 7 [6; 8] | 6 [4; 9] | н/д | 3 [3; 4] | 7 [4; 11] | н/д |
| MLHFQ, баллы | 38 [31; 44 ] | 36 [25; 45 ] | н/д | 41 [25; 53 ] | 30 [24; 48 ] | н/д |
| ВАШ самочувствия | 3.4 [3.0; 5.0] | 4.0 [3.4; 5.3 ] | н/д | 3.5 [1.8; 4.7 ] | 4.8 [4.2; 5.0] | н/д |
Примечание: обозначения см. табл. 1.
Следует отметить также, что в группе лечения ацетазоламидом в отличие от контрольной группы как Канзасский опросник, так и анкета для оценки сна показали небольшое, но достоверное улучшение качества жизни, а также качества сна.
За время последующего наблюдения, которое в среднем составило 11 мес., в контрольной группе умерли 4 пациента, в то время как в группе ацетазоламида – только 1, однако эти различия между группами не достигают статистической значимости, поэтому можно говорить лишь о наблюдающейся положительной тенденции.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Дыхание Чейна−Стокса, являющееся частным примером центрального апноэ сна, часто выявляется у пациентов с ХСН во время сна, однако механизм его возникновения у них до конца не изучен [5, 28]. Считается, что возрастающая на фоне застойных явлений в легких вентиляция приводит к понижению в крови концентрации СО2, которая во сне достигает значений пороговых для апноэ. В результате развивается дыхание Чейна−Стокса, характеризующееся сменой эпизодов постепенного нарастания и убывания дыхательной активности вплоть до возникновения гипопноэ или апноэ. В норме регуляция дыхания ориентирована преимущественно на концентрацию СО2, а насыщение крови кислородом в гораздо меньшей степени влияет на легочную вентиляцию. Хеморецепторы головного мозга чувствительны к содержанию СО2, а также к изменениям кислотно-щелочного состояния (КЩС) крови и омывающей их церебральной жидкости. Соответственно гипокапния и повышение рН ведут к уменьшению легочной вентиляции вплоть до центрального апноэ, в то время как гиперкапния и последующее снижение рН сопровождаются увеличением вентиляции легких [29]. Предполагается, что дыхание Чейна–Стокса возникает за счет чередований возрастания и убывания респираторной стимуляции в зависимости от колебаний РаСО2 выше и ниже величины, являющейся пороговой для возникновения апноэ. Периодическое дыхание возникает в случае, если РаСО2 исходно сопоставимо с индивидуальным порогом возникновения апноэ, так как в этом случае даже небольшие изменения вентиляции легких приводят к колебаниям содержания CO2 выше или ниже уровня, который необходим для нормального дыхания или возникновения апноэ [30].
Ацетазоламид является системным ингибитором карбоангидразы и обладает умеренной диуретической активностью. При этом он повышает экскрецию гидрокарбонатов, что приводит к метаболическому ацидозу [31, 32] и оказывает на дыхание стимулирующий эффект [33]. Предполагается, что на фоне развивающегося ацидоза изменяется чувствительность периферических хеморецепторов и возрастает разница между существующим PаCO2 и его нижним пороговым значением, необходимым для возникновения центрального апноэ, что у пациентов с дыханием Чейна–Стокса приводит к стабилизации дыхания во время сна [34]. Кроме того, положительный эффект от приема ацетазоламида может также реализовываться за счет его диуретического действия и уменьшения застойных явлений, что может улучшать течение ХСН [16, 35].
Эффективность ацетазоламида в различных дозах при апноэ во сне различного генеза исследована в немногочисленных работах, включавших небольшое число пациентов, в основном при краткосрочном наблюдении. Так, C. Schmickl et al., опубликовавшим в 2020 г. метаанализ по данной тематике, удалось найти 28 исследований (включая 12 наблюдательных), половина из которых посвящены обструктивному, а не центральному апноэ сна. Число пациентов в группах ацетазоламида и сравнения составляло от 6 до 21 чел., а медиана среднего срока наблюдения – 6 дней. По результатам метаанализа на фоне ацетазоламида существенно снижался ИАГ, что сопровождалось повышением SpO2, а также улучшением качества сна и снижением АД, причем наибольший эффект продемонстрировали высокие дозы – не менее 500 мг/сут [13].
Большинство работ по применению ацетазоламида при преимущественно центральном апноэ посвящены ЦАС, возникающему на высокогорье, и идиопатическому ЦАС. Так, у 6 пациентов с идиопатическим ЦАС D.P. White et al. выявили значимое уменьшение тяжести апноэ сна после недельного применения препарата [36]. В исследовании с наибольшей продолжительностью (90 дней) W.A. DeBacker et al. получены аналогичные результаты на фоне применения препарата в дозе 250 мг в сутки [12].
В нескольких наблюдательных исследованиях, включавших от 12 до 74 пациентов, и в трех краткосрочных рандомизированных клинических исследованиях (РКИ), включавших от 6 до 20 пациентов, изучалась эффективность ацетазоламида при ХСН как декомпенсированной, так и стабильной. По результатам метаанализа этих исследований ацетазоламид способствовал существенному снижению pH и повышению натрийуреза [37]. В двух из упомянутых РКИ оценивали влияние препарата на тяжесть ЦАС у пациентов с дыханием Чейна−Стокса [16, 36]. По данным исследования S. Javaheri et al., проведенного в 2006 г. на 12 пациентах со стабильной ХСН II–III функционального класса NYHA, назначение ацетазоламида приводило к регрессу нарушений дыхания во время сна, повышению сатурации кислородом, а также улучшению качества сна и повышению дневной активности [16]. На основании этого единственного исследования Американская академия медицины сна (AASM) предложила рассматривать ацетазоламид в качестве одной из возможных опций для коррекции ЦАС, ассоциированного с ХСН [15]. За время, прошедшее после этой публикации, завершены исследования, продемонстрировавшие недостаточную эффективность или потенциальную опасность других методов лечения – СИПАП-терапии и адаптивной сервовентиляции [9, 11], однако не появилось и новых данных в поддержку терапии ацетазоламидом.
В наше рандомизированное исследование для оценки эффективности применения ацетазоламида при дыхании Чейна–Стокса из 928 обследованных пациентов с ХСН II–IV ФК было отобрано лишь 47, у 27 из которых было выявлено периодическое дыхание, и 21 из которых могли быть обследованы повторно через 3 мес. Небольшое число отобранных пациентов объясняется жесткими критериями, исключавшими, в частности, пациентов с сохраненной ФВЛЖ, с ХБП ≥ 3Б стадии, с высокой вероятностью обструктивного апноэ сна или других причин нарушений дыхания (ожирение, регулярный храп, перенесенный инсульт, дыхательная недостаточность), а также с планирующимися вмешательствами, которые могли значимо повлиять на течение ХСН (трансплантация сердца, коронарная реваскуляризация, имплантация устройства ресинхронизирующей терапии и др.).
По результатам нашего исследования добавление к оптимальной терапии ХСН ацетазоламида в дозе 250 мг один раз в сутки за 1 ч до сна в течение 3 мес. существенно снизило тяжесть периодического дыхания, уменьшив количество центральных респираторных событий (ИАГ), и улучшило оксигенацию крови во время сна. Это сопровождалось улучшением качества сна (достоверно) и бодрствования (недостоверно), повышением толерантности к физическим нагрузкам по результатам ТШХ и Суммарного клинического показателя качества жизни Канзасского опросника. У пациентов в группе сравнения, получавших лишь рекомендуемую оптимальную терапию ХСН, существенных изменений указанных показателей не произошло. В целом данные результаты совпадают с результатами, полученными S. Javaheri при лечении ацетазоламидом в течение 6 дней [16]. Существенным отличием нашей работы является значительно более длительный срок терапии и наблюдения.
Нами впервые было предпринято исследование длительного лечения ацетазоламидом у пациентов с ХСН: в среднем срок наблюдения составлял 11 мес. При небольшом количестве включенных больных невозможно достоверно оценить влияние препарата на прогноз, однако можно отметить, что он его, по меньшей мере, не ухудшал: в группе ацетазоламида умер один из 10 пациентов (10%), тогда как в группе стандартной терапии умерло 4 из 11 (36.4%), при том, что изначально состояние пациентов в группе ацетазоламида было, по всей видимости, более тяжелым.
Исходно в группу ацетазоламида случайным образом были распределены пациенты со значимо более высоким ИАГ и более значительной десатурацией кислорода во время сна, большей степенью сонливости в дневное время по данным анкеты бодрствования, худшими гемодинамическими показателями (более высоким Е/е'). Толерантность к нагрузке, по данным ТШХ, также была ниже, чем в группе сравнения, хоть и статистически недостоверно. Через 3 мес. терапии ацетазоламидом, помимо уменьшения проявлений ЦАС, наблюдалось снижение Е/е', хоть статистически и недостоверное. Таким образом, эффект препарата мог быть обусловлен не только его специфическим метаболическим, но и диуретическим действием – уменьшением застоя и, соответственно, тяжести сердечной недостаточности.
Небольшое количество пациентов в исследовании, обусловленное жесткими критериями отбора, не позволило оценить влияние исследуемого препарата на клинически значимые исходы, а также, вероятно, отразилось на статистической достоверности полученных результатов. Ограничением исследования является также открытый дизайн и отсутствие плацебо в группе сравнения. Эти факторы могли обусловить некоторые различия в исходном состоянии пациентов сравниваемых групп. Указанные ограничения не являются принципиальными, но подтверждают необходимость проведения в дальнейшем многоцентровых рандомизированных исследований с двойным слепым дизайном.
ЗАКЛЮЧЕНИЕ
В небольшом пилотном рандомизированном исследовании у стабильных больных с ХСН II–IV ФК со сниженной и промежуточной ФВЛЖ и дыханием Чейна−Стокса терапия ацетазоламидом в дозе 250 мг в сутки в дополнение к оптимальной медикаментозной терапии в течение 3 мес. приводила к снижению концентрации СО2 в крови, уменьшению тяжести апноэ во время сна, увеличению дистанции теста 6-минутной ходьбы, а также к улучшению качества жизни и сна. За 11 мес. на фоне ацетазоламида умер 1 из 10 пациентов, а в группе сравнения умерли 4 из 11 пациентов. С учетом полученных данных представляется целесообразным проведение крупных исследований влияния длительной терапии ацетазоламидом на смертность и частоту госпитализаций у пациентов с ХСН.
Этические нормы. Протокол исследования соответствует положениям Хельсинкской декларации и принципам биомедицинской этики, одобрен локальным этическим комитетом Первого Московского государственного университета им. И.М. Сеченова Минздрава России (Сеченовский университет) (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020 // Российский кардиологический журн. 2020. Т. 25. № 11. С. 4083. Russian Society of Cardiology (RSC). 2020 [Clinical practice guidelines for Chronic heart failure] // Russian Journal of Cardiology. 2020. V. 25. № 11. Р. 4083.
Driver H.S., Pereira E.J., Bjerring K. et al. Validation of the MediByte type 3 portable monitor compared with polysomnography for screening of obstructive sleep apnea // Can. Respir. J. 2011. V. 18. № 3. P. 137.
Javaheri S. Sleep disorders in systolic heart failure: a prospective study of 100 male patients. The final report // Int. J. Cardiol. 2006. V. 106. № 1. P. 21.
Ferrier K., Campbell A., Yee B. et al. Sleep-disordered breathing occurs frequently in stable outpatients with congestive heart failure // Chest. 2005. V. 128. № 4. P. 2116.
Eckert D.J., Jordan A.S., Merchia P., Malhotra A. Central sleep apnea: Pathophysiology and treatment // Chest. 2007. V. 131. № 2. P. 595.
Corra U., Pistono M., Mezzani A. et al. Sleep and exertional periodic breathing in chronic heart failure: prognostic importance and interdependence // Circulation. 2006. V. 113. № 1. P. 44.
Javaheri S., Shukla R., Zeigler H., Wexler L. Central sleep apnea, right ventricular dysfunction, and low diastolic blood pressure are predictors of mortality in systolic heart failure // J. Am. Coll. Cardiol. 2007. V. 49. № 20. P. 2028.
Bradley T.D., Logan A.G., Kimoff R.J. et al. Continuous positive airway pressure for central sleep apnea and heart failure // N. Engl. J. Med. 2005. V. 353 № 19. P. 2025.
Arzt M., Floras J.S., Logan A.G. et al. Suppression of central sleep apnea by continuous positive airway pressure and transplant-free survival in heart failure: a post hoc analysis of the Canadian Continuous Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure Trial (CANPAP) // Circulation. 2007. V. 115. № 25. P. 3173.
Philippe C., Stoica-Herman M., Drouot X. et al. Compliance with and effectiveness of adaptive servoventilation versus continuous positive airway pressure in the treatment of Cheyne-Stokes respiration in heart failure over a six month period // Heart. 2006. V. 92. № 3. P. 337.
Cowie M.R., Woehrle H., Wegscheider K. et al. Adaptive Servo-Ventilation for Central Sleep Apnea in Systolic Heart Failure // N. Engl. J. Med. 2015. V. 373. № 12. P. 1095.
DeBacker W.A., Verbraecken J., Willemen M. et al. Central apnea index decreases after prolonged treatment with acetazolamide // Am. J. Respir. Crit. Care Med. 1995. V. 151. № 1. P. 87.
Schmickl C., Landry S., Orr J. et al. Acetazolamide for Obstructive and Central Sleep Apnea: A Comprehensive Systematic Review and Meta-Analysis // CHEST. 2020. V. 158. № 6. P. 2632.
Wongboonsin J., Thongprayoon C., Bathini T. et al. Acetazolamide Therapy in Patients with Heart Failure: A Meta-Analysis // J. Clin. Med. 2019. V. 8. № 3. P. 349.
Aurora R.N., Chowdhuri S., Ramar K. et al. The treatment of central sleep apnea syndromes in adults: practice parameters with an evidence-based literature review and meta-analyses // Sleep. 2012. V. 35. № 1. P. 17.
Javaheri S. Acetazolamide improves central sleep apnea in heart failure: a double-blind, prospecive study // Am. J. Respir. Crit. Care Med. 2006. V. 173. № 2. P. 234.
Fontana M., Emdin M., Giannoni A. et al. Effect of acetazolamide on chemosensitivity, Cheyne-Stokes respiration, and response to effort in patients with heart failure // Am. J. Cardiol. 2011. V. 107. № 11. P. 1675.
Imiela T., Budaj A. Acetazolamide as Add-on Diuretic Therapy in Exacerbations of Chronic Heart Failure: A Pilot Study // Clin. Drug Investig. 2017. V. 37. № 12. P. 1175.
Mullens W., Damman K., Harjola V.-P. et al. The use of diuretics in heart failure with congestion – a position statement from the Heart Failure Association of the European Society of Cardiology // Eur. J. Heart Fail. 2019. V. 21. № 2. P. 137.
Мареев В.Ю., Гарганеева А.А., Агеев Ф.Т. и др. Экспертное мнение по применению диуретиков при хронической сердечной недостаточности. Общество специалистов по сердечной недостаточности // Кардиология. 2020. Т. 60. № 12. С. 13. Mareev V.Yu., Garganeeva A.A., Ageev F.T. et al. [The use of diuretics in chronic heart failure. Position paper of the Russian Heart Failure Society] // Kardiologiia. 2020. V. 60. № 12. Р. 13.
Ponikowski P., Voors A.A., Anker S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC // Eur. Heart J. 2016. V. 37. № 27. P. 2129.
Бузунов Р.В., Пальман А.Д., Мельников А.Ю. и др. Диагностика и лечение синдрома обструктивного апноэ сна у взрослых. Рекомендации Российского общества сомнологов // Эффективная фармакотерапия. 2018. № 35. С. 34. Buzunov R.V., Palman A.D., Melnikov A.Yu. et al. [Diagnosis and treatment of obstructive sleep apnea syndrome in adults. Recommendations of the Russian Society of Somnologists] // Effective Pharmacotherapy. 2018. № 35. Р. 34.
American Academy of Sleep Medicine. International classification of sleep disorders, 3rd ed. American Academy of Sleep Medicine, 2014. 401 c.
Green C.P., Porter C.B., Bresnahan D.R., Spertus J.A. Development and evaluation of the Kansas City Cardiomyopathy Questionnaire: a new health status measure for heart failure // J. Am. Coll. Cardiol. 2000. V. 35. № 5. P. 1245.
Rector T.S., Kubo S.H., Cohn J.N. Patients’ self-assessment of their congestive heart failure. Part 2: Content, reliability and validity of a new measure, the Minnesota Living with Heart Failure questionnaire // Heart Fail. 1987. P. 198.
Пальман А.Д. Синдром обструктивного апноэ во сне / Актуальные вопросы пульмонологии. М.: Ньюдиамед, 1999. 125 с. Palman A.D. [Obstructive sleep apnea syndrome / Actual problems of pulmonology]. M.: Newdiamed, 1999. 125 р.
Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и др. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение // Кардиология. 2018. Т. 58. № 6S. С. 8. Mareev V.Yu., Fomin I.V., Ageev F.T. et al. [Russian Heart Failure Society, Russian Society of Cardiology. Russian Scientific Medical Society of Internal Medicine Guidelines for Heart failure: chronic (CHF) and acute decompensated (ADHF). Diagnosis, prevention and treatment] // Kardiologiia. 2018. V. 58. № 6S. Р. 8.
Cook C., Cole G., Asaria P. et al. The annual global economic burden of heart failure // Int. J. Cardiol. 2014. V. 171. № 3. P. 368.
Гриппи М.А. Патофизиология легких, издание 3-е, испр. М.: БИНОМ, 2001. 304 с. Grippi M.A. [Pulmonary pathophysiology, 3rd edition, revised]. M.: BINOM, 2001. 304 p.
Xie A., Skatrud J.B., Puleo, D.S. et al. Apnea-hypopnea threshold for CO2 in patients with congestive heart failure // Am. J. Respir. Crit. Care Med. 2002. V. 165. № 9. P. 1245.
Машковский М.Д. Лекарственные средства. 16-е изд. М.: Новая волна, 2019. 1216 c. Mashkovsky M.D. [Medicines]. 16th ed. M.: New Wave, 2019. 1216 p.
Zahedi K., Barone S., Xu J., Soleimani M. Potentiation of the effect of thiazide derivatives by carbonic anhydrase inhibitors: Molecular mechanisms and potential clinical implications // PLoS ONE. 2013. V. 8. № 11. P. e79327.
Teppema L.J., Dahan A. Acetazolamide and breathing. Does a clinical dose alter peripheral and central CO2 sensitivity? // Am. J. Respir. Crit. Care Med. 1999. V. 160. № 5. Pt. 1. P. 1592.
Bekfani T., Abraham W.T. Current and future developments in the field of central sleep apnoea // Europace. 2016. V. 18. № 8. P. 1123.
Nakayama H., Smith C.A., Rodman J.R. et al. Effect of ventilatory drive on CO2 sensitivity below eupnea during sleep // Am. J. Critical. Care Med. 2002. V. 165. № 9. P. 1251.
White D.P., Zwillich C.S., Pickett C.K. et al. Central sleep apnea improvement with acetazolamide therapy // Arch. Intern. Med. 1982. V. 142. № 10. P. 1816.
Javaheri S., Sands S.A., Edwards B.A. Acetazolamide attenuates Hunter-Cheyne-Stokes breathing but augments the hypercapnic ventilatory response in patients with heart failure // Ann. Am. Thorac. Soc. 2014. V. 11. № 1. P. 80.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека