Физиология человека, 2022, T. 48, № 1, стр. 106-114
Допплеровские характеристики потоков и особенности гемодинамики в вертебрально-базилярной системе в норме
А. Ю. Вишнякова 1, *, А. Б. Бердалин 1, С. Э. Лелюк 2, В. Г. Лелюк 1
1 ФГБУ Федеральный центр мозга и нейротехнологий ФМБА России
Москва, Россия
2 ФГБОУ ДПО Российская медицинская академия
непрерывного профессионального образования МЗРФ
Москва, Россия
* E-mail: vishau@yandex.ru
Поступила в редакцию 25.12.2020
После доработки 09.04.2021
Принята к публикации 25.06.2021
- EDN: TERRWR
- DOI: 10.31857/S0131164622010167
Аннотация
Целью исследования явилось определение нормативных показателей кровотока и изучение особенностей нормальной гемодинамики в артериях вертебрально-базилярной системы головного мозга посредством высокоразрешающего ультразвукового дуплексного сканирования. Было обследовано 65 практически здоровых добровольцев мужчин в возрасте от 21 до 57 лет (36 ± 12 лет). Зафиксировано снижение пиковых скоростей кровотока при переходе от V1-сегмента позвоночной артерии (ПА) к V2 и повышение на интракраниальном уровне от проксимальных отделов к дистальным (от V4-сегментов ПА к дистальному отделу основной артерии (ОА)). Отмечена тенденция к более высоким скоростям тока крови в левых позвоночной и задней мозговой артерии по сравнению с правыми. Особенности гемодинамики, по всей видимости, были обусловлены особенностями строения артерий данного бассейна – часто встречающимися различиями диаметров ПА, неодинаковым отхождением ветвей ОА, а также отличиями уровня периферического сопротивления, сопряженными как с активностью и метаболизмом кровоснабжаемых структур, так и тонусом резистивного русла (с меньшей его выраженностью в супратенториальных структурах).
Ультразвуковое исследование артерий вертебрально-базилярной системы (ВБС) головного мозга входит в стандартный протокол ультразвукового дуплексного сканирования (ДС) брахиоцефальных артерий (БЦА) и широко используется в современной клинической практике как в стационарах со специализированными отделениями для больных с острыми нарушениями мозгового кровообращения [1], так и амбулаторно у асимптомных лиц и пациентов с жалобами на головокружение, неустойчивость при ходьбе, нарушениями координации и другими симптомами, которые вне острых состояний обычно расцениваются как проявления хронической вертебрально-базилярной недостаточности [2].
Однако в настоящее время как само исследование, так и интерпретация его результатов сопряжены со сложностями и вызывают затруднения в связи с имеющимся значительным разбросом допплеровских характеристик кровотока в артериях заднего бассейна даже у практически здоровых лиц. Это обстоятельство, безусловно, связанно с особенностями анатомического строения данного сосудистого бассейна, среди которых хочется отметить следующие: часто встречающуюся асимметрию диаметров позвоночной артерии (ПА), наличие мышечных ветвей ПА на экстракраниальном уровне, слияние ПА в основную артерию (ОА) в области моста головного мозга, которая, в свою очередь, отдав три пары мозжечковых артерий, делится на две задние мозговые артерии (ЗМА) [3, 4]. Артериальные анастомозы на уровне ствола мозга преимущественно располагаются внутри самой ткани мозга, а в области затылочных долей больших полушарий – на поверхности мозга. Анастомозами на уровне крупных артерий служат задние отделы Виллизиева круга и бульбарное артериальное кольцо [3, 4]. Такое уникальное строение артериального русла заднего бассейна головного мозга требует более детального подхода к оценке его гемодинамических особенностей.
В настоящее время опубликованы сведения, посвященные результатам ультразвуковой оценки показателей гемодинамики в артериях ВБС у практически здоровых лиц [5, 6], а также изучена их зависимость от пола [7] и возраста [6, 8]. Однако дополнение уже имеющихся знаний в этой области новыми данными в связи с внедрением в практику современных ультразвуковых систем экспертного класса, а также ангиографических методик является не только обоснованным, но и необходимым.
Таким образом, целью настоящего исследования явилось изучение особенностей нормальной гемодинамики в ВБС головного мозга с помощью высокоразрешающего ультразвукового ДС.
МЕТОДИКА
В исследование были включены сведения о 65 практически здоровых добровольцах в возрасте от 21 до 57 лет (36 ± 12 лет), обследованных амбулаторно.
Критериями включения служили мужской пол и возраст от 20 до 60 лет. Критериями исключения являлись: женский пол, наличие анемии, сахарного диабета, острых нарушений мозгового кровообращения и инфарктов миокарда в анамнезе, сердечной недостаточности любой выраженности и этиологии, заболеваний дыхательной системы, дыхательной недостаточности любой выраженности, ожирения, а также любых стенозов или окклюзий артерий ВБС и атеросклеротических поражений сонных артерий с редукцией просвета 30% и более по диаметру (по ECST). Добровольцев в возрасте старше 60 лет в исследование не включали в связи с невозможностью, в подавляющем большинстве случаев, их отнесения к категории “практически здоровых” лиц.
Всем входящим в исследование лицам проводили высокоразрешающее ультразвуковое ДС экстракраниальных отделов БЦА и транскраниальное ДС артерий основания головного мозга на ультразвуковых системах Acuson Sequoia – 512 и S – 2000 (Siemens AG, Германия) электронными многочастотными широкополосными линейными секторным фазированными датчиками с частотами сканирования от 5 до 9 и от 2 до 4 МГц, соответственнo.
При ДС оценивали: скоростные показатели кровотока и межинтимальные (внутрипросветные) диаметры ПА в V1 и V2-сегментах (на уровне С3–С6 позвонков). При транскраниальном исследовании оценивали скоростные показатели кровотока в V4-сегментах обеих ПА, проксимальной, средней и дистальной трети ОА (на разных глубинах локации соответственно – 70–80, 80–90 и 90–100 мм), в Р1- и Р2-сегментах ЗМА.
Статистическую обработку осуществляли с использованием программных пакетов SPSS Statistics версии 23.0 (IBM, США) и R software версии 3.3.2. Нулевую гипотезу отвергали при уровне значимости р ≤ 0.05. Для описания количественных переменных применяли медиану и квартили, минимальное и максимальное значения, для качественных – частоту и долю (в процентах). При изучении корреляций между количественными или порядковыми переменными использовали метод расчета коэффициента корреляции по Спирмену. Анализ пространственной динамики показателей кровотока проводили при помощи общей линейной модели с повторными измерениями.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В исследуемой выборке мужчин по данным ДС “нормальное” (классическое) строение артерий ВБС было в 78.5% случаев. В остальных 21.5% были выявлены варианты строения артерий заднего бассейна, наиболее частым из которых являлась гипоплазия (диаметр менее 2 мм) или малый диаметр (диаметр от 2.0 до 2.5 мм) правой ПА (9.3%). Гипоплазия или малый диаметр какой-либо одной из ПА встречались в 13.8% случаев (табл. 1).
Таблица 1.
Зарегистрированные при дуплексном сканировании (ДС) варианты строения артерий заднего бассейна
| Вариант строения | n = 65 | % от всей выборки |
|---|---|---|
| Нормальное строение | 51 | 78.5 |
| Гипоплазия или малый диаметр правой ПА | 6 | 9.3 |
| Гипоплазия или малый диаметр левой ПА | 3 | 4.6 |
| Высокое вхождение правой ПА в канал поперечных отростков шейных позвонков на уровне С5–С6 или С4–С5 | 4 | 6.2 |
| Фетальный тип строения ЗМА | 1 | 1.5 |
При оценке различий диаметров парных ПА между собой в исследуемой выборке лиц было выявлено статистически значимое преобладание диаметра левой ПА над правой. Диаметр левой ПА оказался больше такового правой в 64.4% случаев; в среднем диаметр левой ПА был больше диаметра правой ПА на 0.5 мм (р = 0.001) (табл. 2). При этом диаметр ПА на экстракраниальном уровне (на отрезке V1–V2) значимо не менялся по ходу указанных отрезков каждой из артерий.
Таблица 2.
Результаты определения диаметров позвоночной артерии (ПА) (медиана (процентили 25; 75), минимальное–максимальное значения)
| Сегмент | Правая ПА | Левая ПА |
|---|---|---|
| V1 сегмент | 3.1 | 3.5* |
| (2.8; 3.6) | (3.1; 3.9) | |
| 1.6–4.1 | 1.8–4.4 | |
| V2 сегмент (на уровне С4-С6 шейных позвонков) | 3.1 | 3.4* |
| (2.8; 3.5) | (3.1; 3.7) | |
| 1.4–4.2 | 2.1–4.7 | |
| V2 сегмент (на уровне С3-С4 шейных позвонков) | 3.2 | 3.6* |
| (2.9; 3.6) | (3.1; 3.9) | |
| 1.2–4.2 | 2.1–4.7 |
Результаты измерения линейных скоростных показателей кровотока и индексов периферического сосудистого сопротивления выявили наличие определенных градиентов потока в артериях ВБС на шее и в голове (рис. 1, табл. 3 и 4). На экстракраниальном уровне скорость кровотока в ПА от V1 к V2 сегменту значимо снижалась, а на интракраниальном – на участке от V4 сегментов ПА к дистальной трети ОА – значимо повышалась. В то же время, пульсативный индекс (PI) от V1 к V2 сегменту ПА значимо снижался, интракраниально был достоверно ниже, чем на шее; на участке от V4 сегментов ПА – в ОА – до Р1 сегментов ЗМА – значимо не изменялся, достоверно меньшим оказался в Р2-сегментах ЗМА.
Рис. 1.
Усредненная по времени максимальная скорость кровотока (TAMX) и пульсативный индекс (PI) в артериях заднего бассейна. А – усредненная по времени максимальная скорость кровотока в разных артериях заднего бассейна, Б – пульсативный индекс в разных артериях заднего бассейна; графическое представление (боксплоты). ПА – позвоночная артерия, V2, V4 – сегменты ПА, С4−С6, С3−С4 – шейные позвонки (уровень оценки ПА), ОА – основная артерия, ЗМА – задняя мозговая артерия, Р1, Р2 – сегменты ЗМА.
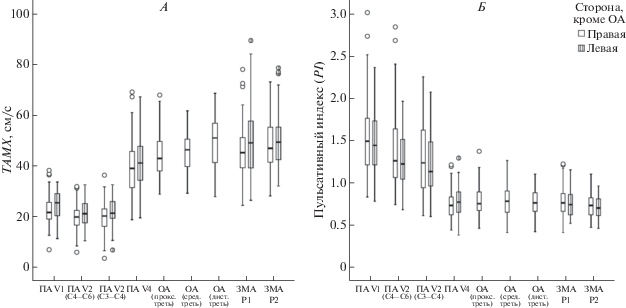
Таблица 3.
Скоростные показатели кровотока и индексы периферического сопротивления в экстракраниальных отделах позвоночных артерий (ПА) (медиана (процентили 25; 75), минимальное значение–максимальное значение)
| ПА | Vps, см/c | Ved, см/c | TAMX, см/c | TAV, см/c | PI | RI |
|---|---|---|---|---|---|---|
| V1 справа | 45.5 | 13.4 | 21.6 | 11.7 | 1.49 | 0.71 |
| (38.6; 53.9) | (11.4; 16.0) | (18.9; 25.8) | (9.9; 14.0) | (1.21; 1.77) | (0.66; 0.76) | |
| 19.6–85.7 | 3.6–25.8 | 6.9–38.2 | 2.8–19.6 | 0.83–3.01 | 0.54–0.87 | |
| V2 (С4–С6) справа | 37.8* | 12.5* | 19.8* | 11.2* | 1.26* | 0.66* |
| (33.6; 45.8) | (10.6; 14.7) | (16.6; 22.5) | (9.9; 13.0) | (1.06; 1.64) | (0.62; 0.74) | |
| 17.0–67.2 | 2.8–22.7 | 5.9–31.8 | 7.2–22.3 | 0.74–2.84 | 0.53–0.84 | |
| V2 (С3–С4) справа | 35.7* | 13.2* | 20.2* | 11.4* | 1.23* | 0.65* |
| (30.9; 42.4) | (10.2; 14.7) | (16.1; 23.0) | (9.3; 13.6) | (0.94; 1.62) | (0.58; 0.73) | |
| 12.3–61.6 | 0.8–25.0 | 3.5–36.3 | 4.9–26.0 | 0.61–3.27 | 0.45–0.94 | |
| V1 слева | 49.8 | 15.5 | 25.4 | 13.8 | 1.44 | 0.69 |
| (41.8; 57.8) | (12.0; 18.5) | (20.3; 29.1) | (10.6; 15.4) | (1.21; 1.74) | (0.65; 0.75) | |
| 26.7–80.5 | 6.0–22.6 | 11.3–33.6 | 5.6–20.1 | 0.78–4.48 | 0.57–0.92 | |
| V2 слева | 40.2* | 13.5* | 21.1* | 11.6* | 1.22* | 0.66* |
| (32.5; 46.8) | (11.5; 16.9) | (17.5; 25.2) | (9.4; 14.0) | (1.04; 1.52) | (0.60; 0.70) | |
| 22.3–65.6 | 5.1–24.3 | 10.4–32.5 | 4.0–18.9 | 0.68–3.54 | 0.53–0.89 | |
| V2 (С3–С4) слева | 40.1* | 13.9* | 21.3* | 12.6* | 1.13* | 0.64* |
| (35.2; 45.7) | (12.1; 17.0) | (19.3; 25.9) | (10.4; 15.2) | (0.96; 1.48) | (0.58; 0.70) | |
| 14.0–62.2 | 3.7–21.5 | 6.8–32.5 | 2.8–22.5 | 0.60–3.53 | 0.47–0.88 |
Примечание: Vps – пиковая систолическая скорость кровотока, см/с, Ved – конечная диастолическая скорость кровотока, см/с, TAMX – усредненная по времени максимальная скорость кровотока, см/с, TAV – усредненная по времени средняя скорость кровотока, см/с, PI – пульсативный индекс (Gosling), RI – резистивный индекс (Pourcelot); * – достоверны различия между оцениваемыми показателями в V1 и V2-сегментах ПА (p < 0.01). Остальные обозначения см. табл. 2.
Таблица 4.
Скоростные показатели кровотока и индексы периферического сопротивления в интракраниальных отделах позвоночной (ПА), основной (ОА) и задней мозговой (ЗМА) артерий (медиана (процентили 25; 75), минимальное значение–максимальное значение)
| Артерия | Vps, см/c | Ved, см/c | TAMX, см/c | TAV, см/c | PI | RI |
|---|---|---|---|---|---|---|
| ПА V4 справа |
56.8 | 28.0 | 39.0 | 22.6 | 0.75 | 0.50 |
| (44.6; 67.2) | (23.0; 32.9) | (31.3; 46.1) | (19.7; 29.2) | (0.62; 0.84) | (0.46; 0.55) | |
| 25.2–89.3 | 13.0–48.0 | 18.7–69.1 | 10.8–39.9 | 0.44–1.21 | 0.38–0.64 | |
| ПА V4 cлева |
58.9 | 29.0 | 41.1 | 25.0 | 0.77 | 0.51 |
| (48.8; 74.6) | (24.3; 34.4) | (33.5; 48.1) | (18.8; 31.2) | (0.65; 0.90) | (0.47; 0.55) | |
| 22.9–120.0 | 12.7–68.0 | 19.5–90.0 | 10.6–49.0 | 0.38–1.29 | 0.34–0.65 | |
| ОА (проксимальная треть) |
65.4* | 30.4* | 42.9* | 26.5* | 0.75 | 0.51 |
| (55.1; 77.0) | (27.0; 35.3) | (37.4; 50.3) | (22.4; 33.4) | (0.67; 0.90) | (0.48; 0.56) | |
| 43.4–106.7 | 20.2–49.0 | 28.8–67.9 | 11.9–42.6 | 0.46–1.37 | 0.38–0.68 | |
| ОА (средняя треть) | 67.4** | 32.0** | 46.3** | 30.6** | 0.78 | 0.53 |
| (56.1; 77.7) | (28.2; 37.0) | (39.7; 50.7) | (24.5; 34.9) | (0.65; 0.90) | (0.47; 0.56) | |
| 46.4–109.7 | 21.1–45.9 | 29.2–61.7 | 17.9–47.9 | 0.41–1.26 | 0.35–0.67 | |
| ОА (дистальная треть) | 77.0**, # | 36.0**, # | 51.0**, # | 33.7**, # | 0.76 | 0.52 |
| (61.1; 85.6) | (30.1; 41.3) | (41.3; 57.0) | (28.0; 39.9) | (0.66; 0.88) | (0.47; 0.56) | |
| 42.0–98.8 | 18.9–50.6 | 27.8–68.6 | 14.7–45.4 | 0.42–1.10 | 0.36–0.63 | |
| ЗМА Р1 справа |
66.7** | 31.8** | 45.2** | 28.6** | 0.76 | 0.51 |
| (57.3; 78.5) | (7.6; 36.7) | (39.1; 51.1) | (25.1; 32.9) | (0.66; 0.87) | (0.47; 0.57) | |
| 33.6–111.8 | 17.0–59.0 | 24.4–78.0 | 15.2–42.5 | 0.41–1.22 | 0.35–0.67 | |
| ЗМА Р1 слева |
67.5** | 34.8** | 49.1**, # | 30.0** | 0.74 | 0.51 |
| (58.5; 86.8) | (27.5; 40.3) | (38.8; 57.9) | (24.9; 36.3) | (0.62; 0.86) | (0.46; 0.56) | |
| 33.7–123.5 | 17.1–67.8 | 26.4–89.4 | 16.2–50.1 | 0.52–1.15 | 0.41–0.65 | |
| ЗМА Р2 справа |
70.0** | 32.7** | 46.9**, # | 29.7** | 0.72**, ## | 0.51 |
| (58.2; 77.7) | (27.7; 39.0) | (41.2; 55.3) | (26.2; 33.7) | (0.62; 0.83) | (0.46; 0.55) | |
| 38.9–100.3 | 19.0–54.7 | 28.1–73.1 | 18.8–41.5 | 0.47–1.10 | 0.39–0.63 | |
| ЗМА Р2 слева |
69.0** | 35.6** | 49.3**, # | 30.8** | 0.70**, ## | 0.50 |
| (61.9; 79.1) | (30.7; 39.7) | (42.0; 55.4) | (25.2; 35.2) | (0.61; 0.84) | (0.45; 0.54) | |
| 47.5–109.9 | 22.6–55.8 | 32.0–78.6 | 18.5–49.9 | 0.46–0.96 | 0.38–0.59 |
Примечание: V4 – четвертый сегмент ПА (интракраниальная часть ПА от входа в полость черепа до слияния в ОА), Р1, Р2 – первый и второй сегменты ЗМА; * – достоверны различия с соответствующими показателями в правой ПА, p < 0.05; ** – достоверны различия с соответствующими показателями в обеих ПА, p < 0.05; # – достоверны различия с соответствующими показателями в проксимальных и средних отделах ОА, p < 0.05; ## – достоверны различия с соответствующими показателями во всех отделах ОА и Р1-сегментах ЗМА, p < 0.05. Остальные обозначения см. табл. 3.
Данных, свидетельствующих о наличии асимметрии линейных скоростных показателей кровотока и индексов периферического сопротивления в ПА (V1- и V2-сегментах) и в ЗМА между правой и левой стороной выявлено не было. В то же время, слева в ПА оцениваемые скоростные показатели кровотока были несколько выше, а уровень периферического сопротивления – ниже, чем справа (рис. 1, табл. 3 и 4). Аналогичные данные были получены для ЗМА – скоростные показатели кровотока в левой ЗМА были несколько выше, чем в правой. Значимых корреляций скоростных характеристик кровотока в испилатеральных ПА и ЗМА выявлено не было. Одновременно скоростные показатели кровотока в обеих ПА (справа только пиковая систолическая скорость кровотока (Vps), слева – все скоростные показатели) коррелировали с таковыми в ОА. Например, коэффициент корреляции между Vps в правой ПА (V2-сегменте на уровне С3–С4) и Vps в ОА (средняя треть) оказался равным 0.34, а для левой ПА составил 0.54 (р = 0.001). В свою очередь, скорости кровотока в ОА значимо не коррелировали с таковыми в обеих ЗМА. Индексы периферического сосудистого сопротивления в ПА, ОА и ЗМА продемонстрировали значимые зависимости между собой с коэффициентами корреляции в среднем 0.55 (р = 0.001).
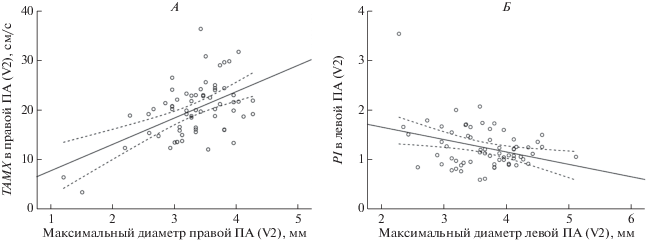
При корреляционном анализе были выявлены значимые положительные взаимосвязи между диаметрами ПА, с одной стороны, и линейными скоростными показателями потоков (конечной диастолической (Ved) и усредненной по времени максимальной (TAMX) скоростями) в них, с другой; обратные взаимосвязи – между диаметрами ПА и показателями, характеризующими уровень периферического сосудистого сопротивления (пульсативным (PI) и резистивным (RI) индексами). Так, коэффициенты корреляции для правой ПА (С3-С4) составили: диаметр артерии с Ved r = = 0.53, с TAMX r = 0.51, c PI r = –0.54, c RI r = = ‒0.52; для левой ПА (С3–С4) – диаметр артерии с Ved r = 0.40, с TAMX r = 0.38, c PI r = –0.36, c RI r = –0.28. Зависимость усредненной по времени максимальной скорости кровотока (TAMX) и пульсативного индекса (PI) от диаметра ПА представлены на рис. 2.
Рис. 2.
Зависимость TAMX в правой ПА (А) и PI в левой ПА (Б) от диаметров артерий. А – зависимость усредненной по времени максимальной скорости кровотока в правой ПА от ее диаметра, Б – зависимость пульсативного индекса в левой ПА от ее диаметра. Остальные обозначения см. рис. 1.
ОБСУЖДЕНИЕ РЕЗУЬТАТОВ
Различия диаметров ПА, в том числе и значительные, широко распространены в популяции и признаются вариантом нормы. Наиболее часто доминирующей по величине просвета является левая ПА [9, 10]. В настоящем исследовании диаметр левой ПА также оказался больше, чем правой. Подобные различия могут быть объяснены особенностями отхождения ПА: справа ПА – третье деление артерий (из-за наличия плечеголовного ствола), слева – второе деление (левая подключичная артерия отходит непосредственно от дуги аорты). В редких случаях левая ПА может самостоятельно отходить от дуги аорты [11], и в таком случае, это будет первое деление. Отхождение правой ПА от дуги аорты считается крайне редким вариантом, выявляемым, обычно, при ангиографии [12].
В определенной степени диаметры ПА оказываются детерминированными генетически, на что указывают A.D. Tarnoki et al., обследовавшие 172 близнецов (54 монозиготных и 32 дизиготных) [13]. Хотя не исключается, что диаметры ПА зависят также от особенностей протекания процесса эмбриогенеза.
Несмотря на то, что в настоящей работе были выявлены значимые различия диаметров ПА и показана их взаимосвязь с допплеровскими характеристиками кровотока, значимых различий скоростей потоков и индексов периферического сопротивления в правой и левой ПА между собой выявлено не было. Слева скорости кровотока были недостоверно выше, а уровень периферического сопротивления – ниже, чем справа, что также согласуется с литературными данными [6, 8]. По всей видимости, такие различия уровней периферического сопротивления можно объяснить тем, что при условии примерно равного числа мышечных ветвей у обеих ПА доля кровотока для кровоснабжения структур головного мозга в левой ПА оказывается больше, чем в правой, а мозговой кровоток характеризуется, как известно, низким периферическим сопротивлением. При этом, согласно опубликованным I.W. Liu et al. данным, констатировано, что не только гипоплазированные ПА, как это представлялось ранее, но и артерии диаметром до 3.0 мм, могут, в частности, заканчиваться задней нижней мозжечковой артерией и не принимать участия в кровоснабжении бассейнов ОА и ЗМА [14].
Это обусловливает различия объемов кровоснабжения мозговых структур и оказывает влияние на допплеровские характеристики внутрипросветных потоков. В рамках настоящего исследования не предусматривалось одновременной оценки ПА с помощью томографических ангиографических методов, в частности магнитно-резонансной и рентгеновской мультиспиральной компьютерной ангиографии – и разделения ПА по характеру кровотока в зависимости от вариантов их строения. В свою очередь, отсутствие значимых различий в скоростных показателях кровотока в группе в целом может быть связано с тем, что в большинстве случаев ПА сливаются в ОА и имеют близкие по размеру и “типу” артериолярного русла бассейны.
Несмотря на то, что диаметр каждой из ПА на протяжении всего экстракраниального отдела, доступного изучению с использованием ДС, оставался неизменным, допплеровские характеристики кровотока в V1- и V2-сегментах ПА достоверно отличались между собой. В определенной степени на гемодинамику в V1-сегменте ПА и ее отличия от таковой в V2-сегменте мог влиять характер потока и уровень давления в подключичной артерии, а также особенности отхождении ПА (угол отхождения, отсутствие деформации над устьем ПА) от подключичной артерии. Не исключено также, что более существенную роль играли различия ветвления ПА в V1- и V2-сегментах. Помимо мышечных ветвей (rami musculares), отходящих от ПА как в V1-, так и V2-сегментах и кровоснабжающих предпозвоночные мышцы, от V2-сегментов ПА отходит и ряд других более крупных. К ним относятся корешковые артерии (парные сегментарные ветви к позвоночнику, твердой мозговой оболочке и шейным корешкам) и 3–5 непарных корешково-спинальных артерий, формирующих сосуд в передней срединной борозде спинного мозга, являющийся спинальным продолжением передней спинномозговой артерии и играющим важнейшую роль в кровоснабжении спинного мозга [3].
Главной особенностью строения ВБС, как уже отмечалось выше, является слияние двух крупных ПА в один ствол ОА. Данное обстоятельство обусловливает и определенные изменения гемодинамики в данной области. Линейные скоростные показатели кровотока в интракраниальных сегментах ПА достоверно между собой не различались, но в то же время, скорости потоков в правой ПА были статистически значимо ниже, чем в проксимальном отделе ОА. Слева наоборот, кровоток в ПА достоверно не отличается от такового в проксимальном отделе ОА, что, вероятно, было обусловлено тем, что ОА может рассматриваться как продолжение ПА большего диаметра, которой, как показано ранее, служит левая ПА. При этом скорости потоков в ОА значимо коррелировали с таковыми в обеих ПА, коэффициент корреляции для левой ПА оказался выше, чем для правой. Действительно, по данным патолого-анатомических и ангиографических исследований, ОА обычно непрямолинейна, имеет С- или S-образный ход, так как является продолжением артерии большего диаметра; колено деформации располагается со стороны ПА меньшего диаметра, которая при подобных обстоятельствах впадает в доминирующую ПА под углом, близким к прямому [4, 10].
Впервые зарегистрированные нами различия скоростных показателей кровотока в разных (условно выделенных) отделах ОА могут быть следствием особенностей отхождения от нее большого числа ветвей разного диаметра и сбросом крови в их просветы. Вероятнее всего, речь идет об отхождении значительного числа относительно крупных ветвей в дистальном участке ОА (задние мозговые и верхние мозжечковые артерии) по сравнению с другими ее отделами [3, 4]. Эти сосуды обладают обширной сетью артериол в затылочных долях и мозжечке, что создает определенный градиент давления в ОА. В то же время, в связи с ветвлением диаметр ОА, хотя и несущественно, но уменьшается от проксимального отдела к дистальному. Указаний на это в опубликованных ранее ангиографических и патологоанатомических исследованиях не встречается, данный вопрос требует дальнейших уточнений.
Следует отметить, что кровоток в ЗМА не коррелировал с таковым ни в ипсилатеральных ПА, ни в ОА. Возможно, он должен обусловливаться характером деления и диаметрами самих ЗМА [10]. В ряде случаев кровоток в ЗМА может зависеть от кровотока в каротидном бассейне, особенно в случаях фетального строения ЗМА [3].
Особенностью показателей кровотока в ЗМА является отсутствие значимого снижения скорости кровотока от Р1-сегментов к Р2, и даже некоторое ее увеличение. Это коренным образом отличается от картины, наблюдающейся в каротидном бассейне, где скорость кровотока в средней мозговой артерии, наоборот, снижается от проксимальных отделов к дистальным (от М1- к М2- и М3-сегментам). Вероятно, это может быть связано с отсутствием крупных ветвей ЗМА в Р1-сегменте ввиду его малой продолжительности, а также, возможно, некоторым уменьшением диаметра ЗМА в дистальном направлении и влиянием кровотока из каротидного бассейна по задним соединительным артериям.
Полученные данные, свидетельствующие о том, что показатели, отражающие периферическое сопротивление в Р2-сегментах ЗМА, оказались наименьшими из оцениваемых в интракраниальных артериях ВБС (в Р1-сегментах ЗМА и ОА), предположительно могут свидетельствовать о том, что доля крови на кровоснабжение корковых структур повышается от V4-сегмента ПА к Р2-сегментам ЗМА. Как отмечалось ранее, характерной особенностью ВБС является то, что она кровоснабжает филогенетически и анатомически неоднородные структуры с неодинаковой ангиоархитектоникой и разными уровнями метаболизма тканей (с одной стороны, это структуры ствола мозга и мозжечок, с другой – затылочные доли больших полушарий) [4]. Следовательно, можно обоснованно предположить, что на разных уровнях ВБС тонус резистивного русла оказывается различным – в корковых отделах он более низкий. Это также может обусловливать наличие градиента давления от проксимальных отделов ВБС (V4-сегментов ПА) к дистальным (дистальный отдел ОА и ЗМА).
Таким образом, в настоящем исследовании была осуществлена оценка допплеровских характеристик кровотока в артериях ВБС на экстра- и интракраниальном уровнях. Выявленные различия показателей кровотока в разных артериях ВБС не противоречат сформировавшимся в настоящее время представлениям об особенностях гемодинамики в данном сосудистом бассейне, а также дополняют их новыми данными.
ВЫВОДЫ
1) Диаметр левой ПА чаще оказывался больше диаметра правой ПА (примерно в 65% случаев), что обусловливало тенденцию к более высокому по скорости току крови с меньшим периферическим сопротивлением в левой ПА, чем в правой.
2) Выявлены значимые положительные корреляции между диаметрами ПА, с одной стороны, и линейными скоростными показателями потоков (конечной диастолической и усредненной по времени максимальной скоростями) в них, с другой; обратные корреляции – между диаметрами ПА и показателями, характеризующими уровень периферического сосудистого сопротивления (пульсативным и резистивным индексами).
3) При ДС на экстракраниальном уровне было снижение линейных скоростей кровотока по ходу ПА от V1-сегмента к V2, тогда как на интракраниальном уровне зафиксирована обратная закономерность – увеличение линейных скоростей кровотока от проксимальных отделов (V4-сегментов ПА) к дистальным (дистальной трети ОА).
4) Установлено, что в норме при ультразвуковом ДС удается зарегистрировать повышение линейных скоростей внутрипросветных потоков в ОА от ее проксимальных отделов к дистальным, что должно учитывать при проведении “эталонных” сравнений.
5) Показатели, характеризующие уровень периферического сопротивления, в интракраниальных артериях заднего бассейна демонстрировали снижение от проксимальных участков (ПА) к дистальным (Р2 ЗМА), что, скорее всего, являлось отражением аналогичных изменений тонуса дистального русла.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Федерального центра мозга и нейротехнологий ФМБА (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках Государственного задания № 056-00171-19-01. Регистрационный номер темы АААА-А19-119042590018-0 (от 29 марта 2019).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Приказ Министерства здравоохранения РФ от 15 ноября 2012 г. № 928н “Об утверждении Порядка оказания медицинской помощи больным с острыми нарушениями мозгового кровообращения” (с изменениями на 21 февраля 2020 года).
Neto A.C.L., Bor-Seng-Shu E., Oliveira M.L. et al. Magnetic resonance angiography and transcranial Doppler ultrasound findings in patients with a clinical diagnosis of vertebrobasilar insufficiency // Clinics (Sao Paulo). 2020. V. 20. № 75. P. e1212.
Хейнс Д. Нейроанатомия: атлас структур, срезов и систем / Пер. с англ.; под ред. Бобыловой М.Ю. М.: Логосфера, 2008. 344 с.
Хосе М. Вальдуэза, Стефан Й. Шрайбер, Йенс-Эрик Рёль, Рандольф Клингебиль. Нейросонология и нейровизуализация при инсульте / Пер. с англ.; под общ. ред. проф. Лелюка В.Г., Губского Л.В. М.: МЕДпресс-информ, 2012. 608 с.
Albayrak R., Degirmenci B., Acar M. et al. Doppler sonography evaluation of flow velocity and volume of the extracranial internal carotid and vertebral arteries in healthy adults // J. Clin. Ultrasound. 2007. V. 35. № 1. P. 27.
Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. 3-е изд. М.: Реал Тайм, 2007. 416 с.
Morovic S., Skaric-Juric T., Demarin V. Morphologic and hemodynamic characteristics of vertebral arteries in men and women // Rad za Medicinske znatosti. 2007. V. 31. P. 121.
Nemati M., Bavil A.S., Taheri N. Comparison of normal values of Duplex indices of vertebral arteries in young and elderly adults // Cardiovasc. Ultrasound. 2009. V. 7. P. 2.
Hong J.M., Chung C.S., Bang O.Y. et al. Vertebral artery dominance contributes to basilar artery curvature and peri-vertebrobasilar junctional infarcts // J. Neurol. Neurosurg. Psychiatry. 2009. V. 80. № 10. P. 1087.
Vitosevic F., Rasulic L., Medenica S.M. Morphological Characteristics of the Posterior Cerebral Circulation: An Analysis Based on Non-Invasive Imaging // Turk. Neurosurg. 2019. V. 29. № 5. P. 625.
Einstein E.H., Song L.H., Villela N.L. et al. Anomalous Origin of the Left Vertebral Artery from the Aortic Arch // Aorta (Stamford). 2016. V. 4. № 2. P. 64.
Goldbach A., Dass C., Surapaneni K. Aberrant Right Vertebral Artery with a Diverticulum of Kommerell: Review of a Rare Aortic Arch Anomaly // J. Radiol. Case Rep. 2018. V. 12. № 5. P. 19.
Tarnoki A.D., Fejer B., Tarnoki D.L. et al. Vertebral Artery Diameter and Flow: Nature or Nurture // J. Neuroimaging. 2017. V. 27. № 5. P. 499.
Liu I.W., Ho B.L., Chen C.F. et al. Vertebral artery terminating in posterior inferior cerebellar artery: A normal variation with clinical significance // PLoS One. 2017. V. 12. № 4. P. e0175264.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


