Физиология человека, 2022, T. 48, № 1, стр. 57-68
Переключение между нейронными сетями необходимо для восстановления сознания после тяжелой травмы мозга
Л. Б. Окнина 1, *, Е. Л. Машеров 2, О. С. Зайцев 2, Е. В. Александрова 2
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 ФГАУ Национальный медицинский исследовательский центр нейрохирургии
имени академика Н.Н. Бурденко МЗ РФ
Москва, Россия
* E-mail: leliia@yandex.ru
Поступила в редакцию 24.03.2021
После доработки 29.05.2021
Принята к публикации 25.06.2021
- EDN: EXTYMS
- DOI: 10.31857/S013116462201012X
Аннотация
Тяжелая черепно-мозговая травма (ЧМТ) может вести к одной из форм нарушения сознания, среди которых особый интерес вызывают синдром ареактивного бодрствования (UWS) и состояние минимального сознания (MCS). Целью данного исследования было проанализировать функциональные связи при прослушивании звуков у пациентов с ЧМТ. Были зарегистрированы потенциалы, связанные с событиями у 20 пациентов с ЧМТ и 20 здоровых испытуемых. При регистрации использовали oddball, состоящую из стандартных и девиантных тонов. Функциональные связи вычислялись по методу Грейнджера. Применение дискриминантного анализа к оценке значений функциональных связей позволило улучшить разделение пациентов с UWS и MCS. Наиболее значимыми являются функциональные связи между правой теменной и левой теменной областями, и функциональные связи между левой теменной и правой лобной областями. В меньшей степени на точность разделения оказывают влияние значения функциональных связей внутри правой лобной области, а также ее связи с левой лобной областью. Полученные данные позволяют предположить, что одним из ключевых условий для восстановления сознания является сохранность способности переключать активность между функциональными сетями, обеспечивающими произвольное и непроизвольное внимание.
Сознание включает в себя два основных компонента – пробуждение (arousal), которое связывают с активностью кортико-таламо-субкортикальной мозговой сети и корково-стволовым взаимодействием, и осознание (awareness), обеспечиваемое взаимодействием отделов коры [1, 2]. Тяжелая черепно-мозговая травма (ЧМТ) может вести к одной из форм нарушения сознания, среди которых особый интерес и трудности дифференцировки представляют синдром ареактивного бодрствования (unresponsive wakefulness state (UWS)) и состояние минимального сознания (minimally conscious state (MCS)). UWS характеризуется пробуждением пациента при отсутствии других признаков сознания. У пациентов в MCS появляются эмоциональные реакции и неустойчивые попытки выполнения отдельных инструкций [3–5].
В настоящее время активно развиваются методы выявления нейрофизиологических механизмов, обеспечивающих формирование бессознательных состояний при травме мозга [6]. Прежде всего, это оценка функциональных сетей мозга, которые хотя и выявляются методами математического и статистического анализа, имеют под собой анатомический базис. В состав функциональных сетей входят функциональные центры и функциональные связи, обеспечивающие взаимодействие между центрами [7].
Среди когнитивных функций, характерных для ясного сознания, одно из основных мест занимает внимание. В его реализации участвуют нейроны верхних бугров четверохолмия в среднем мозге, ядер подушки в таламусе [8] и кора больших полушарий [9, 10].
Выделяют две глобальные нейронные сети внимания [11]. Одна сеть включает интрапариетальную борозду (intraparietal sulcus, IPS), верхнюю теменную дольку (superior parietal lobule, SPL) и области (frontal eye field, FEF), включающие в себя часть средней лобной извилины (middle frontal gyrus, MFG) и прецентральной извилины (precentral gyrus, PG). То есть эта сеть имеет в своем составе лобную и теменную части. Также имеются указания на вовлечение в эту сеть зрительной коры. Отмеченные структуры образуют дорзальную, или фронто-париетальную систему когнитивного контроля (DAT), обеспечивающую произвольный, целенаправленный контроль к стимулам определенного типа и обеспечивающую адекватную реакцию на этот стимул, так называемый top-down, или нисходящий контроль.
Вторая сеть включает височно-теменное пересечение (temporoparietal junction, TPJ), куда входит нижняя теменная долька (intraparietal lobule, IPL) и верхняя височная извилина (superior temporalis gyrus, STG), и нижняя лобная кора (inferior frontal cortex, IFC), включающая часть нижней лобной извилины (inferior frontal gyrus, IFG) и средней лобной извилины (middle frontal gyrus, MFG). Это вентральная система контроля (VAT), которая имеет правостороннюю латерализацию и обеспечивает непроизвольное внимание, так называемый bottom-up reorienting, или восходящий контроль [12, 13]. VAT доминирует, когда человек не концентрируется на окружающей обстановке. По мере вовлечения человека в выполнение задания усиливается активность DAT [14, 15].
Во взаимодействии структур DAT участвует верхний продольный пучок (superior longitudinal fasciculus, SLF), обеспечивающий связь между лобной, теменной и затылочной частями системы [16]. В связи между задней теменной и соседней передней теменной дольками с латеральной лобной корой также участвует крючковидный пучок (uncinate fasciculus, UF) [17].
Традиционно для исследования внимания используют потенциалы, связанные с событиями (ПСС), регистрируемые с использованием oddball парадигмы [18], суть которой сводится к регистрации ответов на стимулы, которые выделяются по одному или нескольким параметрам от стандартных стимулов. В мета-анализе [19] показано, что активация VAT в большей степени связана с необычностью стимула, вне зависимости от его модальности. VAT важна для динамической оценки стимулов и выявления их изменений. При этом лобные отделы DAT ассоциированы с нисходящим контролем, тогда как другие области DAT вместе с VAT вовлечены в оценку окружающей обстановки и оценку стандартных стимулов. Кроме того, за пределами двух данных систем в сенсорную оценку стимулов вовлечены подкорковые структуры, включая скорлупу, таламус и другие области, связанные с активацией подкорковых структур и ствола мозга.
Обе системы внимания находятся в постоянной динамической зависимости друг от друга [20]. Способность систем активироваться как одновременно, так и реципрокно обеспечивается активностью нижней и средней лобной извилины [21]. При этом до сих пор нет достаточных данных, в какой структуре происходит переключение активности двух систем. В отношении зрительной модальности участие в переключении систем отводится передней островковой области (anterior insula) и нижней лобной извилине (inferior frontal gyrus, IFG) [22].
Также стоит отметить, что ни одна функциональная сеть мозга не является стабильной. В каждый момент времени отмечается разная активность одной или нескольких доминирующих при данной активности функциональных сетей [23].
В качестве базовой гипотезы в данном исследовании было взято предположение, что у пациентов с разной степенью сохранности когнитивных функций в ответ на стандартный и девиантный тон будет выявляться разная степень активности лобных и теменных отделов мозга, входящих в вентральную и дорзальную систему внимания. Кроме того, структуры, входящие в систему внимания, частично перекрываются с нейронной сетью пассивной работы мозга, или default mode network (DMN) [14], которая наиболее активна во время покоя (resting state). Активность данной сети в покое является одним из необходимых условий включения процессов последующей активации непроизвольного внимания [24]. При этом необходимо учитывать, что сеть DMN состоит из нескольких подсетей, среди которых выделяют лобную и теменно-затылочно-височную подсистемы [25]. Также необходимо учитывать, что использование слуховых стимулов должно вызывать активацию височной нейронной сети, участвующей в слуховом восприятии и разрушение которой является критичным для восстановления сознания у пациентов с UWS и MCS [26, 27].
Целью данного исследования было проанализировать особенности функциональных связей, предположительно входящих в состав нейронных систем, активирующихся при слуховом восприятии у пациентов с ТЧМТ и нарушенным сознания. В последние несколько лет оценку функциональных сетей начали проводить на основе анализа биопотенциалов мозга [28]. Кроме того, стал возможен пересчет функциональных связей на предположительно сохранные тракты мозга [29]. В настоящей работе для вычисления функциональных связей был использован метода Грейнджера [30]. Полученные значения функциональных связей на основе методов статистического анализа позволили выявить особенности восприятия слуховых стимулов у пациентов с UWS и MCS.
МЕТОДИКА
В исследование включили 20 пациентов (18 мужчин, 2 женщины) с ТЧМТ и нарушением сознания. Характеристики пациентов представлены в табл. 1.
Таблица 1.
Характеристика пациентов
| Пациент | Пол | Дней после ТЧМТ | Возраст | Уровень сознания | Тип нарушения сознания |
|---|---|---|---|---|---|
| 1 | M | 55 | 31 | UWS | З |
| 2 | M | 232 | 17 | UWS | Х |
| 3 | M | 72 | 18 | UWS | З |
| 4 | M | 839 | 34 | UWS | Х |
| 5 | M | 32 | 49 | UWS | З |
| 6 | М | 85 | 36 | UWS | З |
| 7 | М | 63 | 62 | UWS | З |
| 8 | М | 2829 | 30 | UWS | Х |
| 9 | М | 271 | 32 | UWS | Х |
| 10 | M | 1634 | 31 | MCS | Х |
| 11 | Ж | 665 | 35 | MCS | Х |
| 12 | M | 27 | 19 | MCS | З |
| 13 | M | 316 | 24 | MCS | Х |
| 14 | М | 25 | 27 | MCS | З |
| 15 | Ж | 45 | 34 | MCS | З |
| 16 | M | 80 | 26 | MCS | З |
| 17 | M | 504 | 36 | MCS | Х |
| 18 | M | 361 | 23 | MCS | Х |
| 19 | M | 627 | 42 | MCS | Х |
| 20 | М | 620 | 56 | MCS | Х |
Пациенты имели затяжное (менее 6 мес.) или хроническое (более 6 мес.) нарушение сознания [31]. В работу включены данные исследования при поступлении в стационар, до проведения медикаментозного лечения и реабилитационных мероприятий.
В состоянии UWS было 9 пациентов (5 – с затяжным и 4 – с хроническим). С MCS было 11 пациентов (4 – с затяжным и 7 – с хроническим).
В дальнейшем у всех пациентов с UWS, 2 пациентов с затяжным MCS и у 2 с хроническим MCS отмечены позитивные клинические изменения, но без выхода в ясное сознание. Положительные клинические изменения включали расширение двигательных возможностей, более устойчивую фиксацию взора и слежения за объектами, появление отдельных эмоциональных реакций, а также наличие клинических признаков понимания речи в виде попыток выполнения простых инструкций (открывание/закрывание глаз, простые движения конечностями), и попыток произнесения звуков (речи).
Контрольная группа состояла из 20 здоровых испытуемых в возрасте от 18 до 59 лет (средний возраст 41 год). Все они были правшами, не имели в анамнезе неврологических, психиатрических заболеваний и ЧМТ.
Регистрацию биопотенциалов проводили на оборудовании фирмы Нейроботикс (Россия) от 32 электродов, расположенных по схеме 10–20% с дополнительными электродами. Регистрацию проводили относительно ушных электродов, используя цифровое объединение. Импеданс был менее 5 кОм, частота пропускания от 0.1 до 70 Гц, использовали аналого-цифровое преобразование с точностью 16 бит, частота опроса составляла 1024 Гц, применяли режекторный фильтр 50 Гц.
Регистрация потенциалов, связанных с событием (ПСС) осуществляли с использованием методики oddball paradigm. Учитывая состояние пациентов и их быструю утомляемость, всего предъявляли 100 звуков. Стандартный тон был интенсивностью 76 дБ частотой 800 Гц и длительностью 80 мс. Девиантный тон – интенсивностью 76 дБ, частотой 400 Гц, длительностью 80 мс. Стандартных тонов было 80%, целевых – 20%. Звуки подавались через наушники бинаурально в псевдослучайном порядке. Последовательность предъявлялась пассивно, без какой-либо инструкции.
Анализ данных. Биопотенциалы обрабатывали в программе “Brainstorm” [32]. К анализу принимали безартефактные участки записи. Перед анализом проводили фильтрацию 2–40 Гц.
Эпоха усреднения ПСС включала 100 мс предстимульного интервала и 1000 мс после стимула. Анализировали ответы на оба тона. Вычисляли усредненные ПСС (GrandMean) для пациентов с затяжным и хроническим UWS и с затяжным и хроническим MCS.
Функциональные связи вычисляли по методу Грейнджера [30]. Метод представляет собой меру линейной зависимости, которая проверяет, можно ли уменьшить дисперсию ошибки для линейной авторегрессионной модели оценки сигнала A при добавлении в модель данных другого сигнала B. Если данное утверждение верно, то сигнал B, согласно Грейнджеру, оказывает причинное влияние на сигнал A, т.е. независимая информация о прошлом B улучшает предсказание A по сравнению с ситуацией, когда известно только прошлое А. Мера причинности по Грейнджеру имеет положительные значения, когда есть причинно-следственная связь и равна нулю, если такой связи нет.
В работе использовали линейную авторегрессионную модель 10 порядка, т.е. сравнивали оценки вида ${{y}_{t}} = {{a}_{1}}{{y}_{{t - 1}}} + \ldots {{a}_{{10}}}{{y}_{{t - 10}}}$ и ${{y}_{t}} = {{a}_{1}}{{y}_{{t - 1}}}$ + $ + \ldots {{a}_{{10}}}{{y}_{{t - 10}}} + {{b}_{1}}{{z}_{{t - 1}}} + \ldots {{b}_{{10}}}{{z}_{{t - 10}}},$ где y – значения сигнала для величины, влияние на которую другой переменной исследуется, z – значения сигнала для предполагаемой причины, t – отсчет времени, ${{a}_{i}},~{{b}_{i}}$ – параметры модели. Оценку показателя причинности, нормированную от 0 до 1, вычисляли, исходя из среднеквадратичных ошибок этих моделей.
Использовали модель с порядком 10. Порядок, равный 10, выбран исходя из литературных данных, и позволяет учесть наличие до 5 периодических процессов в сигнале и при частоте опроса 1024 позволяет учитывать процессы передачи сигнала с задержкой порядка 10 мс. Функциональные связи вычисляли между всеми возможными парами регистрирующих электродов. Для расчета использовали отрезок времени от 0 до 1000 мс от подачи стимула.
Полученные значения функциональных связей пересчитывали на анатомические тракты мозга, которые соединяют области мозга, находящиеся под регистрирующими электродами. Для корректного решения задачи все тракты мозга разбиваются на определенные кластеры, учитывающие проекцию трактов, активные во время выполнения задания зоны мозга, а также имеющие порог активации выше вычисленного на основе значений функциональных связей. При пересчете использовали модель, включающую в себя 130 трактов [29]. Пороговое значение визуализации было выбрано среди рекомендованных, при котором выявлялись наиболее выраженные отличия у пациентов разных групп наблюдений.
Статистический анализ. Для выявления временны́х интервалов, на которых ответы на стандартный и девиантный тон отличаются, проводили сравнение ПСС по каждому отсчету с использованием теста Стьюдента.
При анализе функциональных связей для выявления отличий между пациентами с разной степенью нарушения сознания использовали непараметрический тест Краскела−Уоллиса.
Для разделения пациентов с разными формами нарушения сознания использовали дискриминантный анализ.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ ПСС у здоровых испытуемых. Были выделены 4 группы электродов, на которых отличия ответов на стандартный и девиантный тоны были максимальны. Это левая лобная группа Fs: F3, F7, T7, FC3, FT7, Fp1; правая лобная группа Fd: F4, F8, T8, FC4, FT7, FP2; левая теменная группа Ps: P3, O1, P7, CP3, TP7; и правая теменная группа Pd: P4, O2, P8, CP4, TP8.
На рис. 1 показаны ПСС в лобных и теменных (F3, F4, P3, P4) отведениях. Серым цветом выделены временны́е интервалы, на которых отличия ПСС в ответ на стандартный и девиантный тон достигают статистической значимости (p < 0.05). Для левой лобной области Fs: 55–215, 575–580, 688–697 мс, правой лобной области Fd: 155–206, 674–678, 689–694 мс, левой теменной области Рs: 183–194, 647–661, 743–761 мс, правой теменной области Рd : 187–196, 408–411, 512–518, 652–673, 753–757 мс.
Рис. 1.
ПСС у здоровых испытуемых (GrandMean n = 20). А – ПСС в ответ на стандартный и девиантный тон в лобных и теменных отведениях, серым цветом выделены области, где отличия значимые (p < 0.05). Б – амплитудные топограммы на пиковых латентностях компонентов N100, N200 и Р300. В – визуализация функциональных связей через реконструированные предположительно активные тракты мозга в ответ на I – стандартный и II – девиантный тон.
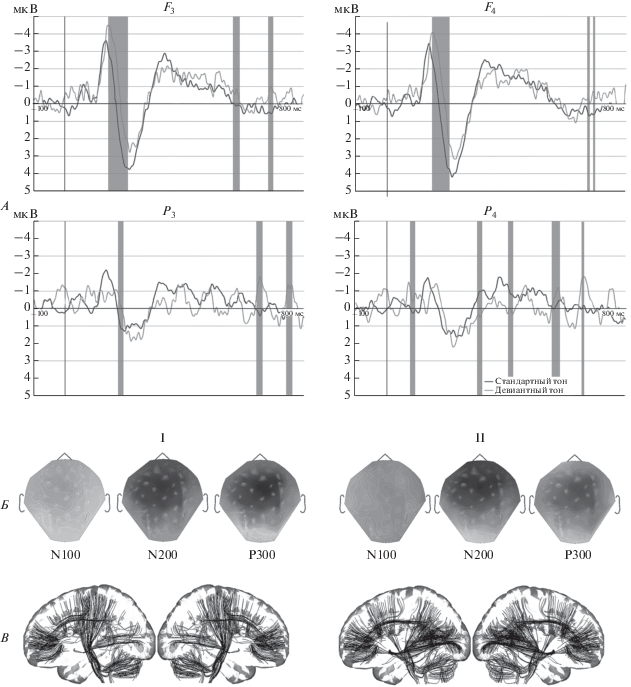
Максимальная амплитуда ответа на пиковых латентностях N200 и Р300 отмечается в правой лобной области.
Связанные со ПСС функциональные связи были визуализированы после пересчета на предположительно активные тракты. Полученная трехмерная модель предполагает активность кортико-спинальных трактов; трактов, связывающих височную и теменную область и переднего продольного пучка. При этом в ответ на стандартный тон более отчетливо выделяются тракты в левом полушарии, тогда как в ответ на девиантный тон – справа.
Анализ ПСС у пациентов с ЧМТ. У пациентов с ЧМТ отчетливо выделялся только компонент, эквивалентный N200, который лучше всего визуализировался в левой лобной области в ответ на стандартный тон у пациентов с хроническим MCS, и, в меньшей степени, у пациентов с UWS.
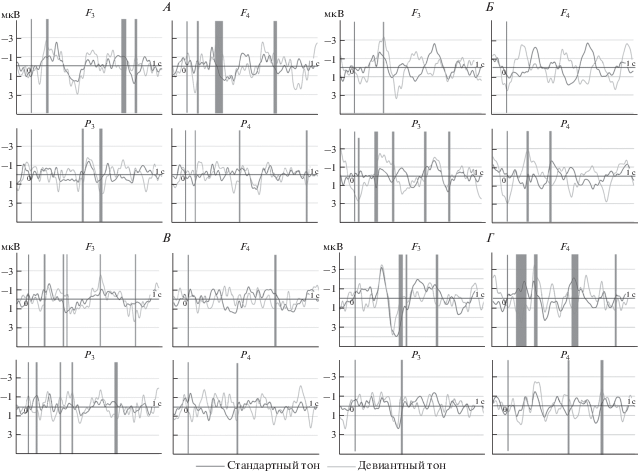
На рис. 2 показаны ПСС у пациентов с нарушением сознания. Выделены временные интервалы, где отличия на стандартный и девиантный тон достигали статистической значимости (p < < 0.05). У пациентов с длительным UWS значимые отличия выявляются на интервалах в левой лобной области Fs: 120–136, 684–728, 792–816 мс, правой лобной области Fd: 84–96, 224–288, 668–684, 704–712 мс, левой теменной области Ps: 388–400, 528–540 мс, правой теменной области Pd: 60–72, 398–412, 904–916 мс. То есть, хотя отличия и есть, они в большей степени характерны для правой лобной области, для интервала компонента N200. У пациентов с хроническим UWS значимые отличия в ответ на стандартный и целевой тон для Fs: 246–250 мс, Рs: 32–44, 172–184, 304–312, 552–568, 748–756 мс, Рd: 174–172, 328–352 мс, т.е. выявленные отличия носят хаотический характер и в большей степени затрагивают левую теменную область. У пациентов с затяжным MCS отличия между ответами на стандартный и девантный тон отмечаются для Fs: 100–110, 248–252, 266–270, 510–520, 792–800 мс, Fd: 660–672 мс, Рs: 46–64, 224–244, 308–328, 640–652 мс, Рd: 368–378 мс. То есть выявленные отличия в большей степени затрагивают левую лобно-теменную область. У пациентов с длительным MCS значимые отличия выявляются для Fs: 332–364, 388–396, 608–620 мс, Fd: 76–140, 212–222, 484–532, 804–816 мс, Рs: 344–360 мс, Рd: 448–456, 696–708 мс, т.е. отличия выявляются в большей степени в правой лобной области.
Рис. 2.
Усредненные по группам наблюдений (GrandMean) ПСС в ответ на стандартный и девиантный тон. А – у пациентов в затяжным UWS (n = 5), Б – хроническим UWS (n = 4), В – затяжным MCS (n = 4), Г – хроническим MCS (n = 7). Показаны лобные (F3, F4) и теменные (Р3, Р4) отведения. Серым цветом выделены области, где отличия на стандартный и девиантный тон значимые (p < 0.05).
Анализ функциональных связей. При количественном анализе были оценены функциональные связи между всеми возможными сочетаниями пар электродов – 992 пары. Все значения функциональных связей у пациентов с нарушением сознания выше таковых у здоровых испытуемых (p < 0.001). При этом не было выявлено значимых отличий значений функциональных связей у пациентов с разной формой и длительностью нарушения сознания (рис. 3). Это позволило предположить, что для уровня нарушения сознания будет важно не только абсолютное значение функциональных связей, но и разные сочетания функциональных связей. Для проверки данного предположения были проанализированы функциональные связи внутри и между 4 ранее выделенными группами электродов: Fs, Fd, Ps и Pd.
Рис. 3.
Средние значения функциональных связей, усредненные по всем возможным парам отведений. Представлены значения для каждого испытуемого и пациента в ответ на стандартный и девиантный тон. з-UWS – затяжное UWS, x-UWS – хроническое UWS, з-MCS – затяжное MCS, х-MCS – хроническое MCS, з-MCS-в – затяжное MCS c последующей положительной клинической динамикой, х-MCS-в – хроническое MCS с последующей положительной клинической динамикой.
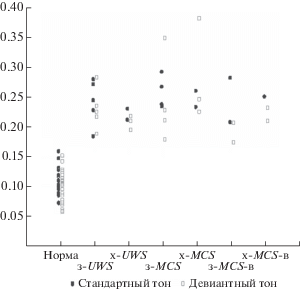
У здоровых испытуемых статистически значимые отличия функциональных связей в ответ на стандартный и девиантный тон выявляются между правой лобной и левой теменной областями: Fd vs. Ps (p < 0.05). У пациентов с UWS значимых отличий выявлено не было. У пациентов с MCS значимые отличия отмечены между правой лобной и правой теменной областями и между правой и левой теменными областями: Fd vs. Ps и Pd vs. Ps (p < 0.05).
При сопоставлении функциональных связей у пациентов с разной формой нарушения сознания статистически значимых отличий не было выявлено. Однако были выявлены области, которые можно рассматривать как зону повышенного внимания для дальнейших исследований. Анализ ответов на стандартный тон показал, что у пациентов разных групп максимальные отличия достигают в значениях функциональных связей между отведениями правой лобной области Fd : H(5, N = 19) = 10.29737, p = 0.067. Анализ ответов на девиантный тон выявил, что максимальные отличия выделяются в связях между правой теменной и правой лобной областью Pd–Fd: H(5, N = 19) = 9.737895, p = 0.083; между правой лобной и правой теменной областью Fd–Pd: H(5, N = = 19) = 9.880526, p = 0.079 и между теменными отделами Pd–Ps: H(5, N = 19) = 9.871053, p = 0.079.
Использование дискриминантного анализа показало, что максимальную значимость для разделения пациентов с UWS и MCS имеют функциональные связи в ответ на стандартный тон в правой лобной группе электродов и между левой теменной и правой лобной группой электродов; в ответ на девиантный тон – между левой теменной группой и правой лобной и правой теменной и левой теменной группами. Критерии включения и исключения Fвкл = 6, Fискл = 5. Wilks’ Lambda: F(24, 102) = 10.710, p < 0.0001 (табл. 2, рис. 4).
Таблица 2.
Данные дискриминантного анализа
| Тип тона | Область функциональных связей | Коэффициент Wilks’-Lambda | F-критерий Фишера (6.30) | p-значение |
|---|---|---|---|---|
| Девиантный тон | Ps–Fd | 0.028 | 5.98 | 0.0003 |
| Pd–Ps | 0.029 | 6.37 | 0.0002 | |
| Стандартный тон | Ps–Fd | 0.038 | 9.75 | 0.0001 |
| Fd–Fd | 0.037 | 9.53 | 0.0001 |
Рис. 4.
Данные дискриминантного анализа. Проекция пациентов на наилучшую разделяющую плоскость. Обозначения см. рис. 3.
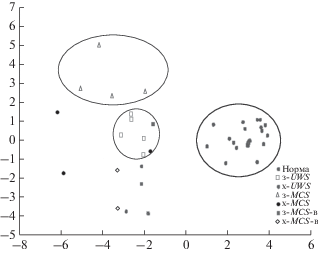
Применение дискриминантного анализа с более мягкими критериями включения и исключения (Fвкл = 4, Fискл = 3), Wilks’ Lambda: F(54, 126) = = 10.048, p < 0.0001, показало, что значимыми также являются функциональные связи в ответ на стандартный тон внутри левой лобной области, между правой лобной и левой лобной областями и между правой теменной и левой теменной областями; в ответ на девиантный тон – внутри правой лобной области.
Пересчет функциональных связей на тракты мозга показал, что у пациентов с затяжным UWS в ответ на девиантный тон отмечается большее количество связей в лобных отделах и меньшее количество “вертикальных” трактов, по сравнению с ответом на стандартный тон (рис. 5). У пациентов с хроническим UWS резко снижено общее число всех связей.
Рис. 5.
Пересчет функциональных связей на тракты мозга у пациентов с нарушением сознания. В ответ на I – стандартный и II – девиантный тоны у пациентов. А – с затяжным UWS, Б – хроническим UWS, В – затяжным MCS, Г – хроническим MCS.
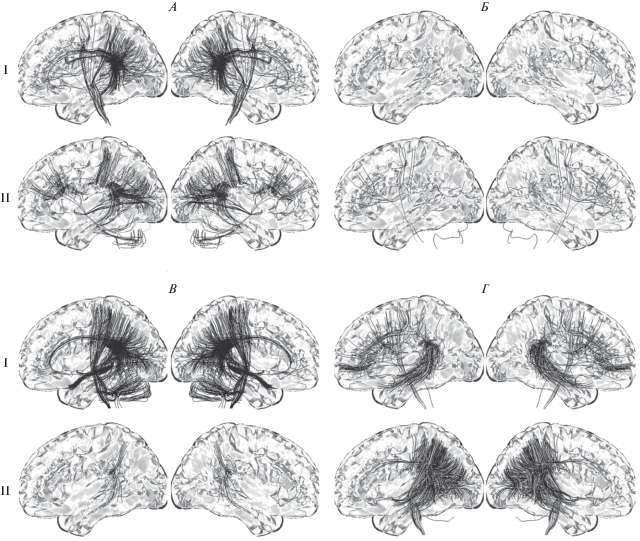
У пациентов с затяжным MCS в ответ на стандартный тон выделяются преимущественно связи в теменной области и “вертикальные” связи. При этом в ответ на девиантный тон выделяется значительно меньшее число связей. У пациентов с хроническим MCS в ответ на стандартный тон выделяются связи в лобных отделах. На девиантный тон выделяются в большей степени связи в теменной области и “вертикальные” связи.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В исследовании использовалась двухстимульная oddball парадигма в пассивной модификации, т.е. звуки предъявлялись без предварительной инструкции. Для здоровых испытуемых эта задача является очень простой. Выявленные отличия в ответ на стандартный и девиантный тон в большей степени отражают активацию непроизвольного внимания. Можно полагать, что выявленные отличия предположительно отражают переключение между собой как минимум двух нейронных сетей. Наиболее вероятно, одна из этих сетей относится к вентральной системе внимания, доминирующей во время непроизвольного внимания, поскольку максимальные отличия в ПСС в ответ на стандартный и девиантный тон отмечаются в лобных отделах, а максимальные отличия функциональных связей между стандартным и девиантным тоном отмечаются для связей между правой лобной и левой теменной областями. То есть в ответ на девиантный тон предполагается усиление влияния правой лобной области на теменную. В данном исследовании мы не рассматривали временные интервалы внутри ПСС, однако ранее в работах с поиском дипольных источников было показано, что при переходе от непроизвольного к произвольному слуховому вниманию происходит последовательная активация правой и левой височной области, левой цингулярной коры, правой лобной области и левой и правой теменной области [33, 34].
Применение дискриминантного анализа позволило выявить функциональные связи, которые в большей степени отличаются у пациентов с UWS и MCS. Это функциональные связи между правой теменной и левой теменной областями и между левой теменной и правой лобной областями. И в меньшей степени это выражено в связях внутри правой лобной области, а также ее связях с левой лобной областью. Полученные данные позволяют предположить, что у пациентов с UWS и MCS разная степень сохранности произвольных функций, включая внимание, что, вероятно, является одним из ключевых условий для восстановления ясного сознания.
При этом необходимо учитывать, что у пациентов отмечается неустойчивое выделение компонентов ПСС. Отчасти, это может быть обусловлено достаточно небольшим числом подаваемых стимулов в последовательности. Но поскольку дисперсия среднего изменяется обратно пропорционально числу усреднений, даже при подаваемом количестве стимулов можно ожидать успешного выделения ответа, если его амплитуда уступает амплитуде спонтанной активности не более чем на порядок. Это подтверждается хорошим выделением ответа у здоровых испытуемых. Учитывая, что все пациенты имели ТЧМТ и находились в бессознательном состоянии в течение нескольких месяцев, можно полагать, что отсутствие ответов в большей степени обусловлено состоянием пациента, а не особенностями методики.
У пациентов с MCS максимальные отличия функциональных связей в ответ на стандартный и девиантный тон отмечаются между правой лобной и левой теменной областями и правой теменной и левой теменной областями. Можно предположить, что это ведет к одновременной активации вентральной и дорзальной систем внимания, что не позволяет им эффективно работать и ведет к нарушению обеих систем. У пациентов с затяжным MCS отмечена большая выделяемость связей в теменной области в ответ на стандартный тон. Можно полагать, что реагирование на более часто повторяющийся тон может обеспечиваться одновременно работающими системами внимания, тогда как выделение редкого тона является достаточно сложной задачей, для выполнения которой необходимо переключение между собой передней и задней систем внимания.
У пациентов с хроническим MCS в ответ на стандартный тон отмечается активация отдельных двунаправленных связей в лобных отделах при практически полном отсутствии активации в теменной области. Тогда как в ответ на девиантный тон отмечается активация в теменной области при практически полном отсутствии связей в лобных отделах. Нельзя исключать, что именно недостаточная фоновая активация трактов, относящихся в другой системе, не позволяет полноценно переключаться нейронным сетям с одной на другую. Две системы, хотя и имеют реципрокные отношения, частично перекрываются, чего нет у пациентов с нарушением сознания. Нельзя исключать, что у пациентов с длительным MCS формируются редуцированные системы, которые при сохранности переключения между собой, не могут обеспечить достаточной общей активации частей, входящих в разные подсистемы. То есть входящие части в переднюю систему внимания не могут входить и в заднюю систему, и наоборот. При том, что в норме эти системы частично перекрываются, за счет чего обеспечивается их быстрое переключение и постоянная работа.
У пациентов с длительным UWS в ответ на стандартный тон происходит в большей степени дорзальной системы внимания. Однако при недостаточной активации вентральной системы, эта активация не способна работать в полной мере. У пациентов с хроническим UWS доминирующим является не способность к переключению между системами, а значительные нарушения и недостаточность элементов, входящих в каждую из систем. Это подтверждается практически полным отсутствием визуализированных трактов.
Выявлено, что максимальные отличия отмечаются в реконструированных трактах, находящихся в глубине. Это согласуется с данными клинических работ, которые выявили, что в первую очередь при травме мозга повреждаются пути, тяготеющие к центру мозга. Прежде всего, это касается мозолистого тела (corpus callosum) и свода (formix). Также при травме часто повреждается внутренняя капсула (internal capsule), верхний и нижний продольный пучки (superior и inferior longitudinal fasciculi) и мозжечковые волокна. Кроме того, более длинные тракты больше подвержены повреждению. При этом посмертные исследования показывают, что изменения могут выявляться только на гистологическом уровне [35]. Последний факт, отчасти, может объяснять то, что эти изменения не могут быть выявлены трактографией.
Отдельно стоит отметить, что максимальные отличия в функциональных связях и реконструированных трактах выявляются у пациентов с хроническим нарушением сознания. Это согласуется с работами, показывающими, что нарушения связей в остром периоде легкой травмы могут быть обусловлены межклеточным отеком и носить обратимый характер, тогда как в отдаленном периоде данные изменения отражают потерю волокон и необратимы. Хотя данные были получены на спортсменах [36], можно полагать, что при более тяжелой травме хотя бы часть механизма носит тот же характер.
ЗАКЛЮЧЕНИЕ
Показано, что дискриминантный анализ может быть использован для разделения пациентов с UWS и MCS на основе значений функциональных связей, связанных с восприятием звуков. При этом наиболее значимыми являются функциональные связи между правой теменной и левой теменной группами связей, между левой теменной и правой лобной областями. И в меньшей степени оказывают влияние на точность разделения связи внутри правой лобной области, а также ее связи с левой лобной областью.
Этические нормы. Все исследования были проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях. Исследования проводили в рамках плановых научных тем и комплексного клинического обследования при оказании медицинской помощи в Национальном медицинском исследовательском центре нейрохирургии им. академика Н.Н. Бурденко Минздрава России (Москва). Исследование было одобрено местным этическим комитетом.
Информированное согласие. Все испытуемые были осведомлены о цели и методах исследования и подписывали информированное согласие. Учитывая состояние пациентов, согласие на проведение исследования подписывали их законные представители (родственники), при полном понимании цели и методов исследования.
Финансирование работы. Исследование выполнено на средства государственного бюджета по госзаданию на 2019–2021 гг. (АААА-А17-117092040004-0).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Vithoulkas G., Muresanu D.F. Conscience and consciousness: a definition // J. Med. Life. 2014. V. 7. № 1. P. 104.
Billeri L., Filoni S., Russo E.F. et al. Toward Improving Diagnostic Strategies in Chronic Disorders of Consciousness: An Overview on the (Re-) Emergent Role of Neurophysiology // Brain Sci. 2020. V. 10. № 1. P. 42.
Laureys S., Celesia G., Cohadon F. et al. Unresponsive wakefulness syndrome: a new name for the vegetative state or apallic syndrome // BMC Med. 2010. V. 8. № 1. P. 1.
Boly M., Faymonville M.E., Peigneux P. et al. Cerebral processing of auditory and noxious stimuli in severely brain injured patients: differences between VS and MCS // Neuropsychol. Rehabil. 2005. V. 15. № 3–4. P. 283.
Naccache L. Minimally conscious state or cortically mediated state? // Brain. 2018. V. 141. № 4. P. 949.
Edlow B.L., Claassen J., Schiff N.D. et al. Recovery from disorders of consciousness: mechanisms, prognosis and emerging therapies // Nat. Rev. Neurol. 2021. V. 17. № 3. P. 135.
Hayes J.P., Bigler E.D., Verfaellie M. Traumatic Brain Injury as a Disorder of Brain Connectivity // J. Int. Neuropsychol. Soc. 2016. V. 22. № 2. P. 120.
Shipp S. The brain circuitry of attention // Trends Cogn. Sci. 2004. V. 8. № 5. P. 223.
Hopfinger J.B., Buonocore M.H., Mangun G.R. The neural mechanisms of top-down attentional control // Nat. Neurosci. 2000. V. 3. № 3. P. 284.
MacDonald D.D, Ingersoll C.G., Berger T.A. Development and evaluation of consensus-based sediment quality guidelines for freshwater ecosystems // Arch. Environ. Contam. Toxicol. 2000. V. 39. № 1. P. 20.
Petersen S.E., Posner M.I. The attention system of the human brain: 20 years after // Annu. Rev. Neurosci. 2012. V. 35. P. 73.
Corbetta M., Shulman G.L. Control of goal-directed and stimulus-driven attention in the brain // Nat. Rev. Neurosci. 2002. V. 3. № 3. P. 201.
Mason M.F., Norton M.I., Van Horn J.D. et al. Wandering minds: the default network and stimulus-independent thought // Science. 2007. V. 315. № 5810. P. 393.
Buckner R.L., Andrews-Hanna J.R., Schacter D.L. The brain’s default network: anatomy, function, and relevance to disease // Ann. N.Y. Acad. Sci. 2008. V. 1124. P. 1.
Raichle M.E., MacLeod A.M., Snyder A.Z. et al. A default mode of brain function // Proc. Natl. Acad. Sci. U.S.A. 2001. V. 98. № 2. P. 676.
Allan P.G., Briggs R.G., Conner A.K. et al. Parcellation-based tractographic modeling of the dorsal attention network // Brain Behav. 2019. V. 9. № 10. P. e01365.
Barbeau E.B., Descoteaux M., Petrides M. Dissociating the white matter tracts connecting the temporo-parietal cortical region with frontal cortex using diffusion tractography // Sci. Rep. 2020. V. 10. № 1. P. 8186.
Polich J. Updating P300: an integrative theory of P3a and P3b // Clin. Neurophysiol. 2007. V. 118. № 10. P. 2128.
Kim H. Involvement of the dorsal and ventral attention networks in oddball stimulus processing: a meta-analysis // Hum. Brain Mapp. 2014. V. 35. № 5. P. 2265.
Ptak R. The frontoparietal attention network of the human brain: action, saliency, and a priority map of the environment // Neuroscientist. 2012. V. 18. № 5. P. 502.
Vossel S., Geng J.J., Fink G.R. Dorsal and Ventral Attention Systems: Distinct Neural Circuits but Collaborative Roles // Neuroscientist. 2014. V. 20. № 2. P. 150.
Cazzoli D., Kaufmann B.C., Paladini R.E. et al. Anterior insula and inferior frontal gyrus: where ventral and dorsal visual attention systems meet // Brain Commun. 2021. V. 3. № 1. P. fcaa220.
Allen E.A., Damaraju E., Plis S.M. et al. Tracking whole-brain connectivity dynamics in the resting state // Cereb. Cortex. 2014. V. 24. P. 663.
Wu M., Li F., Wu Y. et al. Impaired frontoparietal connectivity in traumatic individuals with disorders of consciousness: A dynamic brain network analysis // Aging Dis. 2020. V. 11. P. 301.
Fingelkurts An.A., Fingelkurts AI.A. Persistent operational synchrony within brain default-mode network and self-processing operations in healthy subjects // Brain Cogn. 2011. V. 75. № 2. P. 79.
Demertzi A., Gomez F., Crone J.S. et al. Multiple fMRI system-level baseline connectivity is disrupted in patients with consciousness alterations // Cortex. 2014. V. 52. P. 35.
Huang Z., Dai R., Wu X. et al. The self and its resting state in consciousness: an investigation of the vegetative state // Hum. Brain Mapp. 2014. V. 35. № 5. P. 1997.
Coquelet N., De Tiège X., Destoky F. et al. Comparing MEG and high-density EEG for intrinsic functional connectivity mapping // Neuroimage. 2020. V. 210. P. 116556.
Yeh F.C., Panesar S., Fernandes D. et al. Population-averaged atlas of the macroscale human structural connectome and its network topology // Neuroimage. 2018. V. 178. P. 57.
Geweke J. Measurement of Linear Dependence and Feedback between Multiple Time Series // J. Am. Stat. Assoc. 1982. V. 77. № 378. P. 304.
Зайцев О.С. Психопатология тяжелой черепно-мозговой травмы. М.: МЕДпресс-информ, 2011. 336 с. Zaitsev O. Psikhopatologiia Tiazheloi Cherepno-Mozgovoi Travmy [Psychopathology of Severe Traumatic Brain Injury]. M.: MEDpress-inform, 2011. 336 p.
Tadel F., Baillet S., Mosher J.C. et al. Brainstorm: a user-friendly application for MEG/EEG analysis // Comput. Intell. Neurosci. 2011. V. 2011. Article ID 879 716.
Oknina L.B., Wild-Wall N., Oades R.D. et al. Frontal and temporal sources of mismatch negativity in healthy controls, patients at onset of schizophrenia in adolescence and others at 15 years after onset // Schizophr. Res. 2005. V. 76. № 1. P. 25.
Jemel B., Oades R.D., Oknina L. et al. Frontal and temporal lobe sources for a marker of controlled auditory attention: the negative difference (Nd) event-related potential // Brain Topogr. 2003. V. 15. № 4. P. 249.
Hayes J.P., Bigler E.D., Verfaellie M. Traumatic Brain Injury as a Disorder of Brain Connectivity // J. Int. Neuropsychol. Soc. 2016. V. 22. № 2. P. 120.
Henry L.C., Tremblay J., Tremblay S. et al. Acute and chronic changes in diffusivity measures after sports concussion // J. Neurotrauma. 2011. V. 28. № 10. P. 2049.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


