Физиология человека, 2022, T. 48, № 1, стр. 69-78
Негативные компоненты зрительных вызванных ответов в саккадической парадигме “GO/NOGO” у “быстрых” и “медленных” испытуемых
М. В. Славуцкая 1, 2, *, С. А. Карелин 1, А. В. Котенев 1
1 Московский государственный университет имени М.В. Ломоносова
Москва, Россия
2 ФГБНУ “Центр психического здоровья”
Москва, Россия
* E-mail: mvslav@yandex.ru
Поступила в редакцию 29.01.2021
После доработки 18.03.2021
Принята к публикации 30.04.2021
- EDN: JOVNAL
- DOI: 10.31857/S0131164622010143
Аннотация
В саккадической парадигме “Go/NoGo” анализировали параметры и топографию негативных компонентов зрительного вызванного потенциала (ВП) на пусковые (Go) и тормозные (NoGo) стимулы в зависимости от индивидуальной величины латентного периода (ЛП) саккадического ответа. Целью работы являлось изучение функционального значения компонентов N1 (150) и N2 (250) в саккадической парадигме “Go/NoGo” в группах “быстрых” и “медленных” испытуемых. Показано, что амплитуда компонента N1 в “Go” условиях выше у медленных испытуемых (ЛП – 272 ± 8 мс), а в “NoGo” условиях – у быстрых (ЛП – 180 ± 7 мс). В “NoGo” условиях латентность компонента N1 больше у быстрых испытуемых, а латентность компонента N2 у медленных испытуемых. Выявленные различия в параметрах и топографии негативных компонентов ВП, позволяют рассматривать компонент Go-N1 как коррелят активации процессов направленного внимания на стадии анализа стимула у “медленных” испытуемых, и на стадии принятия решения и инициации саккады у “быстрых” испытуемых. Компонент NoGo-N2 может рассматриваться как коррелят принятия решения и “торможения” ответа у “медленных” испытуемых, а у “быстрых” испытуемых – как коррелят мониторинга тормозного ответа и “обновления памяти”. Высказывается предположение, что выявленные различия могут быть обусловлены более высоким уровнем моторной готовности у “быстрых” испытуемых и более высоким уровнем неспецифического торможения моторной системы у “медленных” испытуемых в предстимульном периоде.
Саккадические движения глаз на зрительные стимулы служат информативной моделью для изучения механизмов произвольной регуляции адаптивных ответов. Согласно ряду психофизиологических концепций в программу зрительно вызванной саккады, которая формируется в латентном периоде (ЛП), включены когнитивные функции внимания, принятия решения, торможения (фиксация глаз) [1–3]. В клинических и нейрофизиологических исследованиях показано анатомическое и функциональное перекрытие структур, контролирующих программирование саккады и функции внимания, принятия решения и торможения [4–7]. Однако механизмы их интеграции в произвольном контроле саккадических ответов остаются мало изученными.
Одной из возможностей решения этой проблемы может служить анализ связанных с событием потенциалов ЭЭГ, ассоциированных как с процессами переработки зрительной информации [8–10], так и с программированием саккады [11, 12]. Адекватным методом для исследования произвольного контроля саккадического поведения является экспериментальная парадигма “Go/NoGo” [5–13]. Ранее нами были установлены различия в выраженности и топографии позитивных компонентов ERP в саккадической парадигме “Go/NoGo” в зависимости от индивидуальной величины ЛП саккады, что позволило предположить различную функциональную значимость одних и тех же компонентов вызванного потенциала (ВП) в группе “быстрых” и “медленных” испытуемых [14]. Так, компонент Go-P100 у “быстрых” испытуемых отражает процессы принятия решения и инициации саккады, а у “медленных” – процессы оценки стимула.
Средняя величина ЛП саккадических движений глаз отражает скорость сенсомоторной реакции, характерную для конкретного человека. В дифференциальной психофизиологии скорость реакции служит показателем индивидуального темпа протекания психофизиологических процессов как в ЦНС, так и в поведении, которую ассоциируют с уровнем когнитивных, физиологических и физико-химических процессов [15].
Однако нейрофизиологических исследований индивидуальной скорости подготовки произвольных ответов практически нет. Существуют отдельные работы, в которых были показаны отличия в параметрах ранних и поздних компонентов ВП при формировании быстрых и медленных ответов в ходе эксперимента у одного и того же испытуемого в парадигме “oddball” [16, 17]. Однако функциональная значимость компонентов ВП в зависимости от индивидуальной средней величины ЛП ответа конкретного испытуемого не изучалась. Подобные исследования в условиях саккадической парадигмы “Go/NoGo” до настоящего времени не проводились. В связи с этим представляет интерес дальнейший анализ усредненных потенциалов ЭЭГ в группе “быстрых” и “медленных” испытуемых. Актуальность исследования также связана с использованием в клинических исследованиях некоторых компонентов ВП как маркеров нарушения когнитивных функций при ряде психических заболеваний без учета индивидуальной величины латентности ответа.
Цель данной работы – изучить функциональное значение негативных компонентов N1 и N2 в парадигме “Go/NoGo” в зависимости от индивидуальной величины ЛП саккадического ответа в группе “быстрых” и “медленных” испытуемых.
Негативные компоненты ВП ассоциируют с процессами активации и внимания, необходимых на всех этапах сенсомоторной интеграции, а также при произвольном торможении [8, 12, 18]. Анализ негативных компонентов ВП в саккадической парадигме “Go/NoGo” позволит получить дополнительную информацию о функциональной взаимосвязи процессов внимания, принятия решения и торможения при программировании саккадических ответов или их отмены.
МЕТОДИКА
В исследовании принимали участие 24 праворуких испытуемых (20 мужчин) в возрасте 18–22 (20 ± 2) года с нормальным или скорректированным зрением, и отсутствием неврологических заболеваний в анамнезе.
Оборудование. Электроэнцефалограмму регистрировали монополярно от 25 отведений (FP1, FP2, F7, F8, F3, F4, Fz, FC3, FC4, FCz, C3, C4, Cz, T3, T4, T5, T6, CP3, CP4, CPz, P3, P4, Pz, O1, O2) c помощью фиксирующей шапочки “MCScap-E” (Россия) по схеме 10-10 , модифицированной для 32 электродов, и аппаратного комплекса NVX-52 (Россия). В качестве референтного отведения использовали объединенный ушной электрод. Горизонтальные движения глаз регистрировали биполярно с помощью электроокулограммы (ЭОГ). Чашечковые электроды диаметром 10 мм располагали у наружного края правой и левой глазниц. Сопротивление под электродами не превышало 5 кОм. Частота оцифровки сигналов равнялась 512 Гц; фильтр верхних частот 70 Гц, постоянная времени для регистрации ЭЭГ – 1 с, а для регистрации ЭОГ – 0.5 с.
Процедура. Во время эксперимента испытуемый находился в темной камере, сидя в кресле с подголовником. Зрительные стимулы в виде кружков или крестиков белого цвета (диаметр 0.2 угл. град) предъявляли на черном экране монитора, расположенного в 60 см от глаз испытуемого. Использовали три зрительных стимула – центральный фиксационный стимул (ЦФС) и два периферических зрительных стимула (ПЗС), которые располагали на расстоянии 7 угл. град слева или справа от ЦФС по горизонтальной линии и служили целевыми стимулами. ПЗС включали одновременно с выключением ЦФС (рис. 1).
Рис. 1.
Схема предъявления стимулов. А – “Go” условия, Б – “NoGo” условия, В (а, б) – предъявляемые стимулы.
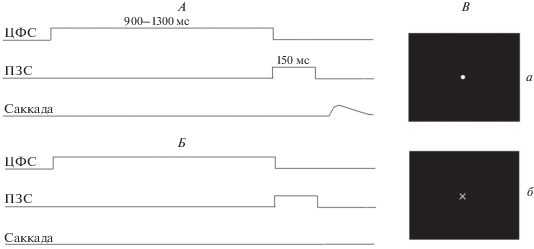
В ходе эксперимента каждому участнику равно вероятностно предъявляли два типа целевых стимулов – пусковой (“Go”), на который следовало совершить саккаду, и тормозный (“NoGo”), на который взор переводить не следовало. Применяли метод контрбалансировки стимулов – у половины испытуемых пусковым стимулом был крестик, а тормозным – кружок, а у второй половины – наоборот, кружок был пусковым стимулом, а крестик – тормозным. Испытуемые должны были фиксировать взгляд на ЦФС, а при предъявлении ПЗС (кружок или крестик) должны были как можно быстрее перевести на него взгляд. После движения глаз испытуемые произвольно возвращали взгляд в центр экрана. При предъявлении тормозного ПЗС (крестика или кружка) испытуемые должны были продолжать удерживать взгляд в центре экрана. Интервал между последующими реализациями стимулов составлял 2–3 с.
Длительность ЦФС составляла 1000–1300 мс, длительность ПЗС – 150 мс. ПЗС различного сигнального значения предъявляли с равной вероятностью в левом или правом зрительном полуполе. Используемая модификация парадигмы “Go/NoGo” минимизирует возможность формирования у испытуемого установки на производство саккады или ее торможение в зависимости от вероятности предъявления пусковых или тормозных стимулов.
Каждому испытуемому предъявляли от 250 до 400 зрительных стимулов в течение эксперимента. Стимулы предъявляли блоками по 50 стимулов в каждом. После 2–3 блоков испытуемому предлагали сделать небольшой перерыв для отдыха. Эксперименту предшествовало обучение испытуемого, в течение которого ему предъявляли от 1 до 3 стимульных блоков.
Анализ данных. Планирование и управление экспериментом, сбор и первичный анализ данных проводили средствами комплексной электрофизиологической лаборатории CONAN-NVX. Поиск саккад, вычисление величины их ЛП, усреднение ЭЭГ-записей и их анализ осуществляли автоматически с помощью системы CONAN-m и оригинальных компьютерных программ SACCADE SEACH и CONAN GLEW. Начало саккады определяли как момент первой из трех последовательных точек отклонения кривой ЭОГ от нулевой линии. Записи ЭЭГ с артефактами от движения глаз исключали из обработки.
Для более четкого выявления компонентов ВП использовали выборочный способ усреднения ЭЭГ. Для усреднения выбирали только те записи ЭЭГ, в которых величина ЛП саккады на пусковые (Go) стимулы варьировала в узком диапазоне (±20 мс) от среднего значения или главной моды в распределении ЛП саккадических ответов. Подобный метод усреднения необходим из-за широкого диапазона колебаний величины ЛП саккады у всех испытуемых (от 85 до 500 мс), и позволяет с большей уверенностью сопоставлять компоненты ВП с определенной стадией программирования саккады в ЛП и зрительной переработки.
Использовали два типа усреднения, в которых триггерами служили моменты включения ПЗС (прямое усреднение) или начала саккадического ответа по ЭОГ (обратное усреднение). Число записей ЭЭГ для усреднения колебалось от 25 до 30 в зависимости от испытуемого. Интервал усреднения составлял 2000 мс: 1000 мс до триггера и 1000 мс после. Нулевая линия устанавливалась на отрезке в 500 мс до начала саккады для “Go” стимулов. При предъявлении тормозных “NoGo” стимулов использовали только прямое усреднение и нулевую линию устанавливали на отрезке, аналогичном соответствующему усреднению в “Go” условиях. При этом записи ЭЭГ для усреднения выбирали произвольно в каждом последовательном экспериментальном блоке, и их число равнялось числу записей в “Go” усреднении.
Компоненты ВП выделяли с помощью специализированного программного блока (ERP) системы CONAN-m. Использовали дополнительную фильтрацию усредненных записей ЭЭГ с верхней частотной границей 30 Гц. Оценивали амплитуду (А), латентность пика (ПЛ) и топографию компонентов ВП N1 и N2. Амплитуда пика потенциалов измерялась от нулевой линии в каждом отведении ЭЭГ в интервалах 90–170 мс для компонента N1 и 175–300 мс для компонента N2. При обратном усреднении компонент N –(минус)1 премоторного потенциала выделяли в интервале 75–20 мс до начала саккады.
По данным компьютерного анализа для каждого испытуемого вычисляли средние значения амплитуды и латентности максимального пика компонентов N1 и N2 для группы “быстрых” и “медленных” испытуемых. В связи с индивидуальными различиями в локализации пиков компонентов N1 и N2 в отведениях ЭЭГ проводили межгрупповое сравнение соотношения числа максимальных пиков компонента у всех испытуемых в передних фронто-центральных отведениях (F3, F4, Fz, FC3, FC4, FCz, C3, C4, Cz) и в задних центрально-теменно-затылочных (CP3, CP4, CPz, P3, P4, Pz, O1 и O2).
Для качественного анализа пространственно-временной динамики распределения фокусов компонента ВП по коре использовали метод ЭЭГ-картирования амплитуды компонента с шагом 8 мс. Критерием наличия фокуса потенциала определенного знака в конкретном усреднении ЭЭГ служила интенсивность его окраски, равная или превышающая уровень в 25% от минимального значения по цветовой шкале амплитуды ВП для конкретного усреднения. В последовательных “картах” ЭЭГ визуально оценивали представленность фокусов компонента ВП в отведениях ЭЭГ и направленность смены его фокусов по отведениям в период развития потенциала (top-down, bottom up или др.).
Статистический анализ данных проводили с помощью программ STADIA 8.0G и MS Excel. Для оценки межгрупповых различий в параметрах компонентов ВП использовали двухфакторный дисперсионный анализ для модели фиксированных факторных эффектов с повторными измерениями. Первый фактор – группа (2 уровня – “быстрые” и “медленные” испытуемые), второй вспомогательный фактор – отведение (19 уровней). Такой анализ проводили отдельно для четырех сочетаний: “условие” (2 уровня – “Go” или “NoGo”) и “латеральность” (2 уровня – стимул слева или справа). В случае значимого эффекта проводили апостериорное сравнение средних значений амплитуды и латентности пика, используя критерий Стьюдента (t) и критерий Вилкоксона (W). Для коррекции множественных сравнений применяли поправку Бонферрони. Различия в частотах событий оценивали по Z‑критерию согласия частот [18].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Статистический анализ позволил разделить всех испытуемых по средней величине ЛП саккады на две группы: “быстрые” испытуемые (ЛП = = 180 ± 7 мс) и “медленные” испытуемые (ЛП = = 272 ± 8 мс) по 12 чел. в каждой группе (t = 9.78, p = 0.00007).
В пусковых условиях у “медленных” испытуемых в интервале ЛП саккады располагались компоненты N1 и N2, а у “быстрых” испытуемых только компонент N1 (рис. 2). Компонент Go-N2 анализировали только у “медленных” испытуемых, так как у “быстрых” испытуемых в большинстве случаев он искажался моторными потенциалами от саккадического ответа.
Рис. 2.
Вызванные потенциалы (ВП) ЭЭГ и фрагменты ЭЭГ-картирования их амплитуды у “быстрых” и “медленных” испытуемых. А – Grand–усреднения ЭЭГ-потенциалов от включения пусковых (1) и тормозных (2) стимулов по группе “быстрых” испытуемых, n = 282 (сплошная линия) и по группе “медленных” испытуемых, n = 296 (пунктирная линия); Б – фрагмент ЭЭГ-картирования амплитуды компонентов ВП в “Go” (1) и “NoGo” (2) условиях в группе “быстрых” (1 и 2) и “медленных” испытуемых (3 и 4, соответственно). 1 – Go-N1 – фокусы темного цвета в интервале 96–144 мс; 2 – NoGo-N1 (96–128 мс), NoGo-N2 (208–256 мс); 3 – Go-N1 (80–128 мс), Go-N2 (192–264 мс); 4 – NoGo-N1 (112–144 мс), NoGo-N2 (176–224 мс). Шаг картирования 16 мс. Стрелка обозначает условное начало саккады. Триггер усреднения – включение сигнального стимула справа (0 мс).
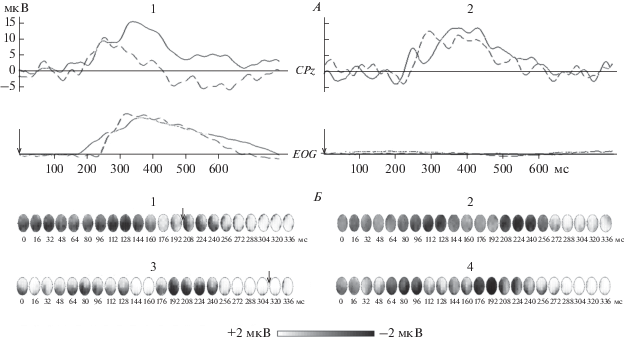
Латеральных различий в параметрах пиков негативных компонентов ВП обнаружено не было, и их значения для саккад влево и вправо были усреднены. Средние значения амплитуды и латентности пика компонентов N1 и N2 в зависимости от сигнального значения стимулов представлены в табл. 1.
Таблица 1.
Параметры негативных компонентов вызванного потенциала (ВП) N1 и N2 на “Go” и “NoGo” стимулы
| Условие | N1 | N2 | ||||||
|---|---|---|---|---|---|---|---|---|
| “быстрые” испытуемые | “медленные” испытуемые | “быстрые” испытуемые | “медленные” испытуемые | |||||
| А мкВ | ПЛ мс | А мкВ | ПЛ мс | А мкВ | ПЛ мс | А мкВ | ПЛ мс | |
| Go | *3.6 ± 0.4** | *127 ± 9 | 4.9 ± 0.5** | 138 ± 7 | 4.9 ± 0.6 | 193 ± 6 | ||
| NoGo | *4.8 ± 0.3* | *159 ± 6* | 3.7 ± 0.5* | 131 ± 5* | 5.2 ± 0.4 | 182 ± 4* | 4.1 ± 0.5 | 197 ± 6* |
Компонент N1. Дисперсионный анализ выявил влияние фактора “группа” на амплитуду компонента N1 как в “Go” условиях (F [2, 19] = = 29.2, p = 8.2 × 10–14 для стимулов слева и F [2, 19] = = 9.1, p = 2.1 × 10–8 для стимулов справа), так и в “NoGo” условиях (F [2, 19] = 2.1, p = 0.033 для стимулов слева и F [2, 19] = 45.1, p = 0.004 для стимулов справа). При этом у “быстрых” испытуемых амплитуда компонента Go-N1 была меньше, чем у “медленных” (на 1.3 мкВ ± 0.5 мкВ, W = 235, p = = 0.026), а в тормозных, наоборот, амплитуда компонента NoGo-N1 была больше у “быстрых” испытуемых, чем у “медленных” (на 1.1 ± 0.5 мкВ, W = 321.5, p = 0.003).
Влияние фактора “группа” на ПЛ компонента N1 показано только в тормозных условиях (F [2, 19] = 2.1, p = 0.003 для стимулов слева и F [2, 19] = 45, p = 1.6 × 10–13 для стимулов справа) – у “быстрых” испытуемых ПЛ компонента NoGo – N1 была больше на 28 ± 6 мс (W = 235, p = 0.026).
В зависимости от испытуемого пики компонента N1 располагались в лобной, центральной или теменно-затылочной зонах. В группе “медленных” испытуемых они были представлены преимущественно в контралатеральных отведениях (16 случаев против 6 в пусковых условиях и 15 против 7 в тормозных – Z = –3.3, р = 0.0009 и Z = –2.7, р = 0.007 соответственно), а у “быстрых” испытуемых они c равной вероятностью располагались как в котра-, так и в ипсилатеральных отведениях.
По данным динамического картирования амплитуды ВП компонент N1 независимо от группы имеет диффузную локализацию фокусов с одновременной представленностью в нескольких зонах коры, включая сагиттальные зоны. При развитии компонента может происходить смена его фокусов как внутри полушария, так и между полушариями (рис. 3, 4 ). При этом у большинства испытуемых независимо от группы и сигнальности стимула преобладала нисходящая (top–down) направленность перехода фокусов компонента N1 из фронто-центральных зон в теменно-затылочные (в 37 случаев против 11 у быстрых” испытуемых и в 38 случаях против 10 у “медленных” (Z = –5.511, р = 3.65 × 10–8 и Z = –5.92, р = 3.3 × × 10–9 соответственно).
При обратном усреднении от начала саккады аналогом компонента Go-N1 у “быстрых” испытуемых является премоторный потенциал N – (минус)1, развивающийся в интервале 80–25 мс до начала саккады.
Компонент N2. При обратном усреднении аналогом компонента Go-N2 у “медленных” испытуемых является премоторный потенциал N –1, развивающийся в интервале 80–25 мс до начала саккады.
Различий в параметрах компонентов Go- и NoGo-N2 у “медленных” испытуемых обнаружено не было.
Дисперсионный анализ выявил влияние фактора “группы” только на величину латентности пика компонента NoGo-N2 (F [2, 19] = 3.9, p = = 0.0003 для стимулов слева и F [2, 19] = 19.9, p = = 2.2 × 10–9 для стимулов справа). У “быстрых” испытуемых ПЛ компонента NoGo-N2 была на 15.1 ± 4.3 мс меньше, чем у “медленных” испытуемых (W = 277, р = 0.01). Однако практически у всех “медленных” испытуемых латентность его пика была меньше величины ЛП саккады в “Go” условиях, а у “быстрых” испытуемых –превышала или совпадала с величиной ЛП саккады.
Пики компонента NoGo-N2 в группе “медленных” испытуемых были с равной вероятностью представлены во фронто-центральных или теменно-затылочных отведениях (10 против 14, р > > 0.05), а у “быстрых” испытуемых они преобладали в теменно-затылочных зонах (20 против 4, Z = 4.1, р = 3.98 × 10–5). В обеих группах пики компонента N2 были также локализованы в сагиттальных отведениях Fz, FCz, Cz, CPz и Pz, при этом в большем числе случаев в группе “быстрых” испытуемых по сравнению с “медленными” (14 случаев из 24 и 7 случаев из 24, соответственно, Z = –2.33, р = 0.02).
Динамическое картирование амплитуды ЭЭГ показало, что независимо от “группы” у большинства испытуемых компонент NoGo-N2 имеет диффузную локализацию фокусов с одновременной представленностью в нескольких отведениях, при этом однозначной направленности распространения фокусов при развитии компонента не наблюдалось.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таким образом, показаны различия в параметрах и топографии компонентов N1 и N2 между группами “быстрых” и “медленных” испытуемых, что позволяет предположить различную природу одних и тех же компонентов в зависимости от индивидуальной величины ЛП ответа.
Компонент N1 зрительного ВП относят к ранним сенсорным потенциалам, отражающим процессы детекции стимула. Согласно многочисленным данным литературы он рассматривается как маркер направленного внимания, вызывающего локальную активацию корково-таламических сетей мозга, усиливающих сенсорный вход для значимых стимулов [8, 18, 19].
Можно предположить, что увеличение амплитуды компонента Go-N1 у “медленных” испытуемых отражает усиление активационных процессов пространственного внимания, облегчающих анализ зрительного стимула как саккадической цели. Преобладание контралатеральной представленности пиков компонента Go-N1 у “медленных” испытуемых, соответствует этому предположению.
Компонент Go-N1 у “быстрых” испытуемых (также как и компонент Go-N2 у “медленных”) располагался во временном окне 70–20 мс до начала саккады. При обратном усреднении от саккады его премоторным аналогом является потенциал N –1. Этот компонент ассоциируется с процессами моторной подготовки и инициации движения [12, 20–22]. Увеличение амплитуды потенциала N1 в условиях направленного внимания было показано нами ранее в парадигме М. Познера “cost-benefit” [23].
В ряде исследований с использованием парадигмы “Go/NoGo” было установлено, что компонент N1 отражает сдвиг внимания к позиции цели, необходимый как для ее детекции, так и принятия решения и подготовки саккады [4, 24]. Согласно нашим данным у “быстрых” испытуемых компонент Go-N1 может быть коррелятом как сенсорных, так и премоторных процессов, включающих принятие решения и инициацию саккады. В отличие от “медленных” испытуемых у “быстрых” испытуемых пики компонента Go-N1 располагались как в контралатеральном, так и в ипсилатеральном полушарии относительно стимула, что может отражать включение пространственного и моторного внимания. Известно, что эти виды внимания контролируются нейрональными сетями противоположных полушарий головного мозга – левого для моторного внимания [25, 26] и правого для пространственного [27–29].
Полученные в работе данные о диффузной локализации пиков компонента Go-N1 во фронто-центральных, теменно-затылочных или височных отведениях у различных испытуемых независимо от группы, могут отражать индивидуальные “паттерны” компонента, и свидетельствовать о включении фронто-теменных сетей внимания и саккадического контроля в подготовку ответа в парадигме “Go/NoGo”. Преобладание нисходящей направленности (top–down) перехода фокусов компонента Go-N1 при развитии потенциала независимо от группы соответствует предположению о включении механизмов направленного внимания на стадии анализа стимула у “медленных” испытуемых, и на стадии принятия решения и инициации саккады у “быстрых” испытуемых [30–32].
Увеличение амплитуды компонента NoGo-N1 в тормозных условиях у “быстрых” испытуемых может отражать усиление активационных процессов направленного внимания на стадии оценки тормозного стимула и принятия решении о торможении саккады. Близкие результаты были описаны ранее в мануальной парадигме “Go/NoGo” [33]. Приуроченность компонента NoGo-N1 к временному интервалу соответствующему началу движения по ЭМГ в “Go” условиях позволило авторам рассматривать компонент NoGo-N1 как коррелят принятия решения о торможении движения. Обнаруженное в нашей работе увеличение латентности пика компонента NoGo-N1 у “быстрых” испытуемых по сравнению с “медленными” может отражать “затруднение” процессов торможения саккадических ответов при высокой индивидуальной скорости подготовки ответа.
Различия в величине ЛП саккады в группах “быстрых” и “медленных” испытуемых могут определяться индивидуальной спецификой подготовительных процессов ожидания сигнальных стимулов во время действия фиксационного стимула, такими как моторная готовность, связанная с включением моторного внимания и активацией премоторных цепей [34], а также неспецифическим торможением моторной системы перед произвольным движением [35]. Возможно, что “быстрые” испытуемые обладают более высоким уровнем системы моторной готовности, а “медленные” испытуемые – более высоким уровнем неспецифического торможения. В соответствии с эти предположением увеличение амплитуды компонента N1 в тормозных условиях по сравнению с пусковыми у “быстрых” испытуемых может рассматриваться как механизм повышения эффективности торможения в условиях высокого уровня моторной готовности.
Компонент Go-N2 изучался нами только у “медленных” испытуемых. Как указано выше, он соответствует компоненту Go-N1 у “быстрых” испытуемых, и также может рассматриваться как коррелят включения направленного внимания на стадии принятия решения и инициации саккады.
Исследованию компонента N2 в парадигме “Go/NoGо” посвящено большое количество работ, однако в настоящее время не существует единого мнения относительно функционального значения этого компонента. В различных исследованиях выдвигаются предположения о функциональном значении компонента N2 как индикатора торможения ответа [36, 37], или мониторинга результата и обновления информации в памяти [38, 39]. Выделяют также два функциональных субкомпонента NoGo-N2, один из которых связан с торможением ответа и опосредуется дорсолатеральными и вентральными зонами префронтальной коры, а второй – с мониторингом конфликта и обусловлен активностью передней цингулярной зоны [40].
В нашей работе обнаружены различия в латентности пика компонента NoGo-N2 у “быстрых” и “медленных” испытуемых. Соотношение латентностей пика компонента NoGo-N2 и сакадического ответа позволяет предположить, что компонент NoGo-N2 может отражать процессы принятия решения и “торможение” ответа у “медленных” испытуемых и мониторинг торможения и “обновление” содержания памяти у “быстрых”.
Различия в локализации пиков компонента NoGo-N2 в зависимости от группы испытуемых соответствуют этому предположению. Более частая локализация пиков компонента NoGo-N2 во фронто-центральных отведениях у “медленных” испытуемых позволяет ассоциировать его с процессами торможения. В настоящее время хорошо известна ведущая роль фронтальной и префронтальной коры (зоны IFG, pre SMA, ACC, dPMC) в процессах торможения независимо от характера тормозной задачи (стоп сигнал, GoNo/Go или антисаккады) и двигательного ответа (движения руки или глаз, речь) [41]. У “быстрых” испытуемых пики компонента NoGo-N2 были чаще, чем у “медленных”, представлены в сагиттальных отведениях Fz, FCz, Cz, CPz и Pz, в которые проецируются ведущие зоны саккадического контроля (SEF), мониторинга и оценки результата поведения (ACF, PCF) [5, 42, 43].
Преимущественная локализация пиков компонента NoGo-N2 в теменно-затылочных отведениях у “быстрых” испытуемых также подтверждает его возможную корреляцию с процессами обновления зрительно-пространственной памяти. Именно задняя теменная кора непосредственно участвует в обеспечении функций зрительно-пространственной памяти и внимания [44]. Взаимосвязь процессов памяти и внимания в процессах селекции цели и их включение в единую систему рабочей памяти показана во многих работах [45, 46].
ЗАКЛЮЧЕНИЕ
Таким образом, у “быстрых” и “медленных” испытуемых в парадигме “Go/NoGo” показаны различия в параметрах и топографии компонентов N1 и N2 ВП на “пусковые” и “тормозные” стимулы, что позволило предположить различную функциональную природу этих компонентов в зависимости от индивидуальной величины ЛП саккады. В пусковых условиях компонент Go-N1 может рассматриваться как коррелят включения механизмов направленного внимания на стадии анализа и оценки стимула у “медленных” испытуемых, и на стадии принятия решения и инициации саккады у “быстрых” испытуемых.
В тормозных условиях компонент NoGo-N2 может рассматриваться как коррелят принятия решения и “торможения” ответа у “медленных” испытуемых и как коррелят мониторинга тормозного ответа и “обновления памяти” у “быстрых” испытуемых.
Полученные данные позволяют предположить различные механизмы произвольной регуляции при подготовке и торможении саккадических ответов в зависимости от индивидуальной величины их ЛП, которые ассоциируются с уровнями активации и топографии корковых сетей внимания и саккадического контроля. Кроме того, различия в величине ЛП саккады в группах “быстрых” и “медленных” испытуемых могут определяться индивидуальной спецификой подготовительных процессов в период ожидания сигнальных стимулов при действии фиксационного стимула: более высоким уровнем моторной готовности у “быстрых” испытуемых и более высоким уровнем неспецифического торможения у “медленных” испытуемых. Для проверки этого предположения возможен дальнейший анализ медленных потенциалов ЭЭГ в период ожидания значимых стимулов в парадигме “Go/NoGo”.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом биологического факультета МГУ им. М.В. Ломоносова (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках государственного задания Министерства науки и высшего образования РФ (тема № 121032500081-5).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Becker W. Saccadic eye movements as a control system. The Neurobiology of Saccadic Eye Movements. Amsterdam: Elsevier, 1989. P. 43.
Fischer B., Breitmeyer B. Mechanism of visual attention revealed by saccadic eye movement // Neuropshychology. 1987. V. 25. № 1A. P. 73.
Findley J.M., Walker R. A model of saccadic generation based on parallel processing and competitive inhibition // Behav. Brain Sci. 1999. V. 22. № 4. P. 661.
Eimer M., van Velzen J., Cherry E., Press C. ERP correlates of shared control mechanisms involved in saccade preparation and in covert attention // Brain Res. 2007. V. 1135. № 1. P. 154.
Gaymard B., Ploner C.J., Rivaud S. et al. Cortical control of saccades // Exp. Brain Res. 1998. V. 123. № 1–2. P. 159.
De Haan B., Morgan P.S., Rorden Ch. Covert orienting of attention and overt eye movements activate identical brain regions // Brain Res. 2008. V. 1204. P. 102.
Kable J., Glimcher P. The neurobiology of decision: consensus and controvercy // Neuron. 2009. V. 63. № 6. P. 733.
Иваницкий А.М, Стрелец В.Б., Корсаков И.А. Информационные процессы мозга и психическая деятельность. М.: “Наука”, 1984. 189 с.
Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. М.: “МЕДпресс-информ”, 2003. 246 с.
Portella C., Machado C., Arias-Carrion O. et al. Relationship between early and late stages of information processing: even-related potential study // Neurol. Int. 2012. V. 4. P. 71.
Jagla F., Zikmund V. Changes in bioelectrical brain activity related to programming of saccadic eye movement // Activ. Nerv. Super. 1989. V. 31. P. 142.
Славуцкая М.В., Моисеева В.В., Шульговский В.В. Внимание и движения глаз. II. Психофизиологические представления, нейрофизиологические модели и ЭЭГ-корреляты // Журн. высш. нерв. деят. им. И.П. Павлова. 2008. Т. 58. № 2. С. 131. Slavutskaya M.V., Moiseeva V.V., Shul’govski$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\iota } $ V.V. [Attention and eye movements in human: psychophysiological concepts, neurophysiological models and EEG correlates] // Zh. Vyssh. Nerv. Deyat. Im. I.P. Pavlova. 2008. V. 58. № 2. P. 131.
Lisberger S., Fuch A., King W., Evinger L. Effect of mean reaction time on saccadic responses to two step stimuli with horizontal and vertical components // Vision Res. 1975. V. 15. P. 1021.
Славуцкая М.В., Карелин С.А., Котенев А.В., Шульговский В.В. Позитивные компоненты вызванного ответа на зрительные стимулы в саккадической парадигме “Go/NoGo” у человека // Физиология человека. 2019. Т. 45. № 2. С. 5. Slavutskaya M.V., Karelin S.A., Kotenev A.V., Shulgovsky V.V. The Positive Components of the Evoked Response to Visual Stimuli in the Saccadic “Go/NoGo” Paradigm in Humans // Human Physiology. 2019. V. 45. № 2. P. 115.
Русалов В.М., Трофимова И.Н. О представленности типов психической деятельности в различных моделях темперамента // Психологический журн. 2011. Т. 32. № 3. С. 74.
Iragui V.J., Kutas M., Mitchiner M.R., Hillyard S.A. Effects of aging on event-related brain potentials and reaction times in an auditory oddball task // Psychophysiology. 1993. V. 30. № 1. P. 10.
Bahramali H., Gordon E., Li W.M. et al. Fast and slow reaction time changes reflected in ERP brain function // Int. J. Neurosci. 1998. V. 93. № 1–2. P. 75.
Hillyard S.A., Vogel E.K., Look S.J. Sensory gain control (amplification) as a mechanism of selective attention (electrophysiological and neuroimaging evidence) // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 1998. V. 353. № 1373. P. 1267.
Мачинская Р.И. Нейрофизиологические механизмы произвольного внимания (аналитический обзор) // Журн. высш. нерв. деят. им. И.П. Павлова. 2003. Т. 53. № 2. С. 133. Machinskaya R.I. [Neurophysiological mechanisms of voluntary attention: a review] // Zh. Vyssh. Nerv. Deyat. Im. I.P. Pavlova. 2003. V. 53. № 2. P. 133.
Shibasaki H., Barret G., Halliday E., Halliday A. Components of the movement-related cortical potential and their scalp topography // EEG Clin. Neurophysiol. 1980. V. 49. № 3–4. P. 213.
Иванова М.П. Корковые механизмы произвольных движений у человека. М.: “Наука”, 1991. 189 с.
Praamastra P., Stegeman D.F., Horstinc M.I. et al. Movement-related potentials preceding voluntary movement are modulated by the mode of movement selection // Exptl. Brain Res. 1995. V. 103. № 3. P. 429.
Slavutskaya M.V., Shulgovskii V.V. Presaccadic brain potentials in conditions of covert attention orienting // Span. J. Psychol. 2007. V. 10. № 2. P. 277.
Tian Y., Liang S., Yao D. Attentional orienting and response inhibition: insights from spatial-temporal neuroimaging // Neurosci. Bull. 2014. V. 30. № 1. P. 141.
Omori M., Yamada H., Murata T. et al. Neuronal substrates participating in attentional set-shifting of rules for visually guided motor selection, a functional magnetic response imaging investigation // Neurosci. Res. 1999. V. 33. № 4. P. 317.
Rushworth M.F.S., Nixon Ph.D., Renowden Sh. et al. The left parietal cortex and motor attention // Neuropsychologia. 1997. V. 35. № 9. P. 1261.
Posner M. Orienting of attention // Q. J. Exp. Psychol. 1980. V. 32. № 1. P. 3.
Coull J.T. Neural correlates of attention and arousal insights from elrctrophysiology, functional neuroimaging and psychopharmacology // Prog. Neurobiol. 1998. V. 55. № 4. P. 343.
Corbetta M., Shulman G.L. Control of goal-directed and stimulus-driven attention in the brain // Nat. Rev. Neurosci. 2002. V. 3. № 3. P. 201.
Desimone R., Duncan J. Neural mechanisms of selective visual attention // Annu. Rev. Neurosci. 1995. V. 18. P. 193.
Miller E.K., Cohen J.D. An integrative theory of prefrontal cortex function // Annu. Rev. Neurosci. 2001. V. 24. P. 167.
Foxe J.J., Simpson G.V. Flow of activation from V1 to frontal cortex in humans. A framework for defining “early” visual processing // Exp. Brain Res. 2002. V. 142. № 1. P. 139.
Filipović S.R., Jahanshahi M., Rothwell J.C. Cortical potentials related to the nogo decision // Exp. Brain Res. 2000. V. 132. № 3. P. 411.
Everling S., Korappmann P., Flohr H. Cortical potentials preceding pro- and antisaccades in man // EEG Clin. Neurophisiol. 1997. V. 102. № 4. P. 356.
Greenhouse I., Sias A., Labruna L., Ivry R.V. Nonspecific inhibition of the motor system during response preparation // J. Neurosci. 2015. V. 35. № 30. P. 10675.
Eimer M. Effects of attention and stimulus probability on ERPs in a Go/Nogo task // Biol. Psychol. 1993. V. 35. № 2. P. 123.
Falkenstein M., Koshlykova N.A., Kiroj V.N. et al. Late ERP components in visual and auditory Go/Nogo tasks // EEG Clin. Neurophysiol. V. 96. № 1. P. 36.
Neuwenhuis S., Yeung N., Cohen J.D. Stimulus modality, perceptual overlap, and the go/no-go N2 // Psychophysiology. 2004. V. 41. № 1. P. 57.
Friedrich J., Beste Ch. Paradoxical, causal effects of sensory gain modulation on motor inhibitory control – a tDCS, EEG-source localization study // Sci. Rep. 2018. V. 8. № 1. P. 17486.
Lavric A., Pizzagalli D.A., Forstmeier S. When ‘go’ and ‘nogo’ are equally frequent: ERP components and cortical tomography // Eur. J. Neurosci. 2004. V. 20. № 9. P. 2483.
Chambers Ch. D., Garavan H., Bellgrove M.A. Insights into the neural basis of response inhibition from cognitive and clinical neuroscience // Neurosci. Biobehav. Rev. 2009. V. 33. № 5. P. 631.
Pierrot-Deseiligny Ch., Ploner C.J., Muri R.M. et al. Effect of cortical lesion on saccadic: eye movements in humans // Ann. N.Y. Acad. Sci. 2002. V. 956. P. 216.
Hayden B.Y., Nair A.C., McCoy A.N., Platt M.L. Posterior cingulate cortex mediates outcome-contingent allocation of behavior // Neuron. 2008. V. 60. № 1. P. 19.
Goldman-Rakic P.S. Circuitry of primate prefrontal cortex and regulation of behavior by representation memory / Handbook of Physiology. Sect I. American Physiol. Society. Bethesda. Maryland. 1997. V. 5. Part I. P. 373.
Rowe J., Friston K., Frackowiak R., Passingham R. Attention to action: Specific modualation of corticocortical interaction in humans // Neuroimage. 2002. V. 17. № 2. P. 988.
Soto D., Heinke D., Humphreys G.W., Blanco M.J. Early, top-down guidance of attention from working memory // J. Exp. Psychol. Hum. Percept. Perform. 2005. V. 31. № 2. P. 248.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


