Физиология человека, 2022, T. 48, № 1, стр. 79-88
Сопоставление сывороточных концентраций некоторых цитокинов и распределения уровня постоянного потенциала головного мозга у пациентов с вибрационной болезнью
О. И. Шевченко 1, *, О. Л. Лахман 1, Г. М. Бодиенкова 1, Е. В. Боклаженко 1
1 ФГБНУ Восточно-Сибирский институт медико-экологических исследований
Ангарск, Россия
* E-mail: oich68@list.ru
Поступила в редакцию 18.01.2021
После доработки 17.03.2021
Принята к публикации 25.06.2021
- EDN: SKQLMY
- DOI: 10.31857/S0131164622010131
Аннотация
В основе развития вибрационной болезни (ВБ) лежит ответ на застойное возбуждение преимущественно со стороны симпатического отдела вегетативной нервной системы, гипоталамической области, корковых зон головного мозга, приводящее к дисбалансу в эндокринной регуляции, развитию метаболической недостаточности. Взгляд на ВБ, обусловленную сочетанным воздействием локальной и общей вибрации, как вариант мембранопатологического процесса, при котором наиболее уязвимыми являются мембраны сосудистого эндотелия, предполагает изучение взаимосвязи топографии уровня постоянного потенциала (УПП), интегрально отражающего мембранные потенциалы нейронов, глии и гематоэнцефалического барьера, с сывороточными концентрациями про- и противовоспалительных цитокинов. Цель исследования – сопоставить изменения сывороточных концентраций цитокинов и распределения уровня постоянного потенциала головного мозга у пациентов с вибрационной болезнью, обусловленной сочетанным воздействием локальной и общей вибрации. Обследованы 28 пациентов, у которых установлены во время работы в контакте с вредным производственным фактором диагноз ВБ 2 степени, обусловленной сочетанным воздействием локальной и общей вибрации, отсутствие экспозиции к вибрации на момент исследования и коморбидной патологии, способной повлиять на обмен цитокинов. Группу сравнения представили 15 мужчин, не подвергавшихся в профессиональной деятельности воздействию вибрации. Концентрации IL-2, IL-4, IL-8, IFN-γ определяли в сыворотке крови методом твердофазного иммуноферментного анализа. Регистрацию УПП осуществляли с помощью метода нейроэнергокартирования. Применены методы статистического анализа с определением W-критерия Шапиро−Уилка, U-критерия Манна−Уитни, метод ранговой корреляции Спирмена. В группе пациентов с ВБ установлено преобладание умеренно повышенного УПП при сопоставлении с группой сравнения в центральном (р = 0.04), центральном левом (р = 0.02), правом височном (р = 0.03) отведениях. Выявлена взаимосвязь уровней IL-2 и УПП в центральном левом (rs = 0.47), теменном правом (rs = = 0.37), затылочном (rs = 0.38) отделах головного мозга (ГМ); IL-4 и УПП в лобных правом (rs = 0.41) и левом (rs = 0.45), височном (rs = 0.39), центральном (rs = 0.51) межполушарными градиентами; IL-8 и УПП в лобных правом (rs = 0.41) и левом (rs = 0.43), центральном межполушарным градиентом (rs = 0.38); IFN-γ и УПП лобном левом (rs = 0.41), центральным межполушарным градиентом (rs = = 0.42). Увеличение УПП в лобных (правом, левом), правом височном, затылочном, центральных, теменном правом отделах мозга при ВБ сочетается с гиперпродукцией IL-8, IFN-γ. На основании полученных взаимосвязей установлена сопряженность усиленного нейроэнергообмена в передних отделах ГМ с активацией нейровоспалительного процесса за счет гиперпродукции IL-4 и IL-8. Увеличение концентраций IL-2 сопряжено с ростом УПП в задних отделах головного мозга.
В последнее десятилетие по мере активного развития нейронаук все больший клинический интерес исследователей представляет изучение взаимосвязей энергетического обмена головного мозга (ЭОГМ), церебральных метаболических процессов с состоянием иммунной системы (ИС), нарушение взаимодействия которых способствует возникновению расстройств гомеостаза, развитию сосудистых, неврологических заболеваний [1, 2]. Исследования P.B. Gorelick et al. показали, что в повреждении сосудов и нейронов основополагающая роль принадлежит воспалению [3]. Однако до сих пор отсутствуют сведения, способные установить первопричинность нейровоспаления и нейрональной дисфункции в повреждении головного мозга (ГМ), объяснить роль нейровоспаления в ишемизации ГМ [4, 5].
В работах современных исследователей установлено, что вследствие проникновения в центральную нервную систему (ЦНС) циркулирующих периферических иммунных клеток и их взаимодействия с микроглией развивается иммунный ответ в виде про- и противовоспалительных реакций, осуществляемых с помощью цитокинов – многоуровневой сетевой структуры [6–8]. Интерлейкины способствуют изменению морфофункциональных параметров гипоталамической области мозга [9, 10]. При этом метаболические нарушения в глии являются предшественниками возникновения иммунопатологического процесса в ЦНС [11–14].
В литературе накоплены данные электрофизиологических исследований о существовании взаимосвязи между интенсивностью ЭОГМ в определенных церебральных структурах и активностью естественных киллеров [15, 16]. Результаты исследований В.В. Абрамовой и др. свидетельствуют о преобладании ЭОГМ в правом полушарии по сравнению с левым при повышении пролиферативного ответа Т-лимфоцитов (усиление иммунного ответа). Данный факт авторы связывают с возникновением начальных стадий стресса [17].
На современном этапе развития медицины труда существуют знания, доказывающие, что в основе развития вибрационной болезни (ВБ) лежит ответ на застойное возбуждение преимущественно со стороны симпатического отдела вегетативной нервной системы, гипоталамической области, корковых зон ГМ, приводящее к дисбалансу в эндокринной регуляции, развитию метаболической недостаточности [6, 18]. Также известно, что вестибулокоординаторные нарушения при ВБ обусловлены длительным стрессорным воздействием вибрации, приводящим к срыву адаптационных возможностей вестибулярной системы [19]. У пациентов с ВБ, обусловленной сочетанным действием общей и локальной вибрации, при проведении стабилометрии в 100% случаев Л.С. Васильева и др. [20] установили постуральные нарушения в виде выраженных и умеренных нарушений равновесия, в патогенезе которых важную роль играет формирование очага застойного возбуждения в ГМ в центрах вибрационной чувствительности. Посредством методов нейроэнергокартирования (НЭК), стимуляционной электронейромиографии, исследования соматосенсорных вызванных потенциалов при стимуляции срединного и большеберцового нервов, количественного сенсорного тестирования были определены выраженные демиелинизирующие изменения нервов верхних и нижних конечностей, а функциональные – на уровне шейного отдела спинного мозга и соматосенсорной зоны коры ГМ, замедление проведения афферентных волн возбуждения от дистальных по восходящим путям спинного мозга до задних столбов шейного отдела, а также повышение порогов температурной чувствительности к холодовым и тепловым стимулам и болевой чувствительности тепловой модальности [20]. По данным ряда авторов, отличительной особенностью электроэнцефалограммы (ЭЭГ) при полиневропатии конечностей, обусловленной воздействием локальной и общей вибрации, является вовлечение в патологический процесс структур ГМ с изменениями со стороны мозжечка, стволовых структур и гипоталамуса, нарушения вегетативной и афферентной регуляции церебрального уровня в стволовых, подкорковых и корковых отделах [21, 22].
В настоящем исследовании представляет интерес изучение особенностей ЭОГМ при помощи метода НЭК, который позволяет объективизировать степень выраженности вегетативной дисфункции, оценить состояние метаболизма глюкозы ГМ, и, как следствие, состояние энергетической активности ГМ [23]. Регистрация уровня постоянного потенциала (УПП) корковых областей ГМ, основанного на современных представлениях о зависимости электрических характеристик сосудов и капилляров от деформации потоком крови сосудистой стенки, а также разности потенциалов, возникающей на границе гематоэнцефалического барьера (ГЭБ) и зависящей от интенсивности энергетического обмена в прилегающей нервной ткани, методом НЭК способствует получению новых знаний об энергетическом обеспечении биоэлектрических процессов головного мозга [23, 24].
Вследствие дизрегулирующего влияния ЦНС на сосудистый тонус развивается ангиоспазм с последующей генерализацией патологического процесса в виде расстройства системной гемодинамики. Данные современных исследователей указывают на важную роль эндотелиальной дисфункция в патогенезе ВБ [25]. У пациентов с ВБ сотрудниками Восточно-Сибирского института медико-экологических исследований (г. Ангарск) выявлены изменения в клеточном и гуморальном звеньях иммунитета [7, 26, 27]. С.А. Бабановым, Р.А. Бараевой и др. показаны изменения цитокинового статуса в виде повышения уровня провоспалительных цитокинов ФНО-α, IL-8, IL-10, снижения IL-4 при ВБ от воздействия как локальной, так и общей вибрации [28, 29]. Однако установление церебрального ангиодистонического синдрома, являющегося одним из проявлений ВБ, обусловленной сочетанным воздействием локальной и общей вибрации, в настоящее время является затруднительным из-за отсутствия специфичной доказательной базы [30–32].
Таким образом, исследование распределения УПП во взаимосвязи с изменениями сывороточных концентраций цитокинов важно при изучении роли корково-подкорковых образований ГМ в процессах нейровоспаления, для расширения представлений об особенностях функционирования ГМ. Несмотря на многочисленные факты о взаимосвязи нервной и ИС, в литературе нами не найден ответ на вопрос, как соотносится топография УПП, интегрально отражающего мембранные потенциалы нейронов, глии и ГЭБ [33, 34], с сывороточными концентрациями про- и противовоспалительных цитокинов у пациентов с ВБ, обусловленной сочетанным воздействием локальной и общей вибрации.
Изучение нарушений нейроиммунного взаимодействия, позволяющего организму адаптироваться к условиям окружающей среды, будет способствовать дополнению знаний о патогенезе ВБ, откроет перспективы для новых подходов лечения, включающих коррекцию нейроиммунной регуляции у пациентов с данной патологией [6, 24].
Цель исследования – сопоставить изменения сывороточных концентраций цитокинов и распределения уровня постоянного потенциала головного мозга у пациентов с ВБ, обусловленной сочетанным воздействием локальной и общей вибрации.
МЕТОДИКА
В исследовании принимали участие 28 пациентов (мужчин) с ВБ 2 степени, обусловленной сочетанным воздействием локальной и общей вибрации (основная (I) группа, средний возраст 52.24 ± 0.47 года). Критерием включения в основную группу было наличие установленного во время работы в контакте с вредным производственным фактором диагноза ВБ, отсутствие экспозиции к вибрации на момент исследования, без коморбидной патологии, которая могла бы повлиять на обмен цитокинов (ожирение, сахарный диабет, артериальная гипертензия и т.д.). Диагноз ВБ был установлен на основании классификационных критериев болезней и состояний МКБ 10-ого пересмотра. Среди жалоб пациентов I группы ведущими были ноющие боли в мышцах рук и ног, приступообразные парестезии, преимущественно в ночное время, снижение силы в руках, плохой сон из-за болей и онемения, зябкость рук и ног в сырую погоду, болезненность при движениях в локтевых суставах, приступы головокружения, ухудшение памяти, шум в ушах. Выделили следующие клинические синдромы: умеренно выраженная вегетативно-сенсорная полиневропатия рук и ног, периферический ангиодистонический синдром рук, церебральный ангиодистонический синдром. Все обследования выполнили при поступлении в клинику, до проведения лечения. Группу сравнения представляли 15 здоровых мужчин в возрасте 53.0 ± 0.84 года (II группа), которые по специфике профессиональной деятельности не подвергались воздействию вибрации и не имели на момент исследования острых и хронических (в стадии обострения) заболеваний.
Кровь для исследования у пациентов брали однократно при поступлении в стационар, натощак, используя пробирки Vacutainer (США), которые центрифугировали при 1500 оборотов в минуту в течение 15 мин для получения сыворотки. Сыворотку отбирали в отдельные пробирки Эппендорф (Eppendorf, Германия). Содержание цитокинов (IL-2, IL-4, IL-8, IFN-γ) определяли на высокоскоростном автоматическом иммуноферментном анализаторе третьего поколения Alisei Q.S. (SEAC, Италия) с использованием стандартных тест-систем производства ЗАО “Вектор-Бест” (Россия).
УПП регистрировали посредством метода НЭК при 12-канальном отведении: Fz – лобном центральном, Fd – лобном правом, Fs – лобном левом, Сz – центральном, Cd – центральном правом, Cs – центральном левом, Pz – центральном теменном, Pd – теменном правом, Ps – теменном левом, Оz – затылочном, Td – правом височном, Ts – левом височном. Рассчитывали уровень интенсивности энергетического обмена по всем отделам (Хср.). С помощью градиента Td–Ts устанавливали межполушарную височную асимметрию энергетического метаболизма, Cd–Cs – центральную. Исследования проводили на аппаратно-программном комплексе для топографического картирования электрической активности “Нейроэнергокартограф” (аппарат “Нейро-КМ”, Россия) с помощью неполяризуемых хлорсеребряных электродов. Регистрацию осуществляли после элиминации артефактов физической и физиологической природы. Активные электроды размещали на голове по схеме 10 × 20, референтный электрод – на запястье правой руки [33, 35].
Статистическую обработку результатов проводили с помощью пакета прикладных программ “STATISTICA 6.0” (StatSoft, США). Проверку нормальности распределения количественных показателей выполняли с использованием критерия Шапиро–Уилка. Для межгруппового сравнения количественных показателей возраста обследованных пациентов применяли параметрический критерий Стьюдента (данные представлены в виде средней (М) и ее ошибки (m)). Межгрупповое сравнение количественных показателей, характеризующих УПП и цитокины, осуществляли с использованием непараметрического метода U-критерия Манна–Уитни (данные представлены в виде медианы и интерквартильного размаха Me (Q25–Q75)). Корреляционный анализ проводили методом ранговой корреляции Спирмена. Критический уровень значимости при проверке статистических гипотез p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В результате анализа распределения УПП у пациентов I группы выявлено его статистически значимое преобладание в лобном правом и левом (Fd, Fs), правом височном (Td), затылочном (Oz), центральном и центральном левом (Cz, Cs), теменном правом (Pd) отделах ГМ при сопоставлении с таковыми в группе сравнения. Отмеченные локальные изменения УПП при ВБ выявляются на фоне его общего повышения во всех исследуемых областях и определенного сглаживания регионарных различий этого показателя, присущих норме (рис. 1). У лиц I группы повышение УПП в центральном и центральном левом (Cz, Cs), правом височном (Td) отведениях соответствовало умеренно выраженному усилению ЭОГМ, в остальных – легко выраженному.
Рис. 1.
Профили распределения уровня постоянного потенциала (УПП) в исследуемых группах. * – различия статистически значимы между I (а) и группой сравнения (б), p < 0.05.
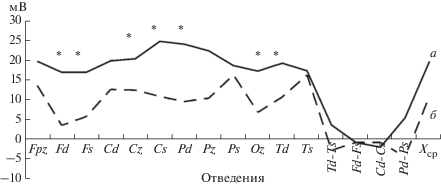
Средний УПП у пациентов с ВБ был умеренно повышен и имел статистически значимое отличие от такового в группе сравнения, который соответствовал нормальному уровню ЭОГМ (табл. 1).
Таблица 1.
Достоверно отличающиеся от группы сравнения параметры уровня постоянного потенциала (УПП) у пациентов с вибрационной болезнью (ВБ), связанной с сочетанным воздействием локальной и общей вибрации, Ме (Q25–Q75)
| Показатели УПП, мВ | Пациенты с ВБ, обусловленной сочетанным воздействием локальной и общей вибрации | Группа сравнения | Уровень статистической значимости отличий (р) |
|---|---|---|---|
| Fd | 11.02 (6.57–15.81) | 0.31 (–3.34–2.45) | 0.0003 |
| Fs | 11.85 (7.74–20.15) | 3.97 (–1.27–10.62) | 0.007 |
| Oz | 14.72 (7.75–18.85) | 1.47 (–3.75–9.98) | 0.0013 |
| Td | 18.80 (12.04–23.53) | 4.57 (1.03–19.59) | 0.026 |
| Cz | 21.96 (10.37–30.44) | 10.66 (6.95–14.69) | 0.035 |
| Cs | 19.71 (14.81–26.85) | 10.37 (6.46–14.95) | 0.015 |
| Pd | 14.96 (7.89–25.29) | 4.51 (2.07–9.35) | 0.012 |
| Xср | 17.92 (13.19–21.67) | 8.63 (3.78–11.09) | 0.0017 |
Сравнительная оценка сывороточных концентраций цитокинов у обследованных I, II групп, в зависимости от наличия ВБ, позволила выявить статистически значимое нарастание уровней провоспалительного IL-8 (24.29 (14.42–65.16) пг/мл и 14.03 (8.00–18.76) пг/мл соответственно, p = = 0.009) и IFN-γ (21.38 (1.68–94.28) пг/мл и 0.87 (0.01–9.49) пг/мл соответственно, p = 0.008), ассоциируемое с цитотоксичностью, воспалительными состояниями хронического и острого характера при данной профессиональной патологии.
Данные корреляционного анализа позволили выявить взаимосвязи между уровнем цитокинов и параметрами УПП в вышеуказанных двенадцати отведениях у обследованных пациентов. Зарегистрированы статистически значимые прямые корреляционные связи между концентрацией IL-2 и УПП в центральном левом, теменном правом, затылочном корковых отделах ГМ; IL-4 и УПП в лобном правом и левом отведении, межполушарными градиентами Td–Ts (разность потенциалов между правым и левым височными отведениями) и Cd–Cs (разность потенциалов между правым и левым центральными отведениями); IL-8 и УПП в лобном правом и левом, межполушарным градиентом Cd–Cs; IFN-γ и УПП лобном левом отведении, межполушарным градиентом Cd–Cs (табл. 2). Указанные зависимости показывают, что увеличение продукции IL-4, IL-8, IFN-γ сопровождается повышением УПП в лобных правом и левом отведении, центральном правом корковых отделах ГМ. Повышение УПП в центральном, теменном правом, затылочном отведениях ассоциировано с гиперпродукцией IL-2.
Таблица 2.
Корреляционные коэффициенты между уровнем постоянного потенциала (УПП) и показателями сывороточных концентраций цитокинов у пациентов с вибрационной болезнью (ВБ), обусловленной сочетанным воздействием локальной и общей вибрации, (р < 0.05)
| Показатели цитокинов, пг/мл | УПП, мВ | ||||||
|---|---|---|---|---|---|---|---|
| Fd | Fs | Cs | Pd | Oz | Td–Ts | Cd–Cs | |
| IL-2 | – | – | 0.48 | 0.38 | 0.39 | – | – |
| IL-4 | 0.42 | 0.45 | – | – | – | 0.39 | 0.52 |
| IL-8 | 0.41 | 0.44 | – | – | – | – | 0.38 |
| IFN-γ | – | 0.42 | – | – | – | – | 0.42 |
В группе сравнения в результате применения корреляционного анализа наблюдалась несколько иная картина взаимоотношений. Так, установлена прямая статистически значимая зависимость между УПП теменного центрального отдела ГМ и показателями IL-4, IL-8, IFN-γ (rs = 0.54; 0.69; 0.65, р = 0.036; 0.022; 0.018 соответственно). Повышение IFN-γ было сопряжено с ростом УПП в лобном левом, затылочном отделах ГМ (rs = 0.54; 0.53, p = 0.028; 0.030 соответственно). Установлено, что увеличение концентрации IFN-γ сопровождалось снижением УПП межполушарного лобного градиента (Fd-Fs) (rs = –0.65, р = = 0.031), характеризующим преобладание активности в лобном отделе левого полушария ГМ. Данные факты указывают на то, что преобладание ЭОГМ в теменном отделе правого полушария связано с увеличением IL-4, IL-8, IFN-γ.
В результате выполненной работы показано, что при сочетанном воздействии локальной и общей вибрации происходит усиление ЭОГМ в лобном правом и левом (Fd, Fs), правом височном (Td), затылочном (Oz), центральных (Cz, Cs), теменном правом (Pd) отделах ГМ, что согласуется и дополняет полученные ранее данные о состоянии нейроэнергообмена при ВБ [36].
При обсуждении значимости полученных результатов, опираясь на современную концепцию о механизмах регуляции избирательной проницаемости ГЭБ посредством нейроваскулярной единицы (НВЕ), в которой межклеточные взаимодействия осуществляются посредством белков плотных контактов, белков щелевых контактов, цитокинов и их рецепторов, факторов роста, нейротрансмиттеров [37–39], авторским коллективом предположена возможность возникновения каскада нейрососудистых реакций у пациентов с ВБ вследствие нарушения функций НВЕ (перфузии и метаболизма) [40]. Гипотетически выявленные изменения УПП могут служить маркерами дисфункции регуляторных систем, значимых в патогенезе нейровоспалительных процессов, задействованных в развитии церебрального ангиодистонического синдрома у пациентов с ВБ, обусловленной сочетанным воздействии локальной и общей вибрации.
Кроме того, поскольку любые нарушения межклеточных взаимодействий внутри НВЕ приводят к повреждению коры ГМ, подкорковых ганглиев и их взаимосвязей [41, 42], с помощью установленных корреляционных связей предпринята попытка объяснения факта соотношения топографии УПП с сывороточными концентрациями медиаторов воспаления в гипоксически-ишемическом процессе в ЦНС при ВБ, обусловленной сочетанным воздействием локальной и общей вибрации.
По мнению Е.В. Мирошник и др., по мере развития патологического процесса в организме, происходит усиление ЭОГМ в задних отделах коры ГМ по сравнению с передними [43]. Данное явление установлено при использовании величины межполушарной асимметрии (ВМПА) мощности биопотенциалов при анализе электроэнцефалографии (ЭЭГ) с применением визуального анализа (по Е.А. Жирмунской), программ спектрального анализа энергетических спектров с картированием, и объясняется тем, что в норме в передних отделах коры преобладают влияния десинхронизирующих структур, в задних — синхронизирующих, проявляющихся большими значениями ВМПА в передних отделах неокортекса. Дисбаланс активности де- и синхронизирующих отделов неспецифической системы мозга при снижении мощности ЭЭГ по мере прогрессирования нарушений мозгового кровообращения обеспечивается посредством преобладания активности синхронизирующего отдела, а в последующем – десинхронизирующего [44].
Наибольшее число установленных прямых корреляционных связей было получено между параметрами высокого УПП, опосредованно характеризующими наличие мембранопатологического процесса в нейронах, глии и ГЭБ в лобных (правой и левой), височной и центральной корковых областях правого полушария ГМ (нарастание ацидоза) и гиперпродукцией IL-8.
Ссылаясь на известные данные нейрофизиологических исследований о том, что основные восходящие проекции от стриопаллидарной системы принимают лобные доли, от центральных неспецифических структур (в частности, ретикулярной формации, проходящей через ядра таламуса) ГМ – центральные, от областей зрительного, вестибулярного анализаторов, лимбико-гиппокампальных образований – височные и затылочная [45–48], можно предположить, что изменения функциональной активности коры в виде усиления УПП в вышеперечисленных корковых отделах ГМ инициируются дисфункцией соответствующих подкорковых регуляторных структур, способствующей гиперпродукции IL-2, IL-4, IL-8, IFN-γ. Вероятно, возникновение нейровоспалительных реакций с вовлечением в патологический процесс стриопаллидарной системы, ретикулярной формации, таламуса, лимбико-гиппокампальных образований провоцирует повышение УПП в лобных, центральных, затылочной, правой височной и правой теменной областях ГМ, участвуя в формировании нейрогенного иммунодефицита у пациентов с ВБ [49].
Дальнейшее изучение роли состояния нейроиммунологических процессов в патофизиологических механизмах ВБ позволит получить диагностические критерии, определяющие риск повреждения ЦНС при ВБ, что может быть полезным при разработке персонифицированных лечебно-профилактических мероприятий, направленных на коррекцию церебральной дисфункции.
ВЫВОДЫ
Таким образом, анализ полученных результатов исследований в сопоставлении с данными литературы послужил обоснованием следующих выводов:
1. У пациентов с ВБ установлено усиление нейроэнергообмена в лобном правом и левом, правом височном, затылочном, центральных, теменном правом отделах ГМ, сопровождающееся гиперпродукцией IL-8, IFN-γ.
2. Выявленная положительная корреляционная зависимость между IL-4 и IL-8 с высоким УПП в лобных (правой и левой гемисферы), височном и центральном отделах правого полушария головного мозга может отражать топографическую значимость указанных корковых зон в активации нейровоспалительного процесса при ВБ. Сопряженность возрастания уровней IL-2 и УПП в центральных, правой теменной, затылочной долях головного мозга, по-видимому, свидетельствует о заинтересованности диэнцефальных и лимбико-гиппокампальных структур у пациентов с ВБ.
Этические нормы. Работа соответствует этическим стандартам, разработанным в соответствии с Хельсинской декларацией Всемирной медицинской ассоциации “Этические принципы проведения научных медицинских исследований с участием человека” с поправками 2000 г. и “Правилами клинической практики в Российской Федерации”, утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266 и одобрены локальным биоэтическим комитетом Восточно-Сибирского института медико-экологических исследований (Ангарск).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена за счет финансовых средств, выделенных в рамках Государственного задания ФГБНУ ВСИМЭИ (Ангарск).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Депутат И.С., Нехорошкова А.Н., Грибанов А.В. и др. Анализ распределения уровня постоянного потенциала головного мозга в оценке функционального состояния организма (Обзор) // Экология человека. 2015. № 10. С. 27. Deputy I.S., Nekhoroshkova A.N., Gribanov A.V. et al. Analysis of the distribution of the level of constant potential of the brain in assessing the functional state of the body (Review) // Human Ecology. 2015. № 10. P. 27.
Созаева Д.И., Бережанская С.Б. Основные механизмы взаимодействия нервной и иммунной систем. Клинико-экспериментальные данные // Кубанский научно медицинский вестник. 2014. № 3. С. 145. Sozaeva D.I., Berezhanskaya S.B. The main mechanisms of interaction between the nervous and immune systems. Clinical and experimental data // Kuban Scientific Medical Bulletin. 2014. № 3. Р. 145.
Gorelick P.B., Scuteri A., Black S.E. et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association // Stroke. 2011. V. 42. № 9. P. 2672.
Bilbo S.D., Smith S.H., Schwarz J.M. A lifespan approach to neuroinfl ammatory and cognitive disorders: a critical role for glia // J. Neuroimmune Pharmacol. 2012. V. 7. № 1. P. 24.
Wrona D. Neural-immune interactions: an integrative view of the bidirectional relationship between the brain and immune systems // J. Neuroimmunol. 2006. V. 172. № 1–2. P. 38.
Азовскова Т.А., Лаврентьева Н.Е. Изменение иммунного гомеостаза при воздействии производственной вибрации // Медицинский совет. 2016. № 10. С. 174. Azovskova T.A., Lavrentieva N.E. Changes in immune homeostasis when exposed to industrial vibration // Medical Council. 2016. № 10. Р. 174.
Бодиенкова Г.М., Курчевенко С.И. Oценка цитокинов и белка теплового шока при вибрационной болезни // Медицинская иммунология. 2018. Т. 20. № 6. С. 895. Bodyenkova G.M., Kurchevenko S.I. Assessment of cytokines and heat shock protein in vibration disease // Med. Immunol. 2018. V. 20. № 6. Р. 895.
Кулеш А.А., Куклина Е.М., Шестаков В.В. Взаимосвязь цитокинов в цереброспинальной жидкости и сыворотке крови с неврологическим и функциональным статусом в остром периоде ишемического инсульта // Клиническая медицина. 2016. Т. 94. № 9. С. 657.
Абдурасулова И.Н., Клименко В.М. Роль иммунных и глиальных клеток в процессах нейродегенерации // Медицинский академический журн. 2011. Т. 11. № 1. С. 12. Abdurasulova I.N., Klimenko V.M. The role of immune and glial cells in the processes of neurodegeneration // Med. Acad. J. 2011. V. 11. № 1. Р. 12.
Багаутдинов М.Р., Брындина И.Г. Церамиды гиппокампа как вероятный компонент в патогенезе нейрогенеративных нарушений при эмоциональном и метаболическом стрессе с учетом различной стресс-резистентности организма // Уральский медицинский журн. 2015. № 1(124). С. 126.
Евсеев В.А. Антитела к нейромедиаторам в механизмах нейроиммунопатологии. М.: РАМН, 2007. С. 148.
Харькова Ю.О., Ужахов А.М., Ужахов Т.М. и др. Морфофункциональная перестройка основных структурных элементов головного мозга при артериальной гипертензии // Бюллетень медицинских интернет-конференций. 2015. Т. 5. № 12. С. 1674.
Перекрест С.В., Гаврилов Ю.В., Абрамова Т.В. Активация клеток гипоталамических структур при введении антигенов различной природы (по экспрессии c-fos гена) // Медицинская иммунология. 2006. Т. 8. № 5–6. С. 631. Perekrest S.V., Gavrilov Yu.V., Abramova T.V. Activation of cells of hypothalamic structures with the introduction of antigens of various nature (by expression of the c-fos gene) // Med. Immunol. 2006. V. 8. № 5–6. Р. 631.
Brat D.J., Bellail A.C., Van Meir E.G. The role of interleukin-8 and its receptors in gliomagenesis and tumoral angiogenesis // Neuro Oncol. 2005. V. 7. № 2. P. 122.
Davidson R.J., Coe C.C., Dolski I., Donzella B. Individual differences in prefrontal activation asymmetry predict natural killer cell activity at rest and in response to challenge // Brain Behav. Immun. 1999. V. 13. № 2. P. 93.
Lekander M., Fredrikson M., Wik G. Neuroimmune relations in patients with fibromyalgia: A positron emission tomography study // Neurosci. Lett. 2000. V. 282. № 3. P. 193.
Абрамов В.В., Ершов О.В., Смык А.В. Взаимосвязь функциональной асимметрии иммунной системы и ЦНС при формировании иммунного ответа // Нейроиммунология. 2009. Т. 7. № 1. С. 6.
Швалев О.В., Колесова Е.Б., Федорова С.Б. Современные аспекты патогенеза вибрационной болезни // Медицина труда и промышленная экология. 2019. Т. 59. № 9. С. 807. Shvalev O.V., Kolesova E.B., Fedorova S.B. Modern aspects of the pathogenesis of vibration disease // Russian J. Occupational Health and Industrial Ecology. 2019. V. 59. № 9. Р. 807.
Котиринич И.А. Клинические особенности вибрационной патологии от воздействия общей низкочастотной вибрации и статодинамической перегрузки при управлении самодвижущейся техникой // Бюллетень ВСНЦ СО РАМН. 2006. № 3. С. 96. Kotirinich I.A. Clinical features of vibration pathology from the impact of general low-frequency vibration and static-dynamic overload in the control of self-propelled equipment // Acta Biomedica Scientifica. 2006. № 3. P. 96.
Васильева Л.С., Сливницына Н.В., Лахман О.Л. Постуральные нарушения у пациентов с вибрационной болезнью // Медицина труда и промышленная экология. 2019. Т. 59. № 5. С. 314. Vasilyeva L.S., Slivnitsyna N.V., Lakhman O.L. Postural disorders in patients with vibration sickness // Russian J. Occupational Health and Industrial Ecology. 2019. V. 59. № 5. P. 314.
Панков В.А., Бодиенкова Г.М., Кулешова М.В., и др. Состояние функциональных систем организма больных вибрационной болезнью в постконтактном периоде // Медицина труда и промышленная экология. 2015. № 9. С. 110. Pankov V.A., Bodienkova G.M., Kuleshova M.V., et al. The state of the functional systems of the body of patients with vibration disease in the post-exposure period // Russian J. Occupational Health and Industrial Ecology. 2015. № 9. P. 110.
Катаманова Е.В. Анализ патологической активности ЭЭГ у лиц, подвергающихся воздействию общей и локальной вибрации // Международный журн. прикладных и фундаментальных исследований. 2016. № 3–4. С. 570. Katamanova E.V. Analysis of pathological EEG activity in persons exposed to general and local vibration // Int. J. Appl. Fundam. Res. 2016. № 3–4. P. 570.
Фокин В.Ф., Пономарева Н.В. Интенсивность церебрального энергетического обмена: возможности его оценки электрофизиологическим методом // Вестник Российской академии медицинских наук. 2001. № 8. С. 38. Fokin V.F., Ponomareva N.V. The intensity of cerebral energy metabolism: the possibilities of its assessment by the electrophysiological method // Bull. Russ. Acad. Med. Sci. 2001. № 8. Р. 38.
Fokin V.F., Ivashtenko E.I. Change of cerebral acid-base balance with chronic brain ischemic disease in response to vinpotropil therapy // Eur. Neuropsychopharm. 2005. V. 15. № S2. P. 259.
Шпагина Л.А., Герасименко О.Н., Чернышев В.М. и др. Эндотелиальная дисфункция при вибрационной болезни: клинические и патогенетические аспекты. Новосибирск: Сибмедиздат, 2004. 148 с.
Абраматец Е.А., Лахман О.Л., Кудаева И.В. Некоторые аспекты иммунного реагирования больных при различной степени выраженности вибрационной болезни // Медицина труда и промышленная экологии. 2007. № 11. С. 30. Abramatets E.A., Lakhman O.L., Kudaeva I.V. Some aspects of the immune response of patients with varying severity of vibration disease // Russian J. Occupational Health and Industrial Ecology. 2007. № 11. Р. 30.
Бодиенкова Г.М., Курчевенко С.И., Русанова Д.В. Нейроаутоиммунные процессы при вибрационной болезни // Нейрохимия. 2018. Т. 35. № 3. С. 269. Bodyenkova G.M., Kurchevenko S.I., Rusanova D.V. Neuroautoimmune processes in vibration disease // J. Neurochemical. 2018. V. 35. № 3. Р. 269.
Бабанов С.А., Бараева Р.А., Будаш Д.С и др. Состояние иммунного профиля и цитокины при вибрационной болезни // Русский медицинский журн. Медицинское обозрение. 2018. Т. 2. № 1–2. С. 108.
Бараева Р.А., Бабанов С.А. Иммунный профиль при вибрационной болезни от воздействия локальной и общей вибрации // Санитарный врач. 2015. № 7. С. 11.
Фокин В.Ф., Пономарева Н.В., Коновалов Р.Н. Сопряженность динамических характеристик функциональной межполушарной асимметрии с коннективностью у больных хроническими цереброваскулярными заболеваниями // Асимметрия. 2019. Т. 13. № 3. С. 40. Fokin V.F., Ponomareva N.V., Konovalov R.N. The relationship of the dynamic characteristics of functional interhemispheric asymmetry with connectivity in patients with chronic cerebrovascular diseases // J. Asymmetry. 2019. V. 13. № 3. Р. 40.
Hirata M., Matsumoto T., Toibana N. et al. Involvement of the Central Nervous System in Vibration Syndrome // Int. Arch. Occup. Environ. Health. 1995. V. 67. № 3. P. 173.
Hirata M., Sakakibara H. Visually-evoked P300 and NOGO potentials as indicators of central nervous system function in patients with vibration syndrome // Int. Arch. Occup. Environ. Health. 2008. V. 82. № 1. P. 79.
Фокин В.Ф., Пономарева Н.В. Энергетическая физиология мозга. М.: Антидор, 2003. 288 с.
Фокин В.Ф., Пономарева Н.В., Коновалов Р.Н. и др. Асимметрия лобно-теменных нейросетей покоя у больных с хронической сосудистой энцефалопатией // Асимметрия. 2019. Т. 13. № 2. С. 50. Fokin V.F., Ponomareva N.V., Konovalov R.N. et al. Asymmetry of the fronto-parietal resting neural networks in patients with chronic vascular encephalopathy // J. Asymmetry. 2019. V. 13. № 2. Р. 50.
Шмырев В.И., Витько Н.К., Миронов Н.П. и др. Нейроэнергокартирование высокоинформативный метод оценки функционального состояния мозга. Данные нейроэнергокартирования при когнитивных нарушениях и снижении умственной работоспособности: методические рекомендации. М.: Издательство: Клиническая больница № 1 Управления делами Президента РФ, 2010. 21 с.
Шевченко О.И., Лахман О.Л. Состояние энергетического обмена головного мозга у пациентов с профессиональными заболеваниями от воздействия физических факторов // Экология человека. 2020. № 2. С. 18. Shevchenko O.I., Lakhman O.L. The state of energy metabolism of the brain in patients with occupational diseases from the influence of physical factors // Human Ecology. 2020. № 2. Р. 18.
Кувачева Н.В., Салмина А.Б., Комлева Ю.К. и др. Проницаемость гематоэнцефалического барьера в норме, при нарушении развития головного мозга и нейродегенерации // Журн. неврологии и психиатрии им. C.C. Корсакова. 2013. Т. 113. № 4. С. 80. Kuvacheva N.V., Salmina A.B., Komleva Yu.K. et al. [Permeability of the blood-brain barrier is normal, with impaired development of the brain and neurodegeneration] // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. 2013. V. 113. № 4. Р. 80.
Моргун А.В., Кувачева Н.В., Таранушенко Т.Е. и др. Современные представления о патогенезе перинатального ишемического повреждения клеток нейроваскулярной единицы головного мозга: молекулы-мишени для нейропротекции // Вестник Российской академии медицинских наук. 2013. Т. 68. № 12. С. 26. Morgun A.V., Kuvacheva N.V., Taranushenko T.E. Modern concepts of the pathogenesis of perinatal ischemic damage to the cells of the neurovascular unit of the brain: target molecules for neuroprotection // Bull. Russ. Acad. Med. Sci. 2013. V. 68. № 12. Р. 26.
Ballabh P., Braun A., Nedergaard M. The blood-brain barrier an overview: structure, regulation, and clinical implications // Neurobiol. Dis. 2004. V. 16. № 1. P. 1.
Добрынина Л.А. Нейроваскулярное взаимодействие и церебральная перфузия при старении, церебральной микроангиопатии и болезни Альцгеймера // Анналы клинической и экспериментальной неврологии. 2018. Т. 12. № 5. С. 87.
Моргун А.В., Кувачева Н.В., Хилажева Е.Д. и др. Особенности экспрессии коннексинов клетками нейроваскулярной единицы в норме и при гипоксии в условиях эксперимента // Бюллетень сибирской медицины. 2014. Т. 13. № 6. С. 5. Morgun A.V., Kuvacheva N.V., Khilazheva E.D. et al. Features of the expression of connexins by cells of the neurovascular unit in normal conditions and during hypoxia under experimental conditions // Bull. of Siber. Med. 2014. V. 13. № 6. P. 5.
Barkovich A.J. Magnetic resonance techniques in the assessment of myelin and myelination // J. Inherit. Metab. Dis. 2005. № 28. P. 311.
Мирошник Е.В., Зверева З.Ф., Бобров А.Ф. Сопоставление показателей биоэлектрической активности головного мозга и энергетических процессов в ткани мозга (величины межполушарных различий мощности биопотенциалов гомологичных отведений и уровня постоянного потенциала головного мозга) // Медицина экстремальных ситуаций. 2017. Т. 60. № 2. С. 49.
Зверева З.Ф., Ванчакова Н.П., Золотарева Н.Н. Клинические и нейрофизиологические показатели у больных с дисциркуляторной энцефалопатией // Журн. неврологии и психиатрии им. C.C. Корсакова. 2010. Т. 110. № 2. С. 15. Zvereva Z.F., Vanchakova N.P., Zolotareva N.N. [Clinical and neurophysiological parameters in patients with discirculatory encephalopathy] // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. 2010. V. 110. № 2. Р. 15.
Болдырева Г.Н. Нейрофизиологический анализ поражения лимбико-диэнцефальных структур мозга человека. Краснодар: Экоинвест, 2009. 231 с.
Болдырева Г.Н. Атипичные формы церебральной альфа активности при поражении регуляторных структур мозга человека // Физиология человека. 2018. Т. 44. № 3. С. 14. Boldyreva G.N. Atypical forms of cerebral alpha activity with damage to the regulatory structures of the human brain // Human Physiology. 2018. V. 44. № 3. P. 246.
Болдырева Г.Н., Шарова Е.В., Добронравова И.С. Роль регуляторных систем мозга в формировании ЭЭГ человека // Журн. высшей нервн. деят. им. И.П. Павлова. 2000. Т. 50. № 5. С. 19. Boldyreva G.N., Sharova E.V., Dobronravova I.S. [The role of brain regulatory systems in the formation of human EEG] // Zh. Vyssh. Nerv. Deyat. Im. I.P. Pavlova. 2000. V. 50. № 5. P. 19.
Matthews S.C., Paulus M.P., Simmons A.N. et al. Functional subdivisions within anterior cingulate cortex and their relationship to autonomic nervous system function // Neuroimage. 2004. V. 22. № 3. P. 1151.
Рукавишников В.С., Панков В.А., Кулешова М.В. и др. Теории сенсорного конфликта при воздействии физических факторов: основные положения и закономерности формирования // Медицина труда и промышленная экология. 2015. № 4. С. 1. Rukavishnikov V.S., Pankov V.A., Kuleshova M.V. et al. Theories of sensory conflict under the influence of physical factors: basic provisions and patterns of formation // Russian J. Occupational Health and Industrial Ecology. 2015. № 4. С. 1.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


