Физиология человека, 2022, T. 48, № 2, стр. 14-27
Эффект чрескожной электрической стимуляции спинного мозга на функциональную активность спинального торможения в системе мышц-синергистов голени у человека
А. А. Челноков 1, *, Л. В. Рощина 1, Д. А. Гладченко 1, Е. А. Пивоварова 1, И. В. Пискунов 1, Р. М. Городничев 1
1 ФГБОУ ВО Великолукская государственная академия физической культуры и спорта
Великие Луки, Россия
* E-mail: and-chelnokov@yandex.ru
Поступила в редакцию 28.12.2020
После доработки 25.01.2021
Принята к публикации 30.04.2021
- EDN: ZJNOUY
- DOI: 10.31857/S0131164622020035
Аннотация
Изучалось влияние 20-минутной чрескожной электрической стимуляции спинного мозга (ЧЭССМ) на выраженность нереципрокного и возвратного торможения спинальных α-мотонейронов у человека в состоянии покоя и слабого по величине мышечного усилия. Установлено, что на протяжении всего времени воздействия ЧЭССМ в состоянии покоя нереципрокное и возвратное торможение α-мотонейронов мышцы-синергиста (m. soleus) ослабевало, инвертируясь на нереципрокное и возвратное облегчение. Нереципрокное облегчение α-мотонейронов мышцы-синергиста сохранялось в течение всего времени последействия, а возвратное облегчение инвертировалось на возвратное торможение, которое усиливалось вплоть до 20 мин после окончания стимуляции. Удержание слабого по величине мышечного усилия во время стимуляции спинного мозга сопровождалось усилением нереципрокного и возвратного торможения α-мотонейронов мышцы-синергиста. Такой постактивационный эффект сохранялся до 20 мин после электрической стимуляции спинного мозга. Активность возвратного торможения была выражена в большей степени во время стимуляции спинного мозга при выполнении слабого по величине произвольного усилия, а постактивационный эффект проявлялся сходными изменениями в выраженности возвратного и нереципрокного торможения: их усилении в течение 10 мин и ослаблении на 20 минуте после окончания стимуляции до фоновых значений. Обсуждаются предполагаемые рефлекторные механизмы нисходящих супраспинальных и восходящих периферических влияний на функциональную активность нерецирокного и возвратного торможения в системе мышц-синергистов голени у человека на основе эффектов ЧЭССМ.
Тормозные системы спинного мозга играют существенную роль в обеспечении двигательной активности человека [1, 2]. Основными тормозными взаимодействиями в системе мышц-антагонистов являются пресинаптическое и реципрокное торможение. Тормозные взаимодействия мышц-синергистов спинального уровня известны как “нереципрокное торможение” или “Ib торможение”, которое реализуется по афферентам Ib от рецепторных сухожильных органов Гольджи на тормозные Ib интернейроны к α-мотонейронам собственной мышцы и/или мышцы-синергиста. Функциональная роль нереципрокного торможения – своевременно предохранять скелетную мышцу от чрезмерного ее напряжения и осуществлять координацию в активности разных мышечных групп [1–5].
Другим тормозным механизмом на спинальном уровне в системе мышц-синергистов является возвратное постсинаптическое торможение, которое регулирует через клетки Реншоу активность нерецирокного торможения [1]. Возвратное торможение выполняет роль отрицательной обратной связи, тем самым лимитирует частоту разрядов α-мотонейронов и ограничивает развитие чрезмерного мышечного усилия [2, 6–9].
В последнее десятилетие опубликовано большое число экспериментальных исследований по применению неинвазивной чрескожной электрической стимуляции спинного мозга (ЧЭССМ) [10–13]. ЧЭССМ основана на накожной электрической активации спинальных нейрональных цепей с помощью электродов, приложенных на сегменты нижних грудных и/или пояснично-крестцовых позвонков. Ее инновационной особенностью является применение безболезненных режимов стимуляционного воздействия [10, 11]. При низкой интенсивности стимуляции спинного мозга активируются низкопороговые афферентные волокна, в определенной степени вовлекаются в процесс и двигательные аксоны. Повышение интенсивности стимуляции вовлекает большее число двигательных аксонов, что приводит к снижению латентности вызванного моторного ответа и окклюзирующему эффекту афферентных путей [10, 11]. Эти данные согласуются с предыдущими результатами, полученными в экспериментах с применением чрескожной [14] и эпидуральной [15, 16] стимуляции спинного мозга.
Показаны постактивационные эффекты 20-минутной электрической стимуляции спинного мозга на проявление пресинаптического и реципрокного тормозного взаимодействия в системе мышц-антагонистов у здоровых испытуемых [17]. Установлены неизвестные ранее закономерности о влиянии 20-минутной электрической стимуляции спинного мозга на повышение силовых способностей мышц [13] и модуляции нереципрокного торможения спинальных α-мотонейронов, обеспечивающего оптимальное функционирование поддержания напряженности скелетных мышц [18]. В то же время в имеющейся литературе отсутствуют сведения о влиянии ЧЭССМ на функциональную активность тормозных механизмов в системе мышц-синергистов человека.
Цель исследования заключалась в изучении влияния 20-минутной электрической стимуляции спинного мозга на проявление нереципрокного и возвратного торможения спинальных α-мотонейронов у человека и возможных физиологических механизмов этих проявлений.
МЕТОДИКА
В исследовании принимали участие 18 здоровых мужчин в возрасте от 27 до 35 лет. ЧЭССМ (стимулятор “Нейро-МВП-8”, ООО “Нейрософт”, Россия) осуществляли с помощью активного электрода диаметром 2.5 см на уровне грудных позвонков T11–T12 в положении лежа на спине в течение 20 мин [10, 11, 19]. Индифферентные электроды прямоугольной формы 5 × 10.2 см2 располагали билатерально над гребнями подвздошных костей. Интенсивность стимула на протяжении первых 10 мин находилась в пределах 30 мА, а в дальнейшем достигала 40 мА. Длительность однократного стимула составляла 0.5 мс, частота следования стимулов – 10 Гц [13].
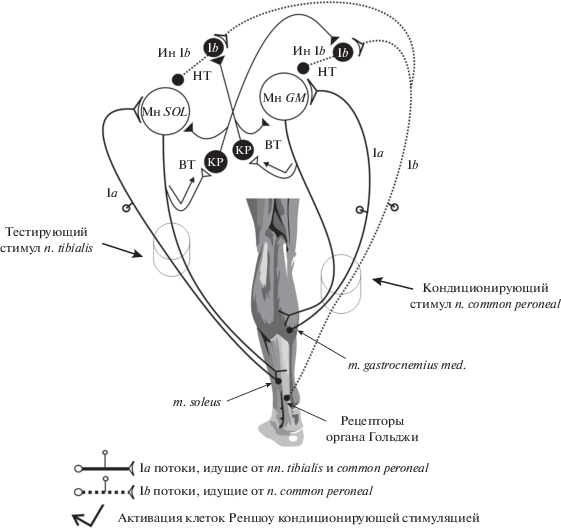
Методика регистрации нереципрокного и возвратного торможения гомонимных α-мотонейронов спинного мозга. Каждому испытуемому наносились кондиционирующие (n. common peroneal) и тестирующие стимулы (n. tibialis) с межстимульным интервалом 6 и 20 мс (рис. 1). Коротколатентный кондиционирующий стимул за 6 мс до тестирующего раздражения активирует афференты Ib, тем самым подавляя тестирующий Н-ответ m. soleus и вызывая на спинальном уровне функциональные изменения в активности нереципрокного торможения [20, 21]. Длиннолатентный кондиционирующий стимул за 20 мс до тестирующего раздражения активирует клетки Реншоу через отходящие моторные коллатерали аксонов α-мотонейронов m. gastrocnemius medialis и m. soleus, что, в свою очередь, снижает возбудимость α‑мотонейронов соответствующих мышц [5, 22]. Контрольный Н-рефлекс использовали для определения выраженности нереципрокного и возвратного торможения, которую вычисляли по формуле: Амплитуда тестирующего Н-ответа/Амплитуда контрольного Н-ответа × 100. Выраженность нереципрокного и возвратного торможения оценивали по наибольшей величине подавления тестирующего Н-рефлекса в %. Сила контрольного и тестирующего стимулов на n. tibialis составляла 15% от интенсивности, вызывающей максимальную амплитуду Н-ответа m. soleus, а кондиционирующего раздражения на n. common peroneal – 95% от величины стимула, вызывающей максимальную амплитуду М-ответа m. gastrocnemius medialis. На мини-электромиографе с программным обеспечением Муо (АНО ИМР “Возращение”, Россия) регистрировали амплитуды Н-рефлексов и М-ответов, осуществляли кондиционирующую стимуляцию афферентов Ib, эфферентных волокон и тестирующее раздражение афферентов Iа, проводили запись ЭМГ-активности мышц-синергистов (m. soleus, m. gastrocnemius medialis) поверхностными накожными электродами диаметром 9 мм: активный электрод фиксировали в проекции двигательной точки мышцы, референтный смещали на расстояние 2 см к сухожилию [2].
Рис. 1.
Схема методики оценки нереципрокного и возвратного торможения гомонимных α-мотонейронов m. soleus. Мн GM – мотонейроны m. gastrocnemius medialis; Мн Sol – мотонейроны m. soleus; Ин Ib – тормозные интернейроны Ib; КР – тормозные клетки Реншоу; НТ – нереципрокное торможение; ВТ – возвратное торможение.
Методика регистрации произвольного мышечного сокращения. Во время выполнения слабого по величине мышечного усилия (5% от максимального произвольного сокращения (МПС)) испытуемые удобно лежали на спине, правая стопа жестко фиксировалась с помощью регулируемых ремней на платформе динамометра (“Biodex Multi-Joint System Pro-3”, США, 2006). В начале каждого эксперимента испытуемые выполняли МПС мышц голени (изометрический тип сокращения). После предлагали выполнить статическое усилие в 5% от МПС и удерживать его в течение 20 мин. Слабое по величине мышечное сокращение отслеживал испытуемый визуально на мониторе компьютера. Выбор слабого по величине МПС связан с тем, чтобы испытуемые могли удержать данное мышечное напряжение в течение 20-минутной ЧЭССМ.
Экспериментальные условия. Записи амплитуд тестирующих Н-ответов m. soleus (нереципрокного и возвратного торможения) проводили: 1) в состоянии покоя до воздействия длительной ЧЭССМ, на 5, 10, 20 минутах стимуляции и на 5, 10, 20 минутах электрического последействия; 2) при удержании слабого по величине изометрического сокращения (5% от МПС) до длительной ЧЭССМ, во время ее воздействия, на 5, 10, 20 мин при удержании 5% от МПС, и после стимуляции, на 5, 10, 20 минутах без удержания 5% от МПС. Запись контрольных Н-рефлексов m. soleus осуществляли в состоянии относительного мышечного покоя.
Статистический анализ данных проводили в программе Statistica v.12.5 Build 192.7 (StatSoft, США). Статистически значимые различия исследуемых параметров выявляли с применением параметрических (однофакторный дисперсионный анализ с post-hoc анализом Newman-Keuls) и непараметрических методов (дисперсионный анализ Kruskal-Wallis Anova). Нормальность распределения выборок определяли с помощью Shapiro-Wilk’s W test. Критическое значение уровня статистической значимости при проверке нулевых гипотез принимали равным 5% (p = 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Эффект ЧЭССМ на выраженность нерецирокного торможения α-мотонейронов мышц-синергистов голени в состоянии относительного мышечного покоя. У испытуемых 20-минутная ЧЭССМ в покое облегчает тестирующий Н-ответ m. soleus, снижая выраженность нереципрокного торможения по отношению к состоянию до стимуляции спинного мозга (табл. 1). Это проявлялось в повышении амплитуды тестирующего Н-ответа m. soleus с 5 по 20 мин воздействия электрической стимуляции (р = 0.000; Kruscal-Wallis Anova) по отношению к фоновым значениям. На протяжении 20-минутного стимуляционного воздействия на спинной мозг выраженность нереципрокного облегчения оставалось постоянной. Непараметрический дисперсионный анализ не выявил значимых различий в амплитудах тестирующих Н-ответов m. soleus между интервалами времени воздействия ЧЭССМ (р = 1.000; Kruscal-Wallis Anova). Эффект облегчения тестирующих Н-ответов m. soleus наблюдался вплоть до 20 минуты после прекращения ЧЭЭСМ по отношению к фону (р = 0.000; Kruscal-Wallis Anova).
Таблица 1.
Эффект 20-минутной электрической стимуляции поясничного утолщения спинного мозга на показатели амплитуды Н-рефлекса m. soleus в условиях коротколатентной кондиционирующей стимуляции n. common peroneal (M ± SE, n = 12)
| Показатели | До стимуляции спинного мозга (фон) | Т2, мВ | ||||||
|---|---|---|---|---|---|---|---|---|
| во время стимуляции спинного мозга (мин) | после стимуляции спинного мозга (мин) | |||||||
| К, мВ | Т1, мВ | |||||||
| 5 | 10 | 20 | 5 | 10 | 20 | |||
| 2.30 ± 0.07 | 1.66 ± 0.03 | 3.53 ± 0.10 | 3.70 ± 0.06 | 3.89 ± 0.11 | 5.84 ± 0.22 | 3.55 ± 0.19 | 3.19 ± 0.12 | |
| Тестирующий Н-рефлекс от контрольного, % | 72.01 ± 2.65 | 155.46 ± 6.06 | 162.51 ± 5.87 | 171.28 ± 8.25 | 161.11 ± 10.60 | 156.18 ± 9.31 | 139.61 ± 4.83 | |
| Р5 мин СМ × фон | р = 0.000 | |||||||
| Р10 мин СМ × фон | р = 0.000 | |||||||
| Р20 мин СМ × фон | р = 0.000 | |||||||
| Р5 мин после СМ × фон | р = 0.000 | |||||||
| Р10 мин после СМ × фон | р = 0.000 | |||||||
| Р20 мин после СМ × фон | р = 0.000 | |||||||
Примечание: К – контрольный Н-рефлекс, Т1 – тестирующий Н-рефлекс в условиях кондиционирующей стимуляции в состоянии покоя, Т2 – тестирующий Н-рефлекс в условиях кондиционирующей стимуляции во время и после стимуляции спинного мозга; СМ – стимуляция спинного мозга; Р5 мин СМ × фон, Р10 мин СМ × фон, Р20 мин СМ × фон – достоверность отличий в амплитуде тестирующего Н-рефлекса от контрольного рефлекса на 5, 10, 20 минутах стимуляции спинного мозга по сравнению с фоном, %; Р5 мин после СМ × фон, Р10 мин после СМ × фон, Р20 мин после СМ × фон – достоверность отличий в амплитуде тестирующего Н-рефлекса от контрольного рефлекса на 5, 10, 20 минутах после стимуляции спинного мозга по сравнению с фоном, %; жирным шрифтом выделены достоверные различия при уровне значимости р < 0.05.
Эффект ЧЭССМ на выраженность нерецирокного торможения α-мотонейронов мышц-синергистов голени при удержании слабого по величине мышечного усилия. При удержания произвольного усилия в 5% от индивидуального максимума без ЧЭССМ происходило незначительное ослабление нереципрокного торможения (р = 0.056; Newman-Keuls) по сравнению с состоянием покоя (фон) (табл. 2). Под воздействием ЧЭССМ в сочетании с произвольным удержанием в 5% от МПС нереципрокное торможение усилилось на 5 (р = 0.022; Newman-Keuls), 10 (р = 0.021; Newman-Keuls) и 20 (р = 0.015; Newman-Keuls) минутах. Во время стимуляции спинного мозга на 5, 10 и 20 минутах в сочетании с произвольным напряжением скелетных мышц выраженность нереципрокного торможения была постоянной (р = = 1.000; Newman-Keuls). Усиление нереципрокного торможения наблюдалось на 5 (р = 0.011; Newman-Keuls) и 10 (р = 0.017; Newman-Keuls) минутах после окончания стимуляционного воздействия на спинной мозг, а к 20 минуте отмечалось его постепенное ослабление, которое достигало фоновых значений (до стимуляции спинного мозга (фон): р = 0.955; до стимуляции спинного мозга + + 5% от МПС: р = 0.121, Newman-Keuls).
Таблица 2.
Эффект 20-минутной электрической стимуляции поясничного утолщения спинного мозга и изометрического сокращения в 5% от МПС на показатели амплитуды Н-рефлекса m. soleus в условиях коротколатентной кондиционирующей стимуляции n. common peroneal (M ± SE, n = 10)
| Показатели | До стимуляции спинного мозга (фон) | Т2, мВ | |||||||
|---|---|---|---|---|---|---|---|---|---|
| до стимуляции спинного мозга + 5% от МПС | во время стимуляции спинного мозга + 5% от МПС (мин) | после стимуляции спинного мозга (мин) | |||||||
| К, мВ | Т1, мВ | ||||||||
| 5 | 10 | 20 | 5 | 10 | 20 | ||||
| 2.01 ± 0.23 | 1.50 ± 0.20 | 1.81 ± 0.20 | 1.15 ± 0.11 | 1.18 ± 0.12 | 1.19 ± 0.11 | 0.92 ± 0.12 | 0.94 ± 0.09 | 1.42 ± 0.14 | |
| Тестирующий Н-рефлекс от контрольного, % | 73.47 ± 2.25 | 93.17 ± 7.06 | 60.35 ± 5.65 | 61.40 ± 5.49 | 62.01 ± 3.97 | 47.18 ± 4.23 | 48.82 ± 3.28 | 72.91 ± 4.52 | |
| Р5% от МПС × фон | р = 0.056 | ||||||||
| Р5 мин СМ × 5% от МПС | р = 0.022 | ||||||||
| Р10 мин СМ × 5% от МПС | р = 0.021 | ||||||||
| Р20 мин СМ × 5% от МПС | р = 0.015 | ||||||||
| Р5 мин после СМ × фон | р = 0.011 | ||||||||
| Р10 мин после СМ × фон | р = 0.017 | ||||||||
| Р20 мин после СМ × фон | р = 0.955 | ||||||||
Примечание: Т2 – тестирующий Н-рефлекс в условиях кондиционирующей стимуляции до и во время стимуляции спинного мозга при выполнении изометрического сокращения в 5% от МПС и после стимуляции спинного мозга в покое; Р5% от МПС × фон, Р5 мин СМ × 5% от МПС, Р10 мин СМ × 5% от МПС, Р20 мин СМ × 5% от МПС – достоверность отличий в амплитуде тестирующего Н-рефлекса от контрольного рефлекса на фоне выполнения 5% от МПС до стимуляции спинного мозга и на 5, 10, 20 минутах стимуляции спинного мозга по сравнению с фоном, %; Р5 после СМ × фон, Р10 после СМ × фон, Р20 после СМ × фон 5 – достоверность отличий в амплитуде тестирующего Н-рефлекса от контрольного рефлекса на 5, 10, 20 минутах после стимуляции спинного мозга по сравнению с фоном, %. Остальные обозначения см. табл. 1.
Эффект ЧЭССМ на выраженность возвратного торможения α-мотонейронов мышц-синергистов голени в состоянии относительного мышечного покоя. ЧЭССМ наиболее существенно оказывала влияние на амплитуду тестирующего Н-ответа m. soleus: в данном случае возвратное торможение α-мотонейронов инвертировалось на его облегчение по отношению к фону (табл. 3; р = 0.000; Newman-Keuls). Методом параметрического дисперсионного анализа выявлено достоверно значимое усиление возвратного облегчения α-мотонейронов m. soleus на 5 минуте стимуляции спинного мозга по сравнению с 10 (р = 0.038; Newman-Keuls) и 20 минутами (р = 0.002; Newman-Keuls). 20-минутная стимуляция спинного мозга оказывала возвратный тормозной эффект на спинальном уровне после ее воздействия (табл. 3). Усиление возвратного торможения протекало вплоть до 20 минуты последействия ЧЭССМ (р = 0.010; Newman-Keuls).
Таблица 3.
Эффект 20-минутной электрической стимуляции поясничного утолщения спинного мозга на показатели амплитуды Н-рефлекса m. soleus в условиях длиннолатентной кондиционирующей стимуляции n. common peroneal (M ± SE, n = 6)
| Показатели | До стимуляции спинного (фон) | Т2, мВ | ||||||
|---|---|---|---|---|---|---|---|---|
| во время стимуляции спинного мозга (мин) |
после стимуляции спинного мозга (мин) |
|||||||
| К, мВ | Т1, мВ | |||||||
| 5 | 10 | 20 | 5 | 10 | 20 | |||
| 1.97 ± 0.11 | 1.32 ± 0.09 | 2.27 ± 0.16 | 2.14 ± 0.13 | 2.04 ± 0.13 | 1.96 ± 0.11 | 1.84 ± 0.12 | 1.46 ± 0.11 | |
| Тестирующий Н-рефлекс от контрольного, % | 66.88 ± 1.60 | 114.74 ± 2.92 | 108.41 ± 1.57 | 103.23 ± 0.84 | 99.75 ± 1.21 | 93.11 ± 1.29 | 74.11 ± 3.03 | |
| Р5 мин СМ × фон | р = 0.000 | |||||||
| Р10 мин СМ × фон | р = 0.000 | |||||||
| Р20 мин СМ × фон | р = 0.000 | |||||||
| Р5 мин после СМ × фон | р = 0.000 | |||||||
| Р10 мин после СМ × фон | р = 0.000 | |||||||
| Р20 мин после СМ × фон | р = 0.010 | |||||||
Примечание: обозначения см. табл. 1.
Эффект ЧЭССМ на выраженность возвратного торможения α-мотонейронов мышц-синергистов голени при удержании слабого по величине мышечного усилия. Выполнение произвольного мышечного усилия в 5% от индивидуального максимума в условиях отсутствия ЧЭЭСМ незначительно ослабляло возвратное торможение (р = 0.597; Newman-Keuls) по сравнению с состоянием покоя (фон) (табл. 4). Под влиянием электрического воздействия на спинной мозг в сочетании с произвольным мышечным напряжением в 5% от МПС возвратное торможение значительно усиливалось на 5 (р = 0.000; Newman-Keuls), 10 (р = = 0.000; Newman-Keuls) и 20 (р = 0.000; Newman-Keuls) минутах. Достоверно значимое усиление возвратного торможения выявлено на 5 минуте стимуляционного воздействия по сравнению с 20 минутой (р = 0.000; Newman-Keuls). После окончания стимуляционного воздействия на спинной мозг усиление тормозного эффекта отмечалось на 5 (р = 0.011; Newman-Keuls) минуте с последующим ослаблением к 20 (р = 0.017; Newman-Keuls) минуте до фоновых значений (до стимуляции спинного мозга (фон): р = 0.528; до стимуляции спинного мозга + 5% от МПС: р = 0.836, Newman-Keuls).
Таблица 4.
Эффект 20-минутной электрической стимуляции поясничного утолщения спинного мозга и изометрического сокращения в 5% от МПС на показатели амплитуды Н-рефлекса m. soleus в условиях длиннолатентной кондиционирующей стимуляции n. common peroneal (M ± SE, n = 6)
| Показатели | До стимуляции спинного мозга (фон) | Т2, мВ | |||||||
|---|---|---|---|---|---|---|---|---|---|
| до стимуляции спинного мозга + + 5% от МПС | во время стимуляции спинного мозга + + 5% от МПС (мин) | после стимуляции спинного мозга (мин) | |||||||
| К, мВ | Т1, мВ | ||||||||
| 5 | 10 | 20 | 5 | 10 | 20 | ||||
| 2.05 ± 0.13 | 1.35 ± 0.11 | 1.44 ± 0.07 | 0.53 ± 0.05 | 0.58 ± 0.06 | 0.79 ± 0.04 | 0.63 ± 0.06 | 0.85 ± 0.06 | 1.42 ± 0.16 | |
| Тестирующий Н-рефлекс от контрольного, % | 65.68 ± 2.53 | 70.82 ± 4.13 | 26.04 ± 2.55 | 28.41 ± 3.12 | 38.80 ± 2.08 | 31.11 ± 2.99 | 41.58 ± 2.91 | 69.04 ± 7.31 | |
| Р5% от МПС × фон | р = 0.597 | ||||||||
| Р5 мин СМ × 5% от МПС | р = 0.000 | ||||||||
| Р10 мин СМ × 5% от МПС | р = 0.000 | ||||||||
| Р20 мин СМ × 5% от МПС | р = 0.000 | ||||||||
| Р5 мин после СМ × фон | р = 0.000 | ||||||||
| Р10 мин после СМ × фон | р = 0.000 | ||||||||
| Р20 мин после СМ × фон | р = 0.528 | ||||||||
Примечание: обозначения см. табл. 1 и 2.
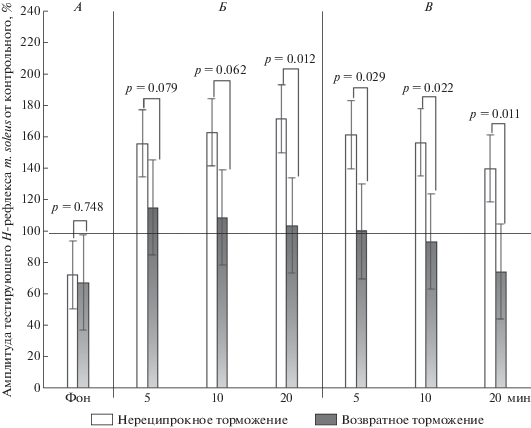
Сравнительный анализ эффекта ЧЭССМ на проявление нереципрокного и возвратного торможения α-мотонейронов мышц-синергистов голени в состоянии относительного мышечного покоя. Данные рис. 2 свидетельствуют о том, что до стимуляции спинного мозга выраженность нереципрокного и возвратного торможения α-мотонейронов m. soleus была постоянной (р = 0.784; Newman-Keuls). Электростимуляция спинного мозга на 20 минуте воздействия вызывала более выраженное нереципрокное облегчение по сравнению с возвратным облегчением (р = 0.012; Newman-Keuls). После окончания электрической стимуляции спинного мозга возвратное облегчение инвертировалось на возвратное торможение с 5 по 20 мин последействия, а нереципрокное облегчение было постоянным, как и при воздействии электрической стимуляции на спинной мозг. На 20 мин (р = 0.011; Newman-Keuls) последействия электрической стимуляции спинного мозга отмечалась наибольшая выраженность возвратного торможения (рис. 2).
Рис. 2.
Амплитуда тестирующего Н-рефлекса m. soleus от контрольного рефлекса до, во время и после чрескожной электрической стимуляции спинного мозга (ЧЭССМ) в состоянии покоя, %. А – до ЧЭССМ; Б – во время ЧЭССМ; В – после ЧЭССМ.
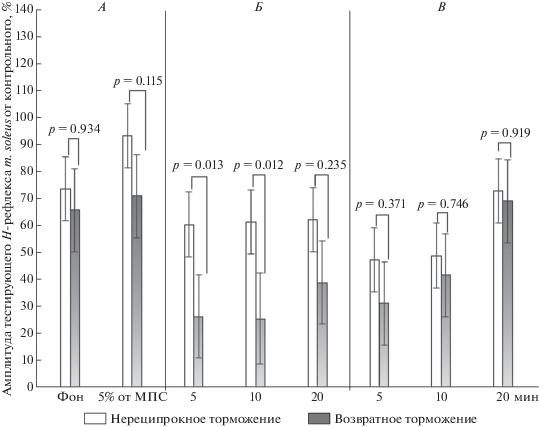
Сравнительный анализ эффекта ЧЭССМ на проявление нереципрокного и возвратного торможения α-мотонейронов мышц-синергистов голени при удержании слабого по величине мышечного усилия. Сравнительный анализ показателей амплитуд тестирующих Н-рефлексов показал, что эффект 20-минутной электрической стимуляции спинного мозга проявлялся в усилении тормозных процессов мышц-синергистов голени на фоне удержания слабого мышечного усилия в 5% от МПС (рис. 3). Из рис. 3 видно, что во время стимуляции спинного мозга на 5 (р = 0.013; Newman-Keuls) и 10 (р = 0.012; Newman-Keuls) минутах наблюдалась наибольшая выраженность возвратного торможения относительно нереципрокного торможения. Последействие ЧЭССМ на 5 и 10 мин усиливало возвратное и нереципрокное торможение, а к 20 мин ослабляло их активность до фоновых значений.
Рис. 3.
Амплитуда тестирующего Н-рефлекса m. soleus от контрольного рефлекса до чрескожной электрической стимуляции спинного мозга (ЧЭССМ) в покое (фон) и при удержании 5% от МПС, во время ЧЭССМ в сочетании с удержанием 5% от МПС и после ее воздействия в покое, %. А – до ЧЭССМ; Б – во время ЧЭССМ в сочетании с удержанием 5% от МПС; В – после ЧЭССМ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты исследования влияния электрической стимуляции спинного мозга на функциональную активность спинального торможения в системе мышц-синергистов голени у человека показали, что в течение 20-минутной стимуляции спинного мозга в состоянии относительного мышечного покоя нереципрокное и возвратное торможение α-мотонейронов мышцы-синергиста снижается (нереципрокное и возвратное облегчение) (табл. 1, 3). Нереципрокное облегчение α-мотонейронов мышцы-синергиста сохранялось до 20 мин после электрической стимуляции спинного мозга, а возвратное облегчение инвертировалось на возвратное торможение, которое усиливалось вплоть до 20 мин последействия. T. Yamaguchi et al. [17], изучая эффекты ЧЭССМ на проявление пресинаптического и реципрокного тормозного взаимодействия в системе мышц-антагонистов у здоровых испытуемых, установили, что после 20-минутной электрической стимуляции спинного мозга реципрокное торможение усиливается в течение 15 мин последействия, а пресинаптическое торможение не отличается от исходного уровня на протяжении 30 мин последействия. Авторы предполагают, что длительный эффект неинвазивного электрического воздействия на спинной мозг индуцирует кратковременные пластические изменения в тормозных Ia интернейронах системы реципрокного торможения [17].
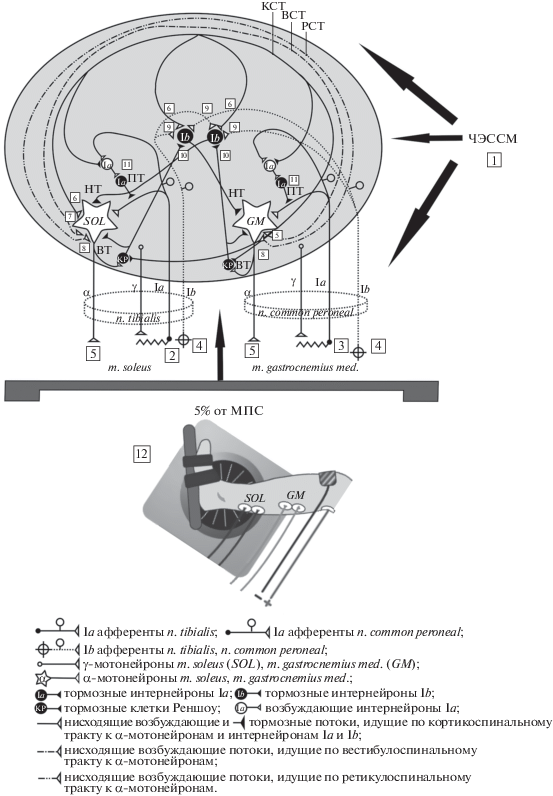
Авторы-разработчики неинвазивного способа ЧЭССМ высказывают предположение, что при воздействии электрической стимуляции на спинной мозг последовательно вовлекаются афференты группы Ia и Ib, афференты группы II, возбуждающие и тормозные спинальные интернейроны, реализующие поли- и олигосинаптические рефлексы, а также пирамидный, ретикулоспинальный и симпатический тракты [10, 11]. Опираясь на высказывания этих авторов, можно предположить, что при воздействии 20-минутной ЧЭССМ (1) в покое последовательно вовлекаются восходящие периферические влияния от Ia (2), (3), Ib (4) афферентов на α-мотонейроны и эфферентные коллатерали аксонов α-мотонейронов (5), а также возбуждающие супраспинальные входы (кортико- (6), вестибуло- (7), ретикулоспинальные (8)) на соответствующие мотонейроны, что приводит к усилению нереципрокных и возвратных облегчающих влияний на моторные ядра мышц-синергистов голени (m. soleus и m. gastrocnemius) (рис. 4).
Рис. 4.
Полагаемая модель тормозной интернейрональной цепи мышц-синергистов голени, опосредуемой восходящими и нисходящими влияниями на спинальные мотонейроны во время и после воздействия 20-минутной чрескожной электрической стимуляции спинного мозга (ЧЭССМ) в сочетании со слабым по величине мышечным напряжением. 1 – ЧЭССМ; 2, 3, 4, 5 – восходящие периферические влияния от Ia и Ib афферентов, и эфферентные коллатерали аксонов α-мотонейронов; 6, 7, 8 – нисходящие супраспинальные влияния от кортико-, вестибуло- и ретикулоспинального трактов; 9 – нереципрокное (Ib) торможение; 10 – возвратное торможение через клетку Реншоу; 11 – пресинаптическое торможение Ia афферентов; 12 – 5% от МПС (максимальное произвольное сокращение); КСТ – кортикоспинальный тракт; ВСТ – вестибулоспинальный тракт; РСТ – ретикулоспинальный тракт; НТ – нереципрокное торможение α-мотонейронов; ВТ – возвратное торможение α-мотонейронов; ПТ – пресинаптическое торможение Ia афферентов.
Результаты собственных исследований показали, что в условиях удержания усилия, составляющего 5% от МПС, нереципрокное и возвратное торможение α-мотонейронов m. soleus до воздействия электрической стимуляции на спинной мозг было слабее, чем в состоянии относительного мышечного покоя (табл. 2, 4, рис. 3). Сходные результаты, описывающие ослабление нереципрокного торможения α-мотонейронов m. soleus при выполнении умеренного по величине статического усилия, представлены в работах E. Pierrot-Deseilligny et al. [23] и А.А. Челнокова и др. [24, 25]. При выполнении умеренного по величине статического усилия наиболее выражено пресинаптическое торможение, которое активно регулирует избыточный афферентный приток к α-мотонейронам мышц-агонистов и антагонистов голени, растормаживая нереципрокные и реципрокные тормозные влияния на них, обеспечивая нормальную двигательную активность человека [24].
Собственные результаты исследований указывают на то, что на фоне 20-минутной ЧЭССМ и выполнения слабого по величине мышечного усилия более выражено возвратное торможение α-мотонейронов m. soleus по сравнению с нереципрокным, которое сохранялось в течение 10 мин воздействия стимуляции на спинной мозг (рис. 3). Постактивационный эффект 20-минутной ЧЭССМ заключался в усилении функциональной активности нереципрокного и возвратного торможения на 5 и 10 минутах, а к 20 мин – в ослаблении их проявления до фоновых значений. Различий в выраженности данных тормозных процессов в системе мышц-синергистов не наблюдалось (рис. 3).
Из имеющихся в настоящее время данных известно, что кортикоспинальные волокна поли- и олигосинаптически конвергируют на тормозные Iа и Ib интернейроны, клетки Реншоу спинного мозга, координирующие афферентные входы к двигательным центрам гомонимных и гетеронимных α-мотонейронов через тормозные спинальные системы (пресинаптическое, реципрокное, нереципрокное и возвратное торможение) [2, 5, 26, 27]. Нисходящие латеральные и вентральные кортикоспинальные пути являются глутаматергическими, которые моно- и полисинаптически возбуждают α-мотонейроны и полисинаптически – γ-мотонейроны [28, 29]. Однако латеральные вестибулоспинальные пути оказывают полисинаптические облегчающие влияния на α-мотонейроны мышц экстензоров и тормозные – на α-мотонейроны мышц флексоров нижних и верхних конечностей. Вместе с тем латеральные ретикулоспинальные пути полисинаптически ингибируют α-мотонейроны мышц экстензоров и облегчают мотонейроны мышц флексоров [30]. Имеется мнение, что руброспинальный тракт оказывает возбуждающие влияния на двигательные центры скелетных мышц [31].
Схема, представленная на рис. 4, предполагает, что 20-минутная ЧЭССМ (1) в сочетании со слабым по величине статическим усилием (12) и ее постактивационный эффект дополнительно активируют возбуждающие кортикоспинальные пути (6) и периферические влияния Ib афферентов от рецепторов Гольджи (4) и эфферентных коллатералей аксонов α-мотонейронов (5), усиливая функциональную активность тормозных интернейронов Ib нереципрокного торможения (9) и клеток Реншоу возвратного торможения (10). Проявление нереципрокного торможения α-мотонейронов мышц-синергистов голени регулируется механизмами возвратного торможения через клетку Реншоу (10) и пресинаптического торможения, опосредованного Ia афферентами на соответствующие интернейроны (11) [2, 24, 25, 32] (рис. 4). Более вероятно, что на фоне 20-минутной электрической стимуляции спинного мозга (1) в сочетании со слабым по величине мышечным усилием (12) и после ее воздействия нисходящие вестибуло- (7) и ретикулоспинальные (8) пути оказывают возбуждающие влияния на двигательные центры мышц-синергистов, обеспечивая скоординированную работу всех спинальных тормозных систем. Это предположение согласуется с работой по изучению особенностей проявления пресинаптического торможения гомонимных Ia афферентов и реципрокного торможения α-мотонейронов m. soleus в покое при активации ретикуло- и вестибулоспинальных путей в ответ на транскраниальную магнитную стимуляцию мозжечка [33].
ЗАКЛЮЧЕНИЕ
Полученные данные восполняют пробел в научных знаниях о механизмах функционирования спинальных тормозных систем мышц-синергистов голени под влиянием чрескожной электростимуляции спинного мозга. ЧЭССМ модулирует нереципрокное и возвратное торможение спинальных α-мотонейронов в состоянии относительного мышечного покоя и при удержании слабого по величине мышечного напряжения. Воздействие электрической стимуляции на спинной мозг в состоянии покоя приводит к ослаблению функциональной активности тормозных спинальных нейронных структур мышц-синергистов, а при удержании слабого по величине мышечного напряжения, наоборот, к их усилению, причем наиболее выраженным является возвратное торможение. Фундаментальные данные, полученные в результате такого рода исследования, могут найти практическое применение в коррекции сегментарных нарушений у лиц с нейромоторными заболеваниями и травмами.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены комиссией по вопросам этики Великолукской государственной академии физической культуры и спорта (Великие Луки).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Бикмуллина Р.Х., Розенталь А.Н., Плещинский И.Н. Тормозные системы спинного мозга в контроле взаимодействий функционально сопряженных мышц // Физиология человека. 2007. Т. 33. № 1. С. 119. Bikmullina R.Kh., Rozental’ A.N., Pleshchinskii I.N. Inhibitory systems of the spinal cord in the control of interactions of functionally coupled muscles // Human Physiology. 2007. V. 33. № 1. Р. 105.
Челноков А.А., Городничев Р.М. Закономерности формирования спинального торможения у человека. М.: ИНФРА-М, 2020. 192 с.
Hunt C.C., Kuffler S.W. Stretch receptor discharges during muscle contraction // J. Physiol. 1951. V. 113. P. 298.
Haase J., Cleveland S., Ross H.G. Problems of postsynaptic autogenous and recurrent inhibition in the mammalian spinal cord // Rev. Physiol. Biochem. Pharmacol. 1975. V. 73. P. 74.
Pierrot-Deseilligny E., Burke D. The Circuitry of the human spinal cord: spinal and corticospinal mechanisms of movement. United States: Cambridge University Press, 2012. 606 p.
Windhorst U. Muscle proprioceptive feedback and spinal networks // Brain Res. Bull. 2007. V. 73. № 4–6. P. 155.
Кудина Л.П., Пиотркевич М. Анализ возвратного торможения, иннервирующих быстрые мышцы у человека // Нейроинформатика. 2006. Часть 1. С. 137.
Obeidat A.Z. New Insights into the Spinal Recurrent Inhibitory Pathway Normally and after Motoneuron Regeneration. Doctor of Philosophy Dissertation. Jordan: Wright State University, 2013. 192 p.
Barrué-Belou S., Marque P., Duclay J. Supraspinal Control of Recurrent Inhibition during Anisometric Contractions // Med. Sci. Sports Exerc. 2019. V. 51. № 11. P. 2357.
Gerasimenko Y., Gorodnichev R., Machueva E. et al. Novel and direct access to the human locomotor spinal circuitry // J. Neuroscience. 2010. V. 30. № 10. P. 3700.
Городничев Р.М., Пивоварова Е.А., Пухов А.М. и др. Чрескожная электрическая стимуляция спинного мозга: неинвазивный способ активации генераторов шагательных движений у человека // Физиология человека. 2012. Т. 38. № 2. С. 46. Gorodnichev R.M., Pivovarova E.A., Puhov A. et al. Transcutaneous electrical stimulation of the spinal cord: a noninvasive tool for the activation of stepping pattern generators in humans // Human Physiology. 2012. V. 38. № 2. Р. 158.
Яфарова Г.Г., Милицкова А.Д., Шульман А.А. и др. Влияние транскраниальной магнитной стимуляции на ответы мышц голени, вызванные чрескожной электрической стимуляцией спинного мозга // Практическая медицина. 2017. № 8(109) С. 201.
Рощина Л.В., Челноков А.А. Эффект чрескожной электрической стимуляции спинного мозга на функциональное состояние моторной системы человека // Теория и практика физической культуры. 2020. № 4(982). С. 30.
Minassian K., Persy I., Rattay F. et al. Posterior root-muscle reflexes elicited by transcutaneous stimulation of the human lumbosacral cord // Muscle Nerve. 2007. V. 35. № 3. P. 327.
Dimitrijevic M., Gerasimenko Yu., Pinter M. Evidence for a spinal central pattern generator in humans // Ann. N.Y. Acad. Sci. 1998. V. 860. P. 360.
Harkema S., Gerasimenko Y., Hodes J. et al. Epidural stimulation of the lumbosacral spinal cord enables voluntary movement, standing, and assisted stepping in a paraplegic human // Lancet. 2011. V. 377. № 9781. P. 1938.
Yamaguchi T., Fujiwara T., Takahara T. et al. The effects of transcutaneous spinal cord stimulation on spinal reciprocal inhibition in healthy persons // Clin. Neurophysiol. 2017. V. 128. № 3. P. 115.
Рощина Л.В., Гладченко Д.А., Пивоварова Е.А., Челноков А.А. Эффект длительной электрической стимуляции спинного мозга на проявления нереципрокного торможения α-мотонейронов скелетных мышц человека // Вестник РУДН. Серия: Медицина. 2019. Т. 23. № 4. С. 390. Roshchina L.V., Gladchenko D.A., Pivovarova E.A., Chelnokov A.A. Effect of Long-Term Electrical Spinal Cord Stimulation on Expression of Non-Reciprocal Inhibition α-Motoneurons of Human Skeletal Muscles // RUDN Journal of Medicine. 2019. Т. 23. № 4. Р. 390.
Gerasimenko Yu., Kozlovskaya I., Edgerton V.R. Sensorimotor regulation of movements: novel strategies for the recovery of mobility // Физиология человека. 2016. Т. 42. № 1. С. 106. Gerasimenko Yu., Kozlovskaya I., Edgerton V.R. Sensorimotor regulation of movements: novel strategies for the recovery of mobility // Human Physiology. 2016. V. 42. № 1. P. 90.
Pierrot-Deseilligny E., Katz R., Morin C. Evidence for IB inhibition in human subjects // Brain Res. 1979. V. 166. № 1. P. 176.
Челноков А.А., Городничев Р.М. Возрастные особенности формирования спинального торможения скелетных мышц у лиц мужского пола // Физиология человека. 2015. Т. 41. № 6. С. 86. Chelnokov A.A., Gorodnichev R.M. Age-related features in the formation of spinal inhibition of skeletal muscles in males // Human Physiology. 2015. V. 41. № 6. Р. 644.
Rossi A., Zalaffi A., Decchi B. Heteronymous recurrent inhibition from gastrocnemius muscle to soleus motoneurones in humans // Neurosci. Lett. 1994. V. 169. № 1–2. P. 141.
Pierrot-Deseilligny E., Morin C., Bergego C., Tankov N. Pattern of group I fibre projections from ankle flexor and extensor muscle in man // Exp. Brain Res. 1981. V. 42. № 3–4. P. 337.
Челноков А.А., Бучацкая И.Н. Функциональные особенности спинального торможения человека при произвольной двигательной активности // Теория и практика физической культуры. 2015. № 6. С. 11. Chelnokov A.A., Buchatskaya I.N. [Functional features spinal inhibition during voluntary motor activity] // Teor. Prakt. Fiz. Kul’t. 2015. № 6. Р. 11.
Челноков А.А., Гладченко Д.А., Федоров С.А., Городничев Р.М. Возрастные особенности спинального торможения скелетных мышц у лиц мужского пола в регуляции произвольных движений // Физиология человека. 2017. Т. 43. № 1. С. 35. Chelnokov A.A., Gladchenko D.A., Fedorov S.A., Gorodnichev R.M. Age-related parameters of spinal inhibition of skeletal muscles in regulation of voluntary movements in men // Human Physiology. 2017. V. 43. № 1. Р. 38.
Knikou M. The H-reflex as a probe: Pathways and pitfalls // J. Neurosci. Methods. 2008. V. 171. № 1. P. 1.
Kubota S., Uehara K., Morishita T. et al. Inter-individual variation in reciprocal Ia inhibition is dependent on the descending volleys delivered from corticospinal neurons to Ia interneurons // J. Electromyogr. Kinesiol. 2014. V. 24. № 1. P. 46.
Rhoades R.A., Bell D.R. Medical Physiology: Principles for Clinical Medicine. 4th editions, Philadelphia: Lippincott Williams & Wilkins, 2012. 851 p.
Королев А.А. Функциональная анатомия нисходящих двигательных систем в норме и при формировании спастического пареза // Фундаментальные исследования. 2013. № 3. С. 92.
Chez C. The control of movement/Posture. Voluntary movement // Principles of Neural Science. 1999. P. 553.
Fujito Y., Aoki M. Monosynaptic rubrospinal projections to distal forelimb motoneurons in the cat // Exp. Brain Res. 1995. V. 105. № 2. P. 181.
Rossi A., Decchi B. Changes in Ib heteronymous inhibition to soleus motoneurons during cutaneous and muscle nociceptive stimulation in humans // Brain Res. 1997. V. 774. P. 55.
Matsugi A., Mori N., Uehara S. et al. Effect of cerebellar transcranial magnetic stimulation on soleus Ia presynaptic and reciprocal inhibition // Neuroreport. 2015. V. 26. № 3. P. 139.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


