Физиология человека, 2022, T. 48, № 2, стр. 61-70
Адаптивные изменения показателей системной гемодинамики и энерготрат молодых мужчин в курсе процедур пассивной гипертермии
С. Ю. Крыжановская 1, *, М. А. Запара 1, Е. Н. Дудник 1, Л. К. Гавриков 2, О. С. Глазачев 1, **
1 ФГАОУ ВО Первый Московский государственный медицинский университет
имени И.М. Сеченова (Сеченовский университет)
Москва, Россия
2 Волгоградский государственный медицинский университет
Волгоград, Россия
* E-mail: svetlanakry@mail.ru
** E-mail: glazachev@mail.ru
Поступила в редакцию 22.03.2021
После доработки 24.05.2021
Принята к публикации 25.06.2021
- EDN: RPGNVL
- DOI: 10.31857/S0131164622020102
Аннотация
Проведена оценка адаптивных сдвигов показателей системной гемодинамики и энерготрат 15 здоровых молодых мужчин в ответ на однократную процедуру пассивной гипертермии (ПГ) и в течение курса 10 таких процедур. Процедуры ПГ длительностью 40 мин проводили в капсуле инфракрасного нагревания тела, при 65–80°С, голова находилась вне капсулы. Анализировали частоту сердечных сокращений, артериальное давление, SрО2, потребление кислорода, энерготраты методом непрямой калориметрии. Рассчитывали интенсивность потоотделения, индекс физиологического напряжения (ИФН). Установлено, что процедуры ПГ сопровождаются повышением энерготрат (по сравнению с процедурами плацебо), но без выраженной стрессорной реакции со стороны системной гемодинамики. Значения ИФН при ПГ соответствовали умеренному тепловому стрессу. В течение курса происходят адаптивные сдвиги в виде снижения энерготрат и повышения интенсивности потоотделения. В 10-й процедуре выявлены связи между степенью прироста температуры тела и уровнем энерготрат.
Адаптация к повторяющимся пассивным тепловым воздействиям (без сочетания с физическими или иными нагрузками), акклиматизация могут улучшать различные функции организма в норме и при патологии [1–3]. Так, в систематическом обзоре [2], показано, что посещение сауны оказывает положительные эффекты как на относительно здоровых людей, так и на пациентов с заболеваниями сердечно-сосудистой, дыхательной, иммунной систем, хроническим болевым синдромом, депрессией. Изучаются нейроэндокринные основы влияния тепловых процедур на физическую работоспособность у спортсменов и их реабилитацию после травм [4, 5]. Есть основания для их использования с целью повышения резистентности к инфекциям, в том числе вирусным [1].
Физиологические механизмы изменений, происходящих в динамике повторяющихся тепловых стимуляций, связаны с термоиндуцированной активацией метаболизма: повышением потребления кислорода и энергии, кардио-респираторных функций, а также увеличением периферического кровотока [6–9]. После процедур и в отставленном периоде усиливаются анаболические процессы [5, 10].
Широкое применение этого относительно дешевого и доступного метода ограничено отсутствием протоколов проведения процедур с четким обоснованием эффективности и безопасности для разных групп населения [1]. В настоящее время для достижения адаптивных изменений рекомендуется применять как минимум 6–7 процедур продолжительностью не менее 30 мин, при этом важным критерием эффективности воздействия является повышение температуры ядра тела – системная гипертермия [11, 12]. В качестве средств нагревания тела человека применяют либо водные иммерсии, либо подачу влажного воздуха температурой 33–42°С, либо сухую сауну (60–90°С) [5]. Очевидно, что динамика температуры тела и кардио-метаболических показателей могут существенно отличаться при разных режимах. Кроме темпа и амплитуды подъема температуры ядра тела, значение может иметь воздействие на периферические терморецепторы, а также нагревание головы/лица, вдыхание горячего воздуха [13–15].
Можно встретить ограниченное число довольно противоречивых публикаций о соотношении величины энерготрат (ЭТ) при пассивной гипертермии (ПГ) с выраженностью индикаторов термического стресса, в том числе в динамике кардиоваскулярных параметров и температуры тела. Оценку количества потребленной энергии часто проводят по гемодинамическим показателям по аналогии с оценкой “пульсовой стоимости” физических нагрузок. Так, по данным работы [16], в однократной процедуре сауны динамика кардиоваскулярных показателей соответствует физической тренировке умеренной интенсивности в диапазоне 60–100 Вт. Однако данные о взаимосвязях значений ЭТ/потребления О2 с частотой сердечных сокращений (ЧСС), артериальным давлением (АД), температурой тела при ПГ достаточно противоречивы. Так, в работе [13] температура ядра тела, температура кожи, систолическое (САД) и диастолическое (ДАД) давление во время сауны имели разную динамику. При проведении нескольких коротких сеансов сауны подряд степень и скорость изменений значений ЧСС, АД, потребления кислорода также различна [9].
Типичными изменениями в процессе долгосрочной тепловой адаптации считают снижение степени прироста ЧСС, температуры тела, повышение интенсивности потоотделения, а также гипотензивный эффект [2, 6, 17]. Сведения относительно динамики ЭТ в курсе тепловых процедур немногочисленны. Одни авторы утверждают, что не выявили значимых изменений кардио-метаболических показателей, например, [8] даже по истечении 3 нед. тепловой адаптации. Другие демонстрируют сдвиги, направленные на формирование более экономичного режима функционирования: уменьшение температуры ядра покоя, степени прироста ЧСС при нагрузке, но при этом различий в количестве потребленного кислорода в покое не отмечено [12, 18–20].
Различия экспериментальных данных связаны с большой вариабельностью как методик применения ПГ (способы, продолжительность и интенсивность нагревания, положение тела во время процедуры, длительность курса), так и групп испытуемых (возраст, пол, физическая подготовка, состояние здоровья, исходный уровень адаптации к тепловым воздействиям и пр.).
Цель настоящего исследования – оценка адаптивных сдвигов показателей системной гемодинамики и энерготрат здоровых молодых мужчин на однократную процедуру интенсивного прогревания, а также в курсе 10 процедур ПГ.
МЕТОДИКА
Дизайн выполненной работы – сбалансированное продольное перекрестное исследование, в которое исходно было отобрано 23 относительно здоровых молодых добровольца (мужчины, средний возраст 20.1 ± 2.3 лет, исходные масса тела 71.4 ± 11.6 кг и длина тела 178.3 ± 7.2 см). Все участники имели средний уровень ежедневной физической активности, оцененной применением русскоязычной версии опросника Global Physical Activity Questionnaire (GPAQ). Большинство имели минимальный предварительный опыт посещения сауны/бани – не регулярно и не чаще 1–2 раз в мес. (8 добровольцев сообщили о посещении сауны с частотой 2–3 раза в мес.).
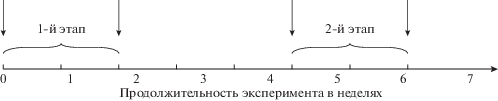
Эксперимент включал в себя два 2-недельных этапа (рис. 1), в течение которых обследуемые прошли по 10 псевдо-гипертермических (плацебо) и ПГ процедур, порядок прохождения которых был рандомизирован: 12 чел. сначала проходили курс плацебо, затем – курс ПГ, 11 других участников – наоборот, начали с процедур ПГ, а затем проходили курс плацебо.
Рис. 1.
Графическое изображение дизайна исследования. В 1-м и 2-м этапах провели по 10 процедур плацебо или пассивной гипертермии. При первой и последней процедуре каждого этапа (указаны стрелками) выполняли непрямую калориметрию.
Гипертермические плацебо-процедуры отпускались в капсуле инфракрасного прогревания “Альфа Бэйсик” (Sybaritic Inc., Minnesota, США). Во время процедуры испытуемый лежал внутри эргономичной капсулы в течение 40 мин, при этом голова находилась снаружи, с возможностью обдува прохладным воздухом вентиляторами, инсталлированными в головной конец капсулы. Температуру в капсуле для ПГ устанавливали в диапазоне 65–80°С, исходя из индивидуальной устойчивости, определяемой в тестовой процедуре. При плацебо-процедуре устанавливали температуру комфорта – 24–25°С. Участники были инструктированы посещать процедуры в первой половине дня, спустя минимум 2 ч после легкого завтрака, в достаточно гидратированном состоянии, но не пить воду/иные напитки за 20–30 мин до и в течение всей процедуры. Было рекомендовано не менять привычного режима, не заниматься интенсивными физическими тренировками в течение всего периода наблюдений.
Регистрация физиологических параметров. В динамике каждой процедуры осуществляли мониторирование значений сатурации крови кислородом (SpO2) с помощью пульсоксиметра MD300 (BCE Tech, КНР), ЧСС с датчиков нагрудного ремня Polar 610i (Финляндия). Температуру тела оценивали исходно, через 20 мин и по окончании процедуры (инфракрасный термометр AND DT-635, AND, Япония), учитывали усредненные данные двукратного измерения в обеих подмышечных областях. Аксиллярная температура в данном случае отражает температуру ядра тела, так как при прогревании повышается эффективность теплообмена между ядром и оболочкой, градиент между ними уменьшается.
До и сразу после каждой процедуры ПГ измеряли массу тела с точностью до 10 г портативным биоимпедансометром Tanita BC-601 (Tanita, Япония), кроме того, у обследуемого, находящегося в ложе капсулы, измеряли значения САД и ДАД (автоматический тонометр AND UA-767, AND, Япония).
Рассчитывали индекс физиологического напряжения (ИФН, Physiological Strain Index – PSI) за процедуру по формуле: PSI = 5(Ts – To)(39.5 – – To)–1 + 5(ЧССs – ЧССo)(180 – ЧССo)–1, где Ts и ЧССs – максимальные значения температуры тела обследуемого и ЧСС при гипертермическом стрессе, To и ЧССо – исходные значение температуры тела и ЧСС обследуемого. Диапазон вариаций ИФН: от 0 (отсутствие напряжения), 4–6 – умеренное напряжение, до 10 (максимальный гипертермический стресс) [21]. Интенсивность потоотделения (ИП) определяли по формуле: ИП = Δm/ППТ, где Δm – разница массы тела, измеренной до и сразу после процедуры, ППТ – площадь поверхности тела обследуемого.
ЭТ обследуемых за 40 мин 1-й и 10-й процедур измеряли методом непрямой калориметрии с применением газового анализатора Fitmate МЕD (COSMED, Италия). Все участники исследования предварительно прошли ознакомительное тестирование; перед каждым измерением газоанализатор подвергали автокалибровке. Регистрировали содержание кислорода в выдыхаемом воздухе и легочную вентиляцию. Оценивали частоту дыхания (ЧД, циклов/мин), минутный объем дыхания (МОД, л/мин), по стандартным метаболическим формулам рассчитывали потребление кислорода (VO2, мл/мин) и ЭТ, используя фиксированное значение дыхательного коэффициента 0.85. В динамике процедуры измерения проводили дважды по 15 мин, данные усредняли и затем производили пересчет на 40 мин.
Статистическую обработку результатов проводили с помощью программы Statistica 11.0. Данные в работе представлены как среднее и стандартное отклонение M ± SD. Проверку нормальности распределения проводили с применением критерия Колмогорова–Смирнова, для оценки достоверности внутри групп и межгрупповых различий показателей в динамике использовали одновыборочный t-критерий и критерий Манна–Уитни соответственно. Корреляции между сдвигами показателей в динамике наблюдений и их значимость оценивали непараметрическим ранговым коэффициентом корреляции Спирмена с интерпретацией значений коэффициентов как сильные (r ≥ 0.6), средней силы (r = 0.59–0.40) и слабые (r = 0.39–0.20). Различия считали значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В анализ включены результаты обследования 15 участников, завершивших полный цикл процедур (5 чел. выбыли из-за низкой приверженности к протоколу исследования, 3 – по причине острого респираторного заболевания). Все обследуемые удовлетворительно переносили процедуры ПГ.
Значения температуры тела повышались к концу процедур ПГ в среднем на 1.5–3.2°С, причем в первых трех процедурах степень прироста была в диапазоне 1.4–1.8°С, а в последующем – повышалась до 2.6–3.2°С (рис. 2). Прирост значений температуры, начиная с 4-ой процедуры, происходил более интенсивно в первые 20 мин от начала воздействия, далее изменения стабилизировались. К окончанию 4-й и всех последующих процедур температура тела достигала 39.0–39.4°С и была значимо выше, чем по завершении первой-второй процедур.
Рис. 2.
Усредненные значения температуры тела (А) и насыщения кислородом гемоглобина (SPO2) обследуемых (Б) в динамике 10 процедур пассивной гипертермии: исходно (а), через 20 мин от начала (б) и в конце процедуры (в). По оси абсцисс указан номер процедуры. На графике представлены средние значения и стандартное отклонение. Отмечены значимые различия (р < 0.05) А – по отношению к значению температуры на соответствующем этапе в первой процедуре, Б – по отношению к исходному значению.
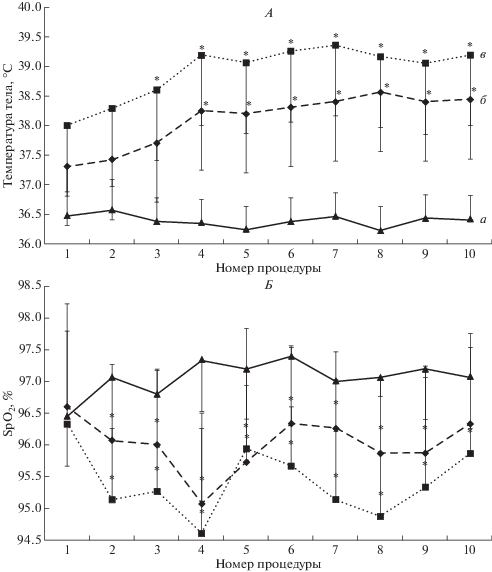
Величина SpO2 в динамике первой процедуры ПГ практически не менялась. В дальнейшем, начиная со второй процедуры, отмечена значимая десатурация крови: SpO2 достигал 94.8–95.5% (рис. 2).
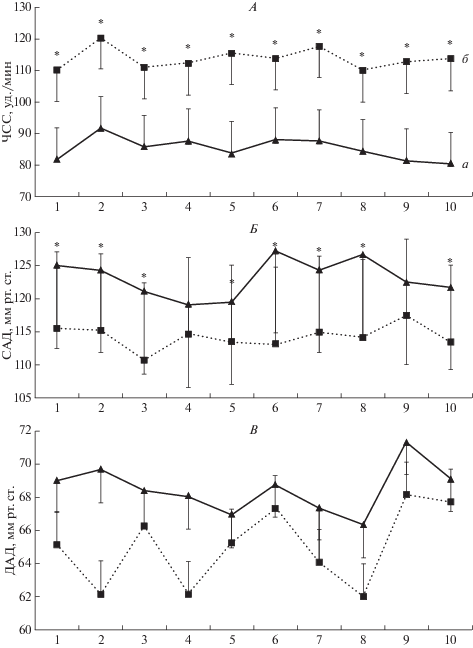
При проведении всех процедур ПГ отмечался типичный гемодинамический “ответ” в виде умеренного прироста ЧСС и снижения САД без значимых сдвигов ДАД (рис. 3), описанный ранее в работах [4, 14].
Рис. 3.
Усредненные значения показателей системной гемодинамики в динамике 10 процедур пассивной гипертермии: исходно (а) и в конце процедуры (б). А – частота сердечных сокращений (ЧСС), Б – систолическое артериальное давление (САД), В – диастолическое артериальное давление (ДАД). По оси абсцисс указан номер процедуры. На графике представлены средние значения и стандартное отклонение. Отмечены значимые различия (р < 0.05) по отношению к исходному значению.
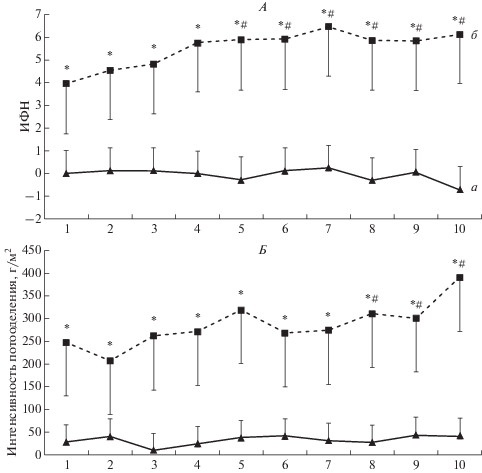
Значения интегративного показателя ИФН, отражающего степень гипертермического стресса, были закономерно выше при ПГ по сравнению с имитационными процедурами (рис. 4). В динамике курса значения ИФН значимо повышались к пятой процедуре (по отношению к значениям в первой) и далее стабилизировались, оставаясь на уровне индикаторов умеренного теплового стресса (5–6 усл. ед.). ИП в динамике плацебо-процедур оставалась минимальной, в то время как в ходе адаптации к ПГ значения ИП были закономерно выше (в среднем в 6–8 раз) (рис. 4). Начиная с восьмой процедуры, значения ИП значимо превышали данные, полученные при первой.
Рис. 4.
Усредненные значения в динамике 10 процедур плацебо (а) и пассивной гипертермии (б): А – индекса физиологического напряжения (ИФН), Б – интенсивности потоотделения. По оси абсцисс указан номер процедуры. На графике представлены средние значения и стандартное отклонение. Отмечены значимые различия (р < 0.05) по отношению к значению в процедуре плацебо (звездочка) и по отношению к значению в первой процедуре гипертермии (решетка).
Значения VO2 и ЭТ во время процедур ПГ были больше, чем в соответствующих плацебо-процедурах на 36 и 29.7% соответственно (табл. 1). При этом в динамике 10-й процедуры показатели VO2 и ЭТ зарегистрированы на значимо меньшем уровне, чем в 1-й. Активация метаболизма при гипертермии сопровождалась развитием умеренного гиперпное (значимый прирост значений МОД по отношению к данным плацебо), степень которого в 10-й процедуре ПГ снижалась.
Таблица 1.
Показатели легочной вентиляции и непрямой калориметрии при проведении процедур пассивной гипертермии и плацебо, M ± SD
| Показатель | Процедуры ПГ | Плацебо-процедуры | ||
|---|---|---|---|---|
| 1-я процедура | 10-я процедура | 1-я процедура | 10-я процедура | |
| ЧД, циклов/мин | 15.9 ± 2.7 | 16.7 ± 3.6 | 15.6 ± 3.1 | 16.5 ± 3.2 |
| МОД, л/мин | 8.8 ± 1.4 | 7.3 ± 2.1 *p = 0.007 |
6.4 ± 1.6 #p = 0.0006 |
6.1 ± 1.7 #p = 0.02 |
| VO2, мл/мин | 283.1 ± 47.9 | 231.1 ± 56.5 *p = 0.009 |
208.3 ± 50.8 #p = 0.001 |
206.9 ± 57.5 |
| Энерготраты, Ккал | 58.4 ± 8.9 | 51.1 ± 5.6 *p = 0.046 |
42.9 ± 8.4 #p = 0.0006 |
39.04 ± 8.2 *p = 0.04 #p = 0.002 |
Прирост VO2 в пересчете на повышение температуры тела на 1°С в первой процедуре составил в среднем 49.1 ± 57.5%/1°С, а прирост ЧСС 32.7 ± ± 23.1 уд./мин/1°С – по отношению к значениям соответствующей плацебо-сессии. В 10-й процедуре ПГ относительные показатели были значимо меньше, чем в первой: повышение VO2 составило 10.9 ± 11.6%/1°С (p = 0.001), а ЧСС – лишь 13.2 ± ± 7.1 уд./мин/1°С (р = 0.05).
Значимых корреляций между степенью прироста температуры тела и динамикой анализируемых метаболических показателей в первой процедуре ПГ не выявлено. При проведении 10-й процедуры ПГ выявлены связи между приростом температуры тела и объемом потребленного кислорода – r(ΔT–VО2) = 0.56, р = 0.02, а также с уровнем энерготрат r(ΔT–ЭТ) = 0.39, р = 0.07. Корреляционные связи между сдвигами показателей гемодинамики с уровнем VO2 и ЭТ не выявлены.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как следует из приведенных данных, при применяемом нами режиме ПГ адаптивные “сдвиги” гемодинамических и метаболических индикаторов на однократную процедуру и в динамике курса различны. Следует отметить, что в работе оценивали термофизиологические эффекты тепловой адаптации в пассивном режиме, т.е. без сочетания с физическими нагрузками, что более характерно для тепловой акклиматизации [22]. В отличие от последней, где сочетаются эффекты экзогенного и эндогенного тепла, в примененном режиме мы фокусировались на оценке эффектов экзогенных интенсивных (65–80°С) температурных стимулов, при этом без нагрева головы участников исследования.
Однократная процедура пассивного прогревания с повышением температуры тела испытуемых на 1.4–1.8°С сопровождалась интенсификацией метаболических процессов, что явилось ожидаемым эффектом и обусловлено, очевидно, как запуском нейроэндокринных механизмов, так и прямым действием тепла на ткани [12]. Активация метаболических процессов подтверждается также умеренной десатурацией крови кислородом, что помимо эффекта повышения температуры тканей/крови на диссоциацию гемоглобина, может быть связано с накоплением метаболитов и развитием относительного ацидоза [23, 24].
Судя по динамике значений ИФН и показателей гемодинамики, уровень индуцированного теплового стресса был умеренным. Степень прироста ЧСС при острой гипертермии (в диапазоне 35–50%) сопоставима с приростом ЧСС при физических нагрузках умеренной интенсивности. Однако, в отличие от данных [16], где отмечено существенное повышение значений АД сразу после 25-минутной процедуры сауны, процедура ПГ в нашем исследовании сопровождалась значимым снижением значений САД. Аналогичный гипотензивный эффект отмечен и в ряде других работ по исследованию срочных и долговременных адаптивных эффектов сауны [9, 17, 25]. Отмеченные противоречия относительно термоиндуцированной динамики АД могут быть связаны с различиями протоколов процедуры ПГ и сауны. Так, в работе [9] авторы считают, что в характере кардиоваскулярных реакций на тепловой стресс имеет значение положение тела при ПГ (сидя/лежа). Вероятно, существенную роль в формировании стрессорный реакции играет нагревание головы/лица и вдыхание горячего воздуха [9, 15, 23]. Так, охлаждение лица вентилятором при пассивном нагревании всего тела изменяло гемодинамику в бассейне сонной артерии [15].
Для интегральной оценки кардио-метаболических адаптивных перестроек под влиянием различных температурных стрессоров предложены индексы термальной кардиореактивности и Q10, отражающие соответственно степени изменений ЧСС и потребления кислорода при смещении температуры ядра тела человека на 1°С [3]. Показано, что в среднем при повышении температуры ядра на 1°С значения индекса термальной реактивности составляют 25–40 уд./мин, а Q10 увеличивается, отражая прирост VO2 на 7–8% от значений покоя при значительной межиндивидуальной вариабельности [26, 27]. Высказана гипотеза о том, что адаптивные термофизиологические эффекты могут проявляться в снижении значений указанных индексов, однако в единственной работе, посвященной этой проблеме, установлено, что акклиматизация в термокамерах при температуре 25–45°С в течение 3 нед. к таким изменениям не приводит [27]. Мы не определяли указанные индексы, но данные, рассчитанные на 1°С прироста температуры тела в начальной процедуре, несколько превышают результаты, полученные в работах [3, 27], а также уровень кардиальной реактивности при 30-минутных процедурах сауны [17].
В конце курса, при проведении 10-й процедуры ПГ, несмотря на более выраженный прирост температуры тела, значения VО2 и ЭТ оказались значимо ниже, чем в исходе, что свидетельствует об адаптивном снижении термо-индуцированной метаболической активности. Сходные выводы сделаны в работе [20], где также отмечено снижение ЭТ, зарегистрированных в состоянии покоя (но не при тепловом стрессе, как в нашем исследовании) после 10 процедур ПГ. Логично, что относительные показатели степени прироста VO2 и ЧСС на каждый 1°С повышения температуры тела снизились, в отличие от данных, полученных в работе [27]. При этом уровень энерготрат и VO2 достоверно коррелировал со степенью повышения температуры тела. Одним из объяснений отмеченных адаптивных сдвигов может быть снижение степени термически индуцированной симпатической активности, уровня адреналина и кортизола, что, в частности, отмечено при обследовании здоровых добровольцев после 7 дней адаптации к ПГ [28]. Прирост температуры тела, возможно, связан с интенсивной вазодилатацией. Но этот факт требует дополнительных исследований.
Мы не увидели изменений сдвигов значений гемодинамических показателей в ответ на ПГ в курсе процедур – каждое прогревание сопровождалось примерно одинаковыми уровнями развития тахикардии, снижения САД. О стабильных гемодинамических “ответах” на гипертермию свидетельствует и динамка ИФН – отмечено его повышение в диапазоне умеренного стресса во второй части курса ПГ, но преимущественно за счет прироста температуры, тогда как прирост ЧСС оставался на том же уровне. С другой стороны, есть сведения о том, что при регулярном проведении ПГ в течение двух и более недель происходит снижение как АД и ЧСС покоя [2, 6, 17], так и степени прироста ЧСС при повторном выполнении физической нагрузки [22]. По данным работы [7] такая динамика наблюдается только у физически подготовленных людей (спортсменов). В нашем же исследовании принимали участие здоровые нетренированные добровольцы. Кроме того, возможно, курс адаптации к ПГ был недостаточно продолжительным для формирования устойчивых адаптивных гемодинамических перестроек при термическом стрессе.
Подтверждением развития адаптации терморегуляторных механизмов в курсе ПГ является повышение ИП – во время 10-й процедуры значения оказались в среднем на 40% выше, чем в первой, что может быть связано с улучшением кровоснабжения кожи и активацией периферических терморецепторов за счет значимого нагревания. Кроме того, взаимосвязь регуляции процесса потоотделения с метаболизмом подтверждает тот факт, что при тепловой адаптации фактически одновременно с повышением интенсивности потения происходит изменение состава пота, в частности уменьшение уровня лактата [29]. Предполагаемая кожная вазодилатация при ПГ в замкнутом пространстве капсулы может быть обусловлена рефлекторными механизмами, прямым воздействием тепла и образованием гуморальных регуляторов. Основными стимулами к их выделению является напряжение сдвига эндотелия и метаболиты, в том числе образующиеся в потовых железах [7, 24]. Ранее показано, что в процессе адаптации к ПГ улучшается реактивность сосудов, в том числе, за счет эндотелиальной функции, что способствует снижению АД и повышению периферического кровотока [1, 7].
ЗАКЛЮЧЕНИЕ
Однократная процедура ПГ в капсуле инфракрасного нагревания тела (без воздействия на голову) длительностью 40 мин, сопровождается повышением интенсивности метаболизма в среднем на 36% по сравнению с плацебо-процедурой, развитием умеренного теплового стресса, понижением САД. Проведение 10 процедур ПГ в течение двух недель вызывает адаптивные изменения терморегуляторных механизмов, которые проявляются в уменьшении прироста ЭТ и увеличении ИП. При этом сдвиги показателей системной гемодинамики оставались на одном уровне. Таким образом, при использовании курса процедур ПГ в указанном режиме у здоровых добровольцев наблюдаются выраженные адаптивные метаболические сдвиги без развития существенной стрессорной реакции со стороны системной гемодинамики, что свидетельствует об эффективности и безопасности выбранной методики. Полученные результаты демонстрируют отсутствие прямой взаимосвязи между величиной энерготрат и показателями системной гемодинамики во время гипертермических процедур.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский университет) (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа частично поддержана грантом РФФИ № 19-013-00465 А “Прямые и перекрестные эффекты адаптации к системной гипертермии: влияние на качество жизни, нейро-гормональный и психофизиологический статус человека”.
Благодарности. Авторы выражают благодарность всем добровольцам – участникам исследования, а также компании “Sybaritic Inc.” (США) за предоставленные безвозмездно термокапсулы “Альфа Бэйсик” для проведения гипертермических процедур. Компания и ее представители не участвовали в дизайне исследования, сборе, анализе и интерпретации данных, подготовке публикации.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Cohen M. Turning up the heat on COVID-19: heat as a therapeutic intervention // F1000Res. 2020. V. 9. P. 292.
Heathcote S.L., Hassmén P., Zhou S., Stevens C.J. Passive Heating: Reviewing Practical Heat Acclimation Strategies for Endurance Athletes // Front. Physiol. 2018. V. 9. P. 1851.
Ihsan M., Périard J.D., Racinais S. Integrating Heat Training in the Rehabilitation Toolbox for the Injured Athlete // Front. Physiol. 2019. V. 10. P. 1488.
Глазачев О.С., Кофлер В., Дудник Е.Н. и др. Влияние адаптации к пассивной гипертермии на аэробную работоспособность и кардио-респираторную выносливость у спортсменов-любителей // Физиология человека. 2020. Т. 46. № 1. С. 66. Glazachev O.S., Kofler W., Dudnik E.N. et al. Impact of Adaptation to Passive Hyperthermia on Aerobic Performance and Cardio-Respiratory Endurance in Amateur Athletes // Human Physiology. 2020. V. 46. № 1. Р. 66.
Hussain J., Cohen M. Clinical Effects of Regular Dry Sauna Bathing: A Systematic Review // Evid. Based Complement. Alternat. Med. 2018. V. 2018. P. 1857413.
Brunt V.E., Howard M.J., Francisco M.A. et al. Passive heat therapy improves endothelial function, arterial stiffness and blood pressure in sedentary humans // J. Physiology. 2016. V. 594. № 18. P. 5329.
Gravel H., Behzadi P., Cardinal S. et al. Acute vascular benefits of Finnish sauna bathing in patients with stable coronary artery disease // Can. J. Cardiol. 2021. V. 37. № 3. P. 493.
Kampmann B., Bröde P. Heat Acclimation Does Not Modify Q10 and Thermal Cardiac Reactivity // Front. Physiol. 2019. V. 10. P. 1524.
Podstawski R., Borysławski K., Clark C.C.T. et al. Correlations between Repeated Use of Dry Sauna for 4 × × 10 Minutes, Physiological Parameters, Anthropometric Features, and Body Composition in Young Sedentary and Overweight Men: Health Implications // Biomed Res. Int. 2019. V. 2019. P. 7535140.
Kim K., Monroe J.C., Gavin T.P., Roseguini B.T. Skeletal muscle adaptations to heat therapy // J. Appl. Physiol. (1985). 2020. V. 128. № 6. P. 1635.
Gryka D., Pilch W.B., Czerwińska-Ledwig O.M. et al. The influence of Finnish sauna treatments on the concentrations of nitric oxide, 3-nitrotyrosine and selected markers of oxidative status in training and non-training men // Int. J. Occup. Med. Envir. Health. 2020. V. 33. № 2. P. 173.
Pilch W., Szyguła Z., Klimek A. et al. Changes in the lipid profile of blood serum in women taking sauna baths of various duration // Int. J. Occup. Med. Envir. Health. 2010. V. 23. № 2. P. 167.
Бакулин В.С., Макаров В.И., Богомолова М.М., Панина Н.Г. Физиологические критерии регламентации уровня гипертермического воздействия сауны // Вестник ВолГМУ. 2007. Т. 3. № 23. С. 6.
Глазачев О.С., Крыжановская С.Ю., Дудник Е.Н. и др. Адаптация к пассивной гипертермии: влияние на субъективные характеристики качества жизни, тревожности и уровень мозгового нейротрофического фактора (BDNF) // Рос. физиол. журн. им. И.М. Сеченова. 2019. Т. 105. № 5. С. 544.
Nakata H., Namba M., Kakigi R., Shibasaki M. Effects of face/head and whole-body cooling during passive heat stress on human somatosensory processing // Am. J. Physiol. Regul. Integr. Comp Physiol. 2017. V. 312. № 6. P. 996.
Ketelhut S., Ketelhut R.G. The blood pressure and heart rate during sauna bath correspond to cardiac responses during submaximal dynamic exercise // Complement. Ther. Med. 2019. V. 44. P. 218.
Li Z., Jiang W., Chen Y. et al. Acute and short-term efficacy of sauna treatment on cardiovascular function: A meta-analysis // Eur. J. Cardiovasc. Nurs. 2020. V. 20. № 2. P. 96.
Mang Z.A., Fennel Z.I., Realzola R.A. et al. Heat acclimation during low-intensity exercise increases VO2max and Hsp72, but not markers of mitochondrial biogenesis and oxidative phosphorylation in skeletal tissue // Exp. Physiol. 2021. V. 106. № 1. P. 290.
Pallubinsky H., Phielix E., Dautzenberg B. et al. Passive exposure to heat improves glucose metabolism in overweight humans // Acta Physiol. 2020. V. 229. № 4. P. 1.
Pallubinsky H., Schellen L., Kingma B.R.M. et al. Thermophysiological adaptations to passive mild heat acclimation // Temperature. 2017. V. 4. № 2. P. 176.
Moran D.S., Shitzer A., Pandolf K.B. A physiological strain index to evaluate heat stress // Am. J. Physiol. Regul. Integr. Comp. Physiol. 1998. V. 275. № 1. P. R129.
Périard J.D., Travers G.J.S., Racinais S., Sawka M.N. Cardiovascular adaptations supporting human exercise-heat acclimation // Auton. Neurosci. 2016. V. 196. P. 52.
Зинчук В.В., Жадько Д.Д. Эффект сауны на кислородтранспортную функцию крови и прооксидантно-антиоксидантный баланс у нетренированных лиц // Физиология человека. 2012. Т. 38. № 5. С. 112. Zinchuk V.V., Zhadko D.D. The effect of a sauna on blood oxygen transport and the prooxidant-antioxidant balance in untrained subjects // Human Physiology. 2012. V. 38. № 5. Р. 548.
Литвицкий П.Ф. Нарушения теплового баланса организма: гипертермия, гипетермические реакции, тепловой удар, солнечный удар // Вопросы современной педиатрии. 2010. Т. 9. № 1. С. 96.
Laukkanen T., Kunutsor S.K., Zaccardi F. et al. Acute effects of sauna bathing on cardiovascular function // J. Hum. Hypertens. 2018. V. 32. № 2. P. 129.
Dubé P.-A., Imbeau D., Dubeau D., Auger I. Worker heat stress prevention and work metabolism estimation: comparing two assessment methods of the heart rate thermal component // Ergonomics. 2019. V. 62. № 8. P. 1066.
Kampmann B., Bröde P. Metabolic costs of physiological heat stress responses – Q10 coefficients relating oxygen consumption to body temperature // Extrem. Physiol. Med. 2015. V. 4. P. A103.
Tomiyama C., Watanabe M., Honma T. et al. The effect of repetitive mild hyperthermia on body temperature, the autonomic nervous system, and innate and adaptive immunity // Biomed Res. 2015. V. 36. № 2. P. 135.
Klous L., De Ruiter C., Alkemade P. et al. Sweat rate and sweat composition during heat acclimation // J. Therm. Biol. 2020. V. 93. P. 102 697.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


