Физиология человека, 2022, T. 48, № 2, стр. 51-60
Восприимчивость к МСК-опосредованной иммуномодуляции клеток адаптивного иммунитета здоровых добровольцев, подвергавшихся воздействию длительной “сухой” иммерсии
А. Н. Горностаева 1, *, А. Ю. Ратушный 1, Л. Б. Буравкова 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: HindIII@yandex.ru
Поступила в редакцию 06.07.2021
После доработки 06.08.2021
Принята к публикации 21.09.2021
- EDN: CKAYRY
- DOI: 10.31857/S0131164622020084
Аннотация
В ходе 21-суточной “сухой” иммерсии (СИ) у здоровых испытуемых была исследована чувствительность Т-клеток к МСК-опосредованной иммуносупрессии in vitro. После СИ в ФГА-стимулированных Т-клетках возрастала экспрессия маркера поздней активации (HLA-DR), увеличивалась паракринная активность, снижалась пролиферация, баланс Th1/Th2 смещался в сторону Th1. МСК проявляли иммуносупрессивные свойства при сокультивировании с Т-клетками здоровых обследуемых как в фоновом периоде, так и при воздействии СИ, подавляя позднюю активацию, пролиферацию, и сдвигая баланс цитокинов в сторону Th2. Однако их антипролиферативный эффект не всегда был выражен и зависел от начальной способности Т-клеток отвечать на митоген. Кроме того, выявлена способность МСК сглаживать эффекты СИ.
В настоящее время в связи с развитием пилотируемой космонавтики и перспективами осуществления полетов человека на Луну и Марс, наряду с техническими задачами, не менее важной является задача обеспечения здоровья космонавтов. Известно, что в длительном орбитальном полете на человека воздействует ряд неблагоприятных факторов, таких как перегрузки, космическая радиация, психологический стресс, микрогравитация, замкнутая среда обитания, гипокинезия и др. Воздействие этих факторов негативно влияет на иммунную систему [1, 2], а адаптация, происходящая в ответ на стрессорные нагрузки, приводит к напряженности функционирования этой системы, и, как следствие, иммунной дисрегуляции [3]. Это, в свою очередь, вызывает снижение функциональной и адаптивной активности иммунных клеток, истощение резервных возможностей, из-за чего происходит увеличение частоты рецидивов вирусных заболеваний, активизация условно-патогенной микрофлоры, усиление воспалительных и аллергических реакций [2, 4–9]. Изучение влияния факторов космического полета (КП) на иммунную систему и поиски способов ее стабилизации, имеет большое значение для развития системы медицинского обеспечения КП.
Одной из наземных моделей для изучения физиологических эффектов микрогравитации является “сухая” иммерсия (СИ). Она моделирует часть факторов КП, создавая условия ортостатической и опорной разгрузки, гипокинезии и пе-рераспределение жидкостей в организме [10, 11].
Ранее было установлено, что СИ приводит к снижению функциональной активности популяций клеток, отвечающих за адаптивный и врожденный иммунитет. В условиях СИ в периферической крови испытателей снижалось общее количество естественных киллеров (ЕК) и В-клеток, гранулоцитов с фенотипом TLR4+, моноцитов. При этом повышалось общее количество лейкоцитов, в том числе гранулоцитов и лимфоцитов, уровень которых возрастал за счет популяций CD3+ и CD4+ клеток [12–17]. В периоде реадаптации обнаружено увеличение содержания CD4+ Т-клеток [15]. Относительный популяционный состав клеток крови также претерпевал изменения: увеличивалась доля популяций Т- и В-лимфоцитов [12, 16, 17], доля TLR2+, TLR4+ TLR5+, TLR6+, TLR9+ моноцитов, происходило изменение соотношений субпопуляций ЕК [13], снижалась доля CD8+ Т-клеток [17]. Происходило снижение экспрессии Т-клетками раннего активационного маркера CD69 в ответ на стимуляцию фитогемагглютинина (ФГА) [12, 17], а доля Т-клеток, экспрессирующих маркер активации CD25, повышалась [14, 15]. У обследуемых, находящихся в условиях СИ, наблюдалось общее увеличение паракринной активности иммунными клетками, измеряемой как в плазме крови, так и in vitro. В частности, начиная с 7-х суток воздействия у большинства обследуемых повышался уровень IFNg, IL-2, TNFb, а синтез цитокинов TLR+CD14+ клетками при стимуляции лигандами снижался [17], снижалась продукция IL-8 и IL-1b в 24-суточной культуре Т-клеток [14]. При определении баланса Th2 в плазме крови показано его смещение в сторону Th2 [18].
Как видно, воздействие факторов, моделируемых в СИ, затрагивает функциональную активность практически всех типов иммунных клеток. Одним из возможных способов минимизации этого воздействия может быть использование мультипотентных мезенхимальных стромальных клеток (МСК), которые обладают способностью модулировать иммунный ответ. В настоящее время эти клетки используются для терапии заболеваний, связанных с аутоиммунными, острыми и хроническими воспалительными процессами, а также для подавления реакции трансплантат против хозяина [19–21]. In vitro показано, что МСК воздействуют на все типы иммунных клеток подавляя пролиферацию Т-, В-клеток и ЕК, активацию Т- и В-клеток, снижая цитотоксичность ЕК и т.д. [22–25]. При этом, если иммунные клетки не стимулированы in vitro, МСК поддерживают их интактное состояние, снижая долю апоптотических клеток, не вызывая иммунного ответа с их стороны [26–28]. Таким образом, МСК могут как поддерживать гомеостаз иммунных клеток, так и проявлять супрессорную активность, в зависимости от исходного состояния иммуноцитов.
Целью данной работы было изучить способность МСК модулировать иммунный ответ Т-клеток здоровых обследуемых в условиях СИ, а также выяснить эффективность применения МСК для снижения негативного влияния на иммунную систему факторов, моделируемых в СИ.
МЕТОДИКА
В экспериментах использовали МСК стромально-васкулярной фракции из коллекции лаборатории.
МСК размораживали, помещали в СО2 инкубатор с атмосферной концентрацией кислорода (5% СО2 + 95% воздуха (20% О2), 37°С, 100% влажности) и культивировали в среде α-MEM, с 10% эмбриональной телячьей сыворотки (ЭТС, HyClone, США) и 1% пенициллина/стрептомицина (Gibco, США).
В эксперименте использовали венозную кровь шести добровольцев (здоровые мужчины в возрасте от 24 до 32 лет, получившие допуск врачебно-экспертной комиссии), участвовавших в эксперименте СИ. Кровь отбирали натощак в утренние часы в следующих временны́х точках: фон (2-е сутки до начала эксперимента), 7-е и 21-е сут (во время экспериментального воздействия), +7 сут (период восстановления, через семь дней после завершения эксперимента). Условия эксперимента подробно описаны ранее [10].
Мононуклеары выделяли на градиенте плотности (ρ = 1.077, Гистопак, Sigma–Aldrich, США) согласно инструкции производителя. Выделение популяции CD3+ клеток методом магнитной сепарации проводили по методике производителя (Miltenyi Biotec, Германия). Часть полученных клеток окрашивали антителами CD3-FITC (BD Bioscience, США) и оценивали долю положительных клеток с помощью проточного цитофлуориметра Accuri C6 (BD Bioscience, США). Выделенные Т-клетки культивировали в полной среде RPMI 1640 (Gibco, США), содержащей 2 мМ L-глутамина (Gibco, Россия), 1% пенициллина/стрептомицина (Gibco, США), 5% инактивированной ЭТС (HyClone, США). Для активации Т-клеток в среду добавляли фитогемагглютинин (ФГА, Sigma, США) в конечной концентрации 10 мкг/мл.
Т-лимфоциты добавляли к МСК 3-го пассажа, достигшим состояния монослоя. Соотношение МСК/Т-лимфоциты во всех экспериментах составляло 1 : 10. Время сокультивирования – 72 ч. После взаимодействия Т-лимфоциты отбирали для анализа.
Пролиферативную активность Т-клеток определяли с помощью йодида пропидия (PI) (Sigma, США) по доле клеток, находящихся в G2M фазе клеточного цикла, используя методику SubG1, описанную для метода проточной цитофлуориметрии в протоколах BD Bioscience (США).
Позднюю активацию оценивали по доле Т-клеток, экспрессирующих HLA-DR, используя антитела CD3-FITC/HLA-DR-PE (BD Bioscience, США), в качестве изотипического контроля использовали IgG-PE/IgG-FITC (BD Bioscience, США).
Анализ цитокинового профиля монокультур Т-клеток, МСК и сокультуры после взаимодействия выполняли с помощью коммерческого набора для мультиплексного анализа цитокинов, хемокинов и факторов роста Cyto/Chemo MAG Premix 41 Milliplex, Merсk (Millipore, Германия), определяющего содержание IL-8, IL-4, VEGF, MCP-1, MIP-1a, MIP-1b, Eotaxin, TNFa, IFNg, TNFb, IL-2, MCP-3, GM-CSF GRO, IL-6, FGF-2 IP-10, RANTES, Fractalkine, MDC, IFNa2, IL-10 и др. Для анализа образцов использовали систему MagPix на базе мультиплексного флуоресцентного иммуноанализатора MAGPIX (Millipore, Германия), позволяющую детектировать до 50 мишеней в одном образце.
Для статистической обработки данных использовали программное обеспечение GraphPad Prism 7, критерий Two-way ANOVA (с последующим применением критерия Тьюки). Отличия считались значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Характеристика Т-клеток в монокультуре при активации in vitro. Важным показателем ответа Т-клеток на митоген является экспрессия на их поверхности молекул антигена главного комплекса гистосовместимости II класса (МНС II), которые детектируются с помощью антител HLA-DR и являются поздним маркером активации [29, 30].
В фоновом периоде лимфоциты всех обследуемых выраженно реагировали на стимуляцию митогеном (ФГА), в результате экспрессия HLA-DR на поверхности Т-клеток возрастала. Доля активированных клеток в фоновых точках составляла 10–30% в зависимости от индивидуальной реакции обследуемого.
Способность Т-клеток активироваться в ответ на ФГА увеличивалась при нахождении обследуемого в условиях СИ. Увеличение доли активированных Т-клеток у двух обследуемых происходило на 7-е сутки, а у трех – на 21-е. У одного обследуемого под воздействием иммерсии наблюдался небольшой спад, а в периоде реадаптации происходило увеличение (рис. 1). Через 7 сут после завершения СИ у всех обследуемых происходило восстановление, причем у двух из них с превышением фоновых значений (рис. 1).
Рис. 1.
Динамика изменения поздней активации Т-клеток в моно- и сокультуре с мезенхимальными стромальными клетками (МСК). Указана доля CD3-положительных клеток, экспрессирующих маркер активации HLA-DR. Данные представлены отдельно по каждому обследуемому (n = 6).
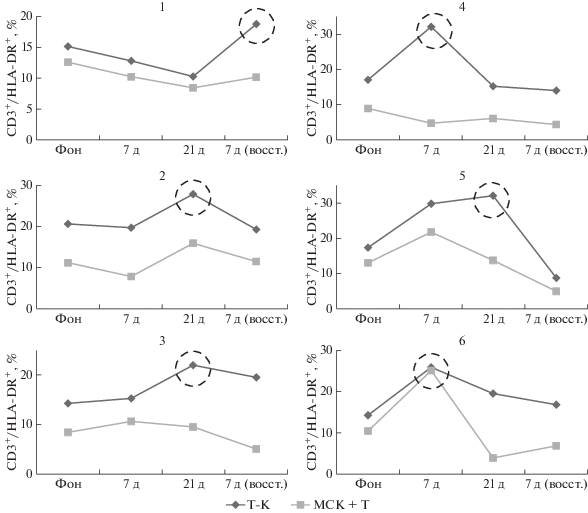
В целом, можно сказать, что СИ приводит к возрастанию способности Т-клеток активироваться по маркеру HLA-DR в ответ на митоген. В период реадаптации способность к активации восстанавливается до уровней, сопоставимых с фоновыми. Эти данные согласуются с ранее полученными результатами, показывающими повышение экспрессии другого маркера активации (CD25) на Т-клетках в ответ на стимуляцию антителами при воздействии СИ [14]. Очевидно, что в СИ происходит сенситизация Т-клеточного звена, что может свидетельствовать о большей напряженности иммунной системы.
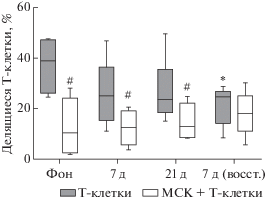
Еще одним важным показателем функциональной активности Т-клеток, является их пролиферация в ответ на стимуляцию митогеном. Клетки всех обследуемых показали выраженный ответ на митоген, в фоновом периоде доля делящихся Т-клеток на третьи сутки после добавления ФГА составляла от 25 до 50% (рис. 2). Во время СИ пролиферативная активность Т-клеток in vitro снижалась, начиная с 7-го дня воздействия у всех обследуемых (кроме одного), и продолжала падать относительно фона на всем протяжении СИ. У пяти обследуемых этот эффект сохранялся даже в восстановительном периоде. В связи с большими индивидуальными различиями в реакции Т-клеток обследуемых на митоген, статистически достоверным (р < 0.05) было только снижение в периоде реадаптации (рис. 2).
Рис. 2.
Динамика изменения пролиферативной активности Т-клеток в моно- и сокультуре с мезенхимальными стромальными клетками (МСК). * – достоверное отличие по сравнению с фоновым значением (р < 0.05), # – достоверное отличие по сравнению с монокультурой Т-клеток (р < 0.05).
Аналогичные результаты были получены ранее при моделировании условий микрогравитации с помощью клиностатирования: уменьшение доли делящихся клеток происходило в культурах CD4+ и CD8+ Т-лимфоцитов, стимулированных митогенами ФГА и КонА [31, 32]. Также при изучении влияния факторов КП показано снижение пролиферативной активности лимфоцитов, стимулированных ФГА, у космонавтов после полетов разной длительности, по сравнению с предполетными показателями. Кроме того в Т-клетках снижался синтез РНК и ДНК. Для восстановления показателей требовался период от 7 до 21 сут [33]. По-видимому, адаптация к воздействию факторов КП приводила к падению пролиферативного потенциала Т-клеток. Таким образом, воздействие СИ на человека снижает способность Т-клеток к бласттрансформации в ответ на пролиферативные стимулы. Причем эффект усугубляется с течением времени, а для полного восстановления семидневного периода может быть недостаточно.
Стимулированные ФГА Т-клетки в фоновом периоде секретировали широкий спектр цитокинов. В кондиционированной среде на низком уровне (от 5 до 50 пкг/мл) детектировались IFN‑a2, MCP-3, IL-2, IL-1RA и IL-5. Содержание цитокинов TNFb, sCD40L, Fractalkine, IL-1b, IL-13, IL-17A, IL-10, MCP-1, IL-4, IL-6 и IP-10 в среде составило от 50 до 500 пкг/мл. В наибольшем количестве Т-клетки секретировали TNFa, IFNg, GM-CSF, GRO, MDC, RANTES, MIP-1a, MIP-1 и IL-8, концентрация которых могла достигать до 10 000 пкг/мл.
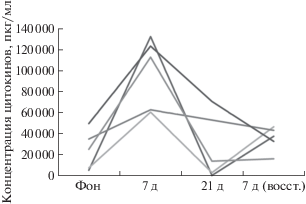
Динамика изменения продукции и уровень цитокинов, секретируемых in vitro Т-клетками, выделенными из венозной крови во время СИ, значительно отличались у участников эксперимента. Например, концентрация в кондиционированной среде такого провоспалительного цитокина как IFNg варьировала от 1000 до 10 000 пкг/мл. Просуммировав концентрации всех цитокинов, производимых Т-клетками, мы получили кривую, отражающую изменения общей паракринной активности по временны́м точкам. Оказалось, что динамика суммарной секреции у всех обследуемых, несмотря на разный уровень продукции цитокинов, очень схожа (рис. 3).
При воздействии СИ Т-клетки в ответ на стимуляцию ФГА секретировали существенно больше цитокинов, чем при аналогичной стимуляции в фоновом периоде. Кратность увеличения суммарного количества цитокинов в среде достигала десятки раз. Пик увеличения у всех обследуемых приходился на 7-е сутки воздействия. К 21-му дню уровень цитокинов падал до уровня значений близких к фоновым. В восстановительном периоде у большинства обследуемых не наблюдалось резкого колебания содержания растворимых факторов в среде. Однако у двух обследуемых было показано возрастание паракринной активности на 7-е сутки после окончания СИ (рис. 3).
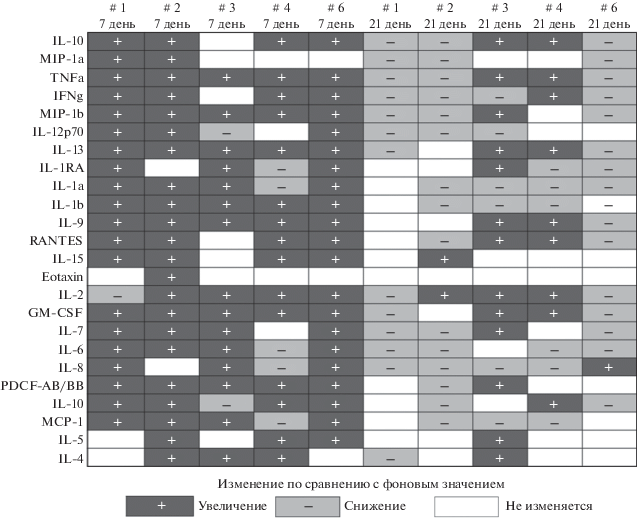
При анализе изменения уровня каждого цитокина в отдельности выяснилось, что вклад в динамику достигался за счет как про-, так и противовоспалительных медиаторов, а также растворимых факторов, участвующих в разных биологических процессах (рис. 4). Это указывает на повышение чувствительности Т-клеток к стимуляции митогеном ФГА, в течение первых семи дней воздействия СИ. Затем паракринная активность клеток нормализуется и восстанавливается до уровня близкого к фоновому.
Рис. 4.
“Тепловая карта”, характеризующая направленность изменений продукции основных цитокинов Т-клетками обследуемых на 7-й и 21-й день воздействия СИ по сравнению с фоновыми значениями.
Важной характеристикой иммунного ответа Т-клеток, связанной с паракринной активностью, является не только уровень секреции растворимых факторов, но и их баланс. Хелперное звено Т-клеток действует по принципу антагонистов, которыми являются клетки Th1 и Th2 типов. Th1-лимфоциты активируют клеточный иммунитет, а Th2 – гуморальный, синтезируя разный спектр цитокинов: Th1 – преимущественно TNFa, IFNg, TNFb, IL-2, а Th2 – IL-4, IL-5, IL-9, IL-10, IL-13 [34–36]. При определении Th1/Th2 баланса берется отношение суммарной продукции цитокинов Th1 к суммарной продукции цитокинов Th2. В ответ на воздействия различных факторов в функционировании иммунной системы могут происходить изменения, что, в свою очередь, вызывает смещение баланса Th1/Th2. Избыточное смещение нежелательно в обоих случаях, так изменения в сторону Th1 чреваты аутоиммунными заболеваниями, а Th2 – аллергическими [37, 38].
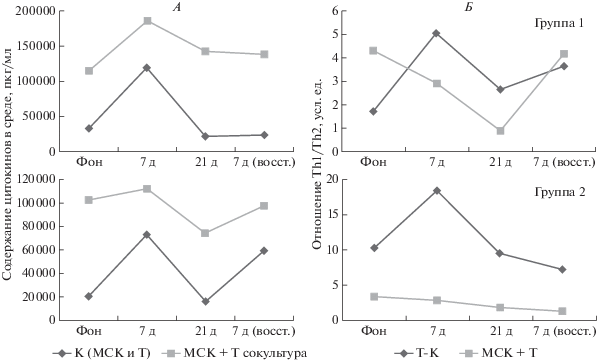
Соотношение Th1/Th2 для Т-клеток в фоновом периоде варьировало в зависимости от индивидуальной реакции обследуемого на митоген ФГА и составляло от 2 до 10. В условиях СИ смещение баланса в культуре Т-клеток в Th1-направлении значительно усиливалось (в 2–3 раза). Это изменение было ярко выражено на 7-е сутки воздействия, затем эффект снижался и к 21-му дню СИ приближался к фоновым значениям. В периоде реадаптации реакцию Т-клеток можно было условно поделить на две группы: в группе 1 смещение в сторону Th1 снова начинало усиливаться, а в группе 2, напротив, снижалось (рис. 5, Б). Оказалось, что Т-клетки обследуемых в этих группах отличаются по балансу Th1/Th2 в фоновом периоде. В группе 1 соотношение Th1/Th2 не превышало 5, а в группе 2 было достаточно высоким и достигало 20 кратного уровня (рис. 5, Б). Таким образом, динамика восстановления Th1/Th2 баланса после СИ зависела от исходного соотношения у испытателей в фоновом периоде.
Рис. 5.
Изменение паракринного профиля Т-клеток в моно- и сокультуре с мезенхимальными стромальными клетками (МСК). А – динамика изменения суммарной продукции цитокинов. Данные репрезентативных обследуемых. Б – изменение Th1/Th2 баланса в кондиционированной среде.
Ранее увеличение секреторной активности лимфоцитов было отмечено как после воздействия СИ, так и после КП. Так на 7-е сутки в условиях СИ было показано увеличение лимфоцитами продукции IFNg, TNFa, IL-2, IL-1b, IL-6, IL-8, которое могло сохраняться и в периоде реадаптации [17]. У большинства космонавтов выявлена повышенная секреция иммунными клетками IFNg, IL-2 после длительных КП [33].
Таким образом, изменение паракринного ответа Т-клеток на стимуляцию ФГА при воздействии СИ говорит о значительном сдвиге функционального состояния иммунной системы. Повышение уровня секретируемых цитокинов в целом, и смещение баланса в сторону Th1 в частности, может свидетельствовать о провоспалительной реакции иммуннокомпетентных клеток.
Влияние сокультивирования с МСК на активацию Т-клеток in vitro. Снижение на поверхности Т-клеток экспрессии антигена главного комплекса гистосовместимости II класса (HLA-DR) при сокультивировании с МСК – один из примеров проявления их иммуносупрессивной активности [39, 40]. В фоновом периоде МСК успешно осуществляли иммуносупрессию в отношении Т‑лимфоцитов всех обследуемых. Доля Т-клеток, несущих маркер активации HLA-DR, снижалась в 1.5–2 раза. МСК подавляли позднюю активацию Т-клеток, отобранных в различные периоды воздействия СИ, за исключением случаев, когда способность Т-клеток реагировать на стимул резко возрастала. Так, не происходило супрессии на 7-е сутки у шестого обследуемого, когда доля HLA-DR-положительных Т-клеток в монокультуре увеличивалась в 2.5 раза. Стоит отметить, что Т-клетки одного из участников слабо поддавались модулированию активации со стороны МСК. Активация лимфоцитов у него в ответ на стимул была невысокой и, в отличие от остальных обследуемых, снижалась под воздействием СИ. Возможно, при таком уровне активации было недостаточно стимулов для проявления иммуносупрессивных свойств МСК (рис. 1). В целом, можно сказать, что Т-клетки испытателей, подвергающихся СИ, сохраняют чувствительность к иммуномодуляторному воздействию МСК, выявляемому при оценке экспрессии HLA-DR.
Способность МСК подавлять пролиферацию стимулированных лимфоцитов является основным показателем их иммуносупрессивной активности [24, 41, 42]. При сокультивировании с Т-клетками МСК обладали выраженным антипролиферативным эффектом в отношении лимфоцитов всех обследуемых в фоновом периоде. В условиях СИ МСК сохраняли способность подавлять деление Т-клеток (снижение доли делящихся клеток в среднем составляло 50%, р < 0.05). Исключением являлись временны́е периоды, когда лимфоциты резко реагировали на условия, моделирующие эффекты микрогравитации. Так, при снижении доли делящихся клеток до уровня 10% (что происходило у нескольких обследуемых в периоде реадаптации) МСК проявляли свои супрессивные свойства довольно слабо или не проявляли совсем (рис. 2).
Таким образом, МСК в целом сохраняют иммуносупрессивные свойства, но при резкой реакции Т-клеток испытуемого на СИ могут не проявлять их. Это может быть связано с изменениями в активации и секреции растворимых факторов, поскольку выраженный ответ иммунных клеток на митоген необходим для “праймирования” МСК и проявления их супрессивных свойств.
Для определения влияния МСК на цитокиновый профиль ФГА-стимулированных Т-клеток, также была проанализирована суммарная продукция растворимых факторов. Однако, поскольку многие из факторов секретируют не только Т-клетки, но и МСК, в качестве контроля была взята сумма продукции монокультур Т-клеток и МСК. Содержание цитокинов в среде сокультивирования сравнивалось с их суммарным уровнем в среде от активированных ФГА монокультур. Оказалось, что при взаимодействии общая продукция цитокинов была выше, а динамика изменений была такой же, как и в монокультуре Т-клеток. При этом на 7-е сутки воздействия СИ происходила стимуляция паракринной активности, затем ее спад на 21-е сутки. У некоторых испытуемых в периоде реадаптации снова была обнаружена стимуляция секреции цитокинов. Взаимодействие с МСК уменьшало колебания в динамике изменений (рис. 5, А).
Анализ Th1/Th2 показал, что МСК сдвигают баланс в сторону Th2, сглаживая эффекты СИ, при соотношении Th1/Th2 больше 5 (Группа 1). Стоит отметить, что смещение баланса в сторону Th2 при сокультивировании с МСК является одним из проявлений их иммуносупрессивных свойств (рис. 5, Б). Так, показано, что in vitro МСК вызывают смещение функциональной активности иммунных клеток от субпопуляции Th1, продуцирующей провоспалительные IL-2 и IFNg, в сторону Th2, выделяющей противовоспалительные IL-4 и IL-10 [43].
Т-клетки, для которых соотношение Th1/Th2 составляло менее 5, демонстрировали разнонаправленные изменения. МСК в фоновом периоде при сокультивировании сдвигали баланс в сторону Th1, а при увеличении соотношения Th1/Th2 в ходе адаптации к условиям СИ смещали его к Th2. Полученные данные указывают на то, что МСК, благодаря иммуномодуляторным свойствам, могут частично компенсировать влияние СИ на паракринную активность Т-клеток.
Таким образом, в условиях СИ изменяется способность Т-клеток отвечать на стимуляцию митогеном. Повышение активации и секреции растворимых факторов говорит о напряженности функционирования иммунной системы и ее сенситизации. Уменьшение доли делящихся клеток, в свою очередь, может указывать на некоторое истощение резервных возможностей иммуноцитов и снижение их функциональной активности. Данные исследования согласуются с описанными ранее результатами, полученными не только в модели СИ, но и при моделировании микрогравитации in vitro и в условиях КП [3, 18, 32].
При сокультивировании с Т-клетками МСК не только успешно реализовывали иммуносупрессивные свойства, но и частично компенсировали эффекты СИ. Полученные данные открывают перспективы применения МСК для модуляции провоспалительной реакции и минимизации последствий воздействия КП на иммунную систему человека. Однако обнаруженные существенные индивидуальные различия в реакции испытуемых как на условия СИ, так и на МСК, делают необходимым более глубокое изучение связи между исходным состоянием иммунной системы и ее ответом на воздействие экзогенных факторов.
ВЫВОДЫ
1. При воздействии СИ у обследуемых изменяется ответ Т-клеток на митоген ФГА, что in vitro выражается в снижении их пролиферации, повышении экспрессии маркеров поздней активации и секреции паракринных факторов, смещении Th1/Th2 баланса цитокинов. Динамика реакции Т-клеток на условия СИ во многом зависит от индивидуальных особенностей иммунной системы обследуемого.
2. ФГА-стимулированные Т-клетки обследуемых, находящихся в условиях СИ сохраняют восприимчивость к иммуномодуляторному воздействию МСК; в результате происходит подавление активации, пролиферации и смещение Th1/Th2 баланса в сторону Th2. Взаимодействие с МСК частично компенсирует эффекты СИ на Т‑клетки.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, утверждены на заседании ученого совета (протокол № 6 от 27.06.2018) и одобрены комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва) (протокол от 30.09.2018 г.).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Анализ функционального состояния иммунных клеток in vitro выполнен при поддержке Темы 65.3 Плана фундаментальных исследований ГНЦ РФ – ИМБП РАН (Москва). Организация и проведение “сухой” иммерсии выполнена при поддержке РНФ (грант № 18-75-10 086).
Благодарности. Авторы статьи выражают искреннюю благодарность организаторам эксперимента “сухая” иммерсия и добровольцам, принимавшим участие в исследовании.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Рыкова М.П. Иммунная система у российских космонавтов после орбитальных полетов // Физиология человека. 2013. Т. 39. № 5. С. 126. Rykova M.P. Immune system of russian cosmonauts after orbital space flights // Human Physiology. 2013. V. 39. № 5. P. 557.
Morukov B., Rykova M., Antropova E. et al. T-cell immunity and cytokine production in cosmonauts after long-duration space flights // Acta Astronautica. 2011. V. 68. № 7–8. P. 739.
Crucian B.E., Choukèr A., Simpson R.J. et al. Immune System Dysregulation During Spaceflight: Potential Countermeasures for Deep Space Exploration Missions // Front. Immunol. 2018. V. 9. P. 1437.
Ильин В.К., Крюков А.И., Воложин А.И. и др. Исследование дисбиоза, развивающегося в условиях “сухой” иммерсии, и методы его коррекции // Авиакосм. и эколог. мед. 2008. Т. 42. № 5. С. 70. Il’in V.K., Kriukov A.I., Volozhin A.I. et al. [Investigation of dysbiosis developing during ‘‘dry’’ immersion and methods of correction] // Aviakosm. Ekolog. Med. 2008. V. 42. № 5. P. 70.
Dhabhar F.S. Enhancing versus suppressive effects of stress on immune function: implications for immunoprotection and immunopathology // Neuroimmunomodulation. 2009. V. 16. № 5. P. 300.
Jang T.Y., Heo M.J., Jung A.Y., Kim Y.H. Prolonged anti-orthostatic hind limb unloading and murine allergic asthma // Aerosp. Med. Hum. Perform. 2015. V. 86. № 9. P. 803.
Crucian B., Stowe R., Mehta S. et al. Immune system dysregulation occurs during short duration spaceflight on board the space shuttle // J. Clin. Immunol. 2013. V. 33. № 2. P. 456.
Crucian B., Simpson R.J., Mehta. S. et al. Terrestrial stress analogs for spaceflight associated immune system dysregulation // Brain Behav. Immun. 2014. V. 39. P. 23.
Mermel L.A. Infection prevention and control during prolonged human space travel // Clin. Infect. Dis. 2013. V. 56. № 1. P. 123.
Томиловская Е.С., Рукавишников И.В., Амирова Л.Е. и др. 21-суточная “сухая” иммерсия: особенности проведения и основные итоги // Авиакосм. и эколог. мед. 2020. Т. 54. № 4. С. 5.
Navasiolava N.M., Custaud M.A., Tomilovskaya E.S. et al. Long-term dry immersion: review and prospects // Eur. J. Appl. Physiol. 2011. V. 111. № 7. P. 1235.
Пономарев С.А., Рыкова М.П., Антропова Е.Н. и др. Состояние системы врожденного иммунитета человека в условиях 5-суточной “сухой” иммерсии // Авиакосм. и эколог. мед. 2011. Т. 45. № 3. С. 17. Ponomarev S.A., Rykova M.P., Antropova E.N. et al. Human innate immunity under the conditions of five-day dry immersion // Human Physiology. 2013. V. 39. № 7. Р. 780.
Пономарев С.А., Шульгина С.М., Калинин С.А. и др. Состояние системы сигнальных образраспознающих рецепторов семейства toll-like-моноцитов и гранулоцитов человека во время 21-суточной “сухой” иммерсии без средств профилактики // Авиакосм. и эколог. мед. 2019. Т. 53. № 2. С. 36.
Кутько О.В., Рыкова М.П., Антропова Е.Н. и др. Влияние 21-суточной “сухой” иммерсии на продукцию Т-лимфоцитами цитокинов, вовлеченных в регуляцию метаболизма костной ткани // Авиакосм. и эколог. мед. 2019. Т. 53. № 6. С. 42.
Nichiporuk I.A., Vasilieva G.Y., Rykova M.P. et al. Analysis of the relationships between the psychophysiological status and adaptive immunity system under conditions of five-day dry immersion // Human Physiology. 2014. V. 40. № 7. P. 741.
Pakharukova N.A., Pastushkova L.Kh., Larina I.M. et al. Changes of human serum proteome profile during 7-day ‘‘dry’’ immersion // Acta Astronautica. 2011. V. 68. № 9–10. P. 1523.
Berendeeva T.A., Rykova M.P., Antropova E.N. et al. State of the immune system after seven-day “dry” immersion in human // Human Physiology. 2011. V. 37. № 7. P. 840.
Пономарев С.А., Рыкова М.П., Антропова Е.Н. и др. Цитокиновый профиль испытателей-добровольцев в 21-суточной “сухой” иммерсии // Физиология человека. 2020. Т. 46. № 2. С. 76. Ponomarev S.A., Rykova M.P., Antropova E N. et al. Cytokine profile in volunteers during a 21-day dry immersion without countermeasures // Human Physiology. 2020. V. 46. № 2. P. 175.
Squillaro T., Peluso G., Galderisi U. Clinical trials with mesenchymal stem cells: an update // Cell Transplant. 2016. V. 25. № 5. P. 829.
Copland I.B., Qayed M., Garcia M.A. et al. Bone marrow mesenchymal stromal cells from patients with acute and chronic graft-versus-host disease deploy normal phenotype, differentiation plasticity, and immune-suppressive activity // Biology Blood Marrow Transplant. 2015. V. 21. № 5. P. 934.
Erbey F., Atay D., Akcay A. et al. Mesenchymal stem cell treatment for steroid refractory graft-versushost disease in children: a pilot and first study from Turkey // Stem Cells Int. 2016. V. 2016. P. 1641402.
Engela A.U., Baan C.C., Frank J.M.F. et al. On the interactions between mesenchymal stem cells and regulatory T cells for immunomodulation in transplantation // Front. Immunol. 2012. V. 3. P. 126.
Francois M., Romieu-Mourez R., Li M., Galipeau J. Human MSC suppression correlates with cytokine induction of indoleamine 2,3-dioxygenase and bystander M2 macrophage differentiation // Mol. Ther. 2012. V. 20. № 1. P. 187.
Gornostaeva A.N., Bobyleva P.I., Andreeva E.R. et al. Adipose-derived stromal cell immunosuppression of T cells is enhanced under “physiological” hypoxia // Tissue Cell. 2020. V. 63. P. 101320.
Bobyleva P.I., Andreeva E.R., Gornostaeva A.N., Buravkova L.B. Tissue-related hypoxia attenuates proinflammatory effects of allogeneic PBMCs on adipose-derived stromal cells in vitro // Stem Cells Int. 2016. V. 2016. P. 4726267.
Suva D., Passweg J., Arnaudeau S. et al. In vitro activated human t lymphocytes very efficiently attach to allogenic multipotent mesenchymal stromal cells and transmigrate under them // J. Cell. Physiol. 2008. V. 214. № 3. P. 588.
Yang S.H., Park M.J., Yoon I.H. et al. Soluble mediators from mesenchymal stem cells supress T cell proliferation by inducing IL-10 // Exp. Mol. Med. 2009. V. 41. № 5. P. 315.
Gornostaeva A.N., Andreeva E.R., Bobyleva P.I., Buravkova L.B. Interaction of allogeneic adipose tissue-derived stromal cells and unstimulated immune cells in vitro: the impact of cell-to-cell contact and hypoxia in the local milieu // Cytotechnology. 2018. V. 70. № 1. P. 299.
Baecher-Allan C., Wolf E., Hafler D.A. MHC class II expression identifies functionally distinct human regulatory T cells // J. Immunol. 2006. V. 176. № 8. P. 4622.
Viallard J.F., Blanco P., Andre M. et al. CD8+HLA-DR+ T lymphocytes are increased in common variable immunodeficiency patients with impaired memory B-cell differentiation // Clin. Immunol. 2006. V. 119. № 1. P. 51.
Ritz B.W., Lelkes P.I., Gardner E.M. Functional recovery of peripheral blood mononuclear cells in modeled microgravity // FASEB J. 2006. V. 20. № 2. P. 305.
Luo H., Wang C., Feng M., Zhao Y. Microgravity inhibits resting T cell immunity in an exposure time-dependent manner // Int. J. Med. Sci. 2013. V. 11. № 1. P. 87.
Konstantinova I.V., Rykova M.P., Lesnyak A.T., Antropova E.A. Immune changes during long-duration missions // J. Leukoc. Biol. 1993. V. 54. № 3. P. 189.
Talaat R.M., Mohamed S.F., Bassyouni I.H., Raouf A.A. Th1/Th2/Th17/Treg cytokine imbalance in systemic lupus erythematosus (SLE) patients: Correlation with disease activity // Cytokine. 2015. V. 72. № 2. P. 146.
Romagnani S. T-cell subsets (Th1 versus Th2) // Ann. Allergy Asthma Immunol. 2000. V. 85. № 1. P. 9.
Alosaimi B., Hamed M.E., Naeem A. et al. MERS-CoV infection is associated with downregulation of genes encoding Th1 and Th2 cytokines/chemokines and elevated inflammatory innate immune response in the lower respiratory tract // Cytokine. 2020. V. 126. P. 154895.
Boshtam M., Asgary S., Kouhpayeh S. et al. Aptamers Against Pro- and Anti-Inflammatory Cytokines: A Review // Inflammation. 2017. V. 40. № 1. P. 340.
Chousterman B.G., Swirski F.K., Weber G.F. Cytokine storm and sepsis disease pathogenesis // Semin. Immunopathol. 2017. V. 39. № 5. P. 517.
Cappellesso-Fleury S., Puissant B., Apoil P.A. et al. Human fibroblasts share immunosuppressive properties with bone marrow mesenchymal stem cells // J. Clin. Immunol. 2010. V. 30. № 4. P. 607.
Kronsteiner B., Wolbank S., Peterbauer A. et al. Human Mesenchymal Stem Cells from Adipose Tissue and Amnion Influence T-Cells Depending on Stimulation Method and Presence of Other Immune Cells // Stem Cells Dev. 2011. V. 20. № 12. P. 2115.
Nold P., Hackstein H., Riedlinger T., Kasper C. et al. Immunosuppressive capabilities of mesenchymal stromal cells are maintained under hypoxic growth conditions and after gamma irradiation // Cytotherapy. 2015. V. 17. № 2. P. 152.
Terraza-Aguirre C., Campos-Mora M., Elizondo-Vega R. et al. Mechanisms behind the immunoregulatory dialogue between mesenchymal stem cells and Th17 cells // Cells. 2020. V. 9. № 7. P. 1660.
Guo Z., Zheng C., Chen Z. et al. Fetal BM-derived mesenchymal stem cells promote the expansion of human Th17 cells, but inhibit the production of Th1 cells // Eur. J. Immunol. 2009. V. 39. № 10. P. 2840.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека