Физиология человека, 2022, T. 48, № 3, стр. 5-13
Вызванные потенциалы среднего мозга, ассоциированные с началом и окончанием звучания простого тона
А. О. Канцерова 1, *, Л. Б. Окнина 1, Д. И. Пицхелаури 2, В. В. Подлепич 2, Е. Л. Машеров 2, Я. О. Вологдина 2
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 ФГАУ НМИЦ нейрохирургии имени академика Н.Н. Бурденко МЗ РФ
Москва, Россия
* E-mail: anna.kantserova@gmail.com
Поступила в редакцию 23.08.2021
После доработки 25.10.2021
Принята к публикации 15.12.2021
- EDN: LVOIYA
- DOI: 10.31857/S0131164622030080
Аннотация
Анатомическое строение слуховой системы и наличие нескольких взаимодополняющих уровней обработки информации позволяют человеку очень быстро и точно оценивать множество природных звуков, которые имеют минимальные отличия по частоте, длительности или интенсивности. При этом особенности анализа слуховой информации глубинными структурами мозга до конца не исследованы. В частности, до конца не выявлена роль среднего мозга в восприятии слуховой информации. Основу настоящего исследования составили данные анализа активности среднего мозга у 5 чел., полученные во время интраоперационного мониторинга, проводившегося при оперативном вмешательстве по поводу удаления объемных новообразований ствола мозга. Электрические потенциалы регистрировались с использованием глубинного электрода, погруженного в водопровод мозга. Анализировалась активность среднего мозга, ассоциированная с реакцией на простые тоны. Выявлены пики, связанные с началом – S1, S2 и S3 – и окончанием звукового стимула – пик Е. Пики S1, S2 и S3 с наибольшей вероятностью отражают проведение нервного импульса по слуховому пути. Пик Е отражает анализ звуковой информации в среднем мозге.
Анатомическое строение слуховой системы и наличие нескольких взаимодополняющих уровней обработки информации [1] позволяют человеку очень быстро и точно оценивать множество природных звуков, которые имеют минимальные отличия по частоте, длительности или интенсивности [2]. В стволе мозга можно выделить четыре комплекса ядер, участвующих в передаче слуховой информации: слуховые ядра, ядра верхней оливы, латерального лемниска и нижних холмиков. Исследование этих структур у человека сопряжено с рядом трудностей в силу их локализации в глубине мозга [3].
В семидесятых годах прошлого века широкое применение в клинике нашли акустические стволовые вызванные потенциалы (АСВП), которые регистрируются с поверхности головы и отражают проведение слуховой информации от слуховых структур ствола и слухового нерва к коре головного мозга [4]. Изменения ответов АСВП позволяют точно определить уровень поражения слуховой системы [5–7]. Ответы компонентов АСВП имеют латентности до 10 мс и выделяются в ответ на предъявление стимулов в виде щелчков прямоугольной формы, которые предъявляются моноурально [8]. Физической особенностью щелчков является отсутствие восходящего и нисходящего фронтов, которые обеспечивают постепенное вовлечение в процесс слуховых волокон, имеющих одну характеристическую частоту, но разные пороги активации. Это приводит к тому, что в ответ на щелчок возбуждается большая часть слуховых волокон независимо от их частотных и амплитудных характеристик [9]. Это, в свою очередь, ведет к тому, что по слуховому нерву в центральную слуховую систему проходит импульс, который можно зарегистрировать электродами, расположенными на отдалении – на поверхности головы, т.е. регистрируются потенциалы дальнего поля. Однако ответы АСВП позволяют только оценивать сохранность проведения информации по волокнам слуховой системы, но не отражают обработку звуковых стимулов нервными структурами. Это затрудняет применение данного метода в исследовании когнитивных процессов в слуховой системе [10]. Кроме того, общепринятое определение источников генерации компонентов АСВП является противоречивым [11]. Во многом это происходит из-за того, что изначально информация об источниках регистрируемого сигнала была получена путем инвазивных электрофизиологических исследований на животных [12] или на основе изменений в компонентах АСВП при различных патологиях нервной системы [13].
Более полную информацию об активности структур, локализованных в глубине мозга, можно получить, регистрируя биопотенциалы при помощи электродов, имплантированных непосредственно в исследуемую структуру. У человека подобная регистрация возможна только по медицинским показаниям и, как правило, осуществляется с помощью электродов, предназначенных для глубинной стимуляции мозга [14], во время интраоперационного мониторинга (ИОМ) или постоперационного контроля [15]. ИОМ проводится у пациентов, находящихся в состоянии анестезии. При этом потенциалы регистрируются от глубинных структур мозга на фоне медикаментозного обратимого угнетения активности коры [16]. Это позволяет записывать активность глубинных структур без влияния на нее вышележащих отделов мозга, в том числе коры больших полушарий. Регистрирующий электрод располагается при этом в непосредственной близости от структуры, генерирующей электрический сигнал, т.е. происходит регистрация потенциалов ближнего поля.
Основу настоящего исследования составили данные анализа активности среднего мозга человека, полученные во время интраоперационного мониторинга у пациентов, находящихся в состоянии анестезии во время оперативного вмешательства по поводу удаления объемных новообразований головного мозга. Электрические потенциалы регистрировались с использованием глубинного электрода, имплантированного в водопровод мозга. Анализировалась активность среднего мозга, ассоциированная с реакцией на простые тоны.
МЕТОДИКА
В исследование было включено 5 пациентов (4 мужчин, 1 женщина), проходивших хирургическое лечение опухолей ствола головного мозга в МНИЦ нейрохирургии им. академика Н.Н. Бурденко МЗ РФ (г. Москва). Характеристики пациентов представлены в табл. 1. Критериями включения пациентов в исследование были: отсутствие вовлечения в опухолевый процесс среднего мозга, полная сохранность слуховой системы и когнитивных функций до операции.
Таблица 1.
Характеристика пациентов и использованные электроды
| Пациент | Пол | Возраст | Пропофол мг/кг/ч | Электроды, расположенные на поверхности головы | Глубинные электроды | ||
|---|---|---|---|---|---|---|---|
| кол-во | положение по системе 10–20% | кол-во | локализация | ||||
| 1 | Ж | 56 | 8.5 | 16 | F7, F8, FZ, FpZ, C3, C4, CZ, P3, P4, PZ, T3, T4, T5, T6, O1, O2 | 2 | Водопровод мозга |
| 2 | М | 31 | 5.3 | 19 | Fp1, Fp2, F3, F4, F7, F8, FZ, C3, C4, CZ, P3, P4, PZ, T3, T4, T5, T6, O1, O2 | 2 | Водопровод мозга |
| 3 | М | 22 | 8.4 | 17 | Fp1, Fp2, F3, F4, F7, F8, C3, C4, P3, P4, PZ, T3, T4, T5, T6, O1, O2 | 2 | Водопровод мозга |
| 4 | М | 54 | 10.7 | 15 | F3, F4, F7, F8, FZ, C3, C4, CZ, P4, T3, T4, T5, T6, O1, O2 | 2 | Водопровод мозга |
| 5 | М | 45 | 8.3 | 13 | Fp2, F3, F4, F7, F8, FZ, C3, C4, CZ, PZ, T3, T4, T5 | 2 | Водопровод мозга |
Во время нейрохирургического вмешательства у всех пациентов осуществляли доступ в четвертый желудочек и резекцию опухоли. Траектория хирургического доступа позволяла хорошо визуализировать водопровод мозга на всем его протяжении до третьего желудочка. Для проведения интраоперационного мониторинга в просвет водопровода устанавливали одноразовый силиконовый (из медицинского пластиката ПМ-1/42) электрод круглого сечения диаметром 2.7 мм с тремя кольцевидными электродами-контактами из стали марки 12Х18Н10Т. Использовали электрод производства ООО “Нейроэлект” (Россия) (рис. 1). Два первых электрод-контакта располагали под верхними (ростральный электрод) и нижними (каудальный электрод) бугорками четверохолмной пластинки. Третий электрод-контакт выступал в роли референта и располагался в просвете четвертого желудочка. Референтный электрод укутывали хирургической марлей для предотвращения прямого контакта с эпендимой четвертого желудочка. Интраоперационная запись электрических потенциалов продолжалась в течение 15 мин на фоне непрерывного продолжительного внутривенного введения пропофола, доза которого рассчитывалась индивидуально врачом-анестезиологом для достижения на ЭЭГ корковой активности типа “вспышка-подавление”, которые чередовались каждые 3–4 с. Доза пропофола указана в табл. 1.
Рис. 1.
Схема глубинного электрода и его положение по отношению к структурам мозга. А – схематичное изображение глубинного электрода. Б – схема расположения глубинного электрода относительно структур ствола мозга: D1, D2 – регистрирующие контакты (в водопроводе мозга), R – референт, SC – верхние холмики, IC – нижние холмики, PG – периакведуктальное серое вещество.

Все пациенты, которым имплантировали глубинный электрод с целью интраоперационного мониторинга, имели неосложненный послеоперационный период без нарастания общемозговой и очаговой, в том числе среднемозговой, симптоматики. Каждый пациент в послеоперационном периоде проходил нейропсихологическое тестирование, которое не выявило отклонений от дооперационного уровня в когнитивной сфере. У всех пациентов в послеоперационном периоде не было выявлено признаков ухудшения слуха.
Регистрация вызванных потенциалов (ВП). Звуковая последовательность состояла из простых синусоидальных тонов четырех типов: частотой 600 Гц длительностью 80 мс; 800 Гц длительностью 90 мс; 1000 Гц длительностью 100 мс; 2000 Гц длительностью 100 мс. Всего в последовательности было 100 стимулов: по 25 стимулов каждого типа. Все звуки имели восходящую фазу, плато и нисходящую фазу. Межстимульный интервал варьировал от 1100 до 1170 мс. Стимулы подавались бинаурально через накладные наушники.
Звуковая последовательность подавалась с использованием программы “Presentation” (Neurobehavioral Systems, Inc., США).
ВП регистрировали на оборудовании Нейрон-Спектр 4/Р (“Нейрософт”, Россия). Частота дискретизации – 5000 Гц; фильтр высоких частот (ФВЧ) – 0.5 Гц и фильтр нижних частот (ФНЧ) – 500 Гц, сетевой фильтр 50 Гц.
Во время исследования синхронно с регистрацией электрических потенциалов от глубинного электрода проводили регистрацию от игольчатых электродов, расположенных на поверхности головы по схеме 10–20%. Число электродов варьировало от 13 до 19 (табл. 1). Из схемы исключали электроды, попадавшие в область работы нейрохирурга или находившиеся в непосредственной близости от нее. В качестве референтного электрода для электродов, находившихся на поверхности головы, использовали объединенный ушной электрод. Глубинные потенциалы регистрировались биполярно с собственным референтом. Заземляющий электрод, общий для глубинных электродов и электродов, находившихся на поверхности головы, располагали в проекции плечевого сустава.
Отдельным каналом регистрировали электрограмму звуковых стимулов, отражающую ток, подаваемый в наушники при звуковой стимуляции.
Анализ данных. Зарегистрированные потенциалы обрабатывали в программе “Brainstorm” [17]. К анализу принимали безартефактные участки записи, которые подвергались обработке следующими цифровыми фильтрами: ФВЧ 2 Гц и режекторный фильтр 50 Гц.
Для повышения точности синхронизации ответов мозга с подаваемым стимулом перед усреднением ВП анализировали единичные ответы мозга, зарегистрированные на глубинных электродах. Для этого в пределах 5 мс после начала звукового стимула выделяли комплекс из двух пиков, которые были названы по аналогии с ответами АСВП, V и VI, которые отражают проведение нервного импульса по слуховым структурам среднего мозга и надежно выделяются при зрительном анализе. На вершине пика V ставилась метка, относительно которой в дальнейшем производили усреднение ВП в ответ на тон определенной частоты.
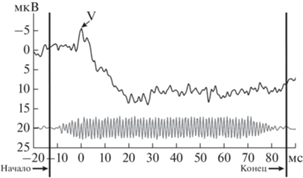
В связи с наличием технического дрейфа (рассинхронизации) маркера события относительно реального начала стимула, точное начало звукового стимула идентифицировалось, опираясь одновременно на ответы со среднего мозга и на электрограмму. Данную процедуру проводили у каждого индивидуального пациента по единичным ответам на стимул. Для этого на первом этапе латентность пика V принимали за нулевую точку. Далее верифицировали начало стимула по электрограмме. Критерием надежности служило статистически достоверное равенство временных интервалов от пика V до начала стимула в электрограмме (рис. 2). Аналогичным образом идентифицировали конец звукового стимула. На завершающем этапе проводили усреднение ВП относительно пика V.
Рис. 2.
Идентификация начала и конца звукового стимула для тона частотой 800 Гц длительностью 90 мс. Показан единичный ответ на стимул (верхняя кривая) и электрограмма тона (нижняя кривая). Показаны индивидуальные данные пациента 5.
ВП включали предстимульный интервал – 100 мс и постстимульный – 300 мс. ВП на каждый тон различной частоты анализировались отдельно. Анализировали ВП, зарегистрированные с обоих глубинных электродов, а также с двух, расположенных на поверхности головы (C3, C4), электродов.
В качестве контроля вычисляли псевдоВП. Для этого на записи потенциалов без звуковых стимулов случайным образом расставляли 25 меток, относительно которых проводилось усреднение.
Статистический анализ проводили в пакете STATISTICA 10.
На полученных ответах ВП анализировали пик V, пик VI, следующий непосредственно за пиком V, пики S1, S2, S3, а также пик Е, выделяемый после окончания звукового стимула. Названия пикам были даны исходя из их предполагаемой функциональной значимости. Пики S1, S2, S3, регистрирующиеся непосредственно после начала, предположительно связаны с оценкой начала звучания (от английского “start” – “начало”), тогда как пик Е регистрируется после окончания звучания тона, он предположительно является маркером окончания звучания тона (от английского “end” – “конец”).
Латентности всех компонентов рассчитывались относительно пика V. Полученные значения сравнивали попарно между тонами разной частоты и длительности. Статистический анализ данных включал в себя непараметрический критерий Манна-Уитни, а также оценку значений медиан и интерквартильных размахов полученных распределений. Данные статистические критерии были выбраны после проверки на нормальность полученных распределений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На ЭЭГ с поверхности головы регистрировалась активность “вспышка-подавление”. Вспышки электрофизиологической активности имели наибольшую амплитуду в лобных отведениях и состояли главным образом из колебаний α-диапазона. На записях электрических потенциалов, регистрируемых с глубинных электродов, паттернов активности по типу “вспышка-подавление” зафиксировано не было.
На ВП, записанных с поверхности головы, не было выявлено устойчивых пиков, повторяющихся в ответ на стимул одной частоты (рис. 3). На ответах ВП, регистрируемых с глубинных электродов, выделялись пики V, VI, S1, S2, S3 и Е. При этом пики ВП, зарегистрированныx с ростральных и каудальных глубинных электродов, различались.
Рис. 3.
Ответы вызванных потенциалов (ВП), зарегистрированные синхронно с глубинных электродов и с электродов, расположенных на поверхности головы. Представлены индивидуальные данные пациента 5 в ответ на тон частотой 800 Гц.

С рострального электрода выделялись пики V, VI, S1, S2, S3 и Е. С каудального электрода отчетливо выделялись только пики V, VI и Е, тогда как пики S1, S2 и S3 имели меньшую амплитуду и нестабильную морфологию, что затрудняло их надежное выделение (рис. 4).
Рис. 4.
Ответы вызванных потенциалов (ВП) при предъявлении стимула частотой 600 Гц, зарегистрированные с рострального глубинного электрода (А), каудального глубинного электрода (Б). Ответы ВП (черная кривая) приведены в сопоставлении с ответами псевдоВП (серая кривая). Представлены индивидуальные данные пациента 5.

Латентность пика VI, зарегистрированного с рострального и каудального электродов, не отличалась между собой. Также не было выявлено статистически значимых различий в латентностях данного пика в ответ на стимулы различной частоты (p > 0.05).
Латентности пиков S1, S2 и S3, зарегистрированных с рострального электрода, статистически не различались при предъявлении стимулов разной частоты. Интерквартильный интервал (ИКИ) латентностей пика S3 превышал таковой для пиков S1 и S2. ИКИ латентностей пиков S3, зарегистрированных в ответ на стимулы 1000 и 2000 Гц, превышали таковые для пиков S1 и S2 в 2 и более раз (табл. 2).
Таблица 2.
Интерквартильные интервалы (ИКИ) латентностей пиков S1, S2 и S3 при предъявлении стимулов различной частоты
| Компонент | S1 | S2 | S3 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Тон, Гц | 600 | 800 | 1000 | 2000 | 600 | 800 | 1000 | 2000 | 600 | 800 | 1000 | 2000 |
| ИКИ, мс | 0.4 | 1.1 | 0.7 | 0.8 | 2.4 | 1.4 | 0.8 | 0.4 | 2.2 | 2.4 | 1.6 | 2.0 |
Пик Е выделялся как с рострального, так и с каудального электродов (рис. 4). ИКИ латентности пика Е с каудального электрода превышали таковые с рострального (табл. 3). Латентности пика E между ответами на звуковые стимулы разных длительностей достоверно различались (p < < 0.05) (рис. 5). При сравнении латентностей пиков Е, зарегистрированных в ответ на стимулы одинаковой длительности, но разной частоты, статистически достоверных различий найдено не было.
Таблица 3.
Отношение интерквартильных интервалов (ИКИ) латентностей пика Е в ответ на стимулы различной частоты
| Частота тона | 600 Гц | 800 Гц | 1000 Гц | 2000 Гц |
|---|---|---|---|---|
| Отношение ИКИ для каудального электрода к ИКИ для рострального | 3 | 2 | 2.1 | 1.9 |
Рис. 5.
Ответы вызванных потенциалов (ВП), зарегистрированные с рострального электрода (черная кривая), в сопоставлении с псевдоВП (серая кривая). Черный отрезок над графиками отмечает время подачи звукового стимула. Индивидуальные данные пациента 1. А – 600 Гц, 80 мс. Б – 800 Гц, 90 мс. В – 1000 Гц, 100 мс. Г – 2000 Гц, 100 мс.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основу работы составили данные анализа электрической активности среднего мозга, в ответ на предъявление простых тонов различной частоты и длительности. Регистрация проводилась в рамках рутинного интраоперационного мониторинга. Данный подход является оригинальным, поскольку традиционно при анализе сохранности слуховой системы используют щелчки, ответ на которые позволяет оценить проведение звукового сигнала по стволовым структурам, но не дает информации об обработке звука [11].
В результате работы были зарегистрированы пики ответов ВП, связанные с началом звукового стимула – это пики V, VI, S1, S2, S3, а также с концом стимула – пик Е. Близость пиков VI, S1, S2 и S3 к пику V по времени генерации и форме пика предполагает, что они отражают сходные физиологические процессы. Пик V по времени возникновения расположен близко к началу звукового сигнала. Он находится на вершине низкочастотной и высокоамплитудной волны, а пик VI – на нисходящем склоне этой волны. Временной интервал между пиками V и VI равен 1.8 мс. Это значение близко к временному интервалу между пиками V и VI АСВП, который составляет 1.6 мс [4]. Это свидетельствует в пользу того, что пики V и VI, зарегистрированные на глубинных электродах, эквивалентны пикам V и VI АСВП. Временные отличия между зарегистрированными на глубинном электроде пиками и АСВП составляют 12.5%. Эти отличия могут отражать специфику проведения информации по слуховой системе в состоянии анестезии. Также нельзя исключить, что на время проведения влияет наличие патологического процесса в стволе мозга и физическое воздействие на мозг во время нейрохирургического вмешательства. Это позволяет предположить, что пики V и VI и следующие непосредственно за ними пики S1, S2 и S3 связаны с реакцией среднего мозга на начало звукового сигнала.
Пик Е сильно отличается по времени генерации и морфологии от остальных пиков, выявленных на глубинных электродах. Его латентность, отсчитанная от пика V, статистически достоверно отличается между тонами с различной длительностью и имеет сходные значения у тонов одинаковой длительности и разной частоты. Это позволяет сделать предположение о том, что структуры, генерирующие компонент Е слуховых ВП, зарегистрированных на глубинных электродах, реагируют на окончание звукового сигнала. Следовательно, можно выдвинуть гипотезу о том, что генерация пика Е связана с окончанием предъявления звукового стимула.
Если предположить, что пики S1, S2, S3 и пик Е генерируются в коре больших полушарий или таламусе, то на глубинном электроде должны регистрироваться потенциалы дальнего поля и, следовательно, они должны одинаково хорошо визуализироваться на сигналах, зарегистрированных и на ростральном, и на каудальном электродах. Однако компоненты S1, S2 и S3 видны только при регистрации ответа на ростральном электроде. Кроме того, ИКИ латентностей пика Е, зарегистрированного на каудальном электроде, превышают таковые с рострального электрода. Все эти факты свидетельствуют в пользу того, что пики S1, S2, S3 и Е генерируются структурой, находящейся в непосредственной близости от рострального электрода, т.е. в среднем мозге.
Если предположить корковое происхождение данных пиков, то кора больших полушарий должна обладать достаточным притоком сенсорной информации и иметь необходимый уровень активности для обработки этой информации. Однако феномен “вспышка-подавление”, регистрируемый в момент стимуляции с электродов, расположенных на поверхности головы, и преобладание во время “вспышек” активности α-диапазона в лобных отделах, а также отсутствие ярко выраженных ответов ВП в ответ на стимулы предполагают прохождение большей части нервных импульсов, возникающих в процессе ответа на звуковой стимул, по волокнам возбуждающей таламокортикальной петли [18]. Данный вид обратной связи между корой и таламусом, возникающий в состоянии анестезии, вызванной действием пропофола, свидетельствует об усилении ингибирования таламокортикальных связей ретикулярным ядром таламуса и, как следствие, о разобщении таламуса и коры [19]. Таким образом, сенсорный поток в кору сильно снижается. Кроме того, отсутствие устойчивых ответов ВП с электродов, расположенных на поверхности головы, в ответ на стимулы говорит о недостаточности активации коры, а также о нехватке сенсорного притока в кору для осуществления минимальных когнитивных процессов [20].
Данное исследование имеет ряд ограничений. Прежде всего, это невозможность регистрации активности среднего мозга у здоровых испытуемых. В связи с этим акцент делался на детальном анализе полученных данных, а не на сравнении их с контрольной группой. Кроме того, целесообразность проведения подобной регистрации ограничена клинической необходимостью интраоперационного мониторинга, что делает невозможным набор больших групп пациентов. Также это накладывает ограничения на длительность проведения исследований и делает невозможным использование более долгих экспериментальных задач.
Регистрация электрических потенциалов в условиях нейрохирургической операционной ограничивает количество размещаемых на поверхности головы электродов, число которых варьировало. Особенности строения ствола мозга человека и операционного доступа (вход в четвертый желудочек и, следовательно, в водопровод мозга осуществлялся через большую затылочную цистерну) сделали затруднительной точную визуальную оценку расположения глубинных кольцевых электродов, поэтому не было возможности вычислить их точные координаты для дальнейшего математического анализа.
К техническим ограничениям исследования можно также отнести особенности подаваемых стимулов. Простые тоны имели восходящий и нисходящий фронты, что затрудняло оценку положения начала и конца звука во времени. В частности, не было возможности оценить порог слышимости для структур среднего мозга у каждого конкретного пациента. Кроме того, погрешность метода измерения начала и конца звукового сигнала составляла до 2 мс. Все это сделало неприемлемым отсчет латентностей ВП традиционным способом – от начала звукового сигнала. В связи с этим, было принято решение считать латентности компонентов ВП от наиболее четко выделяющегося на нативной записи ЭЭГ глубинного компонента – компонента V рострального кольцевого электрода.
К техническим ограничениям также необходимо отнести положение заземляющего электрода. Обычно при регистрации слуховых ВП заземляющий электрод располагается в лобно-сагиттальной позиции (FZ или FpZ). Современные цифровые приборы пересчитывают сигнал на всех расположенных на поверхности головы электродах с учетом биопотенциалов мозга, накапливающихся на заземляющем электроде. Однако для биполярных каналов, как правило использующихся для контрольной записи мио- и кардиограммы, нет вышеописанного пересчета из-за отсутствия необходимости в точной оценке амплитуд получаемых сигналов. Положение заземляющего электрода в проекции плечевого сустава уменьшило, но не полностью исключило шум на нем.
ЗАКЛЮЧЕНИЕ
В данной работе были проанализированы ответы ВП головного мозга, зарегистрированных с глубинных электродов, локализованных в среднем мозге. Анализировались ответы на стимулы, представлявшие собой простые тоны. Были выявлены пики, связанные с началом – S1, S2 и S3 – и окончанием звукового стимула – пик Е. Пики S1, S2 и S3 с наибольшей вероятностью отражают проведение нервного импульса по слуховому пути. Пик Е отражает анализ звуковой информации в среднем мозге.
Этические нормы. Все исследования были проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях. Исследования проводились в рамках плановых научных тем и комплексного клинического обследования при оказании медицинской помощи в НМИЦ нейрохирургии им. академика Н.Н. Бурденко Минздрава России (Москва). Исследование было одобрено местным этическим комитетом.
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено на средства государственного бюджета по госзаданию на 2019-2021 гг. (АААА-А17-117092040004-0).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Kandel R., Schwartz H., Jessell M. et al. Principles of Neural Science, 5th ed. McGraw-Hill, New York, 2012. P. 682.
Королева И.В. Кохлеарная имплантация глухих детей и взрослых (электронное протезирование слуха). СПб.: КАРО, 2012. С. 33.
Sitek K., Gulban O., Calabrese E. et al. Mapping the human subcortical auditory system using histology, postmortem MRI and in vivo MRI at 7T // Elife. 2019. V. 8. P. e48932.
Picton T., Hillyard S., Krausz H., Galambos R. Human auditory evoked potentials. I: evaluation of components // Electroencephalogr. Clin. Neurophysiol. 1974. V. 36. № 2. P. 179.
Nodar R.H., Hahn J., Levine H.L. Brain stem auditory evoked potentials in determining site of lesion of brain stem gliomas in children // Laryngoscope. 1980. V. 90. № 2. P. 258.
Goldie W.D., van Eyes J., Baram T.Z. Brain stem auditory evoked potentials as a tool in the clinical assessment of children with posterior fossa tumors // J. Child Neurol. 1987. V. 2. № 4. P. 272.
Kjaer M. Localizing brain stem lesions with brain stem auditory evoked potentials // Acta Neurol. Scand. 1980. V. 61. № 5. P. 265.
Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. Таганрог: Издательство ТРТУ, 1997. С. 65.
Evans E. The frequency response and other properties of single fibers in the guinea-pig cochlear nerve // J. Physiol. 1972. V. 226. № 1. P. 263.
Eggermont J. Auditory brainstem response // Handb. Clin. Neurol. 2019. V. 160. P. 451.
Shaw N. The temporal relationship between the brainstem and primary cortical auditory evoked potentials // Prog. Neurobiol. 1995. V. 47. № 2. P. 95.
Moller A., Jannetta P., Bennett M., Moller M. Intracranially recorded responses from the human auditory nerve: New insights into the origin of brainstem evoked potentials (BSEPs) // Electroencephalogr. Clin. Neurophysiol. 1981. V. 52. № 1. P. 18.
Hashimoto I., Ishiyama Y., Yoshimoto T., Nemoto S. Brain-stem auditory-evoked potentials recorded directly from human brain-stem and thalamus // Brain. 1981. V. 104. № 4. P. 841.
Swann N., de Hemptinne C., Miocinovic S. et al. Chronic multisite brain recordings from a totally implantable bidirectional neural interface: experience in 5 patients with Parkinson’s disease // J. Neurosurg. 2018. V. 128. № 2. P. 605.
Oknina L., Kantserova A., Masherov E. et al. Functional connectivity between the midbrain and cortex during consciousness recovery after general anesthesia // W-jpmr. 2019. V. 5. № 2. P. 237.
Sahinovic M.M., Struys M.M.R.F., Absalom A.R. Clinical Pharmacokinetics and Pharmacodynamics of Propofol // Clin. Pharmacokinet. 2018. V. 57. № 12. P. 1539.
Tadel F., Baillet S., Mosher J.C. et al. Brainstorm: a user-friendly application for MEG/EEG analysis // Comput. Intell. Neurosci. 2011. P. 879716.
Ching S., Cimenser A., Purdon P. et al. Thalamocortical model for a propofol-induced α-rhythm associated with loss of consciousness // Proc. Natl. Acad. Sci. U.S.A. 2010. V. 107. № 52. P. 22665.
Purdon P., Sampson A., Pavone K., Brown E. Clinical Electroencephalography for Anesthesiologists: Part I: Background and Basic Signatures // Anesthesiology. 2015. V. 123. № 4. P. 937.
Kletecka J., Holeckova I., Brenkus P. et al. Propofol versus sevoflurane anaesthesia: effect on cognitive decline and event-related potentials // J. Clin. Monit. Comput. 2019. V. 33. № 4. P. 665.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


