Физиология человека, 2022, T. 48, № 4, стр. 34-44
Оценка постурального баланса у детей с последствиями родового повреждения периферических нервов верхней конечности
И. Е. Никитюк 1, *, С. В. Виссарионов 1
1 ФГБУ Национальный медицинский исследовательский центр детской травматологии и ортопедии
имени Г.И. Турнера МЗ РФ
Санкт-Петербург, Россия
* E-mail: femtotech@mail.ru
Поступила в редакцию 16.08.2021
После доработки 28.10.2021
Принята к публикации 23.11.2021
- EDN: YROAMC
- DOI: 10.31857/S0131164622020126
Аннотация
Изучены особенности вертикального баланса тела у детей с последствиями родового повреждения плечевого сплетения (РППС). Проведено стабилометрическое обследование 24 детей с односторонним РППС, в возрасте от 10 до 16 лет, из них 12 пациентов – с левосторонним поражением и 12 – с правосторонним. Параметры стабилометрии сравнивали с результатами, полученными в таких же тестах на 12 здоровых детей того же возраста. У пациентов обеих групп выявлено нарушение стабильности вертикального баланса во фронтальной и сагиттальной плоскостях, о чем свидетельствует смещение центра давления (ЦД) тела вдоль осей X и Y относительно абсолютного центра. При этом показатели статокинетических характеристик значительно отклонялись от нормы: были увеличены длина L, площадь S и угол направления колебаний Al статокинезиограмм. Средняя амплитуда колебаний ЦД А была увеличена только в тестах с открытыми глазами. В обеих группах больных наблюдалось значимое снижение по сравнению с нормой коэффициента Ромберга RC и резко выраженное патологическое увеличение корреляционной связи между параметрами L, S и А. Комплексная оценка стабилометрических показателей выявила значимые различия между группами пациентов, что свидетельствует о различающихся постуральных стратегиях обеспечения позного контроля у больных с левосторонним и правосторонним РППС, вероятно обусловленных отклонениями в механизмах организации движения на уровне головного мозга. У пациентов с правосторонним РППС предполагается функциональная реорганизация мозга в генетически предопределенном доминантном левом полушарии, а у пациентов с левосторонним поражением – в субдоминантном правом. В процессе роста и развития обследованных детей кортикоспинальный механизм обеспечения постурального баланса у них формировался под влиянием измененной эфферентной импульсации из зон кортикальной пластичности. По-видимому, различия в постуральной стратегии у больных с левосторонним и правосторонним РППС были обусловлены характером моторных программ, сформированных по-разному, в зависимости от того, в каком из полушарий могла быть кортикальная реорганизация – в доминантном или субдоминантном.
Повреждение периферических нервов может приводить к нарушению непрерывности аксонов и частичной или полной потере сенсорных, моторных и вегетативных функций. Основным методом лечения указанной патологии является хирургическое восстановление нервных стволов [1]. Несмотря на то, что в последние годы были достигнуты значительные успехи в подходах и вариантах лечения с использованием микрохирургической техники, способствующих аксональной регенерации, результаты функционального восстановления органов после реиннервации не полностью удовлетворяют клиницистов [2]. Предполагается, что отсутствие эффективности результатов лечения больных с повреждениями периферических нервов верхних конечностей могут быть обусловлены проблемами, связанными с кортикальной пластичностью – структурными и функциональными последствиями на уровне головного мозга [3]. На сегодняшний день имеются данные, свидетельствующие о пластических способностях головного мозга после травм периферических нервов [4], проявлением которых является снижение активности нейронов соматосенсорной коры вследствие потери сенсорной информации от поврежденного нерва [5]. Однако роль кортикальной пластичности в восстановлении периферической нервной системы в настоящее время до конца не изучена. С учетом этого необходимо обращать внимание на развивающиеся изменения в головном мозге в ответ на повреждение периферических нервов, так как это может привести к более глубокому пониманию механизмов регенерации нервов и способствовать улучшению исходов лечения после их повреждения [6]. В качестве оптимальной клинической модели для изучения повреждения периферических нервов можно рассматривать пациентов с родовым повреждением плечевого сплетения (РППС), которое развивается вследствие тракционной травмы с растяжением или разрывом корешков плечевого сплетения на уровне спинного мозга С5-Т1 во время родов. У больных с последствиями РППС отмечается нарушение постурального контроля и баланса тела [7], причинами которого является сенсомоторный дефицит верхних конечностей, развившийся вследствие измененной афферентации из области пораженного плечевого сплетения [8]. Патофизиологические механизмы контроля вертикальной позы при поражении плечевого сплетения до конца не выяснены, а понимание спинальных и корковых механизмов, лежащих в основе управления локомоциями человека, представляет интерес в аспекте клинического применения при восстановлении нарушений двигательной активности у больных неврологического профиля [9]. С учетом вышеизложенного, изучение постуральной дисфункции у пациентов с родовым повреждением плечевого сплетения является важной и актуальной задачей.
Цель работы – оценить состояние вертикального баланса тела и постуральную стабильность у детей с последствиями одностороннего РППС в зависимости от стороны поражения.
МЕТОДИКА
В обследовании участвовали 24 чел. (дети в возрасте от 10 до 16 лет) с последствиями одностороннего РППС. Больные были представлены двумя основными группами, по 12 чел. в каждой. Группы были однородными по возрасту и уровню поражения плечевого сплетения, у пациентов одной группы было левостороннее поражение, у пациентов другой группы – правостороннее. Критериями включения в исследование являлись: возраст пациентов от 10 до 16 лет, односторонность поражения плечевого сплетения, наличие клинических проявлений заболевания, полный протокол клинического и инструментального обследования, согласие родителей на проведение исследования. У всех детей клинические симптомы РППС свидетельствовали о повреждении верхних корешков плечевого сплетения С5, С6 и С7 (тип Дюшенна–Эрба) и проявлялись контрактурами в плечевом и локтевом суставах, пронацией пораженной конечности. Отмечалась атрофия мышц и снижение их силы, ослабление сухожильных рефлексов, укорочение сегментов пораженной руки. Клинический диагноз был полностью подтвержден результатами электрофизиологических исследований.
Для оценки постурального баланса у пациентов с РППС применяли метод стабилометрии с использованием программно-аппаратного комплекса МБН “Биомеханика” (ООО НМФ “МБН”, Россия). Во время обследования ребенок вставал на стабилоплатформу и принимал удобное вертикальное положение, располагая свои стопы “по-европейски” – со сведенными пятками и разведенными передними отделами стоп под углом 30°. При этом здоровая рука пациента была опущена вдоль вертикальной линии тела, в то время как пораженная верхняя конечность принимала свободное удобное положение. Стабилометрию осуществляли с фиксацией параметров смещения центра давления (ЦД) тела в двух тестовых режимах – с открытыми (ОГ) и закрытыми глазами (ЗГ), длительностью 54 с каждый. Колебания ЦД тела графически были представлены статокинезиограммами – фигурами эллипса с различными отклонениями их осей относительно сагиттальной плоскости (рис. 1). На статокинезиограммах рассчитывали параметры: координаты смещения ЦД во фронтальной X (мм) и сагиттальной Y (мм) плоскостях, длину траектории ЦД L (мм), площадь статокинезиограммы S (мм2), отношение длины статокинезиограммы к ее площади LFS (мм–1), коэффициент Ромберга RC (%). По известным методикам определяли величину угла направления колебаний Al (град) и его значение: положительное – в случае отклонения по часовой стрелке относительно сагиттальной плоскости, отрицательное – против часовой стрелки [10, 11]. Вычисляли изменение угла Al при тестировании пациентов с ОГ и ЗГ ΔAl (град). Дополнительно рассчитывали среднюю амплитуду колебаний ЦД А (мм). В качестве контроля были обследованы 12 детей той же возрастной группы без патологии опорно-двигательной системы и соматических нарушений.
Рис. 1.
Величины угла направления колебаний Al центра давления на статокинезиограммах. А – у здорового ребенка (незначительные отклонения от сагиттальной оси); Б – у пациента с правосторонним родовым повреждением плечевого сплетения (РППС) (умеренные отклонения от сагиттальной оси); В – у пациента с левосторонним РППС (выраженные отклонения от сагиттальной оси). ОГ – тест с открытыми глазами, ЗГ – тест с закрытыми глазами.

Статистическую обработку данных проводили с использованием критерия Манна-Уитни и Уилкоксона при квартильных сравнениях, при анализе корреляционных связей применяли коэффициента Спирмена rs. Пороговый уровень статистической значимости принимали при значении критерия p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При сравнительной оценке количественных показателей стабилометрии у здоровых детей и больных с РППС, у последних выявлены нарушения постурального баланса (табл. 1).
Таблица 1.
Показатели статокинезиограмм здоровых детей и пациентов с родовым повреждением плечевого сплетения (РППС)
| Параметры | Группы обследованных детей | Критерий Манна-Уитни | ||||
|---|---|---|---|---|---|---|
| здоровые (1) Ме [Q1–Q2], n = 12 |
дети с РППС | |||||
| поражение слева (2) Ме [Q1–Q2], n = 12 |
p | поражение
справа (3) Ме [Q1–Q2], n = 12 |
||||
| X, мм | ОГ | 0.2 [–0.4–0.9] |
1.7 [–4.5–4.6] |
0.885 | 1.1 [–2.6–7.9] |
p1–2 = 0.472 p1–3 = 0.501 |
| ЗГ | 0.4 [–0.5–1.2] |
0.8 [–5.1–5.0] |
0.931 | 0.8 [–2.4–4.2] |
p1–2 = 0.835 p1–3 = 0.908 |
|
| |X|, мм | ОГ | 0.8 [0.4–1.1] |
4.6 [1.9–8.2 ] |
0.908 | 3.1 [1.8–10.1 ] |
p1–2 < 0.001 p1–3 = 0.002 |
| ЗГ | 1.1 [0.5–1.4] |
5.1 [2.3–9.4 ] |
0.544 | 2.7 [2.0–8.3] |
p1–2 < 0.001 p1–3 = 0.001 |
|
| Y, мм | ОГ | 4.1 [2.6–5.8 ] |
10.1 [–4.2–18.4] |
0.312 | 12.7 [7.6–24.9 ] |
p1–2 = 0.507 p1–3 = 0.002 |
| ЗГ | 7.0 [3.4–9.0] |
7.6 [–4.2–18.6] |
0.099 | 15.7 [8.3–26.6 ] |
p1–2 = 0.885 p1–3 = 0.010 |
|
| L, мм | ОГ | 635 [534–698] |
765 [624–894] |
0.175 | 990 [715–1145] |
p1–2 = 0.035 p1–3 = 0.002 |
| ЗГ | 699 [650–868] |
869 [695–1013] |
0.112 | 1104 [810–1464] |
p1–2 = 0.214 p1–3 = 0.005 |
|
| S, мм2 | ОГ | 385 [228–441] |
683 [549–1018] |
0.126 | 373 [328–959] |
p1–2 = 0.001 p1–3 = 0.371 |
| ЗГ | 393 [280–743] |
546 [367–992] |
0.470 | 453 [314–776] |
p1–2 = 0.237 p1–3 = 0.795 |
|
| LFS, мм–1 | ОГ | 1.9 [1.2–2.0] |
1.0 [0.9–1.2] |
0.061 | 2.1 [0.9–2.9] |
p1–2 = 0.005 p1–3 = 0.470 |
| ЗГ | 1.6 [1.2–1.7 ] |
1.5 [1.0–2.2] |
0.060 | 2.1 [1.8–3.2 ] |
p1–2 = 0.977 p1–3 = 0.017 |
|
| А, мм | ОГ | 2.3 [2.0–2.7] |
3.6 [3.2–5.4 ] |
0.078 | 3.2 [2.4–3.5 ] |
p1–2 < 0.001 p1–3 = 0.046 |
| ЗГ | 2.9 [1.9–3.6 ] |
2.9 [2.6–3.6 ] |
0.795 | 2.9 [2.4–3.8 ] |
p1–2 = 0.583 p1–3 = 0.840 |
|
| RC (%) | 136 [119–152] |
80 [53–113] |
0.237 | 97 [74–132] |
p1–2 = 0.004 p1–3 = 0.064 |
|
Примечание: p – уровень значимости различий между пациентами с левосторонним и правосторонним РППС; p1–2; 1–3 – уровень значимости различий между здоровыми детьми и пациентами (критерий Манна-Уитни). Символом || обозначен модуль показателей; ОГ – тест с открытыми глазами, ЗГ – тест с закрытыми глазами. Полужирным шрифтом обозначены значения критерия p с приемлемым уровнем статистической значимости.
Анализ абсолютных величин смещения ЦД во фронтальной плоскости не выявил различий в медианных значениях координаты X между здоровыми детьми и обеими группами пациентов с РППС. При этом у пациентов направление отклонения ЦД влево или вправо от срединной оси было равновероятным и не зависело от стороны поражения плечевого сплетения. Оценка модульных значений параметра |X| показала значимое, по сравнению с нормой, и практически одинаковое в обеих группах больных латеральное отклонение ЦД от срединной оси во фронтальной плоскости при ОГ и ЗГ.
При анализе отклонения тела в сагиттальной плоскости (координата Y) выявлена значимая дестабилизация ЦД в обеих группах пациентов, независимо от участия в тестах зрительного анализатора. При этом у пациентов с правосторонним РППС наблюдалось значимое смещение ЦД вперед по сравнению со здоровыми детьми, в то время как у больных с левосторонним поражением плечевого сплетения отклонение ЦД в сагиттальной плоскости от нормы было равновероятным как в переднем, так и в заднем направлении (рис. 2).
Рис. 2.
Графическое отображение смещения центра давления (ЦД) пациентов с односторонним родовым повреждением плечевого сплетения (РППС) в сагиттальной плоскости при открытых и закрытых глазах. РППС-L – пациенты с левосторонним поражением; РППС-R – пациенты с правосторонним поражением.

В обеих группах пациентов показатель средней амплитуды колебаний ЦД А превышал таковой у здоровых детей только при ОГ, при этом параметр АОГ был более высоким при левостороннем поражении плечевого сплетения по сравнению с АОГ – при правостороннем. В то же время при левостороннем РППС наблюдалось снижение медианных показателей соотношений амплитуд ЦД тела в тестах с ОГ и ЗГ АЗГ/AОГ до величины 0.8, которое не было характерно для здоровых детей – 1.2 (p = 0.002) и больных с правосторонним РППС – 1.1 (p = 0.078). Медианные значения длины L, пройденной центром давления, в целом, были увеличены по сравнению с нормой у пациентов обеих групп. При этом значимое увеличение по сравнению с нормой показателей площади S статокинезиограмм было выявлено только у больных с левосторонним РППС при ОГ. Поквартильный анализ параметра S, в отличие от здоровых детей, не выявил у пациентов обеих групп исследования нарастания значений показателей при переходе от теста с ОГ к тесту с ЗГ, что обусловливает значимое снижение коэффициента Ромберга RC в обеих группах больных, по сравнению с нормой, с выраженной тенденцией к его уменьшению ниже 100%.
Параметр LFS в группе пациентов с правосторонним РППС во всех тестах был существенно выше по сравнению с таковым у пациентов с левосторонним поражением, независимо от участия зрительного анализатора. В то же время по сравнению со здоровыми детьми показатель LFSОГ был значимо ниже при левостороннем РППС, а LFSЗГ был значимо выше – при правостороннем.
Для систематизации соотношений статокинетических характеристик L, S и А был проведен корреляционный анализ, который позволил оценить зависимость параметра LFS от амплитуды колебаний А ЦД тела у здоровых детей и больных с односторонним РППС. При ОГ у пациентов обеих групп исследования, независимо от левой или правой стороны поражения плечевого сплетения, мультипликативная связь между параметрами LFS и А оказалась практически одинаковой – отрицательной с сильным коэффициентом корреляции rs, равным, соответственно, –0.80 и –0.82 (рис. 3, Б, В), который существенно превышал показатель здоровых детей: rs = –0.44 (рис. 3, А). В тестах с ЗГ у обследуемых происходило выключение зрительной афферентации, что в норме сопровождалось усилением связи LFS ~ А до rs = = –0.60 (рис. 3, Г). Аналогичное повышение силы корреляционных связей наблюдалось у пациентов с РППС. Однако, если у больных с левосторонним поражением плечевого сплетения нарастание rs было умеренным: до –0.87 (рис. 3, Д), то у больных с правосторонним поражением при закрывании глаз отмечалось резкое увеличение rs: до –0.99 (рис. 3, Е).
Рис. 3.
Линия регрессии (жирная) и ее доверительный интервал (тонкие линии) для характеристики корреляционной связи параметра LFS с амплитудой колебаний А центра давления тела при открытых (А, Б, В) и закрытых (Г, Д, Е) глазах. А – у здоровых детей (rs = –0.44; p = 0.148), Б – у больных с левосторонним родовым повреждением плечевого сплетения (РППС) (rs = –0.80; p = 0.002), В – у больных с правосторонним РППС (rs = –0.82; p = 0.001), Г – у здоровых детей (rs = –0.60; p = 0.043), Д – у больных с левосторонним РППС (rs = –0.87; p = 0.0002), Е – у больных с правосторонним РППС (rs = –0.99; p = 0.000).

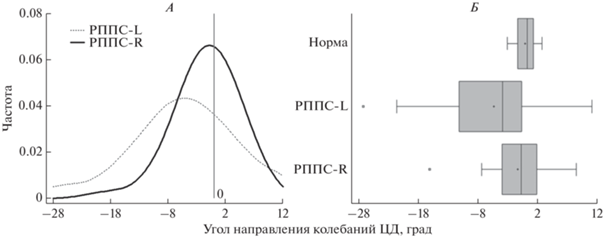
Анализ знаков угла направления колебаний ЦД Al выявил, что у больных с правосторонним РППС ось колебаний отклоняется от срединной сагиттальной оси равновероятно как в сторону поражения, так и в интактную (рис. 4). Такой характер распределения по медианному критерию не имеет значимых отличий от здоровых детей (p = 0.223). У пациентов с левосторонним РППС наблюдается отчетливая тенденция к отклонению оси колебаний от срединной сагиттальной оси в сторону поражения – влево, что по медианным показателям значимо отличается от пациентов с правосторонним поражением (p = 0.048) и от здоровых детей (p < 0.001).
Рис. 4.
Графическое отображение величин углов направления колебаний Al центра давления (ЦД) при открытых и закрытых глазах. А – различия между группами пациентов с родовым повреждением плечевого сплетения (РППС); Б – различия между здоровыми детьми и группами пациентов с РППС. РППС-L – пациенты с левосторонним поражением; РППС-R – пациенты с правосторонним поражением.
Для количественной оценки углов направления колебаний ЦД использовали модули значений угла Al. Предварительно оценивали величины углов Al у здоровых детей. В норме углы направления колебаний незначительно и одинаково отклоняются от сагиттальной оси, независимо от участия зрительного анализатора (рис. 5, табл. 2). У больных с левосторонним поражением плечевого сплетения выявлено резкое увеличение по сравнению со здоровыми детьми отклонения осей статокинезиограмм от сагиттальной оси как при открытых, так и при закрытых глазах (рис. 5, А). При этом в тестах с исключением зрительного контроля происходило значимое нарастание угла Al (табл. 2).
Рис. 5.
Графическое отображение величин углов направления колебаний Al центра давления на статокинезиограммах. А – пациенты с левосторонним родовым повреждением плечевого сплетения (РППС-L); Б – пациенты с правосторонним РППС (РППС-R). ОГ – тест с открытыми глазами, ЗГ – тест с закрытыми глазами.

Таблица 2.
Показатели величины угла направления колебаний центра давления статокинезиограмм здоровых детей и пациентов с родовым повреждением плечевого сплетения (РППС)
| Параметры | Группы обследованных детей | Критерий Манна-Уитни | ||||
|---|---|---|---|---|---|---|
| здоровые (1) Ме [Q1–Q2], n = 12 |
дети с РППС | |||||
| поражение слева (2) Ме [Q1–Q2], n = 12 |
pЛ–П | поражение справа (3) Ме [Q1–Q2], n = 12 |
||||
| |Al|, град | ОГ | 1.2 [1.0–1.7] |
4.1 [2.1–9.0] |
0.032 | 1.5 [1.1–2.8 ] |
p1–2 < 0.001 p1–3 = 0.248 |
| 0.931 | 0.035 | 0.030 | pОГ–ЗГ | |||
| ЗЗГ | 1.3 [0.8–2.0] |
11.0 [5.0–13.6] |
0.051 | 3.6 [2.2–5.3 ] |
p1–2 < 0.001 p1–3 < 0.001 |
|
| |ΔAl|, град | 0.8 [0.5–1.2] |
7.0 [1.4–10.2 ] |
0.078 | 2.1 [1.3–3.5 ] |
p1–2 < 0.001 p1–3 = 0.006 |
|
Примечание: pОГ–ЗГ – уровень значимости различий в тестах с ОГ и ЗГ (критерий Уилкоксона); pЛ–П – уровень значимости различий между группами с левосторонним и правосторонним поражением (критерий Манна-Уитни). Остальные обозначения см. табл. 1.
У пациентов с правосторонним поражением плечевого сплетения отклонение оси эллипса от сагиттальной оси значимо превышало нормальные значения угла Al только при ЗГ (табл. 2, рис. 5, Б). При сравнении квартилей параметра Al между группами пациентов было выявлено значимое превышение такового у больных с левосторонним поражением по сравнению с правосторонним, независимо от зрительного контроля.
В обеих группах больных как с левосторонним, так и с правосторонним РППС, разница в показателях угла направления колебаний ΔAl в тестах с ОГ и ЗГ значимо превышала таковую у здоровых детей. Однако у пациентов с левосторонним поражением плечевого сплетения показатель ΔAl с высоким уровнем значимости превышал ΔAl у пациентов с правосторонним поражением.
Анализ зависимости величины угла направления колебаний Al от величины смещения ЦД по оси X выявила отсутствие значимой корреляционной связи как при левостороннем (rs = –0.07; p = 0.714), так и при правостороннем (rs = 0.04; p = = 0.861) поражении плечевого сплетения. То есть, выраженность асимметрии распределения нагрузки между нижними конечностями у больных с РППС не влияла на величину угла направления колебаний.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В научной литературе подчеркивается существенная роль верхних конечностей в достижении общего постурального баланса, который нарушается при поражении плечевого сплетения [8]. В настоящем исследовании было продемонстрировано неодинаковое снижение постуральной стабильности у больных с последствиями одностороннего РППС, которое может быть обусловлено различающимися постуральными стратегиями, в зависимости от стороны поражения плечевого сплетения – справа или слева. О различиях в постуральных стратегиях можно было судить по следующим признакам. Отклонения ЦД от нормальных значений в сагиттальной плоскости в группах пациентов были разнонаправленные: смещение вперед – у пациентов с правосторонним РППС, равновероятное смещение в переднем и в заднем направлении – у пациентов с левосторонним РППС. Уменьшение по сравнению с нормой параметра LFS, которое характерно для детей с церебральными нарушениями [12], было выявлено только у больных с левосторонним поражением плечевого сплетения при ОГ. В то же время у пациентов с левосторонним РППС при ОГ, выявлено наиболее выраженное по сравнению с нормой увеличение амплитуды колебаний ЦД А, которое является патологическим и отмечается также у детей с поражением головного мозга [13]. Указанные факты свидетельствует в пользу концепции об инициации изменений в супраспинальных структурах при РППС, которые имеют различия в зависимости от стороны поражения.
В настоящем исследовании у пациентов с РППС обеих групп отмечено резкое усиление корреляционной связи между параметрами LFS и А по сравнению со здоровыми детьми. При этом сила связи LFS ~ А при правостороннем поражении значительно превышала таковую – при левостороннем. Различия в синхронизированности параметров системы управления вертикальным балансом у больных с РППС могут указывать на разную степень упорядоченности траектории ЦД, в зависимости от стороны поражения плечевого сплетения. Считается, что повышенная упорядоченность траектории ЦД может рассматриваться как динамический показатель дефицита постурального контроля у пациентов с поражениями центральной нервной системы (ЦНС) на уровне головного мозга [14, 15].
Выявленное у пациентов с РППС латеральное отклонение ЦД от срединной линии и, соответственно, частичное смещение веса тела на правую или левую нижнюю конечность было равновероятным и не зависело от стороны поражения плечевого сплетения. Известно, что асимметричное распределение нагрузки между контралатеральными нижними конечностями приводит к увеличению угла направления колебаний ЦД [16]. Однако в настоящем исследовании у пациентов с РППС, независимо от стороны поражения, подобная взаимосвязь не определялась. При этом у больных с левосторонним РППС ось колебаний ЦД отклонялась, преимущественно, в сторону поражения. В обеих группах пациентов с РППС, в отличие от здоровых детей, угол направления колебаний Al был увеличен и зависел от визуального контроля, что может свидетельствовать о снижении вертикальной устойчивости пациентов, более выраженном при выключении зрительной афферентации. При этом отклонения углов Al от сагиттальной оси у больных с левосторонним поражением плечевого сплетения были более значительными, чем с правосторонним. Увеличение угла направления колебаний при закрывании глаз у пациентов обеих обследованных групп не характерно для здоровых детей, у которых значения угла Al одинаковые в тестах с ОГ и ЗГ. Такая особенность кинематической модели вертикальной стойки у больных с повреждением плечевого сплетения свидетельствует о дестабилизации системы удержания вертикального баланса [10]. В обеих группах обследованных пациентов коэффициент Ромберга ниже нормы, что предполагает превалирование у них проприоцептивной системы над зрительной в системе контроля вертикальной позы. Однако анализ показателей углов Al свидетельствует о существенном вкладе зрительного анализатора в обеспечение постурального контроля у больных с РППС. Необходимо учитывать, что вопрос о преобладающем влиянии проприоцепции либо зрения на положение тела в пространстве, до сих пор, не выяснен [17]. Одновременно с этим констатируется ведущая роль правого полушария в обработке проприоцептивной информации, на что указывают более выраженные нарушения проприоцепции при правополушарных поражениях головного мозга по сравнению с левополушарными [18, 19]. Указанный сенсомоторный феномен обусловлен асимметрией структурно-функциональной организации коры головного мозга – церебральной латерализацией. Важнейшим проявлением функциональной асимметрии полушарий у человека также является неравнозначная функциональная специализация двигательных функций верхних конечностей. Общепризнанна связь между доминированием верхних конечностей и функцией мозга, поэтому у правшей функционально более активным считается левое полушарие, а у левшей – правое [20]. В настоящем исследовании невозможно было определить генетически обусловленное доминирование верхней конечности индивидуально у каждого ребенка с РППС, так как у всех пациентов ведущей являлась рука на непораженной стороне, вследствие выраженного снижения функции конечности – на пораженной. РППС случается у ребенка на таком этапе формирования моторики, когда отсутствует явное доминирование той или другой руки. Целенаправленные движения верхних конечностей начинаются только в возрасте 3–5 мес. [21], а доминирование руки, преимущественно правой, формируется у нормально развивающихся младенцев еще позже – через 7 мес. после рождения [22]. Однако с учетом того, что моторные программы новорожденных являются предшествующими формами локомоции взрослых [23], для интерпретации результатов исследования настоящей работы мы должны были допустить, что моторный онтогенез подавляющего большинства пациентов обеих групп в перинатальном периоде, как и у взрослых, был нацелен на “праворукость”, так как у 70–95% людей доминирующей является правая рука [24].
Таким образом, на основе вышесказанного мы исходили из того, что в обеих группах больных с РППС преобладали дети, у которых при рождении изначально доминантным являлось левое полушарие. В современной литературе имеются убедительные доказательства, свидетельствующие о реорганизации головного мозга после РППС [25]. В таком случае в рамках постулированного в настоящей работе предположения о генетически обусловленной межполушарной асимметрии в обеих группах детей с РППС, у пациентов с правосторонним поражением, надо полагать, имеет место функциональная реорганизация мозга преимущественно в доминантном полушарии, а у пациентов с левосторонним поражением – в субдоминантном. Кортикоспинальный механизм обеспечения постурального баланса у них формировался под влиянием измененной эфферентной импульсации из зон кортикальной пластичности. По-видимому, различия в постуральной стратегии у больных с левосторонним и правосторонним РППС были обусловлены характером моторных программ, сформированных по-разному, в зависимости от того, в каком из полушарий могла иметь место кортикальная реорганизация – в доминантном или субдоминантном. У таких пациентов сформированные в онтогенезе центральные моторные программы леворукости или праворукости могут не соответствовать исполнительным возможностям и потребностям неповрежденной верхней конечности, являющейся “вынужденным” доминирующим эффектором. Это сопровождается нарушениями сенсомоторных механизмов обеспечения локомоций в условиях одностороннего нарушения функции верхней конечности, проявляющихся по-разному, вероятно, в зависимости от вовлеченности в патологический процесс генетически предопределенной “доминирующей” руки. В ответ на травму периферической нервной системы запускаются адаптивные и дезадаптивные механизмы в ЦНС, инициирующие быстрые изменения кортикальной активности, которые могут оказывать положительное или отрицательное влияние на функциональные исходы при РППС [26]. Осложнения после РППС, такие как дефицит постурального контроля, влияют на весь организм, поэтому являются важным вопросом для изучения, поскольку лечение больных детей должно быть сосредоточено на всем теле, а не только на пораженной конечности [27]. Таким образом, имеет большое значение понимание роли не только периферической, но и центральной адаптации в регенерации плечевого сплетения после его родового повреждения. Это будет способствовать разработке новых методов многоуровневого воздействия на нервную систему у детей с РППС, позволяющих восстанавливать кинематическую модель организма и оптимизировать его двигательные функции благодаря эффективной активации сенсомоторных программ вертикального баланса.
ЗАКЛЮЧЕНИЕ
У детей с последствиями РППС было выявлено нарушение функции системы постурального контроля, о чем свидетельствуют дисбаланс вертикальной стойки, выраженные отклонения от показателей нормы статокинетических характеристик, патологическое повышение синхронизированности параметров системы управления вертикальным положением тела. При этом синхронность изменений параметров баланса значительно выше у пациентов с правосторонними поражениями верхней конечности. Комплексная оценка стабилометрических показателей свидетельствует о различающихся постуральных стратегиях обеспечения контроля позы у больных с левосторонним и правосторонним поражением плечевого сплетения, что может быть обусловлено отклонениями в механизмах организации движения на уровне головного мозга. У подавляющего числа пациентов с правосторонним РППС предполагается функциональная реорганизация мозга преимущественно в генетически предопределенном доминантном полушарии – левом, а у пациентов с левосторонним поражением – в субдоминантном правом. Патологические постуральные реакции у больных с односторонним поражением плечевого сплетения могут рассматриваться как критерий снижения адаптивных возможностей устойчивости позы под влиянием изменившихся эфферентных воздействий на опорно-двигательную систему со стороны доминантной или субдоминантной коры головного мозга. Полученные результаты исследования позволяют расширить представления о механизмах влияния ЦНС на постуральный баланс детей с РППС. Представленные данные могут быть использованы в клинической практике с целью воздействия на структуры ЦНС в комплексной программе реабилитации пациентов с данным заболеванием.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным этическим комитетом Национального медицинского исследовательского центра детской травматологии и ортопедии им. Г.И. Турнера Минздрава России (Санкт-Петербург).
Информированное согласие. От каждого участника исследования (или его законного представителя) было получено добровольное письменное информированное согласие после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа проведена в рамках выполнения Государственного задания Министерства здравоохранения РФ.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Вклад авторов в публикацию. И.Е. Никитюк – разработка методологии исследования, написание всех разделов статьи, сбор и обработка данных исследования, анализ полученных результатов. С.В. Виссарионов – идея исследования, формулировка цели, этапное и заключительное редактирование статьи.
Список литературы
Sullivan R., Dailey T., Duncan K. et al. Peripheral nerve injury: stem cell therapy and peripheral nerve transfer // Int. J. Mol. Sci. 2016. V. 17. № 12. P. 2101.
Neumann B., Linton C., Giordano-Santini R., Hilliard M.A. Axonal fusion: An alternative and efficient mechanism of nerve repair // Prog. Neurobiol. 2019. V. 173. P. 88.
Zink P.J., Philip B.A. Cortical plasticity in rehabilitation for upper extremity peripheral nerve injury: a scoping review // Am. J. Occup. Ther. 2020. V. 74. № 1. P. 7401205030p1.
Goswami R., Anastakis D.J., Katz J., Davis K.D. A longitudinal study of pain, personality, and brain plasticity following peripheral nerve injury // Pain. 2016. V. 157. № 3. P. 729.
Xing X.X., Zheng M.X., Hua X.Y. et al. Brain plasticity after peripheral nerve injury treatment with massage therapy based on resting-state functional magnetic resonance imaging // Neural Regen. Res. 2021. V. 16. № 2. P. 388.
Thaploo D., Bhat D.I., Kulkarni M.V., Devi B.I. Brachial plexus injury and resting-state fMRI: Need for consensus // Neurol. India. 2019. V. 67. № 3. P. 679.
Bellows D., Bucevska M., Verchere C. Coordination and balance in children with birth-related brachial plexus injury: a preliminary study // Physiother. Can. 2015. V. 67. № 2. P. 105.
Souza L., Lemos T., Silva D.C. et al. Balance impairments after brachial plexus injury as assessed through clinical and posturographic evaluation // Front. Hum. Neurosci. 2015. V. 9. P. 715.
Солопова И.А., Селионов В.А., Гареева Р.Р., Жванский Д.С. Влияние вибрационной стимуляции на моторные ответы в мышцах плеча при неподвижной руке и ее произвольных и вызванных движениях в условиях разгрузки конечностей // Физиология человека. 2018. Т. 44. № 4. С. 96. Solopova I.A., Selionov V.A., Gareeva R.R., Zhvansky D.S. Influence of vibration on motor responses in the upper arm muscles in stationary conditions and during voluntary and evoked arm movements in limb unloading conditions // Human Physiology. 2018. V. 44. № 4. P. 383.
Никитюк И.Е., Кононова Е.Л., Гаркавенко Ю.Е. Особенности нарушения баланса тела у детей с односторонним укорочением нижней конечности // Ортопедия, травматология и восстановительная хирургия детского возраста. 2019. Т. 7. № 3. С. 45. Nikityuk I.E., Kononova E.L., Garkavenko Yu.E. Characteristics of body balance disorder in children with unilateral lower limb shortening // Pediatric Traumatology, Orthopaedics and Reconstructive Surgery. 2019. V. 7. № 3. P. 45.
Казенников О.В., Киреева Т.Б., Шлыков В.Ю. Исследование вертикальной позы человека при стоянии с разной ориентацией стопы одной или обеих ног // Физиология человека. 2020. Т. 46. № 5. С. 37. Kazennikov O.V., Kireeva T.B., Shlykov V.Yu. Estimation of vertical position standing of human with different foot orientation of one or both legs // Human Physiology. 2020. V. 46. № 5. P. 492.
Никитюк И.Е., Кононова Е.Л., Икоева Г.А., Солохина И.Ю. Влияние роботизированной механотерапии в различных комбинациях с неинвазивной электростимуляцией мышц и спинного мозга на постуральный баланс у детей с тяжелыми формами ДЦП // Вестник восстановительной медицины. 2020. Т. 98. № 4. С. 26. Nikityuk I.E., Kononova E.L., Ikoeva G.A., Solokhina I.Yu. Influence of robotic mechanotherapy in various combinations with non-invasive electrostimulation of muscles and spinal cord on the postural balance in children with severe forms of cerebral palsy // Bulletin of Rehabilitation Medicine. 2020. V. 98. № 4. P. 26.
Никитюк И.Е., Мошонкина Т.Р., Щербакова Н.А. и др. Влияние локомоторной тренировки и функциональной электромиостимуляции на постуральные функции детей с тяжелыми формами ДЦП // Физиология человека. 2016. Т. 42. № 3. С. 37. Nikityuk I.E., Moshonkina T.R., Shcherbakova N.A. et al. Effects of locomotor training and functional electrical stimulation on postural function in children with severe cerebral palsy // Human Physiology. 2016. V. 42. № 3. P. 262.
Donker S.F., Ledebt A., Roerdink M. et al. Children with cerebral palsy exhibit greater and more regular postural sway than typically developing children // Exp. Brain Res. 2008. V. 184. № 3. P. 363.
Никитюк И.Е., Икоева Г.А., Кивоенко О.И. Система управления вертикальным балансом у детей с церебральным параличом более синхронизирована по сравнению со здоровыми детьми // Ортопедия, травматология и восстановительная хирургия детского возраста. 2017. Т. 5. № 3. С. 49. Nikityuk I.E., Ikoeva G.A., Kivoenko O.I. The vertical balance management system is more synchronized in children with cerebral paralysis than in healthy children // Pediatric Traumatology, Orthopaedics and Reconstructive Surgery. 2017. V. 5. № 3. P. 50.
Казенников О.В., Талис В.Л. Позные колебания человека при поворотах туловища в симметричной и асимметричной стойке // Физиология человека. 2019. Т. 45. № 4. С. 46. Kazennikov O.V., Talis V.L. Postural sway during body turn in symmetrical and asymmetrical standing in humans // Human Physiology. 2019. V. 45. № 4. P. 383.
Kuling I.A., van der Graaff M.C.W., Brenner E., Smeets J.B.J. Matching locations is not just matching sensory representations // Exp. Brain Res. 2017. V. 235. № 2. P. 533.
Naito E., Morita T., Amemiya K. Body representations in the human brain revealed by kinesthetic illusions and their essential contributions to motor control and corporeal awareness // Neurosci. Res. 2016. V. 104. P. 16.
Павлова О.Г., Рощин В.Ю., Сидорова М.В. и др. Метод качественной и количественной оценки восприятия движений в отдельных суставах руки // Физиология человека. 2018. Т. 44. № 4. С. 84. Pavlova O.G., Roschin V.Yu., Sidorova M.V. et al. Method for qualitative and quantitative assessment of proprioceptive perception of single-joint arm movements // Human Physiology. 2018. V. 44. № 4. P. 445.
Milenković S., Paunović K., Kocijančić D. Laterality in living beings, hand dominance, and cerebral lateralization // Srp. Arh. Celok. Lek. 2016. V. 144. № 5–6. P. 339.
Hadders-Algra M. Neural substrate and clinical significance of general movements: an update // Dev. Med. Child Neurol. 2018. V. 60. № 1. P. 39.
Hinojosa T., Sheu C.F., Michel G.F. Infant hand-use preferences for grasping objects contributes to the development of a hand-use preference for manipulating objects // Dev. Psychobiol. 2003. V. 43. № 4. P. 328.
Dewolf A.H., Labini F.S., Ivanenko Y., Lacquaniti F. Development of locomotor-related movements in early infancy // Front. Cell. Neurosci. 2021. V. 14. P. 623759.
Gutwinski S., Löscher A., Mahler L. et al. Understanding left-handedness // Dtsch. Arztebl. Int. 2011. V. 108. № 50. P. 849.
Longo E., Nishiyori R., Cruz T. et al. Obstetric brachial plexus palsy: can a unilateral birth onset peripheral injury significantly affect brain development? // Dev. Neurorehabil. 2020. V. 23. № 6. P. 375.
Simon N.G., Franz C.K., Gupta N. et al. Central adaptation following brachial plexus injury // World Neurosurg. 2016. V. 85. P. 325.
Ridgway E., Valicenti-McDermott M., Kornhaber L. et al. Effects from birth brachial plexus injury and postural control // J. Pediatr. 2013. V. 162. № 5. P. 1065.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


