Физиология человека, 2023, T. 49, № 2, стр. 5-17
Поиск функциональных маркеров включения гиппокампа в патологический процесс
Г. Н. Болдырева 1, А. Ю. Кулева 1, Е. В. Шарова 1, *, М. В. Галкин 2, Е. Л. Машеров 2, О. А. Кроткова 2
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 ФГАУ Национальный научно-практический центр нейрохирургии
имени академика Н.Н. Бурденко Минздрава России
Москва, Россия
* E-mail: esharova@nsi.ru
Поступила в редакцию 28.05.2022
После доработки 22.09.2022
Принята к публикации 18.11.2022
- EDN: MNQDVU
- DOI: 10.31857/S0131164622700217
Аннотация
Изучали особенности электроэнцефалограммы (ЭЭГ) и протекания зрительного запоминания у 27 пациентов с внемозговой опухолью медиобазальных отделов правого и левого полушарий. По данным нейровизуализации (магнитно-резонансная томография – МРТ) и морфометрии оценивали степень вовлечения в патологический процесс гиппокампа (ГП). К числу ЭЭГ-маркеров компримирующего воздействия опухоли на ГП была отнесена преимущественная сконцентрированность ирритативно-эпилептиформных знаков в пораженном полушарии, а также наличие эпизодов атипичного α-ритма в зоне проекции опухоли. Найдены признаки неидентичного включения в патологический процесс правого и левого ГП в виде преобладания по всей группе в целом ирритативных знаков в левом полушарии. Эквивалентные дипольные источники (ЭДИ) атипичного α-ритма в большей степени приурочены к гиппокампальным структурам, по сравнению с ирритативными паттернами ЭЭГ. Нейропсихологическое тестирование зрительного запоминания не выявило значимых нарушений мнестических процессов на данном этапе заболевания.
Уточнение особенностей участия разных церебральных структур в формировании механизмов работы поврежденного мозга человека является важной проблемой клинической нейрофизиологии и нейропсихологии. Особую актуальность эта проблема приобретает, в частности, при анализе реорганизации электроэнцефалограммы (ЭЭГ) в случаях поражения подкорковых и базальных структур мозга, когда интерпретация изменений ЭЭГ вызывает наибольшие трудности. Среди опухолей глубинных отделов мозга бесспорный интерес представляет анализ реорганизации ЭЭГ при включении в патологический процесс структур лимбической системы, в частности гиппокампа (ГП).
Это обусловлено тем, что ГП принимает участие в обеспечении управляющих функций [1, 2], эмоциональных реакций [3, 4], а также в поддержании пространственных [5, 6] и мнестических процессов [7–10]. В последние десятилетия наблюдается тенденция к разграничению функций левого и правого ГП, при этом левый ГП связывают с вербально опосредованной эпизодической памятью [11], тогда как правый – с обработкой зрительно-пространственной информации [12].
Важно отметить, что основная часть данных об ЭЭГ-коррелятах дисфункции ГП у человека была получена в рамках клинико-электрофизиологических исследований височной эпилепсии [13–17]. При этом основной акцент авторы делают на анализе эпилептиформных знаков, а при оценке ритмических составляющих ЭЭГ – на их реактивные перестройки при когнитивных пробах.
Моделью для изучения роли гиппокампальных структур в формировании рисунка ЭЭГ может служить исследование пациентов с внемозговой, медленно растущей доброкачественной опухолью (менингиомой), расположенной в непосредственной близости к медиобазальным отделам височной доли. Эти опухоли могли сопровождаться разной степенью компримирующего воздействия на ГП. Пациенты поступали в НМИЦ Нейрохирургии им. акад. Н.Н. Бурденко (г. Москва) для прохождения стереотаксической радиотерапии (РТ) с целью предотвращения дальнейшего роста опухоли. В литературе имеются сведения о том, что ГП может вынужденно получать дозу, сопоставимую с дозой в опухоли в результате проводимой РТ [18]. Кроме того, есть указания на то, что проводимая РТ может приводить к частичному нарушению функций памяти [19, 20]. В связи с этим, проведение ЭЭГ-исследования и нейропсихологического тестирования (НТ) у данной категории пациентов может быть перспективным в поиске ЭЭГ-маркеров дисфункции ГП и уточнении его включенности в организацию мнестической деятельности человека.
Можно полагать, что привлечение современных возможностей нейровизуализации, позволяющей определить степень структурной детерминированности разных паттернов электрической активности мозга, а также определение зон их генерации, может быть перспективным в поисках функциональных маркеров включения ГП в патологический процесс.
Цель работы заключалась в выявлении особенностей реорганизации ЭЭГ и протекания процессов зрительного запоминания у пациентов с внемозговой опухолью медиобазальных отделов мозга, с акцентом на включение в патологический процесс гиппокампальных структур правого или левого полушария.
МЕТОДИКА
Основную группу наблюдения составляли 27 пациентов с менингиомами медиобазальных отделов мозга. У 12 пациентов (средний возраст 50 ± 10 лет; 10 женщин) опухоль локализовалась справа, у 15 пациентов (средний возраст 53 ± 10 лет; 13 женщин) – слева. Для морфологического контроля использовали данные нейровизуализации (магнитно-резонансная томография (МРТ) 1.5 Т, томограф GE Healthcare, США), полученные в отделении радиохирургии и радиотерапии НМИЦ Нейрохирургии им. акад. Н.Н. Бурденко (г. Москва). Для морфометрической оценки опухоли и ГП проводил их оконтуривание в системе дозиметрического планирования iPlan (BrainLab, Германия).
ЭЭГ регистрировали в состоянии покоя с закрытыми глазами на 18-канальном электроэнцефалографе на базе программно-вычислительного комплекса Нейрокартограф (МБН, Россия). Электроды располагали по Международной схеме 10–20%. Проводили визуальный анализ паттернов ЭЭГ: определяли и формализовали особенности выраженности α-ритма (его пространственное распределение, амплитуду, симметричность проявления) и ирритативно-эпилептиформных знаков, а также определяли частоту их повторения на отрезке ЭЭГ. Для сопоставления распределения отдельных патологических паттернов ЭЭГ между группами пациентов использовали критерий χ2 (Хи-квадрат) Пирсона.
У 6 пациентов c наиболее выраженными патологическими паттернами ЭЭГ проводили трехмерную локализацию эквивалентных дипольных источников (ЭДИ) с использованием программы BrainLoc, алгоритм которой был описан ранее [21].
Для определения ЭДИ атипичных форм α-ритма использовали фильтрованные ЭЭГ-реализации в соответствующем частотном диапазоне. Для определения ЭДИ эпилептической активности выбирали сечения на ЭЭГ, соответственно проявлению максимально выраженных эпилептиформных колебаний. Применяли однодипольную модель локализации источников. Достоверность результатов оценивали, исходя из величины коэффициента дипольности (КД); учитывали ЭДИ с КД > 0.93. Результаты представляли точками на 8 срезах изображений мозга, в соответствии с анатомическим атласом Y. Gambarelli et al. [22]. При сопоставлении индивидуальных МРТ-данных пациента с результатами локализации ЭДИ использовали серии изображений формата .jpg, содержащие подряд идущие с одинаковым шагом срезы изображений головного мозга (толщиной 1.1 мм) аксиальной ориентации.
У всех 27 пациентов было проведено НТ зрительного запоминания, которое осуществляли по оригинальной методике Айтрекер-Внимание-Память (АВП) [23]. Последовательно предъявляли 5 стимулов, состоящих из трех расположенных в ряд цветных картинок. Через 10 мин проводили процедуру свободного воспроизведения (“СВ”): требовали вспомнить и назвать ранее предъявляемые картинки. Еще через 20 мин выполняли процедуру узнавания (“У”): участникам предъявляли набор из 30 картинок, в который входили идентичные исходным, несколько видоизмененные и совершенно новые стимулы, среди которых требовали опознать исходные оригинальные изображения. Все ответы протоколировали и в % определяли количество ошибок от максимально возможного по каждому заданию. Группу контроля при НТ составил 21 здоровый испытуемый-правша (средний возраст 34 ± 19.1; 17 женщин).
Статистический анализ полученных данных проводили на базе пакета программы IBM SPSS Statistics Ver.21, с использованием непараметрического критерия Вилкоксона–Манна–Уитни, различия признавали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
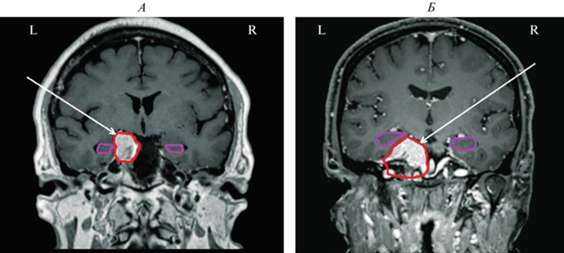
Анализ особенностей реорганизации ЭЭГ у пациентов проводился с учетом данных МРТ, характеризующих отношение опухоли к правому и левому ГП. Согласно этим данным, пациенты были разделены на две группы: в 17 случаях опухоль оказывала компримирующий эффект на ГП (правостороннее поражение – n = 7, левостороннее – n = 10), у 10 пациентов эта структура не подвергалась компрессии со стороны опухоли. На рис. 1 приводятся МРТ снимки мозга двух пациентов с поражением медиобазальных отделов мозга с оконтуриванием опухоли и ГП, позволяющим наглядно представить их соотношения. В случае отсутствия признаков воздействия опухоли на ГП (рис. 1, А) видно, что оба ГП расположены симметрично относительно средней линии; в случае компримирующего воздействия опухоли на ГП (рис. 1, Б), ГП на стороне опухоли смещен вверх и кнаружи.
Рис. 1.
Магнитно-резонансная томография (МРТ) во фронтальной проекции, демонстрирующей степень компримирующего воздействия опухоли на гиппокамп (ГП). А – без воздействия опухоли на ГП (пац. З.); Б – с воздействием опухоли на ГП (пац. М.); стрелкой показана опухоль. L – левое, R – правое полушарие.
Проведенная с использованием оконтуривания опухоли и ГП морфометрическая оценка не выявила статистически значимых различий их объемов в исследуемых группах пациентов с право- и левосторонней локализацией опухоли (табл. 1).
Таблица 1.
Морфометрические данные, полученные при оконтуривании опухоли и гиппокампа (ГП) в системе дозиметрического планирования iPlan
| Морфометрические показатели | Пациенты с правосторонним поражением (n = 12) | Пациенты с левосторонним поражением (n = 15) |
|---|---|---|
| Объем опухоли, см3 | 21.75 ± 9.60 | 25.98 ± 11.94 |
| Объем ГП на стороне поражения, см3 | 3.43 ± 0.38 | 3.13 ± 0.39 |
| Объем контралатерального, “здорового” ГП, см3 | 3.33 ± 0.44 | 3.13 ± 0.36 |
Изменения ЭЭГ пациентов с латерализованным внемозговым опухолевым поражением медиобазальных отделов височной доли отличались неоднородностью и носили преимущественно диффузный характер. Очаговые медленные волны и фокальные эпилептиформные проявления не выявлялись, что было обусловлено небольшими размерами менингиом. На основании визуального анализа паттерна ЭЭГ были выделены наиболее характерные патологические паттерны изменений, которые проявлялись изолированно или сочетались в разных комбинациях.
У 33% пациентов изменения ЭЭГ характеризовались снижением уровня электрической активности с доминированием во всех отделах коры частых колебаний β-диапазона синхронизированного типа. Эти ирритативные признаки проявлялись без межполушарных различий и сочетались с полной или частичной редукцией α-ритма. Хотя частота встречаемости измененных по ирритативному типу ЭЭГ строго не коррелировала с фактором наличия или отсутствия компримирующего воздействия опухоли на ГП, однако несколько выше она отмечалась у пациентов с наличием такого влияния по данным морфометрии (47% в группе с воздействием опухоли на ГП, 30% – в группе без воздействия).
Характерным признаком реорганизации ЭЭГ у пациентов являлось наличие ирритативно-эпилептиформных знаков в виде острых волн (одиночных или групповых), превосходящих по амплитуде уровень фоновой активности; негрубых единичных пик-волновых комплексов; пароксизмальных вспышек экзальтированных α-волн. Эти феномены, отмечавшиеся в 82% случаев, были выражены диффузно, проявляясь с переменным преобладанием сторон, или с устойчивой межполушарной асимметрией, чаще с превалированием на стороне опухоли. Последний вариант продемонстрирован на рис. 2, А. Было установлено, что частота указанных выше эпилептиформных знаков в пораженном полушарии была статистически выше (p < 0.05) в группе пациентов с воздействием опухоли на ГП, чем у пациентов с отсутствием этого воздействия (53 и 10% соответственно), что указывало на причастность гиппокампальных структур к генерации ирритативно-эпилептиформных знаков на ЭЭГ (табл. 2).
Рис. 2.
Разные варианты локализации эпилептиформных знаков в электроэнцефалограмме (ЭЭГ) при поражении медиобазальных отделов мозга. А – эпилептиформные знаки в пораженном полушарии (пац. Он-ко с воздействием опухоли на левый гиппокамп (ГП)); Б – эпилептиформные знаки в “здоровом” полушарии (пац. Т-ва с левосторонним поражением без компримирующего воздействия опухоли на ГП).

Таблица 2.
Частота встречаемости патологических паттернов электроэнцефалограммы (ЭЭГ) при вовлечении в патологический процесс гиппокампальных структур
| Группы пациентов | Снижение уровня эл. активности | Выраженность эпилептиформных феноменов | Атипичные формы α-активности | |||
|---|---|---|---|---|---|---|
| переменное преобладание сторон | преобладание в больном полушарии | преобладание в здоровом полушарии | “диэнцефа- льный” α-ритм | “гиппокам- пальный” α-ритм | ||
| Группа без механического воздействия опухоли на гиппокамп (ГП), n = 10 | 30% | 20% | 10% | 60% | 30% | 10%* |
| Группа с механическим воздействием опухоли на ГП, n = 17 | 47% | 12%* | 53%* | 12%* | 41% | 41%* |
| Группа с механическим воздействием опухоли на правый ГП, n = 7 | 57% | 15% | 43% | 15% | 29% | 29% |
| Группа с механическим воздействием опухоли на левый ГП, n = 10 | 40% | 10% | 60% | 10% | 50% | 50% |
Вариант межполушарной асимметрии в форме преобладания ирритативно-эпилептиформных знаков не на стороне опухоли, а в противоположном полушарии, отмечался преимущественно у пациентов с отсутствием компримирующего воздействия опухоли на ГП (рис. 2, Б). При наличии гиппокампального фактора преобладание указанных феноменов в интактном полушарии чаще отмечалось при правосторонней локализации опухоли, отражая неидентичность включения правого и левого ГП в генерацию эпилептиформных знаков ЭЭГ. Эти особенности проявления межполушарной асимметрии обеспечивали по всей группе пациентов в целом тенденцию преобладания случаев наличия эпи-знаков в левой гемисфере, по сравнению с правой (60 и 43%, соответственно, табл. 2).
Наряду с ирритативно-эпилептиформными знаками, характерной формой реорганизации ЭЭГ, отмечавшейся в 71% случаев, было нарушение пространственной организации α-ритма. Чаще это выражалось в его генерализации по коре, или в перемещении фокуса α-активности из задних в передние корковые зоны. Подобные формы нарушения топографии α-ритма носили эпизодический характер, проявлялись билатерально или с большей выраженностью на стороне расположения опухоли (рис. 3, А).
Рис. 3.
Атипичные формы α-ритма при поражении медиобазальных отделов мозга. А – “диэнцефальный” α-ритм (воздействие опухоли на левый гиппокамп (ГП) у пац. О.); Б – “гиппокампальный” α‑ритм (воздействие опухоли на правый ГП у пац. Р.). Сплошная линия – усиление α-ритма в зоне проекции опухоли; пунктирная – редукция α-ритма в задних отделах пораженного полушария.

Как показали ранее проведенные нами исследования, подобный тип нарушения пространственной организации α-ритма, был характерен для поражения таламо-гипоталамических структур мозга, что позволило условно обозначить его как “диэнцефальный” α-ритм [24]. Измененный по “диэнцефальному” типу α-ритм отмечался у пациентов обеих групп, без статистически значимых различий частоты встречаемости при наличии и отсутствии компрессии ГП со стороны опухоли (табл. 2).
Другой, более редкой (29% от общей выборки) формой изменения топографии α-ритма у пациентов было наличие эпизодов увеличения его амплитуды в пораженном полушарии, в зоне проекции опухоли, в центрально-височной области (рис. 3, Б). Важно подчеркнуть, что усиление α-ритма в зоне проекции опухоли (отмечено сплошной линией) сочеталось с редукцией α-активности в задних отделах пораженного полушария (отмечено пунктиром). Это свидетельствует о независимом характере происхождения этой атипичной формы α-активности от затылочного α-ритма.
В ранее проведенных нами исследованиях было обнаружено, что подобный тип изменения топографии α-ритма характерен для начальной стадии роста опухоли медиобазальных отделов височной доли. Было высказано предположение об участии гиппокампальных структур в генерации этой атипичной формы α-активности [25]. В настоящем исследовании, опирающемся на данные нейровизуализации, было показано, что этот паттерн ЭЭГ, условно обозначенный нами как “гиппокампальный” α-ритм, достоверно чаще (p < < 0.05) отмечался в группе пациентов с компримирующим воздействием опухоли на ГП, что подтверждает предположение о причастности этой структуры мозга к его формированию.
Важным моментом анализа ЭЭГ исследованных пациентов было определение зон генерации выявленных патологических паттернов ЭЭГ в объеме головного мозга с помощью нахождения их ЭДИ. Эффективность этого подхода для уточнения структурной детерминированности разных форм электрической активности мозга человека в норме и патологии была показана в целом ряде исследований [21, 26–33].
В настоящей работе был проведен поиск ЭДИ предполагаемых ЭЭГ-маркеров включения ГП в патологический процесс: описанных выше ирритативно-эпилептиформных знаков, а также атипичной формы α-ритма. Анализ локализации ЭДИ эпилептиформных знаков ЭЭГ у пациентов с компрессией ГП выявил диффузную картину зон их генерации, включая морфологически неизмененные структуры мозга, как на стороне расположения опухоли, так и в условно “здоровом” полушарии.
На рис. 4, А приведены ЭДИ эпилептиформных паттернов ЭЭГ пациентки О-ой, 53 лет, с опухолью, оказывающей компримирующее воздействие на левый ГП. На ЭЭГ (рис. 4, А, а) эпилептиформные знаки в виде групп острых колебаний локализовались в центрально-лобной области левого полушария. На схематичных изображениях срезов мозга (рис. 4, А, б) и при наложении на индивидуальные МРТ (рис. 4, А, в) источники этой активности локализованы в теменно-затылочной и шпорной бороздах пораженного полушария (6 срез), а также в интактном полушарии, в язычковой извилине (6 срез) и зубчатых ядрах мозжечка (8 срез). Источники в ГП или иных лимбических образованиях (а также в тканях, прилежащих к опухоли) отсутствовали.
Рис. 4.
Разные варианты эквивалентных дипольных источников (ЭДИ) эпилептиформных паттернов электроэнцефалограммы (ЭЭГ) в объеме головного мозга у пациентов с воздействием опухоли на левый гиппокамп (ГП). А – пациентка О-ая; Б – пациентка И-на. а – анализируемый паттерн ЭЭГ; б – локализация ЭДИ на аксиальных срезах изображений мозга в программе BrainLoc (номера срезов соответствуют нумерации срезов в атласе Y. Gambarelli et al. [22]); в – локализация ЭДИ, наложенная на соответствующие МРТ-изображения мозга. Коэффициент дипольности (КД) > 0.93.

Наряду с отмеченной диффузной картиной локализации ЭДИ ирритативно-эпилептиформных знаков, не затрагивающих ГП, в двух случаях была отмечена выраженная приуроченность источников этого паттерна ЭЭГ к гиппокампальным структурам. На рис. 4, Б приведены результаты локализации ЭДИ эпилептиформных паттернов у пациентки И-ой, 54 лет, с опухолью, воздействующей на левый ГП. На ЭЭГ (рис. 4, Б, а) в пораженном полушарии отмечался эпилептиформный комплекс, несколько более отчетливо выраженный в передних корковых областях слева. ЭДИ этого паттерна приурочены к зоне вовлеченных в патологический процесс гиппокампальных структур левого полушария (рис. 4, Б, б, в): ГП, миндалина, островок, нижняя лобная и верхняя височная извилины (7 срез); миндалина с направлением ориентации источника в сторону средней височной извилины (8 срез).
Определение ЭДИ другого предполагаемого ЭЭГ-маркера компрессии ГП, проявляющегося в эпизодах усиления α-ритма в зоне проекции опухоли (“гиппокампального” α-ритма), в 5 из 6 случаев обнаружило выраженную привязку этого паттерна ЭЭГ к расположению его ЭДИ в гиппокампальных структурах. На рис. 5, А представлены результаты локализации ЭДИ “гиппокампального” α-ритма у пациента Р-на, 49 лет, с менингиомой, воздействующей на правый ГП. Данный паттерн ЭЭГ характеризовался наличием эпизодов усиления α-ритма в передних отделах пораженного правого полушария, сочетающегося с его редукцией в задних отделах коры на стороне опухоли (рис. 5, А, а). ЭДИ этого паттерна локализовались (рис. 5, А, б, в) в пораженном правом полушарии: 7 срез – ГП, амигдала, черная субстанция, ножка мозга, парагиппокампальная извилина; 8 срез – парагиппокампальная извилина.
Рис. 5.
Эквивалентные дипольные источники (ЭДИ) “гиппокампального” α-ритма электроэнцефалограммы (ЭЭГ) в объеме головного мозга у пациентов с поражением медиобазальных отделов мозга. А – воздействие опухоли на правый гиппокамп (ГП) (пац. Р-ин). Б – воздействие опухоли на левый ГП (пац. Д-ко). Коэффициент дипольности (КД) > 0.93. Остальные обозначения см. рис. 4.

На рис. 5, б представлены результаты ЭДИ “гиппокампального” α-ритма у пациентки Д-ко, 59 лет, с менингиомой, воздействующей на левый ГП. На ЭЭГ (рис. 5, Б, а) отмечается локальное проявление “гиппокампального” α-ритма в левой центрально-лобной области. ЭДИ этого паттерна (рис. 5, Б, б, в) строго приурочены к ГП (6 срез) и нижнему рогу бокового желудочка (7 срез) в пораженном левом полушарии.
Приведенные примеры подтверждают правомерность интерпретации наличия анализируемой формы атипичной α-активности как отражения активации вовлеченного в патологический процесс структур гиппокампального комплекса.
Нейропсихологическое исследование по результатам двух тестов методики АВП не выявило статистически значимых различий показателей зрительного запоминания у исследованных пациентов по сравнению с нормативными данными. Это касалось пациентов как с отсутствием, так и с наличием компримирующего воздействия опухоли на ГП (табл. 3). Эти данные согласуются с ранее полученными результатами специально проведенного исследования динамики мнестических функций в ходе РТ [34].
Таблица 3.
Результаты статистического анализа количества ошибок по методике Айтрекер–Внимание–Память (АВП) для пациентов в сравнении с контрольной группой
| Группы испытуемых | Задание “Свободное воспроизведение” | Задание “Узнавание” | ||
|---|---|---|---|---|
| (Me) | р | (Me) | р | |
| Контрольная группа здоровых испытуемых, n = 21 | 20 | – | 13.3 | – |
| Пациенты без давления опухоли на ГП, n = 10 | 33.3 | 0.85 | 28.3 | 0.07 |
| Пациенты с давлением опухоли на ГП, n = 17 | 26.7 | 0.25 | 20 | 0.22 |
| Правостороннее поражение при давлении опухоли на ГП, n = 7 | 26.7 | 0.47 | 13.3 | 0.85 |
| Левостороннее поражение при давлении опухоли на ГП, n = 10 | 26.7 | 0.28 | 25 | 0.11 |
При этом можно отметить, что выявленная тенденция нарастания (по сравнению с нормой) числа ошибок как при непосредственном вербальном воспроизведении, так и при отсроченном узнавании была более выражена у пациентов с отсутствием компрессии ГП. Кроме того, было установлено, что в группе пациентов с компрессией ГП в тесте “СВ” при право- и левостороннем поражении отмечалось одинаково выраженная тенденция увеличения числа ошибок, по сравнению с нормой. В тесте “У” эта тенденция отмечалась только при компрессии левого ГП.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенный нами анализ паттерна электрической активности мозга пациентов с менингиомами медиобазальных отделов височной доли, показал, что одним из наиболее характерных признаков реорганизации ЭЭГ является наличие характерных ирритативно-эпилептиформных знаков, проявляющихся без признаков ограниченного фокуса в коре, с переменным преобладанием сторон. Сопоставление этих особенностей реорганизации ЭЭГ с данными МРТ показало, что в качестве одного из вероятных маркеров компримирующего воздействия опухоли на гиппокампальные структуры можно рассматривать устойчивое, статистически значимое преобладание признаков функционального раздражения на стороне вовлеченного в патологический процесс ГП. Наряду с этим, было установлено, что вариант межполушарной асимметрии в виде преобладания ирритативно-эпилептиформных знаков в интактном полушарии чаще отмечался при сдавливании опухолью правого ГП. С учетом данных морфометрии, свидетельствующих об отсутствии статистически значимых различий в объемах ГП интереса и опухоли в группах с право- и левосторонним поражением, выявленные полушарные особенности “паттернов раздражения” ЭЭГ, можно рассматривать как отражение неидентичного характера включения правого и левого ГП в патологический процесс, приводящего к преобладанию ирритативно-эпилептиформных знаков по всей группе исследуемых пациентов в целом в левом полушарии.
Рассматривая межполушарную асимметрию в качестве одной из фундаментальных основ формирования механизмов работы мозга, многие авторы также отмечают большую реактивность левого полушария. Это касается работы как здорового, так и больного мозга при разных нозологических формах его поражения [35, 36]. Полученные нами данные, наряду с результатами целого ряда экспериментальных и клинических исследований [37–40] показывают, что важный вклад в формирование межполушарной асимметрии ЭЭГ вносят глубинные отделы мозга, в частности, структуры гиппокампального комплекса.
Следует подчеркнуть, что, анализируя возможные ЭЭГ-маркеры включения ГП в патологический процесс в исследованиях больных с височной эпилепсией, авторы основной акцент делали на анализ эпилептиформных знаков. Лишь в отдельных работах, при рассмотрении изменений ЭЭГ при когнитивных пробах у данной категории больных, анализировались особенности реактивности ритмических составляющих ЭЭГ – θ- и γ-диапазонов частот [15–17].
В нашей работе было установлено, что ЭЭГ-паттерном, коррелирующим с гиппокампальным фактором, являлось наличие эпизодов усиления α-ритма в зоне проекции вовлеченного в патологический процесс ГП, в центрально-височной области на стороне опухоли. Эта форма нарушения топографии α-ритма, условно обозначенная как “гиппокампальный” α-ритм, приводила к инверсии межполушарной асимметрии этих областей по отношению к затылочным отделам мозга.
В литературе описаны некоторые аналоги выявленной нами атипичной формы α-ритма в виде “височной” α-активности [41–43], однако данные о ее генезе крайне противоречивы и недостаточны, чтобы судить о ее происхождении. В проведенном нами ранее ЭЭГ-исследовании пациентов с менингиомами, расположенными в области крыльев основной кости (медиобазальные отделы височной доли), было показано, что наличие эпизодов усиления α-ритма в височной области пораженного полушария является одним из наиболее ранних признаков развития патологического процесса. Использование в этой работе специально разработанной программы дипольной локализации – DIPVIS, где анатомическими ориентирами была желудочковая система, позволило установить, что источники этого ритма локализуются в области нижнего рога бокового желудочка, дно и стенки которого образуют ГП [44].
Исследованные в настоящей работе пациенты отличались менее однородной по своей локализации опухолью, чем изученная ранее группа [44]; компрессия ГП имела вторичный характер, являясь сопутствующим росту опухоли фактором. В связи с этим, подобная картина проявления α-ритма отмечалась в относительно небольшом числе случаев. Кроме того, идентификация этого ритма была затруднена тем, что он часто проявлялся одновременно со вспышками генерализованных экзальтированных α-колебаний, также преобладающих на стороне расположения опухоли. Вместе с тем, результаты ЭДИ позволили обнаружить выраженную привязку этого предполагаемого ЭЭГ-маркера компрессии ГП к расположению его ЭДИ.
Проведенное НТ у пациентов не выявило статистически значимых изменений в протекании процессов кратковременной зрительной памяти, даже в случае компримирующего воздействия опухоли на гиппокампальные структуры. Эти данные согласуются с результатами исследований, показавших, что одностороннее повреждение медиобазальных височных отделов мозга, как правило, не приводит к выраженным нарушениям памяти [10, 34].
Выявленная в нашей работе тенденция нарастания числа ошибок при НТ зрительной памяти у пациентов имела свои особенности, определяемые фактором наличия или отсутствия компримирующего воздействия опухоли на ГП, характером используемых при НТ методик, латерализацией поражения. Эти результаты можно рассматривать в качестве предварительных, требующих подтверждения на более крупной выборке пациентов.
Помимо самостоятельного интереса, полученные данные являются опорными в дальнейшей оценке динамики развития патологического процесса при РТ и уточнения структурной детерминированности мнестических процессов у исследуемой категории пациентов.
ВЫВОДЫ
1. Анализ ЭЭГ при латерализованном внемозговом опухолевом поражении медиобазальных структур мозга, проведенный в сопоставлении с данными нейровизуализации, показал, что в качестве возможных ЭЭГ-маркеров компримирующего воздействия опухоли на гиппокамп можно рассматривать преимущественную сконцентрированность ирритативно-эпилептиформных знаков в пораженном полушарии и наличие эпизодов усиления α-ритма в зоне проекции опухоли (“гиппокампальный” α-ритм).
2. Анализ особенностей паттерна ЭЭГ при разной латерализации поражения, выполненный с учетом морфометрических данных, выявил признаки неидентичного включения правого и левого гиппокампов в патологический процесс, приводящего к преобладанию ирритативно-эпилептиформных знаков по всей группе в целом в левом полушарии.
3. Эквивалентные дипольные источники “гиппокампального” α-ритма были в большей степени приурочены к гиппокампальным структурам, по сравнению с аналогичными источниками характерных для исследованной группы пациентов ирритативно-эпилептиформных паттернов ЭЭГ.
4. Нейропсихологическое тестирование зрительного запоминания не выявило значимых нарушений исследуемых процессов в группе наблюдений – как при отсутствии, так и при наличии компримирующего воздействия опухоли на гиппокамп.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института высшей нервной деятельности и нейрофизиологии РАН (Москва) и Национального научно-практического центра нейрохирургии им. академика Н.Н. Бурденко Минздрава России (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа поддержана РНФ (грант № 17-15-01426) (частично), а также средствами Государственного бюджета.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Mishkin M., Ungerleider L.G., Macko K.A. Object vision and spatial vision: two cortical pathways // Trends Neurosci. 1983. V. 6. P. 414.
Мачинская Р.И. Управляющие системы мозга // Журн. высш. нерв. деят. им. И.П. Павлова. 2015. Т. 65. № 1. С. 33. Machinskaya R.I. [The brain executive systems] // Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 2015. V. 65. № 1. P. 33.
Симонов П.В. Эмоциональный мозг. М.: Наука, 1981. С. 20.
Park G., Thayer J.F. From the heart to the mind: cardiac vagal tone modulates top-down and bottom-up visual perception and attention to emotional stimuli // Front. Psychol. 2014. V. 5. P. 278.
O’Keefe J., Nadel L. The Hippocampus as a Cognitive Map. Oxford: Clarendon Press, 1978. 570 p.
Brunec I.K., Robin J., Patai E.Z. et al. Cognitive mapping style relates to posterior–anterior hippocampal volume ratio // Hippocampus. 2019. V. 29. № 8. P. 748.
Брагина Н.Н. Клинические синдромы поражения гиппокампа. М.: Медицина, 1974. 215 с.
Виноградова О.С. Гиппокамп и память. М.: Наука, 1975. 333 с.
Scoville W.B., Milner B. Loss of recent memory after bilateral hippocampal lesions // J. Neurol. Neurosurg. Psychiatry. 1957. V. 20. № 1. P. 11.
Буклина С.Б. Нарушения высших психических функций при поражении глубинных и стволовых структур мозга. М.: МЕДпресс-информ, 2017. 312 с.
Bonner-Jackson A., Mahmoud S., Miller J. et al. Verbal and non-verbal memory and hippocampal volumes in a memory clinic population // Alzheimers Res. Ther. 2015. V. 7. № 1. P. 61.
Banks S.J., Jones–Gotman M., Ladowski D. et al. Sex differences in the medial temporal lobe during encoding and recognition of pseudowords and abstract designs // Neuroimage. 2012. V. 59. № 2. P. 1888.
Зенков Л.Р. Клиническая эпилептология (с элементами нейрофизиологии). М.: МИА, 2002. 416 с.
Amin U., Benbadis S.R. The Role of EEG in the Erroneous Diagnosis of Epilepsy // Clin. Neurophysiol. 2019. V. 36. № 4. P. 294.
Kota S., Rugg M.D., Lega B.C. Hippocampal Theta Oscillations Support Successful Associative Memory Formation // J. Neurosci. 2020. V. 40. № 49. P. 9507.
Treder M.S., Charest I., Michelmann S. et al. The hippocampus as the switchboard between perception and memory // Proc. Natl. Acad. Sci. USA. 2021. V. 118. № 50. P. e2114171118.
Nicolás B., Sala-Padró J., Cucurell D. et al. Theta rhythm supports hippocampus-dependent integrative encoding in schematic/semantic memory networks // NeuroImage. 2021. V. 226. P. 117558.
Rogers L., Barani I., Chamberlain M. et al. Meningiomas: knowledge base, treatment outcomes, and uncertainties. A RANO review // J. Neurosurg. 2015. V. 122. № 1. P. 4.
Kazda T., Jancalek R., Pospisil P. et al. Why and how to spare the hippocampus during brain radiotherapy: the developing role of hippocampal avoidance in cranial radiotherapy // Radiat. Oncol. 2014. V. 9. № 1. P. 139.
Kim K., Wee C., Seok J. et al. Hippocampus-sparing radiotherapy using volumetric modulated arc therapy (VMAT) to the primary brain tumor: the result of dosimetric study and neurocognitive function assessment // Radiat. Oncol. 2018. V. 13. № 1. P. 29.
Коптелов Ю.М., Гнездицкий В.В. Анализ “скальповых потенциальных полей” и трехмерная локализация источников эпилептической активности мозга человека // Журн. неврол. психиатр. им. С.С. Корсакова. 1989. Т. 89. № 6. С. 11. Koptelov Yu.M., Gnezditskii V.V. [Analysis of scalp potential fields and the three-dimensional localization of sources of epileptic activity in the human brain] // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. 1989. V. 89. № 6. P. 11.
Gambarelli Y., Gurinel G., Cherrot L. et al. Computerized axial tomography: (An anatomic atlas of sections of the human body: Anatomy-rachiology-scannes) // Berlin: Heidelbetg N.Y., 1977. 286 p.
Кроткова О.А., Каверина М.Ю., Данилов Г.В. и др. Движения глаз и межполушарное взаимодействие при распределении внимания в пространстве // Физиология человека. 2018. Т. 44. № 2. С. 66. Krotkova O.A., Kaverina M.Yu., Danilov G.V. et al. Eye tracking and interhemispheric interaction in the distribution of spatial attention // Human Physiology. 2018. V. 44. № 2. P. 175.
Болдырева Г.Н. Нейрофизиологический анализ поражения лимбико-диэнцефальных структур мозга человека. Краснодар: Экоинвест, 2009. 231 с.
Болдырева Г.Н. Атипичные формы церебральной альфа-активности при поражении регуляторных структур мозга человека // Физиология человека. 2018. Т. 44. № 3. С. 14. Boldyreva G.N. Atypical forms of cerebral alpha activity when human brain regulatory structures are damaged // Human Physiology. 2018. V. 44. № 3. P. 246.
Attal Y., Schwartz D. Assessment of subcortical source localization using deep brain activity imaging model with minimum norm operators: a MEG study // PLoS One. 2013. V. 8. № 3. P. e59856.
Krishnaswamy P., Obregon-Henao G., Ahvenin J. et al. Sparsity enables estimation of both subcortical and cortical activity from MEG and EEG // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 48. P. E10465.
Andersen L.M., Jerbi K., Dalal S.S. Can EEG and MEG detect signals from the human cerebellum? // Neuroimage. 2020. V. 15. № 215. P. 116817.
Hnazaee M.F., Wittevrongel B., Khachatryan E. et al. Localization of deep brain activity with scalp and subdural EEG // NeuroImage. 2020. V. 223. P. 117344.
Бирюкова Е.В., Бобров П.Д. Нейрореабилитация с применением экзоскелета руки, управляемого интерфейсом “мозг-компьютер”: реализованный междисциплинарный проект // Авиакосм. и эколог. мед. 2020. Т. 54. № 6. С. 116. Birukova E.V., Bobrov P.D. Neurorehabilitation with the use of arm exoskeleton controlled by a brain-computer interface: implemented interdisciplinary project // Human Physiology. 2021. V. 47. № 7. P. 709.
Верхлюдов В.М., Щучкин Е.В., Ушаков В.Л. и др. Оценка локализации дипольного момента источников альфа- и тета-ритмов ЭЭГ с использованием кластерного анализа в норме и у больных шизофренией // Журн. высш. нерв. деят. им. И.П. Павлова. 2006. Т. 56. № 1. С. 47. Verkhlyutov V.M., Shchuchkin Yu.V., Ushakov V.L. et al. [Estimation of localization and dipole moment of alpha- and theta-rhythm sources by cluster analysis in healthy subjects and schizophrenics] // Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 2006. V. 56. № 1. P. 47.
Фролов А.А., Бирюкова Е.В., Бобров П.Д. и др. Принципы нейрореабилитации, основанные на интерфейс мозг-компьютер и биологически адекватного управления экзоскелетоном // Физиология человека. 2013. Т. 39. № 2. С. 99. Frolov A.A., Biryukova E.V., Bobrov P.D. et al. Principles of neurorehabilitation based on the brain-computer interface and biologically adequate control of the exoskeleton // Human Physiology. 2013. V. 39. № 2. P. 196.
Болдырева Г.Н., Шарова Е.В., Коптелов Ю.М. и др. Исследование генеза патологических паттернов ЭЭГ при опухолевом и травматическом поражении мозга человека // Физиология человека. 2005. Т. 31. № 1. С. 24. Boldyreva G.N., Sharova E.V., Koptelov Yu.M. et al. Study of the genesis of pathological EEG patterns in tumor and traumatic lesions of the human brain // Human Physiology. 2005. V. 31. № 1. P. 18.
Кроткова О.А., Кулева А.Ю., Галкин М.В. и др. Факторы модуляции памяти при лучевом воздействии на гиппокамп // Соврем. Технол. Мед. 2021. Т. 13. № 4. С. 6. Krotkova O.A., Kuleva A.Yu., Galkin M.V. et al. [Memory modulation factors in hippocampus exposed to radiation] // Sovrem. Tehnol. Med. 2021. V. 13. № 4. P. 6.
Zhavoronkova L., Moraresku S., Boldyreva G. et al. FMRI and EEG Reactions to hand motor tasks in patients with mild traumatic brain injury: left-hemispheric sensitivity to trauma // JBBS. 2019. V. 9. № 6. P. 273.
Кулева А.Ю., Шарова Е.В., Болдырева Г.Н. и др. Особенности функциональной коннективности головного мозга в состоянии покоя у пациентов с латерализованным поражением медиобазальных отделов височной доли (данные фМРТ и ЭЭГ) // Журн. высш. нерв. деят. им. И.П. Павлова. 2022. Т. 72. № 2. С. 187. Kuleva A.Yu., Sharova E.V., Boldyreva G.N. et al. [Resting-state features of the brain functional connectivity in patients with lateralized temporal mediobasal lesions (fMRI and EEG data)] // Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 2022. V. 72. № 2. P. 187.
Болдырева Г.Н., Шарова Е.В., Добронравова И.С. Роль регуляторных структур в формировании ЭЭГ человека // Физиология человека. 2000. Т. 26. № 5. С. 19. Boldyreva G.N., Sharova E.V., Dobronravova I.S. [The role of cerebral regulatory structures in formation of the human EEG] // Fiziologiia Cheloveka. 2000. V. 26. № 5. P. 19.
Raynal E., Schnider A., Manuel A.L. Early signal from the hippocampus for memory encoding // Hippocampus. 2020. V. 30. № 2. P. 114.
Bing Ni, Ruijie Wu, Tao Yu et al. Role of the Hippocampus in Distinct Memory Traces: Timing of Match and Mismatch Enhancement Revealed by Intracranial Recording // Neurosci. Bull. 2017. V. 33. № 6. P. 664.
Астахова Е.А., Черенкова С.Э., Марченко Е.В. и др. Взаимоотношение биоэлектрической активности и структурных изменений в гиппокампе при височной фармакорезистентной эпилепсии // Трансляционная медицина. 2021. Т. 8. № 2. С. 5. Astakhova E.A., Cherenkova S.E., Marchenko E.V. et al. [The relationship of bioelectric activity and structural changes in the hippocampus at pharmacoresistant temporal lobe epilepsy] // Translyatsionnaya Meditsina 2021. V. 8. № 2. P. 5.
Hughes J.R., Cayaffa J.J. The EEG in patients at different ages without organic cerebral disease // EEG Clin. Neurophysiol. 1977. V. 42. № 6. P. 776.
Visser S.L., Hooijer C., Jonker C. et al. Anterior temporal focal abnormalities in normal aged subjects: correlations with psychopatological and CT brain scan findings // EEG Clin. Neurophysiol. 1987. V. 66. № 1. P. 1.
Niedermeyer E. The “Third Rhythm”: alpha-like activity over the midtemporal region // Am. J. EEG Technol. 1993. V. 33. № 3. P. 159.
Фролов А.А., Болдырева Г.Н., Коптелов Ю.М. Поиск источников патологической альфа-активности ЭЭГ человека при поражении лимбических структур // Журн. высш. нерв. деят. им. И.П. Павлова. 1998. Т. 48. № 4. С. 687. Frolov A.A., Boldyreva G.N., Koptelov Yu.M. [Sources of pathological EEG alpha-activity in patients with lesions of limbic structures] // Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. V. 48. № 4. P. 687.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


