Физиология человека, 2023, T. 49, № 4, стр. 16-29
Влияние слуховой пространственной маскировки на межполушарную асимметрию вызванных ответов
Л. Б. Шестопалова 1, *, **, Е. А. Петропавловская 1, Д. А. Саликова 1, В. В. Семенова 1
1 ФГБОУН Институт физиологии имени И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: shestopalovalb@infran.ru
** E-mail: shestolido@mail.ru
Поступила в редакцию 08.11.2022
После доработки 26.01.2023
Принята к публикации 21.02.2023
- EDN: XBLNJV
- DOI: 10.31857/S0131164622600811
Аннотация
Работа направлена на исследование межполушарной асимметрии электрической активности мозга в условиях слуховой пространственной маскировки. Использованы неподвижные маскеры различной латерализации и движущиеся тестовые сигналы. Пространственные эффекты создавали за счет межушных различий по интенсивности. Регистрировали ответы на включение сигнала (ON-ответ), на начало движения (motion-onset response, MOR) и на выключение сигнала (OFF-ответ) при предъявлении на фоне маскера и в тишине. Для построения топограмм и анализа асимметрии измеряли амплитуды каждого компонента реакции, усредненные в симметричных электродных кластерах левого и правого полушарий. Анализ ON-ответов показал, что волна N1 демонстрирует контралатеральное преобладание при предъявлении сигнала в тишине, а при маскировке контралатеральность усиливается. Межполушарная асимметрия компонента P2 отсутствовала при предъявлении сигнала в тишине, а во всех комбинациях маскера и сигнала амплитуда P2 была больше в правом полушарии. Асимметрия обоих компонентов была максимальной при разнесении маскера и начального участка сигнала на 180 град. Напротив, в реакции на начало движения (MOR) асимметрия проявлялась только в тишине: волна cN1 была более выражена на стороне, контралатеральной сигналу. Топография OFF-ответа не зависела от присутствия маскера.
Важнейшими признаками, по которым слуховая система человека определяет азимутальное положение источников звука, являются межушная задержка по времени (∆T) и/или межушные различия по интенсивности (∆I). Известны две базовые концепции, описывающие проявления функциональной асимметрии при обработке пространственных признаков звуковых сигналов: контралатеральное доминирование (большая роль отводится полушарию мозга, контралатеральному стороне звуковой стимуляции) и правостороннее доминирование (преобладающая роль приписывается правой слуховой коре). Обе концепции получили значительное количество экспериментальных подтверждений [1]. В то же время имеются свидетельства более сложной картины латерализации мозговой активности, получившей название “модель игнорирования” (neglect model) и описывающей различия в степени контралатеральности между левой и правой слуховой корой [2]. Согласно этой модели, правое полушарие реагирует на звуковые сигналы с левой и с правой стороны, создавая глобальное представление акустического пространства, тогда как левое полушарие реагирует в основном на сигналы, поступающие из контралатеральной (правой) стороны пространства (неподвижные сигналы: [3–5]; движущиеся сигналы: [6, 7]; угловые смещения за счет переключения динамиков: [8]).
В реальной звуковой среде человек сталкивается с необходимостью ориентироваться в потоке звуков, приходящих одновременно от разных источников. Если восприятие одного сигнала ухудшается в присутствии других сигналов, то такое ухудшение восприятия называют маскировкой. Пространственная маскировка наиболее выражена, когда межушные различия (по времени, фазе или интенсивности) в маскере и сигнале близки. Когда пространственные параметры маскера и сигнала становятся различны, и угловое расстояние между ними растет, наблюдается освобождение от маскировки (spatial release from masking, SRM [9]).
Большая часть работ, посвященных освобождению от маскировки, выполнена с применением неподвижных сигналов [9]. Литература относительно маскировки стимулов с изменяющимися пространственными признаками образует довольно мозаичную картину. Имеются экспериментальные свидетельства того, что движение звукового стимула приводит к улучшению его обнаружения по сравнению с неподвижным сигналом, расположенным в его начальной точке [10, 11]. Было установлено, что при введении в тестовый сигнал изменений ∆T в середине, в начале или в конце сигнала, наиболее сильной маскировке диотическим маскером (∆T = 0, ∆I = 0) подвержены сигналы с ∆T = 0 в начале. При введении изменяющихся межушных различий по интенсивности (∆I) уровень маскировки не зависел от того, в какой части стимула величина ∆I была минимальной [12]. В нескольких работах было показано, что движение само по себе, как отдельный признак, не способствовало разделению конкурирующих звуковых потоков и не являлось фактором, улучшающим распознавание тестовых стимулов [13–15]. Таким образом, до сих пор, остается невыясненным, приводит ли движение звукового стимула к улучшению его восприятия в условиях маскировки по сравнению с неподвижным сигналом.
Также во многом незавершенным остается описание нейрональных основ пространственной маскировки, в отличие от ее психофизических проявлений. В частности, представляют интерес изменения топографии активности мозга, вызванной звуковой стимуляцией в условиях пространственной маскировки и в тишине. Настоящее исследование посвящено именно этим вопросам.
Современный подход к изучению нейрональных реакций на движение звука предполагает разнесение во времени момента включения стимула и начала его движения (отсроченное движение). Это позволяет исследовать реакцию на движение отдельно от неспецифического ответа на включение звука (ON-ответа), показателями которого считаются компоненты вызванного потенциала N1 и P2. Ответ на начало движения (motion-onset response, MOR) состоит из раннего негативного (cN1) и последующего позитивного компонентов (cP2) [6, 16, 17]. Амплитуда компонентов cN1 и cP2 монотонно увеличивается с ростом скорости движения, а их латентность уменьшается [17–20].
Настоящая работа направлена на выяснение вопроса об изменениях топографии потенциалов мозга, вызванных стимулами с отсроченным движением в тишине и в условиях пространственной маскировки неподвижными маскерами разной латерализации. Применялась парадигма пространственной маскировки некоррелированных шумовых сигналов в условиях пассивного прослушивания. Поставлена задача проанализировать топографию вызванных ответов на включение звука (компоненты N1 и P2 ON-ответа), на начало его движения (cN1 и cP2 MOR-ответа) и на выключение звука (компоненты N1 и P2 OFF-ответа).
МЕТОДИКА
В экспериментах принимали участие 18 праворуких испытуемых (6 мужчин и 12 женщин) в возрасте от 18 до 45 лет (средний возраст 27.8 ± 1.4 лет) с нормальным слухом и без истории неврологических заболеваний (по отчетам испытуемых).
Условия эксперимента. До участия в экспериментах все испытуемые проходили предварительное тестирование – опрос о состоянии здоровья, стандартную процедуру тональной аудиометрии и тест Н.Н. Брагиной и Т.А. Доброхотовой [21] для определения коэффициента праворукости. Был установлен следующий критерий нормального слуха: отклонение монауральных порогов слышимости от популяционной кривой менее чем на 10 дБ в диапазоне частот от 125 Гц до 10 кГц, при разнице порогов левого и правого уха не более 10 дБ в частотном диапазоне ниже 500 Гц, 5 дБ от 500 до 1500 Гц и 10 дБ выше 2 кГц.
Во время экспериментов испытуемых располагали в кресле внутри экранированной звукоизолированной камеры. Испытуемым дихотическим способом предъявляли звуковые сигналы, и при этом вели запись электроэнцефалограммы (ЭЭГ). Во время звуковой стимуляции испытуемые читали книгу по своему выбору. Подробное описание синтеза сигналов и процедуры эксперимента изложено в нашей предыдущей работе [22].
Стимулы. Исходными сигналами служили два отрезка белого шума, синтезированные с частотой дискретизации 96 кГц и фильтрованные в полосе 200–10 000 Гц. Шумовые посылки, используемые в дальнейшем для создания тестового и маскирующего стимулов (сигнала и маскера, соответственно), были синтезированы независимо, что обеспечивало отсутствие корреляции между ними. Это позволяет создавать два независимых слуховых образа при одновременном предъявлении стимулов, созданных на основе некоррелированных шумовых посылок. Все звуковые стимулы преобразовывали в аналоговую форму при помощи многоканальной аудиоплаты Gina24 (Echo Audio, США) и предъявляли дихотически с помощью звукоизлучателей Etymotic ER-2 (Etymotic Research Inc., США). Звуководы излучателей фиксировали в слуховых проходах с помощью ушных вставок, которые обеспечивали подавление внешних шумов на 30 дБ.
Пространственное положение всех стимулов задавали величиной межушных различий по интенсивности (ΔI). В эксперименте использовали три типа маскеров, различавшихся только пространственным положением (ΔI = –10, 0 и +10 дБ) и обозначенных как левый, центральный и правый (рис. 1). Эти стимулы вызывали ощущение неподвижного звукового образа, расположенного вблизи левого уха, либо около средней линии головы, либо у правого уха. Длительность предъявления каждого маскера составляла 9070 мс.
Рис. 1.
Схема взаимного расположения звукового сигнала и маскера в четырех экспериментальных условиях (А) и расположение электродов на голове испытуемого (Б). Стрелками обозначены траектории движения звуковых стимулов, крестиками – положение маскера. Пунктиром показаны кластеры электродов для статистического анализа в левом (ЛП) и правом (ПП) полушариях мозга.
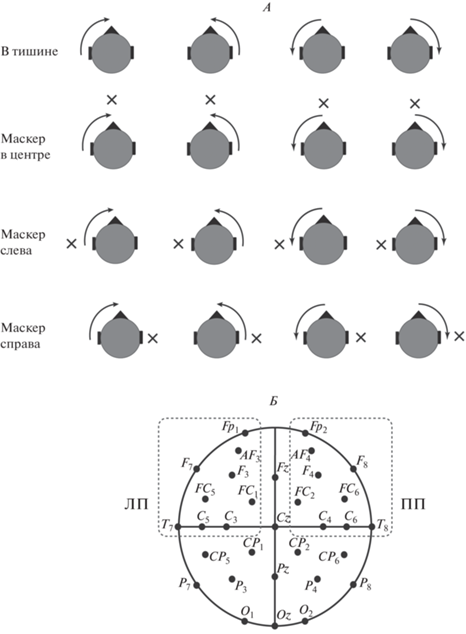
Тестовые сигналы состояли из трех фрагментов, следующих друг за другом без паузы: 1) начального стационарного участка длительностью 1000 мс с постоянной величиной ΔI, равной 0 или ±10 дБ, 2) участка движения длительностью 200 или 400 мс с линейным изменением ΔI (от 0 до ±10 дБ и от ±10 до 0 дБ), 3) конечного стационарного участка длительностью 800 или 600 мс соответственно, с постоянной конечной величиной ΔI, равной ±10 или 0 дБ. Полная длительность тестового сигнала составляла 2000 мс. Данные стимулы вызывали сначала ощущение неподвижного звукового образа, а затем его плавного движения. Расчетные угловые скорости движения стимулов на втором участке, вычисленные на основе соотношения “10 дБ = 90 град”, составили 450 град/с (быстрый) и 225 град/с (медленный) для длительностей участка движения 200 или 400 мс соответственно. Выбор диапазона скоростей определяли граничными условиями формирования потенциала MOR: нижняя граница расчетной скорости при дихотической стимуляции составляет приблизительно 90 град/с [20]. Для проведения исследования были выбраны скорости, позволяющие в тишине получить выраженный электрофизиологический ответ.
В условиях одновременной маскировки тестовые стимулы предъявляли на фоне непрерывно звучащего маскера. За время звучания маскера тестовый стимул повторяли три раза. Интервал между включением маскера и первого тестового сигнала, как и интервалы от конца одного стимула до начала другого, составляли по 770 мс. Отставление начала тестового стимула от маскера позволяло разделить реакции на включение сигнала и на включение маскера. Временнáя структура эпохи стимуляции в условиях обособленного предъявления тестовых стимулов (в тишине, без маскера) была точно такой же, как в условиях маскировки.
Процедура эксперимента. Измерение монауральных порогов и центрирование звукового образа описаны в работе [22]. Интенсивность сигнала на обоих каналах устанавливали на уровне 45 дБ над монауральными порогами слышимости. Интенсивность маскера превосходила тестовый стимул на 5 дБ. Суммирование тестового сигнала и маскера в условиях маскировки приводило к увеличению общей интенсивности стимулов на 6 дБ.
Тип экспериментальной серии определялся пространственным положением маскера (Центральный, Левый, Правый) и скоростью движения тестового стимула (медленный, быстрый), т.е. следовал принципу “одна серия – один маскер” и “одна серия – одна скорость”. Вид тестового стимула определялся скоростью (медленно, быстро) и направлением движения в его среднем фрагменте (от центра влево или вправо, либо слева или справа к центру). Все серии состояли из 8 видов стимулов: 4 вида стимулов без маскера и те же 4 вида в сочетании с маскером (центральным, левым или правым в разных сериях). В пределах одной серии эпохи стимуляции чередовались в квазислучайном порядке, причем эпохи без маскера повторялись по 3 раза, а эпохи с маскером – по 8 раз. Этим обеспечивалось уравновешивание количества ответов для каждого вида стимулов, поскольку эпохи без маскера были одними и теми же в сериях с разным положением маскера. Межстимульный интервал от начала эпохи до начала следующей был фиксирован и составлял 10 000 мс, включая паузу 930 мс между окончанием одной эпохи и началом следующей. Серии каждого типа предъявляли минимум 4 раза каждому из испытуемых. Чередование серий было рандомизировано индивидуально и по всей группе. Каждый из видов эпох с маскером был предъявлен испытуемому минимум 32 раза, что соответствовало (с учетом трехкратного повторения стимулов) предъявлению 96 тестовых сигналов каждого вида. Запись одной серии продолжалась около 8 мин. В течение одного экспериментального дня на одном испытуемом записывали по 6–8 серий. Таким образом, каждый испытуемый проходил эксперимент в течение 3–4 дней с интервалом 1–2 нед.
Регистрация и обработка ЭЭГ. Регистрацию ЭЭГ проводили при помощи хлорсеребряных электродов, в 32 точках по международной системе 10–20, с заменой точек отведения PO3/PO4 на C5/C6. Дополнительные электроды располагали на мочках ушей. Горизонтальную и вертикальную электроокулограммы записывали при помощи электродов, установленных над правым глазом и под левым глазом, ближе к их внешнему краю. Активность регистрировали с помощью энцефалографа ActiveTwo (Biosemi, Голландия) и специально разработанной программы, обеспечивающей фильтрацию сигналов и запись на жесткий диск компьютера. ЭЭГ оцифровывали в полосе 0–102 Гц с частотой дискретизации 2048 Гц с последующим понижением до частоты 512 Гц.
Непрерывную запись ЭЭГ разбивали на эпохи длительностью 10 000 мс. Эпохи, содержащие нестереотипные артефакты, удаляли вручную на основе визуального поиска избыточных изменений потенциала в большинстве каналов (не более 2% эпох). После этого вычисляли потенциал в каждом канале относительно усредненного потенциала всех электродов, и фильтровали в диапазоне 0.5–45 Гц. Оставшиеся артефакты удаляли при помощи метода анализа независимых компонент (ICA), основанного на алгоритме infomax и реализованного в модуле EEGLab среды MATLAB [23]. После устранения артефактов ЭЭГ восстанавливали, и в качестве референса принимали усредненный потенциал электродов на мочках ушей. Затем проводили коррекцию ЭЭГ относительно базовой линии по предстимульному участку длительностью 930 мс перед началом маскера.
Анализ данных. Для получения вызванных потенциалов (ВП) ЭЭГ дополнительно фильтровали в полосе 2–30 Гц. Записи ЭЭГ в каждом из 32 каналов усредняли отдельно по всем типам стимулов для каждого испытуемого. Формирование выборок для анализа ответов в каждом канале на включение (ON-ответ), на начало движения (MOR) и на выключение сигнала (OFF-ответ) происходило следующим образом:
1) в пределах каждой эпохи выделяли участки, соответствующие реакции на каждое из трех повторений тестового сигнала, и усредняли их между собой;
2) усредняли реакции на одинаковые стимулы в тишине, регистрируемые в качестве контроля в сериях с разным положением маскера. Таким образом, для анализа потенциала MOR были сформированы выборки участков ЭЭГ, содержавших ВП на начало движения, отдельно для каждой скорости и направления движения. Для каждого условия у каждого испытуемого в среднем было отобрано и усреднено 97 ± 1 (среднее ± ст. ошибка) участков ЭЭГ;
3) для анализа ON- и OFF-ответов в каждом из условий усредняли реакции на сигналы, содержавшие разные скорости во втором временнóм фрагменте (изменения ΔI в течение 200 или 400 мс), а для ответов на центральные участки сигналов усредняли также реакции на разные направления движения (для ON-ответов – влево и вправо от центра, для OFF-ответов – слева и справа к центру). В результате были сформированы выборки участков ЭЭГ, содержавших ВП на включение и на выключение сигнала в трех возможных положениях (слева, справа или в центре), звучащего в тишине либо на фоне левого, центрального или правого маскера. Для анализа MOR этого усреднения не делали.
С учетом устранения артефактов, в среднем у каждого испытуемого для дальнейшего анализа ON- и OFF-ответов было отобрано 394 ± 12 участков ЭЭГ для центрального положения сигнала и по 197 ± 6 участков ЭЭГ для левого и правого.
Для анализа межполушарной асимметрии вызванной активности были выделены симметричные электродные кластеры в левом (FC1, Fp1, AF3, F3, C3, FC5, C5, F7, T7) и правом полушарии (FC2, Fp2, AF4, F4, C4, FC6, C6, F8, Т8) (рис. 1, Б). Индивидуальные данные ЭЭГ этих отведений усредняли в левом и правом кластере для каждого из экспериментальных условий (рис. 1, А). Для получения гранд-усредненных потенциалов в каждом условии и каждом кластере проводили усреднение по группе в целом. Для определения пиковой латентности каждого из компонентов ВП, относительно которой центрируется временнóе окно при измерении ВП в обоих кластерах, индивидуальные записи ЭЭГ для каждого условия и каждого события усредняли по симметричной группе 24 фронто-центральных электродов (Fz, Cz, Fp1, AF3, F3, F7, FC1, FC5, C3, C5, T7, CP1, CP5, Fp2, AF4, F4, F8, FC2, FC6, C4, C6, Т8, CP2 и CP6).
В левом и правом кластерах индивидуальные значения средних амплитуд компонентов N1, P2 и N2 ON- и OFF-ответов, а также компонентов cN1 и cP2 MOR, определяли в окне шириной 50 мс, центрированном на соответствующем пике потенциала, усредненного по всей выборке (n = 18) и по группе 24 электродов. Измеренные амплитуды ON- и OFF-ответов подвергали 3-факторному дисперсионному анализу (repeated measures ANOVA, rmANOVA) с факторами Маскер (без маскера, левый, центральный, правый), Сигнал (левый, центральный, правый) и Полушарие (левое, правое). Амплитуды компонентов cN1 и cP2 MOR подвергали 4-факторному дисперсионному анализу (repeated measures ANOVA, rmANOVA) с факторами Маскер (без маскера, левый, центральный, правый), Скорость сигнала (быстро, медленно), Направление (от центра влево, от центра вправо, слева к центру, справа к центру) и Полушарие (левое, правое). Для всех компонентов реакции межполушарную асимметрию рассматривали как взаимодействия, включающие фактор Полушарие.
При отклонении данных от сферичности применяли поправку к степеням свободы Гринхауза-Гайссера. При проведении множественных сравнений применяли поправку Бонферрони. Все сравнения проводили с уровнем значимости p < < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
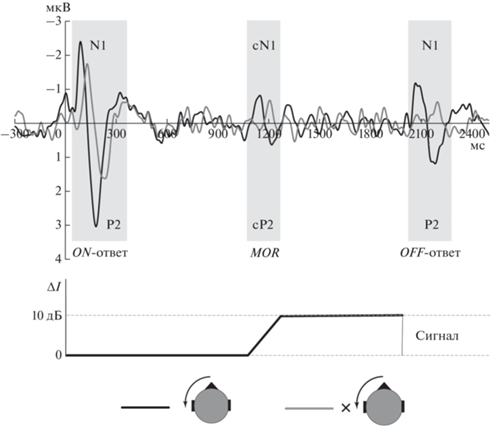
ВП на тестовый сигнал в условиях маскировки. Пример ВП в реакции на тестовый сигнал, предъявленный в тишине или на фоне маскера, приведен на рис. 2. Маскировка оказывала существенное влияние как на амплитуду, так и на латентность основных колебаний ВП. Компоненты N1, P2 и N2 в условиях маскировки развивались позже и достигали меньшей величины, чем в реакции на сигнал в тишине. Подробное исследование влияния пространственной маскировки на параметры ВП описано в работе [22].
Рис. 2.
Пример вызванных потенциалов в реакции на тестовый сигнал без маскера (черная кривая) и в присутствии маскера (серая кривая). Усреднение по группе 24 фронто-центральных электродов и по всей выборке испытуемых (n = 18). В нижней части – схематическое изображение тестового звукового сигнала относительно времени развития вызванного ответа.
Межполушарная асимметрия ON-ответа. Пространственное распределение амплитуд компонентов N1 и P2 ON-ответа существенно изменялось в зависимости от взаимного расположения сигнала и маскера (рис. 3 и 4). Количественная оценка межполушарной асимметрии реакций на тестовый сигнал в тишине и в условиях маскировки проводилась путем сравнения амплитуд основных компонентов ВП в реакциях левого и правого электродных кластеров (FC1, Fp1, AF3, F3, C3, FC5, C5, F7, T7 и FC2, Fp2, AF4, F4, C4, FC6, C6, F8, Т8). Дисперсионный анализ (rmANOVA) средних амплитуд компонентов N1, P2 и N2 (Маскер (без маскера, левый, центральный, правый) × Сигнал (левый, центральный, правый) × Полушарие (левое, правое)) выявил значимые главные эффекты Маскера и Сигнала для всех трех компонентов. Результаты rmANOVA приведены в табл. 1. Главный эффект полушария был обнаружен только для компонента P2: в правом полушарии амплитуда P2 была больше, чем в левом (p < 0.05). Результаты попарных сравнений для 3-факторного взаимодействия показаны на рис. 3 и 4: пунктирными рамками выделены случаи достоверных различий (p < 0.05).
Рис. 3.
Топография амплитуды компонента N1 ответа на включение (ON-ответ) в четырех условиях: в тишине, а также при разном взаимном расположении маскера и сигнала (гранд-усреднение, n = 18). Для построения топограмм использованы амплитуды N1 в каждом отведении, усредненные в окне шириной 50 мс, центрированном на пике соответствующего ответа, усредненного по группе 24 фронто-центральных электродов. Пиковые латентности, использованные для центрирования временны́х окон, приведены под топограммами. Градиентная шкала показывает величину ответа (мкВ). Кружками обозначены начальные точки траекторий движущихся сигналов, крестиками показано положение маскера. Черным пунктиром обозначены статически значимые межполушарные различия, серым пунктиром – случаи пограничной статистической значимости.
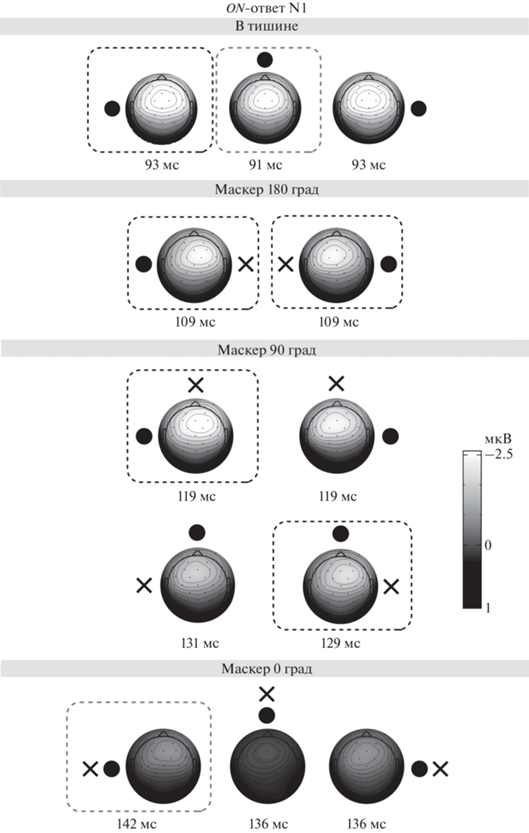
Рис. 4.
Топография амплитуды компонента P2 ответа на включение (ON-ответ) в четырех условиях: в тишине, а также при разном взаимном расположении маскера и сигнала (гранд-усреднение, n = 18). Остальные обозначения см. рис. 3.
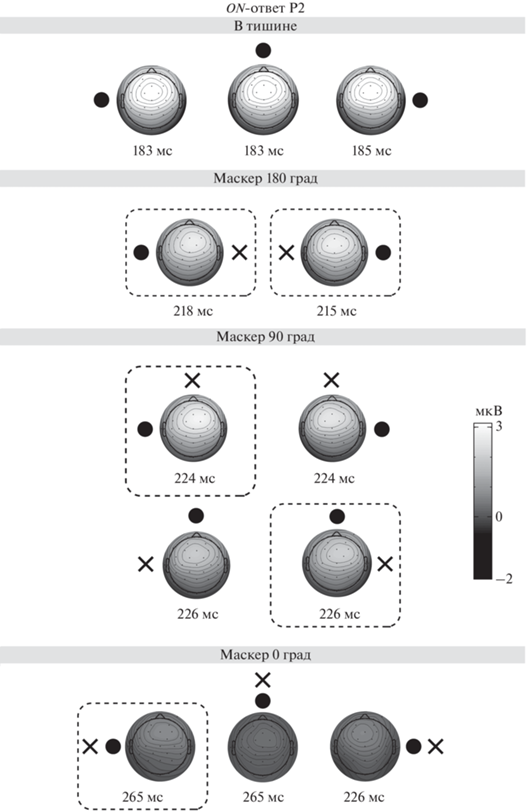
Таблица 1.
Результаты (F, p и эпсилон) 3-факторной rmANOVA средних амплитуд компонентов N1, P2 и N2 в реакциях на тестовый сигнал
| Факторы ANOVA (df) | N1 | P2 | N2 | |||
|---|---|---|---|---|---|---|
| F | p | F | p | F | p | |
| Маскер (3, 51) | 34.94 | <0.001 ε = 0.46 |
110.92 | <0.001 ε = 0.57 |
15.20 | <0.001 ε = 0.69 |
| Сигнал (2, 34) | 46.44 | <0.001 ε = 0.82 |
19.23 | <0.001 ε = 0.80 |
4.82 | <0.05 ε = 0.76 |
| Полушарие (1, 17) | 3.41 | 0.08 | 7.51 | <0.05 | 1.62 | 0.22 |
| Маскер × Сигнал (6, 102) | 39.44 | <0.001 ε = 0.31 |
66.66 | <0.001 ε = 0.41 |
9.94 | <0.001 ε = 0.67 |
| Маскер × Полушарие (3, 51) | 8.66 | <0.001 ε = 0.81 |
0.89 | 0.42 ε = 0.68 |
3.17 | <0.05 ε = 0.82 |
| Сигнал × Полушарие (2, 34) | 31.26 | <0.001 ε = 0.69 |
8.72 | <0.01 ε = 0.71 |
2.87 | 0.08 ε = 0.92 |
| Маскер × Сигнал × Полушарие (6, 102) | 2.10 | 0.09 ε = 0.65 |
8.08 | <0.001 ε = 0.76 |
1.37 | 0.25 ε = 0.71 |
Примечание: факторами ANOVA были Маскер (без маскера, левый, центральный, правый), Сигнал (левый, центральный, правый) и Полушарие (левое, правое). Степени свободы (df) приведены в названиях строк (степень свободы эффекта и степень свободы ошибки). Отличные от единицы величины поправок Гринхауза-Гайссера приведены под соответствующими величинами p.
Максимум волны N1 при предъявлении сигнала в тишине (рис. 3, верхний ряд) занимал фронто-центральное положение (Fz, FC1, FC2), со смещением в правое полушарие в случае левого и центрального сигнала (p < 0.05 и p = 0.056 в попарных сравнениях) и статистически незначимым левосторонним смещением для правого сигнала (p > 0.05). Таким образом, при обособленном предъявлении латерализованных сигналов наблюдалась тенденция к контралатеральному доминированию волны N1, сильнее выраженная при левосторонней стимуляции. На фоне маскера, расположенного у противоположного сигналу уха (рис. 3, маскер 180 град), контралатеральность ответа N1 относительно положения сигнала (p < < 0.05) усиливалась по сравнению с ответом в тишине. При сближении сигнала и маскера на 90 град в случае латерализованных сигналов контралатеральное доминирование оставалось статистически значимым только для левого сигнала (с центральным маскером, p < 0.05), а в случае центрального сигнала сохранялось правостороннее доминирование в присутствии только правого маскера (p < 0.05). При совпадении положения сигнала и маскера (рис. 3, маскер 0 град) наблюдалось слабое контралатеральное (правостороннее) доминирование реакции на левый сигнал и на фоне левого маскера (p = 0.054).
Максимум компонента P2 демонстрировал асимметричное расположение только в условиях маскировки (рис. 4). Статистическая значимость межполушарных различий (p < 0.05) наблюдалась в тех же пространственных комбинациях, что и у компонента N1 (см. пунктир на рис. 3 и 4), но в отличие от N1 смещение фокуса P2 было всегда правосторонним. Фокус активности компонента N2 оставался во фронто-центральном положении независимо от условий маскировки. Дисперсионный анализ (rmANOVA) не выявил значимых межполушарных различий амплитуд N2 (p > 0.05). Хотя взаимодействие Маскер × Полушарие достигло уровня значимости (p < 0.05), оно не подтвердилось в последующих попарных сравнениях.
Межполушарная асимметрия MOR. Взаимное расположение сигнала и маскера оказывало влияние на пространственное распределение только негативного компонента MOR – волны cN1. Результаты дисперсионного анализа (rmANOVA) средних амплитуд сN1 (Маскер (без маскера, левый, центральный, правый) × Скорость сигнала (быстро, медленно) × Направление (от центра влево, от центра вправо, слева к центру, справа к центру) × Полушарие (левое, правое)) приведены в табл. 2.
Таблица 2.
Результаты (F, p и эпсилон) 4-факторной rmANOVA средних амплитуд компонента cN1 MOR в реакциях на движущийся тестовый сигнал
| Факторы ANOVA (df) | Амплитуда cN1 | |
|---|---|---|
| F | p | |
| Маскер (3, 51) | 2.64 | 0.06, ε = 0.96 |
| Скорость (1, 17) | 36.40 | <0.001 |
| Направление (3, 51) | 5.22 | <0.01, ε = 0.71 |
| Полушарие (1, 17) | 5.90 | <0.05 |
| Маскер × Скорость (3, 51) | 3.11 | <0.05, ε = 0.76 |
| Маскер × Направление (9, 153) | 39.44 | <0.05, ε = 0.68 |
| Скорость × Направление (3, 51) | 1.86 | 0.17, ε = 0.67 |
| Маскер × Скорость × Направление (9, 153) | 0.87 | 0.50, ε = 0.51 |
| Маскер × Полушарие (3, 51) | 0.56 | 0.63, ε = 0.92 |
| Скорость × Полушарие (1, 17) | 1.82 | 0.20 |
| Маскер × Скорость × Полушарие (3, 51) | 0.22 | 0.81, ε = 0.66 |
| Направление × Полушарие (3, 51) | 2.94 | <0.05, ε = 0.95 |
| Маскер × Направление × Полушарие (9, 153) | 1.63 | 0.15, ε = 0.68 |
| Скорость × Направление × Полушарие (3, 51) | 1.64 | 0.20, ε = 0.83 |
| Маскер × Скорость × Направление × Полушарие (9, 153) | 0.73 | 0.64, ε = 0.71 |
Примечание: факторами ANOVA были Маскер (без маскера, левый, центральный, правый), Скорость (быстро, медленно), Направление (от центра влево, от центра вправо, слева к центру, справа к центру) и Полушарие (левое, правое). Степени свободы (df) приведены в названиях строк (степень свободы эффекта и степень свободы ошибки). Отличные от единицы величины поправок Гринхауза-Гайссера приведены рядом с соответствующими величинами p.
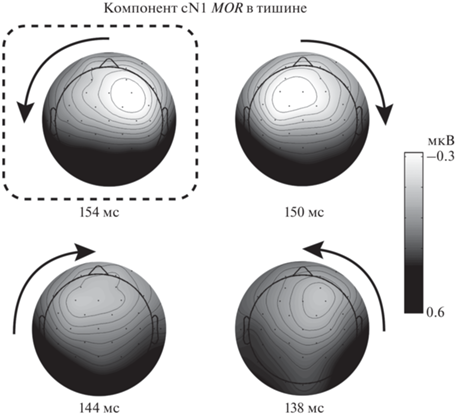
Обнаружены главные эффекты Скорости (F(1, 17) = 36.40, p < 0.001), Направления (F(2.1, 36.4) = 5.22, p < 0.01) и Полушария (F(1, 17) = 5.90, p < 0.05). Главный эффект Полушария отражал большую активность в правом полушарии. Значимый эффект межполушарной асимметрии проявлялся только во взаимодействии Направление × × Полушарие ((F(2.9, 48.6) = 2.94, p < 0.05). Согласно попарным сравнениям, амплитуда cN1 в правом электродном кластере была больше, чем в левом, при движении справа налево (от правого уха к центру и от центра к левому уху, p < 0.05). Однако при таких сравнениях не выявляется вклад маскировки в асимметрию, поэтому целесообразно рассматривать трехфакторное взаимодействие Маскер × Направление × Полушарие (F(6.2, 104.7) = 1.63, p > 0.05). Это взаимодействие в целом не значимо, но в попарных сравнениях обнаружено высоко значимое различие (p < 0.001): только в отсутствие маскера при движении сигнала от центра влево амплитуда сN1 была больше в правом полушарии, чем в левом (рис. 5). Во всех остальных условиях межполушарные различия были далеки от уровня значимости (p > 0.05).
Рис. 5.
Топография амплитуды компонента cN1 ответа на движение (MOR) в отсутствие маскера (гранд-усреднение, n = 18). Стрелками показаны траектории движения тестовых стимулов. Латентности указаны относительно момента начала движения. Остальные обозначения см. рис. 3.
Аналогичный анализ (rmANOVA) средних амплитуд волны cP2 показал, что фактор Полушарие не был значимым и не входил ни в одно значимое взаимодействие (p > 0.05). Фронто-центральное распределение cP2 не изменялось ни при каких экспериментальных условиях.
Межполушарная асимметрия OFF-ответа. Дисперсионный анализ (rmANOVA) средних амплитуд компонентов N1, P2 и N2 ответа на выключение сигнала с факторами Полушарие (левое, правое), Маскер (без маскера, левый, центральный, правый) и Сигнал (левый, центральный, правый)) показал, что ни один из компонентов OFF-ответа не демонстрировал межполушарной асимметрии (p > 0.05): их пространственное распределение оставалось фронто-центральным вне зависимости от экспериментальных условий.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследовали межполушарную асимметрию электрической активности мозга в условиях слуховой пространственной маскировки. Использовали неподвижные маскеры разной латерализации и тестовые сигналы, соответствующие парадигме отсроченного движения. Пространственные эффекты создавали за счет межушных различий по интенсивности. Измеряли амплитуду ВП в реакции на включение тестового сигнала, на его движение и на выключение. Согласно полученным результатам, пространственная маскировка оказывала различное влияние в разных временны́х интервалах вызванных реакций.
Межполушарная асимметрия ON-ответа. ON-ответ представлял собой ВП на включение неподвижных начальных участков сигнала, расположенных по центру или около левого/правого уха. При обособленном предъявлении сигнала (в тишине) наблюдалось контралатеральное преобладание волны N1. Этот результат находится в соответствии с данными литературы, поскольку в целом ряде работ были описаны более сильные или более ранние ответы от полушария, контралатерального сигналу [24–27]. В ситуации самой слабой маскировки, возникавшей при угловом расстоянии 180 град между маскером и сигналом [22], контралатеральность волны N1 относительно положения сигнала становилась сильнее. Можно сказать, что максимум N1 смещался в сторону маскера, как если бы маскер подавлял активность преимущественно на контралатеральной ему стороне. Аналогичный характер асимметрии наблюдался при угловом разнесении 90 град: правосторонний маскер подавлял ответ на центральный сигнал в большей степени в левом (контралатеральном маскеру) полушарии. При сильно выраженной маскировке, когда маскер расположен вблизи начала траектории сигнала, асимметрия практически отсутствовала.
В целом усиление асимметрии распределения N1 в условиях маскировки связано, скорее всего, именно с угловым разнесением маскера и сигнала. В начале эпохи стимуляции звучит только маскер, и реакция на него формируется за счет нейронных популяций, настроенных на соответствующие межушные различия. Затем включение тестового сигнала в другой точке пространства создает заметное слуховое событие, и в реакцию на него вовлекаются другие нейронные группы. В результате можно наблюдать выраженный суммарный ответ (рис. 2) и контралатеральное смещение фокуса активности.
Следует также отметить, что в момент включения сигнала на фоне маскера величина прироста интенсивности в левом и правом акустическом канале различалась в зависимости от взаимного расположения сигнала и маскера. Максимальный прирост интенсивности в канале наблюдается, когда маскер латерализуется с противоположной данному каналу стороны пространства, а сигнал – с той же стороны. Согласно нашим данным, фокус активности N1 смещается в сторону, противоположную каналу, в котором прирост интенсивности максимален. Амплитуду компонента N1 в наибольшей степени связывают с величиной изменений энергии в акустическом раздражителе [28]. Наблюдаемое усиление асимметрии N1 при маскировке позволяет предположить, что на предсознательном этапе (до переключения внимания на стимул) слуховая система использует для выделения сигнала из шума как бинауральные, так и монауральные признаки, в то время как на уровне осознанного восприятия (после переключения внимания) происходит оценка только бинаурального признака – положения слитного звукового образа.
Компонент N1 считается показателем предсознательной обработки стимулов, тогда как волна P2 предположительно отражает переключение внимания [29]. Эти функциональные различия приводят к различиям в топографии волн N1 и P2. Межполушарная асимметрия компонента P2 отсутствовала при предъявлении сигнала в тишине, что также соответствует литературным данным [27], но проявлялась при маскировке. Однако, в отличие от компонента N1, во всех комбинациях маскера и сигнала амплитуда P2 была больше в правом полушарии. В принципе, правосторонняя асимметрия также соответствует данным литературы, свидетельствующим о важности слуховой коры правого полушария для локализации источника звука (нейрохирургические данные: [30–32]; данные функциональной магнитно-резонансной томографии (фМРТ) и магнитоэнцефалографии (МЭГ): [33–35]). Возможно, при одновременном звучании двух сигналов из разных точек пространства слуховая система решает более сложную локализационную задачу, на которую переключается непроизвольное внимание даже в условиях пассивного прослушивания. Согласно существующим представлениям, нейрональные сети, связанные с непроизвольным слуховым вниманием, способны перестраивать изначально существующую контралатеральную асимметрию слуховой системы. Активация этих сетей высокого порядка приводит к тому, что структуры правой фронто-теменной коры обрабатывают сигналы, поступающие не только слева, но и с обеих сторон акустического пространства [2, 36, 37]. Можно предположить, что правосторонняя асимметрия P2 в условиях пространственной маскировки отражает именно эти процессы.
Межполушарная асимметрия MOR. В реакции на начало движения межполушарная асимметрия проявлялась только в тишине. Иными словами, пространственная маскировка движущегося сигнала приводила к исчезновению различий в величине MOR между полушариями, при любом взаимном расположении сигнала и маскера. В отсутствие маскировки негативный компонент MOR (волна cN1), вызванный движением сигнала от центра влево, был более выражен в правом полушарии, т.е. на стороне, контралатеральной сигналу. Максимум cN1 был расположен в области электрода F4 (рис. 5). При движении сигнала от центра вправо максимум cN1 был смещен влево, т.е. также в контралатеральное полушарие, но область максимума захватывала среднюю линию (электроды F3, FC1 и Fz), и смещение не достигало статистической значимости. Движение сигнала слева и справа к центру приводило к незначительному смещению активности в направлении, противоположном направлению движения: сдвигу влево при движении слева к центру и сдвигу вправо при движении справа к центру.
Согласно данным литературы, топография MOR в отсутствие маскировки, чаще всего, описывается как контралатеральное доминирование. Так, по данным [6], максимум распределения MOR находился в полушарии, контралатеральном направлению движения, причем ответ на движение влево имел большую степень контралатеральности, чем на движение вправо. В этой работе движение было создано за счет линейного изменения ∆T. В нашем предыдущем исследовании ([19]: также линейные изменения ∆T) топография амплитуды компонента cN1 характеризовалась правосторонним фронто-центральным максимумом реакции на движение влево и билатеральным распределением реакции на движение вправо.
Систематическое исследование латерализации MOR в тишине было выполнено в условиях свободного звукового поля [27]. В этой работе неподвижные начальные участки сигналов были локализованы слева и справа от средней линии под углом ±44 град, а движение было направлено от них к центру или к периферии. Контралатеральное преобладание cN1 определялось положением начальной точки траектории (слева или справа). Движение к центру или к периферии в левой половине акустического пространства вызывало большую активацию правого полушария. При стимуляции в правой половине пространства ситуация была иной: движение вправо (к периферии) вызывало больший ответ левого полушария, а движение влево (к центру) вызывало симметричный ответ обоих полушарий. Компонент cP2 демонстрировал контралатеральность направлению движения, независимо от положения начальной точки. Движение влево в левой части пространства вызывало больший ответ правого полушария, тогда как движение вправо в правой части пространства вызывало больший ответ слева.
В настоящем исследовании движение сигнала создавалось за счет линейного изменения ∆I. Известно, что акустические признаки, применяемые для создания пространственных эффектов (изменения ∆I или ∆T, передаточные функции головы или стимуляция в свободном поле) влияют не только на амплитуду и латентность компонентов MOR, но и на их пространственное распределение. Стимуляция в свободном поле или с применением передаточных функций приводила к суперпозиции эффектов контралатерального и правостороннего доминирования вызванной активности. Предполагается, что это связано с непроизвольным переключением внимания и с вовлечением нейрональных сетей высокого порядка [38]. Явления межполушарной асимметрии выражены сильнее в случае движения экстернализованных звуковых образов, чем при изменениях ∆I или ∆T. Поэтому неудивительно, что полученные нами результаты только частично соответствуют описанным в работе [27]: асимметрия волны cN1 при движении от периферии к центру в нашей работе оказалась незначительной, а компонент cP2 вообще не демонстрировал асимметрии.
Топография ответов на движение с разными скоростями исследована в работах S. Getzmann и J. Lewald [17, 18, 27]. Сравнение MOR, вызванного плавным движением со скоростями 90, 180 и 360 град/с, показало, что контралатеральность MOR уменьшалась при снижении скорости, а при скорости 90 град/с активация наблюдалась только в правом полушарии [17]. С другой стороны, впоследствии была описана меньшая контралатеральность MOR в реакции на мгновенное смещение стимула, чем на плавное движение [18]. В нашей предыдущей работе [19] при движении стимулов со скоростями 255 и 450 град/с не обнаружено достоверной связи межполушарной асимметрии MOR со скоростью. Согласно данным настоящего исследования, скорость сигнала также не оказывала значимого влияния на распределение MOR по поверхности головы. Таким образом, взаимосвязь скорости стимула и топографии MOR остается до конца не выясненной.
Межполушарная асимметрия OFF-ответа. Распределение OFF-ответа было симметричным при всех экспериментальных условиях, сохраняя максимум во фронто-центральной области. Это свидетельствует о существенных отличиях топографии OFF-ответа от топографии ON-ответа, хотя набор пространственных положений неподвижных участков сигнала, вызывавших OFF- и ON-ответы, был одинаковым. Вероятно, разница в распределении ON- и OFF-ответов связана с их функциональными различиями. Существует точка зрения, что за реакции на включение и выключение сигнала могут быть ответственны отчасти различные популяции нейронов с различными свойствами [39–42]. Фронто-центральное распределение OFF-ответа в принципе может возникать как результат совместной работы широко распределенной нейронной сети, активность которой направлена на перцептивную группировку стимулов [43]. Отсутствие асимметрии OFF-ответа не позволяет отнести возможные непроизвольные переключения слухового внимания к ключевым факторам возникновения межполушарной асимметрии.
ЗАКЛЮЧЕНИЕ
Появление фонового маскера на слуховой сцене усиливало межполушарную асимметрию ON-ответа на сигнал по сравнению с тишиной. При этом компонент N1 демонстрировал контралатеральное преобладание, а компонент P2 – правостороннее. Асимметрия обоих компонентов была максимальной при разнесении маскера и начального участка сигнала на 180 град, т.е. при самой слабой маскировке. При сближении маскера с начальным участком сигнала асимметрия N1 и P2 ослабевала и сохранялась только при левосторонней стимуляции.
В отличие от ON-ответа, в реакции на начало движения межполушарная асимметрия проявлялась только в тишине: волна cN1 при движении от центра влево была более выражена на контралатеральной стороне, т.е. справа. В условиях маскировки различий между потенциалами MOR левого и правого полушарий не было.
Таким образом, проведенное исследование выявило принципиально различное влияние слуховой пространственной маскировки на топографию разных компонентов ВП, регистрируемых в парадигме отсроченного движения. В начале эпохи стимуляции, т.е. в ответе на включение, наблюдалось усиление межполушарной асимметрии компонентов ВП при маскировке. Оно было связано с тем, что включение сигнала представляло достаточно заметное слуховое событие в пределах эпохи, особенно при большом угловом расстоянии между маскером и начальным положением сигнала. В середине эпохи, реакция на движение была сильно подавлена и запаздывала относительно ответа в тишине, поэтому асимметрию распределения MOR невозможно было наблюдать. В конце эпохи не обнаружено асимметрии в топографии OFF-ответа ни в тишине, ни при маскировке. Таким образом, влияние одновременной пространственной маскировки на межполушарную асимметрию ВП в парадигме отсроченного движения сосредоточено, главным образом, в интервале реакции на включение сигнала.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены Комиссией по этике ФГБУН Института физиологии им. И.П. Павлова РАН (Санкт-Петербург) (Протокол № 22-02).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при поддержке РНФ (грант № 22-25-00033).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Вайтулевич С.Ф., Петропавловская Е.А., Шестопалова Л.Б., Никитин Н.И. Функциональная межполушарная асимметрия мозга человека и слуховая функция // Физиология человека. 2019. Т. 45. № 2. С. 103. Vaitulevich S.F., Petropavlovskaya E.A., Shestopalova L.B., Nikitin N.I. Functional interhemispheric asymmetry of human brain and audition // Human Physiology. 2019. V. 45. № 2. P. 202.
Teshiba T.M., Ling J., Ruhl D.A. et al. Evoked and intrinsic asymmetries during auditory attention: implications for the contralateral and neglect models of functioning // Cereb. Cortex. 2013. V. 23. № 3. P. 560.
Deouell L.Y., Bentin S., Giard M.H. Mismatch negativity in dichotic listening: evidence for interhemispheric differences and multiple generators // Psychophysiology. 1998. V. 35. № 4. P. 355.
Kaiser J., Lutzenberger W., Preissl H. et al. Right-hemisphere dominance for the processing of sound-source lateralization // J. Neurosci. 2000. V. 20. № 17. P. 6631.
Salminen N.H., Tiitinen H., Miettinen I. et al. Asymmetrical representation of auditory space in human cortex // Brain. Res. 2010. V. 1306. P. 93.
Krumbholz K., Hewson-Stoate N., Schönwiesner M. Cortical response to auditory motion suggests an asymmetry in the reliance on inter-hemispheric connections between the left and right auditory cortices // J. Neurophysiol. 2007. V. 97. № 2. P. 1649.
Schönwiesner M., Krumbholz K., Rübsamen R. et al. Hemispheric asymmetry for auditory processing in the human auditory brainstem, thalamus, and cortex // Cereb. Cortex. 2007. V. 17. № 2. P. 492.
Briley P.M., Kitterick P.T., Summerfield A.Q. Evidence for opponent process analysis of sound source location in humans // J. Assoc. Res. Otolaryngol. 2013. V. 14. № 1. P. 83.
Litovsky R.Y. Spatial release from masking // Acoust. Today. 2012. V. 8. № 2. P. 18.
Альтман Я.А., Вайтулевич С.Ф. Слуховые вызванные потенциалы человека и локализация источника звука. СПб.: Наука, 1992. 136 с.
Альтман Я.А. Пространственный слух. СПб.: Институт физиологии им. И.П. Павлова РАН, 2011. 311 с.
Bibee J.M., Stecker G.C. Spectrotemporal weighting of binaural cues: Effects of a diotic interferer on discrimination of dynamic interaural differences // J. Acoust. Soc. Am. 2016. V. 140. № 4. P. 2584.
Bőhm T.M., Shestopalova L., Bendixen A. et al. The role of perceived source location in auditory stream segregation: Separation affects sound organization, common fate does not // Learn. Percept. 2013. V. 5. № 2. P. 55.
Shestopalova L., Bőhm T.M., Bendixen A. et al. Do audio-visual motion cues promote segregation of auditory streams? // Front. Neurosci. 2014. V. 8. P. 64.
Pastore M.T., Yost W.A. Spatial Release from Masking with a Moving Target // Front. Psychol. 2017. V. 8. P. 2238.
Варфоломеев А.Л., Старостина Л.В. Слуховые вызванные потенциалы человека при иллюзорном движении звукового образа // Рос. физиол. журн. им. И.М. Сеченова. 2006. Т. 92. № 9. С. 1046.
Getzmann S. Effect of auditory motion velocity on reaction time and cortical processes // Neuropsychologia. 2009. V. 47. № 12. P. 2625.
Getzmann S., Lewald J. Cortical processing of change in sound location: smooth motion versus discontinuous displacement // Brain Res. 2012. V. 1466. P. 119.
Shestopalova L.B., Petropavlovskaia E.A., Semenova V.V., Nikitin N.I. Brain oscillations evoked by sound motion // Brain Res. 2021. V. 1752. P. 147232.
Семенова В.В., Шестопалова Л.Б., Петропавловская Е.А. и др. Латентность вызванного потенциала как показатель интегрирования акустической информации о движении звука // Физиология человека. 2022. Т. 48. № 4. С. 57. Semenova V.V., Shestopalova L.B., Petropavlovskaia E.A. et al. Latency of motion onset response as an integrative measure of processing sound movement // Human Physiology. 2022. V. 48. № 4. P. 401.
Доброхотова Т.А., Брагина Н.Н. Левши. М.: Книга, 1994. 232 с.
Шестопалова Л.Б., Петропавловская Е.А., Саликова Д.А. и др. Слуховые вызванные потенциалы человека в условиях пространственной маскировки // Физиология человека. 2022. Т. 48. № 6. С. 32. Shestopalova L.B., Petropavlovskaia E.A., Salikova D.A. et al. Event-related potentials in conditions of auditory spatial masking in humans // Human Physiology. 2022. V. 48. № 6. P. 633.
Delorme A., Sejnowski T., Makeig S. Enhanced detection of artifacts in EEG data using higher-order statistics and independent component analysis // NeuroImage. 2007. V. 34. № 4. P. 1443.
Fujiki N., Riederer K.A.J., Jousmäki V. et al. Human cortical representation of virtual auditory space: differences between sound azimuth and elevation // Eur. J. Neurosci. 2002. V. 16. № 11. P. 2207.
Palomäki K., Alku P., Mäkinen V. et al. Sound localization in the human brain: neuromagnetic observations // Neuroreport. 2000. V. 11. № 7. P. 1535.
Palomäki K.J., Tiitinen H., Mäkinen V. et al. Spatial processing in human auditory cortex: the effects of 3D, ITD, and ILD stimulation techniques // Brain Res. Cogn. Brain Res. 2005. V. 24. № 3. P. 364.
Getzmann S. Auditory motion perception: onset position and motion direction are encoded in discrete processing stages // Eur. J. Neurosci. 2011. V. 33. № 7. P. 1339.
Somervail R., Zhang F., Novembre G. et al. Waves of Change: Brain Sensitivity to Differential, not Absolute, Stimulus Intensity is Conserved Across Humans and Rats // Cereb. Cortex. 2021. V. 31. № 2. P. 949.
Lewald J., Getzmann S. Electrophysiological correlates of cocktail-party listening // Behav. Brain Res. 2015. V. 292. P. 157.
Tanaka H., Hachisuka K., Ogata H. Sound lateralisation in patients with left or right cerebral hemispheric lesions: relation with unilateral visuo-spatial neglect // J. Neurol. Neurosurg. Psychiatry. 1999. V. 67. № 4. P. 481.
Zatorre R.J., Penhune V.B. Spatial localization after excision of human auditory cortex // J. Neurosci. 2001. V. 21. № 16. P. 6321.
Spierer L., Bellmann-Thiran A., Maeder Ph. et al. Hemispheric competence for auditory spatial representation // Brain. 2009. V. 132. Pt. 7. P. 1953.
Zatorre R.J., Mondor T.A., Evans A.C. Auditory attention to space and frequency activates similar cerebral systems // NeuroImage. 1999. V. 10. № 5. P. 544.
Brunetti M., Belardinelli P., Caulo M. et al. Human brain activation during passive listening to sounds from different locations: an fMRI and MEG study // Hum. Brain Mapp. 2005. V. 26. № 4. P. 251.
Tiitinen H., Salminen N.H., Palomäki K.J. et al. Neuromagnetic recordings reveal the temporal dynamics of auditory spatial processing in the human cortex // Neurosci. Lett. 2006. V. 396. № 1. P. 17.
Petit L., Simon G., Joliot M. et al. Right hemisphere dominance for auditory attention and its modulation by eye position: an event-related fMRI study // Restor. Neurol. Neurosci. 2007. V. 25. № 3–4. P. 211.
Richter N., Schröger E., Rübsamen R. Hemispheric specialization during discrimination of sound sources reflected by MMN // Neuropsychologia. 2009. V. 47. № 12. P. 2652.
Getzmann S., Lewald J. Effects of natural versus artificial spatial cues on electrophysiological correlates of auditory motion // Hear. Res. 2010. V. 259. № 1–2. P. 44.
Abeles M., Goldstein M.H., Jr. Responses of single units in the primary auditory cortex of the cat to tones and to tone pairs // Brain Res. 1972. V. 42. № 2. P. 337.
He J., Hashikawa T., Ojima H., Kinouchi Y. Temporal integration and duration tuning in the dorsal zone of cat auditory cortex // J. Neurosci. 1997. V. 17. № 7. P. 2615.
Recanzone G.H. Response profiles of auditory cortical neurons to tones and noise in behaving macaque monkeys // Hear. Res. 2000. V. 150. № 1. P. 104.
Phillips D.P., Hall S.E., Boehnke S.E. Central auditory onset responses, and temporal asymmetries in auditory perception // Hear. Res. 2002. V. 167. № 1–2. P. 192.
Szabó B.T., Denham S.L., Winkler I. Computational Models of Auditory Scene Analysis: A Review // Front. Neurosci. 2016. V. 10. P. 524.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


