Цитология, 2019, T. 61, № 3, стр. 226-234
Длительное сохранение функциональных изменений, индуцированных вирусом гриппа А и (или) ЛПС, в сублиниях клеток эндотелия человека ECV-304
С. С. Смирнова 1, *, М. М. Писарева 2, Т. Д. Смирнова 2, К. В. Сивак 2, К. В. Воробьев 1
1 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
2 Научно-исследовательский институт гриппа имени А.А. Смородинцева Министерства здравоохранения РФ
197376 Санкт-Петербург, Россия
* E-mail: sm.svetlana.s@gmail.com
Поступила в редакцию 24.09.2018
После доработки 16.12.2018
Принята к публикации 25.12.2018
Аннотация
Вирус гриппа А и вторичная бактериальная инфекция могут быть причиной отдаленных последствий в виде сердечно-сосудистых осложнений или фиброза различных органов, однако механизмы возникновения осложнений недостаточно изучены. В настоящей работе проведена сравнительная оценка функциональных изменений в сублиниях клеток эндотелия человека ECV-304, полученных ранее путем длительного культивирования клеток после воздействия разных инфицирующих доз (ИД) вируса гриппа А и (или) бактериального липополисахарида (ЛПС). Показано, что при длительном культивировании (6 пассажей) клеток эндотелия после внесения патогенных агентов (вируса гриппа и (или) ЛПС) у них сохраняются изменения миграционной активности, проницаемости и экспрессии мРНК цитокинов TNFα и TGFβ (наряду с изменением пролиферативной активности, показанным нами ранее). Характер изменений зависел от вида воздействовавшего агента (агентов). Различия между сублиниями клеток на 6-м пассаже по миграционной активности (максимальной через 4 ч после нанесения раны) коррелировали с различиями по их пролиферативной активности на 1-м пассаже (данные по пролиферации получены ранее). Так, усиление миграции и пролиферации клеток наблюдали в сублиниях под воздействием низкой дозы вируса (ECV-1ИД) и под воздействием ЛПС (ECV-ЛПС), а подавление – в сублинии под воздействием высокой дозы вируса (ECV-1000ИД). В сублиниях ECV-1ИД, ECV-ЛПС и особенно ECV-1ИД+ЛПС было выявлено увеличение экспрессии мРНК цитокинов TNFα и TGFβ, причем это не приводило к индукции апоптоза клеток. Показано также увеличение проницаемости клеток исследуемых сублиний, на что указывало снижение экспрессии мРНК генов окклюдина и ZO-1 – белков, входящих в состав плотных контактов. Проведена оценка воздействия антивирусных препаратов ремантадина и алпизарина на функциональное состояние сублиний клеток, ее результаты свидетельствуют о возможности данных препаратов препятствовать развитию патологических изменений в клетках эндотелия, вызванных вирусом гриппа А и (или) ЛПС. Полученные результаты могут быть полезны для изучения механизмов развития осложнений при инфекции вирусом гриппа А и вторичной бактериальной инфекции.
Клетки эндотелия формируют полупроницаемый барьер между циркулирующей жидкостью и окружающими тканями. Изменение барьерной функции клеток эндотелия вносит значительный вклад в развитие патологических состояний, включая воспаление и нарушение зарастания раневых поверхностей. Кроме того оно может способствовать развитию острых энцефалопатий и дисфункции многих органов (вследствие поражения сердечно-сосудистой системы), образованию фиброза различных органов, повышению ангиогенеза и развитию онкогенеза (Di Pietro, 2016; You, Stallcup, 2017). Нарушение эндотелиального барьера в легких (в частности, вирусом гриппа или бактериальной инфекцией) приводит к проникновению жидкости в альвеолы, вызывая отек легких и развитие острого респираторного дистресс-синдрома (ARDS) (Kwok et al., 2016). Нарушение миграции эндотелиоцитов, изменение пролиферативной и апоптотической активности клеток, а также нарушение клеточной проницаемости являются критическими моментами при развитии патологических состояний.
Способность клеток эндотелия восстанавливать поврежденный внутрисосудистый слой обусловлена активацией миграции близлежащих к ране клеток и повышением их способности к делению. Процесс миграции клеток включает в себя их поляризацию, образование протрузий в направлении движения, открепление и сокращение заднего края клетки, связанные с динамической реорганизацией актинового цитоскелета и микротрубочек за счет вовлечения сигнальных молекул из Rho-семейства малых GTPаз (Kasa et al., 2015).
Ключевыми физиологическими регуляторами внутриклеточных сигнальных путей в клетках эндотелия являются активные формы кислорода (АФК) и азота (Breton-Romero, Lamas, 2014). Эндогенный пероксид водорода (Н2О2) аккумулируется в активно мигрирующих клетках эндотелия в месте повреждения, вызванного различными индукторами воспалительного процесса, в частности бактериального или вирусного происхождения. Основным источником АФК являются NAD(P)H-оксидазы Nox. В клетках эндотелия широко представлены Nox2 и ее гомолог Nox4 (Basuroy et al., 2009). В стимуляции сигнальных систем, связанных с миграцией клеток эндотелия, особенно важна роль фактора роста эндотелия сосудов (VEGF), который взаимодействует с АФК, образованными не только в цитозоле с помощью Nox2 и Nox4, но и в митохондриях (Kim et al., 2017).
Эндотелиальный барьер поддерживается локально продуцируемыми вазоактивными агентами, такими как гистамин, простагландин, тромбин, VEGF. Они модулируют проницаемость клеточной мембраны, вызывая динамичные изменения адгезионных (AJ) и плотных (TJ) контактов, а также регулируют центростремительное натяжение клетки вследствие реорганизации кортикального слоя актина и образования актомиозиновых стресс-фибрилл (Dejana et al., 2008; Kasa et al., 2015).
Усиление миграции клеток эндотелия в присутствии бактериального липополисахарида (ЛПС) используется как показатель конверсии клеток эндотелия в активированные фибробласты через эндотелиально-мезенхимальный переход (Sarmiento et al., 2014).
Вирус гриппа так же, как и ЛПС, способен вызывать в клетках эпителия и эндотелия образование АФК через индукцию Nox2 и Nox4, что может способствовать репродукции самого вируса (Amatore et al., 2015). Показано разрушение межклеточных контактов и снижение содержания белков клаудина-4 и клаудина-5 (CLDN5), входящих в состав TJ, при заражении клеток эндотелия вирусом гриппа (Armstrong et al., 2012; Short et al., 2016).
Воспалительная реакция в клетках, индукция апоптоза, повышение клеточной проницаемости и реорганизация белков цитоскелета осуществляются вирусом гриппа А через те же клеточные механизмы и сигнальные пути (Rho/ROCK, p38, JNK), которые вовлечены в механизмы действия ЛПС (Zhang et al., 2014; Liu et al., 2015).
Представленная выше информация относится к исследованиям, результаты которых получены при острой вирусной инфекции in vivo или в ранние сроки (12–24 ч) после применения ЛПС, либо высоких инфицирующих доз (ИД) вируса гриппа in vitro. Однако мы не нашли информацию относительно одновременного воздействия вируса гриппа и ЛПС на клеточные культуры.
Ранее нами впервые было показано, что в зараженных вирусом гриппа непермиссивных для вируса гриппа клетках эндотелия человека линии ECV-304 с уменьшением ИД вируса в течение 3–5 сут после заражения происходит усиление пролиферации клеток при одновременном повышении их апоптоза. Нормальная репродукция вируса гриппа в непермиссивных клетках нарушается, присутствие вируса обнаруживается только на уровне мРНК поверхностных вирусных белков на протяжении не более 1–2 пассажей (Даниленко и др., 2016). Изменение физиологического состояния клеток на 1-м пассаже (3–5 сут) являлось первым этапом изменения клеток под воздействием вируса гриппа, а дальнейшее культивирование клеток (3–8 пассажи) приводило к устойчивой повышенной пролиферации при низком уровне апоптоза (Смирнова и др., 2018).
Цель настоящей работы состояла в выяснении связи между первичным воздействием агентов (высокие и низкие ИД вируса гриппа и (или) ЛПС) на клетки ECV-304 и характером отдаленных функциональных изменений сублиний клеток ECV-304 на 6-м пассаже после воздействия. Исследовали изменения миграционной активности клеток, экспрессии генов на уровне мРНК фактора некроза опухоли альфа (TNFα), трансформирующего фактора роста бета (TGFβ), NOX4, а также белков, входящих в состав TJ и определяющих проницаемость клеточных мембран – генов CLDN5, окклюдина (OCLD) и ZO-1. Кроме того, оценивали корреляцию функциональных изменений с пролиферативной активностью и апоптозом клеток этих же сублиний, исследованных ранее (Смирнова и др., 2018), а также способность антивирусных препаратов ремантадина и алпизарина восстанавливать нормальное функционирование клеток эндотелия.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали сублинии перевиваемой линии клеток эндотелия человека ECV-304, полученные после заражения вирусом гриппа А/Брисбен/10/07 (H3N2). Клетки заражали низкой дозой вируса (1 ИД), соответствующей множественности инфекции (МИ), равной 0.000001 или высокой дозой (1000 ИД; МИ = 0.001) и дополнительно (или только) воздействовали 100 нг/мл ЛПС Escherichia coli (Sigma, США). Клетки пересевали на 6–7 сут в соотношении 1 : 3 в среде альфа-МЕМ (Биолот, Россия), содержащей 1% фетальной бычьей сыворотки (ФБС) (HyClone, США) без антибиотиков. Для снятия клеток с поверхности использовали раствор версена с химопсином. Контрольные (интактные) и экспериментальные клетки находились на 6-м пассаже после воздействия агентов (Смирнова и др., 2018). В зависимости от внесенного агента (вирус и его ИД, ЛПС или вирус и ЛПС совместно) сублиниям клеток дали следующие наименования: ECV-1ИД, ECV-1000ИД, ECV-ЛПС, ECV-1ИД+ЛПС и ECV-1000ИД+ЛПС.
Оценка миграционной активности. Суспензии клеток соответствующих сублиний высевали в 6-луночные планшеты (Nunс, Дания) в концентрации 7 × 104 кл./мл (4 мл на лунку) в среде альфа-МЕМ с 1% ФБС, планшеты помещали в СО2-инкубатор (37°С и 5% СО2). На следующие сутки на клеточном монослое наконечником на 200 мкл проводили царапину, клетки промывали бессывороточной средой, затем добавляли среду альфа-МЕМ с 1% ФБС. В экспериментальные лунки вносили десятикратные растворы исследуемых антивирусных препаратов по 0.4 мл (1/10 часть от объема среды). Сразу после внесения препаратов (точка 0) и затем через 4, 8, 12 и 24 ч проводили фотосъемку отмеченного участка раневой поверхности под микроскопом Axio Vert A1 (Carl Zeiss, Германия) при увеличении объектива 10×. На снимках в программе AxioVision Rel. 4.8 определяли площадь раневой поверхности, затем рассчитывали изменение площади во времени, т.е. зарастание раны. Конечный результат выражали в % относительно изменения площади раневой поверхности в контрольных образцах (не подвергавшихся заражению и воздействию препаратов) на каждом временном сроке.
Оценка экспрессии генов. На 4-е сут после нанесения раны (когда рана практически полностью зарастала) клетки снимали с поверхности лунок, считали, промывали бессывороточной средой, центрифугировали и использовали для оценки изменения экспрессии генов цитокинов и других клеточных факторов методом ПЦР в реальном времени. РНК из исследуемых образцов выделяли с использованием комплекта реагентов “АмплиПрайм РИБО-преп” (ЦНИИ эпидемиологии, Россия) согласно инструкции. Для оценки экспрессии генов проводили накопление кДНК на матрице РНК в реакции обратной транскрипции с помощью комплекта реагентов “Реверта-L” (ЦНИИ эпидемиологии, Россия). Реакцию амплификации осуществляли в термоциклере Rotor-Gene 6000 (Corbett Research, Австралия) по следующей программе: денатурация при 95°С 10 мин, 40 циклов при 95°С 20 с, затем 57°С 40 с и 72°С 20 с. Состав реакционной смеси в объеме 25 мкл: 5 мкл кДНК, 10 мкл готового 2.5-кратного ПЦР-буфера (Синтол, Россия), 0.5 мкл SynTaq ДНК-полимеразы (5 ед/мкл) (Синтол, Россия), по 0.5 мкл растворов праймеров и зондов (10 пмоль/мкл) (ДНК-Синтез, Россия). В качестве внутреннего стандарта использовали праймеры к актину (ACTB). Последовательности олигонуклеотидных праймеров и зондов для TNFα, TGFβ, NOX4, CLDN5, OCLD, ZO-1 и ACTB представлены в табл. 1. Уровень экспрессии определяли 2–3 раза, конечный результат выражали в отн. ед., показывающих изменение экспрессии генов относительно контроля и рассчитанных по формуле 2–∆∆Сt, где Сt – значение порогового цикла анализируемого образца (Wong, Medrano, 2005).
Таблица 1.
Последовательности праймеров и TaqMan-зондов для определения экспрессии мРНК генов цитокинов, белков плотных контактов и других клеточных факторов
| Ген | Прямой праймер 5'–3' |
Зонд 5'–3' | Обратный праймер 5'–3' |
|---|---|---|---|
| TNFα | ACTTTGGAGTGATCGGCC | ROX–CGAACCCCGAGTGACAAGCCT–BHQ2 | GCTTGAGGGTTTGCTACAAC |
| TGFβ | TGAGGGCTTTCGCCTTAGC | HEX–CTCCTGTGACAGCAGGGATAACACACTGC–BHQ1 | CGGTAGTGAACCCGTTGATGT |
| NOX4 | CTGGACCTTTGTGCCTGTACTG | ROX–AGCAATAAGCCAGTCACCATCATTTCGGTC–BHQ2 | ACCATTCGGATTTCCATGACA |
| CLDN5 | CTGGTCTTTACTCCATCG | ROX–ACTCCCGCCCTCTCTCAA-BHQ2 | AGCAGATTCTTAGCCTTC |
| OCLD | ACAAGAGCTTACAATCAGA | HEX–TGTATTCATCAGCAGCAGCCAT–BHQ1 | CTTCACTTGCTTCAGTCT |
| ZO-1 | GCTACGCTATTGAATGTC | HEX–TCCACTCTGCTAATGCCTCTG–BHQ1 | GTGATCGACCAGAATGAT |
| ACTB | TCTACAATGAGCTGCGTGTGGCTCCC | CY5–CAAGGCCAACCGCGAGAAGATGACCCAGATCAT–BHQ2 | AGCAACGTACATGGCTGGGGTGTTGAA |
Раствор препарата ремантадина (Sigma, Германия) или алпизарина (ФГБНУ ВИЛАР, Россия) готовили на бессывороточной среде альфа МЕМ и использовали в конечной концентрации соответственно 20 или 50 мкг/мл.
На каждую временну́ю точку использовали по 2 лунки, эксперименты проводили не менее 3-х раз.
Статистический анализ проводили с использованием теста U–Манна–Уитни для сравнения двух групп непараметрических выборок. Значимыми считали различия при Р < 0.05.
РЕЗУЛЬТАТЫ
Оценка клеточной миграции проведена на сублиниях клеток ECV-304, полученных ранее (Смирнова и др., 2018) и находящихся на 6-м пассаже после воздействия вируса гриппа и (или) ЛПС. Миграционную активность оценивали по изменению площади раневой поверхности во времени (по зарастанию раны). В результате выявлено, что максимальная миграционная активность во всех клеточных сублиниях (по сравнению с контрольными интактными клетками) наблюдается в первые 4 ч (здесь и далее время указано в ч после нанесения раны). Затем миграция клеток замедляется к 8–12 ч и до 24 ч сохраняется практически на уровне миграции через 12 ч и контроля (рис. 1а). При сравнении разных сублиний наибольшая миграционная активность отмечена у клеток эндотелия после контакта с минимальной заражающей дозой вируса гриппа (сублиния ECV-1ИД, миграционная активность 141% относительно контроля через 4 ч). Миграция клеток, зараженных высокой дозой вируса (ECV-1000ИД), была минимальной (54% относительно контроля через 4 ч). Клетки после контакта с ЛПС (как при моновоздействии, так и совместно с вирусом) имели немного повышенную миграционную активность в первые часы после нанесения раны (4–8 ч), а в дальнейшем миграция сохранялась на уровне контрольных клеток (рис. 1а).
Рис. 1.
Миграционная (пассаж 6) (а, б) и пролиферативная (в; пассажи 1 и 6) активность сублиний клеток ECV-304, полученных после однократного воздействия на 1 пассаже вируса гриппа А/Брисбен/10/07 (H3N2) и (или) 100 нг/мл липополисахарида (ЛПС) E. coli; влияние антивирусных препаратов (20 мкг/мл ремантадина и 50 мкг/мл алпизарина), внесенных сразу после нанесения раны на 6 пассаже, на миграционную активность сублиний клеток ECV-304 (а). Здесь и далее: ИД – инфицирующая доза, контроль – клетки ECV-304, культивируемые в среде без воздействий. В зависимости от внесенного агента (ИД вируса, ЛПС или вирус и ЛПС совместно) сублинии клеток имеют наименования: ECV-1ИД, ECV-1000ИД, ECV-ЛПС, ECV-1ИД+ЛПС и ECV-1000ИД+ЛПС. Миграционную активность оценивали по изменению площади зарастания раны через 4, 8, 12 и 24 ч после ее нанесения, результат выражали в % относительно изменения площади раневой поверхности в контрольных образцах на каждом временном сроке; звездочка показывает достоверность отличия от контроля при Р < 0.05. в: данные взяты из: Смирнова и др., 2018.
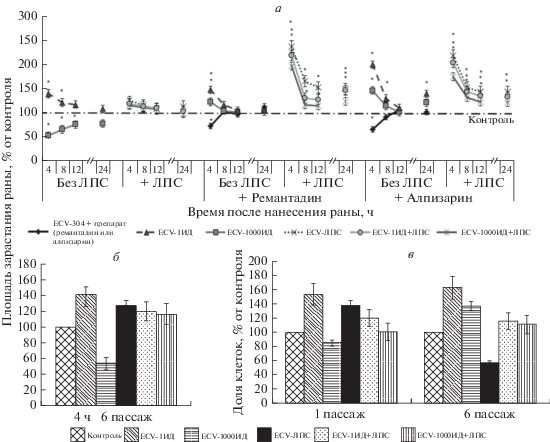
Для оценки влияния антивирусных препаратов (ремантадина и алпизарина) на миграционную активность клеток препараты вносили в лунки с клетками сразу после нанесения раны. В результате показано значительное влияние данных препаратов на клеточную миграцию. Ремантадин снижал миграционную активность контрольных клеток через 4 ч после нанесения раны до 73%, а алпизарин – до 67%, но через 8 ч уровень миграции восстанавливался. Ремантадин практически не влиял на миграцию клеток сублинии ECV-1ИД (148% через 4 ч), но уровень миграции клеток сублинии ECV-1000ИД в присутствии ремантадина поднимался выше контроля (до 123% через 4 ч), и еще большее повышение миграционной активности этих сублиний вызывал алпизарин через 4 ч (до 200% в сублинии ECV-1ИД и до 147% в сублинии ECV-1000ИД). Наибольшее повышение клеточной миграции вызывали оба препарата в сублиниях, обработанных ЛПС: ECV-ЛПС (до 238% ремантадин и 219% алпизарин), ECV-1ИД+ЛПС (219 и 204% соответственно) и ECV-1000ИД+ЛПС (197 и 175% соответственно). Во всех сублиниях максимальный уровень миграции в присутствии препаратов также отмечен через 4 ч после нанесения раны и снижение миграции к 8 ч, но при этом миграционная активность оставалась выше уровня контроля (рис. 1а).
Мы обнаружили также, что характер различий миграционной активности между сублиниями клеток на 6-м пассаже в точке максимальной активности (4 ч после нанесения раны) коррелировал с различиями в пролиферативной активности клеток на 1-м пассаже (данные по пролиферации получены ранее (Смирнова и др., 2018)). Так, усиление миграции и пролиферации клеток наблюдали в сублиниях ECV-1ИД и ECV-ЛПС, а подавление – в сублинии ECV-1000ИД (рис. 1б, 1в). При сравнении миграции и пролиферации клеток на 6-м пассаже сходство в большинстве сублиний сохранялось, за исключением сублинии ECV-ЛПС, у которой на 6-м пассаже пролиферативная активность снижалась, и сублинии ECV-1000ИД, у которой, наоборот, наблюдалось усиление пролиферации (рис. 1б, 1в).
Таким образом, различия миграционной активности клеток изучаемых сублиний на 6-м пассаже обусловлены изначальным (на 1-м пассаже) воздействием агентов (вирусом в высокой или низкой дозе и (или) ЛПС) на клетки.
На 4 сут после нанесения раны (при практически полном зарастании раны) клетки изучаемых сублиний снимали с поверхности 6-луночных планшетов и использовали для определения уровня экспрессии мРНК цитокинов (TNFα и TGFβ), оксидазы NOX4 и белков TJ (OCLD, ZO-1 и CLDN5) (сублинии ECV-1000ИД и ECV-1000ИД+ЛПС не использовали).
Результаты ПЦР показали, что в клетках, подвергавшихся воздействию вируса и (или) ЛПС, наблюдается повышенная экспрессия мРНК цитокинов TNFα и TGFβ, причем наибольший уровень экспрессии этих цитокинов был в клетках сублинии ECV-1ИД+ЛПС (соответственно в 46 и 19 раз выше контроля). Добавление антивирусных препаратов ремантадина и алпизарина значительно снижало повышенную вирусом и (или) ЛПС экспрессию мРНК этих цитокинов, но при этом ремантадин сам по себе стимулировал экспрессию мРНК TNFα (в 19 раз выше контроля) (рис. 2).
Рис. 2.
Анализ экспрессии генов TNFα, TGFβ, NOX4 и клаудина-5 (CLDN5) в сублиниях клеток ECV-304 на 4 сут 6-го пассажа после полного зарастания нанесенной раны. По данным ПЦР в реальном времени. На рис. 2 и 3 результаты представлены в отн. ед., показывающих изменение экспрессии генов относительно контроля и рассчитанных по формуле 2–∆∆Сt; контроль принят за 1.
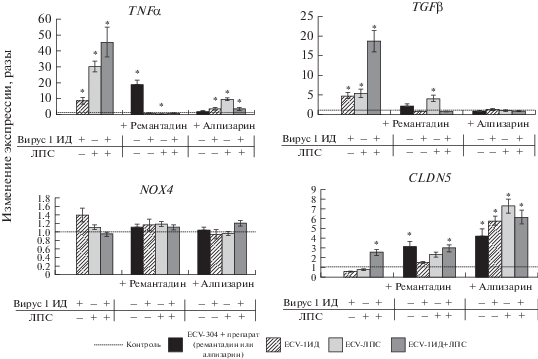
Небольшое повышение уровня экспрессии мРНК NOX4 отмечено только в сублинии ECV-1ИД (в 1.4 раза выше контроля), а антивирусные препараты снижали это повышение до уровня контроля. Экспрессия мРНК белка TJ CLDN5 находилась на уровне контроля во всех сублиниях клеток, кроме ECV-1ИД+ЛПС, у которой экспрессия мРНК CLDN5 была в 2.5 раза выше контроля. Добавление антивирусных препаратов повышало уровень экспрессии мРНК гена этого белка во всех сублиниях, особенно в присутствии алпизарина (максимально в 7.3 раза в сублинии ECV-ЛПС), что может свидетельствовать о нормализации клеточной проницаемости (рис. 2).
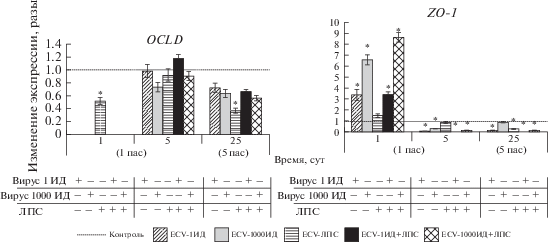
В отдельном эксперименте оценивали уровень экспрессии мРНК генов других белков, входящих в семейство TJ: OCLD и ZO-1. Результаты показали, что в клетках ECV-304 после однократного воздействия разных доз вируса гриппа А и (или) ЛПС с 1-го по 5-й пассажи происходит постепенное снижение уровня экспрессии мРНК этих генов, хотя это в меньшей степени отразилось на OCLD и в большей на ZO-1 (рис. 3). Эти данные свидетельствуют о том, что под воздействием вируса гриппа и (или) ЛПС происходит повышение проницаемости клеточных мембран, которое сохраняется в исследуемых сублиниях клеток на протяжении длительного периода времени.
ОБСУЖДЕНИЕ
Ангиогенез играет важную роль во многих физиологических и патологических процессах, и одним из регулирующих ангиогенез факторов является апоптоз. Хорошо известна способность высоко вирулентных штаммов птичьего гриппа вызывать смертельную инфекцию у цыплят в результате апоптоза клеток эндотелия различных органов (Swayne, 2007). Тем не менее механизмы патогенеза при гриппозной инфекции, в частности связь с апоптозом и нарушением барьерной функции, не всегда ясны. В условиях in vitro показана способность вирусов гриппа А человеческого происхождения вызывать TNF-индуцированный апоптоз в клетках эндотелия (HUVEC) (Sumikoshi et al., 2008). В то же время повышение клеточной проницаемости в клетках микроваскулярного эндотелия человека (HMVEC) и связь с апоптозом была обнаружена только у живого (инфекционного) вируса гриппа А, тогда как UV-инактивированный авирулентный вирус гриппа продолжал вызывать повышение клеточной проницаемости, но не вследствие индукции апоптоза, а в результате деградации белка TJ CLDN-5 (Armstrong et al., 2012). Хорошо известна роль цитокинов TNFα и TGFβ как в индукции апоптоза, так и в нарушении барьерных функций клетки, однако нередко эти процессы могут протекать независимо (Petrache et al., 2001; van Meeteren, ten Dijke, 2012).
В предыдущей работе мы показали, что апоптоз во всех полученных сублиниях клеток эндотелия, культивируемых более 3-х пассажей (в частности 6), находился на очень низком уровне, как в контрольных клетках. При этом антивирусные препараты ремантадин и алпизарин при воздействии на клетки сублинии ECV-1ИД 6-го пассажа снижали повышенную пролиферацию и в то же время стимулировали апоптоз всех сублиний (Смирнова и др., 2018).
Сравнительное изучение сублиний клеток эндотелия человека ECV-304 в настоящей и предыдущей работе (Смирнова и др., 2018) показало, что заражение непермиссивных клеток вирусом гриппа А (как в высокой, так и в очень низкой дозах) и воздействие ЛПС могут изменять миграционную, пролиферативную и апоптотическую активности клеток и нарушать барьерную функцию клеток. И мы показали впервые, что эти функциональные изменения можно наблюдать на протяжении длительного периода культивирования клеток после воздействия.
В исследованных сублиниях клеток происходило постепенное снижение (с увеличением количества пассажей) экспрессии мРНК генов OCLD и ZO-1, входящих в комплекс TJ, что является свидетельством повышения клеточной проницаемости (Kasa et al., 2015). Полученные нами в этой и предыдущей работе (Смирнова и др., 2018) результаты свидетельствуют о приобретении в процессе культивирования (после 3-го пассажа) клетками эндотелия всех сублиний устойчивости к апоптозу, несмотря на высокий уровень экспрессии мРНК генов как TNFα, так и TGFβ, особенно в сублинии ECV-1ИД+ЛПС. Это указывает на связь цитокинов TNFα и TGFβ с повышением клеточной проницаемости, но не с индукцией апоптоза в данном случае. Данный вывод подтверждается и тем фактом, что в присутствии антивирусных препаратов ремантадина и алпизарина ингибируется экспрессия генов TNFα и TGFβ, восстанавливается клеточная проницаемость (за счет увеличения экспрессии мРНК гена CLDN5) с одновременным повышением уровня апоптоза, что также свидетельствует о способности этих препаратов восстанавливать функциональное состояние клеток.
Характерно, что уровень экспрессии мРНК гена NOX4 лишь незначительно был повышен только в одной сублинии, полученной после заражения вирусом гриппа в низкой дозе (ECV-1ИД) и отличающейся повышенным уровнем пролиферации. Это позволяет предположить, что дисфункция клеток изучаемых сублиний при длительном культивировании может быть обусловлена повышением АФК не только в цитозоле (за счет оксидаз Nox2 и Nox4), но и, вероятно, в большей степени в митохондриях (Harel et al., 2017).
Многофункциональный цитокин TGFβ способен повышать пролиферацию клеток и их устойчивость к апоптозу через сигнальный путь ALK5 Smad 2/3/NF-κB, вызывающий превращение клеток эндотелия в миофибробласты (van Meeteren, ten Dijke, 2012; Montorfano et al., 2014). TGFβ считается цитокином, играющим центральную роль в развитии фиброза. Снижение чувствительности легочных фибробластов к Fas-индуцированному апоптозу (устойчивость к апоптозу) при повышенном уровне апоптоза альвеолярных клеток эпителия является характерным признаком развития фиброза легких, когда участки с разрушенным слоем эпителиоцитов со сниженной способностью к репарации заполняются устойчивыми к апоптозу фибробластами (Maher et al., 2010; Liu, Desai, 2015). Полученные нами результаты (увеличение экспрессии мРНК TGFβ на фоне развития устойчивости к апоптозу) подтверждают связь гриппозной инфекции и воздействия ЛПС (в особенности) с образованием миофибробластов и возможностью развития фиброза легких. Таким образом, добавление ЛПС в момент заражения клеток ECV-304 вирусом гриппа А вносит дополнительную дисфункцию в состояние клеток эндотелия, подобно тому как наслоение вторичной бактериальной инфекции даже при нетяжелых формах заболевания гриппом сопровождается серьезными, нередко отдаленными осложнениями (McCullers, 2006).
Наши данные также показывают, что клетки эндотелия, инфицированные одним вирусом гриппа А, могут приобрести атипичность (повышенную пролиферативную активность при очень низком уровне апоптоза), что может способствовать активному распространению подобных клеток и затруднению репарации поврежденных участков сосуда нормальными клетками эндотелия. Это может привести к повышенному ангиогенезу, способствующему развитию онкогенеза, а также, возможно, явиться причиной внутрисосудистых образований “неизвестного генеза” с признаками псевдоопухолевой гиперплазии (Diaz-Flores et al., 2017).
Таким образом, результаты работы показали, что в наших условиях постановки экспериментов (использование разных доз вируса и (или) ЛПС с последующим длительным культивированием клеток) изменения функционирования клеток эндотелия наблюдаются в течение длительного периода времени после воздействия. Показана также связь между первоначальным действующим агентом (вирус и (или) ЛПС) и направлением функциональных изменений (усилением или снижением) миграционной и пролиферативной активности и проницаемости клеток. Антивирусные препараты ремантадин и алпизарин активно влияли на все исследуемые процессы жизнедеятельности клеточных сублиний, что свидетельствует о возможности данных препаратов препятствовать развитию патологических изменений в клетках эндотелия, вызванных вирусом гриппа А и (или) ЛПС.
Полученные результаты будут полезны для поиска механизмов развития осложнений при инфекции вирусом гриппа А и вторичной бактериальной инфекции.
Список литературы
Даниленко Д.М., Смирнова С.С., Смирнова Т.Д., Писарева М.М., Плотникова М.А., Дробинцева (Дурнова) А.О., Еропкин М.Ю. 2016. Ответ клеток перевиваемых линий карциномы легкого (А-549) и эндотелия (ECV-304) человека на заражение вирусом гриппа А при различной степени инфицированности клеток. Цитология. 58 (3) : 192–200. (D.M. Danilenko, S.S. Smirnova, T.D. Smirnova, M.M. Pisareva, M.A. Plotnikova, A.O. Drobintseva (Durnova), M.Yu. Eropkin. 2016. Reaction of established cell lines of human lung carcinoma (A-549) and endothelium (ECV-304) to the infection with various multiplicity of influenza virus A. Tsitologiya. 58 (3) : 192–200.)
Смирнова С.С., Смирнова Т.Д., Сивак К.В., Воробьев К.В. 2018. Изменение функционального состояния клеток эндотелия человека перевиваемой линии ECV-304 под воздействием вируса гриппа А, липополисахарида E. coli и ряда препаратов. Цитология. 60 (4) : 287–296. (S.S. Smirnova, T.D. Smirnova, K.V. Sivak, K.V. Vorobiev. 2018. Change in the functional state of cells of the human endothelial cell line ECV-304 under the influence of influenza A virus, lipopolysaccharide from E. coli and some drugs. Tsitologiya. 60 (4) : 287–296.)
Amatore D., Sgarbanti R., Aquilano K., Baidelli S., Limonci E., Civitelli L., Nencioni L., Garaci E., Ciriolo M.R., Palamara A.T. 2015. Influenza virus replication in lung epithelial cells depends on redox-sensitive pathways activated by NOX4-derived ROS. Cell. Microbiol. 17 : 131–145.
Armstrong S., Wang Ch., Tigdi J., Si X., Dumpit C., Charles S., Gamage A., Moraes Th., Warren L. 2012. Influenza infects lung microvascular endothelium leading to microvascular leak: role of apoptosis and claudin-5. PloS One 7. 10 : e47323. doi 10.1371/journal.pone.0047323
Basuroy Sh., Bhattacharya S., Charles W., Parfenova H. 2009. Nox4 NADPH oxidase mediates oxidative stress and apoptosis caused by TNF-α in cerebral vascular endothelial cells. Am. J. Physiol. Cell Physiol. 296 : 422–432.
Breton-Romero R., Lamas S. 2014. Hydrogen peroxide signaling in vascular endothelial cells. Redox Biol. 2 : 529–534.
Dejana E., Orsenigo F., Lampugnani M.G. 2008. The role of adherens junctions and VE-cadherin in the control of vascular permeability. J. Cell Science. 121 : 2115–2122.
Diaz-Flores L., Gutierrez R., Garcia-Suarez M., Saez F., Gutierrez E., Villadares F., Carrsco J., Diaz-Flores L.Jr., Madrid J. 2017. Morphofunctional basis of the different types of angiogenesis and formation of angiogenesis-related secondary structures. Histol. Histopathol. 32 : 1239–1279.
Di Pietro L. 2016. Angiogenesis and wound repair: when enough is enough. J. Leukocyte Biol. 100 : 979–984.
Harel S., Mayaki D., Sanchez V., Hussain S. 2017. NOX2, NOX4, and mitochondrial-derived reactive oxygen species contribute to angiopoietin-1 signaling and angiogenic responses in endothelial cells. Vascul. Pharmacol. 92 : 22–32.
Kasa A., Csortos C., Verin A.D. 2015. Cytoskeletal mechanisms regulating vascular endothelial barrier function in response to acute lung injury. Tissue Barriers. 3 : e974448. doi 10.4161/21688370.2014.974448
Kim Y., Kim S., Tatsunami R., Yamamura H., Fukai T., Ushio-Fukai M. 2017. ROS-indused ROS release orchestrated by Nox4, Nox2, and mitochondria in VEGF signaling and angiogenesis. Am. J. Physiol. Cell Physiol. 312 : 749–764.
Kwok H., Poon P., Fok S., Ying-Kit Y., Mak N., Chan M., Peiris J., Wong R. 2016. Anti-inflammatory effects in indirubin derivatives on influenza A virus-infected human pulmonary microvascular endothelial cells. Sci. Rep. 6 : 18941–18953.
Liu H., Yu X., Yu S., Kou J. 2015. Molecular mechanisms in lipopolysaccharide-induced pulmonary endothelial barrier dysfunction. Int. Immunopharmacol. 29 : 937–946.
Liu R-M., Desai L. 2015. Reciprocal regulation of TGF-β and oxygen species: a perverse cycle of fibrosis. Redox Biol. 6 : 565–577.
Maher T., Evans I., Bottoms S., Mercer P., Thorley A., Nicholson A., Laurent G., Tetley T., Chambers R., McAnulty R. 2010. Diminished prostaglandin E2 contributes to the apoptosis paradox in idiopathic pulmonary fibrosis. Am. J. Respir. Crit. Care Med. 182 : 73–82.
McCullers J. 2006. Insights into interaction between influenza virus and pneumococcus. Clin. Microbiol. Rev. 193 : 571–582.
van Meeteren L.A., ten Dijke P. 2012. Regulation of endothelial cell plasticity by TGF-β. Cell Tiss. Res. 347 : 177–186.
Montorfano I., Becerra A., Cerro R., Echeverria C., Saez E., Morales M.G., Fernandez R., Cabello-Verrugio C., Simon F. 2014. Oxidative stress mediates the conversion of endothelial cells into myofibroblasts via a TGF-β1 and TGF-β2-dependent pathway. Lab. Investigation. 1–15.
Petrache I., Verin A., Crow M., Birukova A., Liu F., Garcia J. 2001. Differential effect of MLC kinase in TNF-α-induced endothelial cell apoptosis and barrier dysfunction. Am. J. Physiol. Lung Cell Mol. Physiol. 280 : L1168–L1178.
Sarmiento D., Montorfano I., Caceres M., Echeverria C., Fernandez R., Cabello-Verrugio C., Cerda O., Tapia P., Simon F. 2014. Endotoxin-induced vascular endothelial cell migration is dependent on TLR4/NF-kB pathway, NAD(P)H oxidase activation, and transient receptor potential melastatin 7 calcium channel activity. Int. J. Biochem. Cell Biol. 5 : 11–23.
Short K.R., Kasper J., van der Aa S., Andewed A.C., Zaaraoui-Boutahar F., Goeijenbier M., Richard M., Herold S., Becker C., Scott D.R., Limpens R.W., Koster A.J., Barcena M., Foucher R.A., Kirpatrick C.J., Kuiken T. 2016. Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur. Respir. J. 47 : 954–966.
Sumikoshi M., Hashimoto K., Kawasaki Y., Sakuma H., Suzutani T., Suzuki H., Hozoya M. 2008. Human influenza virus infection and apoptosis induction in human vascular endothelial cells. J Med Virol. 80 (6) : 1072–1078.
Swayne D. 2007. Understanding the complex pathobiology of high pathogenicity avian influenza viruses in birds. Avian Dis. 51(1 Suppl.) : 242–249.
You W., Stallcup W. 2017. Location of VEGF to vascular ECM is an important aspect of tumor angiogenesis. Cancers. 9 : 97–111.
Zhang Ch., Wu Y., Xuan Z., Zhang Sh., Wang X., Hao Y., Zhang Sh. 2014. P38MAPK, Rho/ROCK and PKC pathway are involved in influenza-induced cytoskeletal rearrangement and hyperpermeability in PMVEC via phosphorylating ERM. Virus Res. 192 : 6–15.
Wong M.L., Medrano J.F. 2005. Real-time PCR for mRNA quantitation. BioTechniques. 39 : 75–85.
Дополнительные материалы отсутствуют.