Цитология, 2020, T. 62, № 11, стр. 763-772
Мезенхимные стромальные клетки: роль в формировании гематоонкологической ниши
А. В. Чубарь 1, *, Н. И. Енукашвили 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: annachubar95@incras.ru
Поступила в редакцию 08.08.2020
После доработки 13.08.2020
Принята к публикации 16.08.2020
Аннотация
Микроокружение костного мозга (КМ) является важным компонентом поддержки нормального гемопоэза. Компоненты микроокружения (эндотелиальные клетки, остеобласты, адипоциты, мезенхимные стромальные клетки костного мозга (МСК-КМ) и иммунные клетки) регулируют пролиферацию и дифференцировку гематопоэтических стволовых клеток (ГСК) в КМ. Однако при развитии гематоонкологических заболеваний микроокружение КМ изменяется под влиянием опухолевых клеток. В настоящий момент успешное лечение таких заболеваний осложнено развитием лекарственной резистентности, связанной с различными механизмами снижения воздействия химиотерапевтических агентов на опухоль. Измененное микроокружение способствует возникновению лекарственной устойчивости в опухолевых клетках через клеточные контакты и синтезируемые цитокины. МСК-КМ – один из основных типов стромальных клеток КМ, способных к дифференцировке в различные клетки мезенхимного происхождения. Значительную роль в формировании, прогрессировании и развитии гематоонкологической опухоли играют МСК ниши. Цель обзора – проанализировать данные о роли МСК в формировании гематоонкологической ниши и их вкладе в формирование лекарственной резистентности. В работе определяются предпосылки влияния МСК-КМ (изменение фенотипа, устойчивость к цитостатикам) на выживание опухоли. Показано изменение компонентов гематопоэтической ниши при развитии лейкозов и множественной миеломы и ключевая роль измененных МСК-КМ в индукции синтеза антиапоптотических факторов в клетках опухоли. Таким образом, для успешного лечения гематоонкологических заболеваний необходим подбор методов лечения, воздействующих не только на сами опухолевые клетки, но и на компоненты ниши, в частности на МСК. Особенно необходима, кроме прочих, разработка подходов, направленных на нормализацию кроветворной ниши, которая поможет предотвратить развитие рецидивов заболеваний.
Микроокружение костного мозга (КМ) является необходимым компонентом в поддержке гемопоэза. Представленное различными внеклеточными компонентами и такими популяциями клеток, как эндотелиальные клетки, остеобласты, адипоциты, мезенхимные стромальные клетки костного мозга (МСК-КМ), иммунные клетки, микроокружение КМ регулирует пролиферацию и дифференцировку гематопоэтических стволовых клеток (ГСК) (Mendelson, Frenette, 2015). Однако при развитии гематологических заболеваний микроокружение КМ может изменяться под действием контактов с опухолевыми клетками. Одним из препятствий в успешном лечении гематоонкологических заболеваний является развитие лекарственной резистентности, обусловленной различными механизмами уменьшения воздействия химиотерапевтических агентов на опухоль (Meads et al., 2008). Микроокружение КМ может способствовать возникновению лекарственной устойчивости через клеточные контакты и синтезируемые цитокины.
МСК-КМ – один из основных типов клеток ниши. Это фибробластоподобные клетки, способные к дифференцировке в различные клетки мезенхимного происхождения (Friedenstein et al., 1970). При лейкозах МСК-КМ могут индуцировать синтез антиапоптотических сигналов и изменения метаболизма опухолевых клеток, повышая их выживаемость в условиях терапии. По сравнению с опухолевыми клетками МСК-КМ менее чувствительны к химиотерапевтическим агентам, что приводит к сохранению измененных клеток микроокружения КМ даже после проведенного успешного лечения и увеличивает шансы развития рецидива (Somaiah et al., 2018).
В связи с этим сохраняется необходимость изучения взаимодействий опухоли и микроокружения в целях прояснения механизмов поддержки роста опухоли и развития резистентности к лечению. Определение механизмов возникновения лекарственной устойчивости является одним из ключевых вопросов при исследовании процессов повторного возникновения опухолей и устойчивости к выбранным методам терапии. Задача данного обзора – проанализировать данные о роли МСК в формировании гематоонкологической ниши и их вкладе в формирование лекарственной резистентности.
УСТРОЙСТВО ГЕМАТОПОЭТИЧЕСКОЙ НИШИ
Активность ГСК и процесс кроветворения в здоровом КМ поддерживается в тесной связи со стромальным микроокружением, представленным несколькими типами клеток. Среди них можно выделить МСК и их дифференцированные производные (остеобласты, хондроциты, адипоциты), фибробласты, эндотелиальные клетки, клетки иммунной системы и другие. КМ – орган, богатый растворимыми факторами, среди которых различные цитокины, хемокины и факторы роста. Внутри КМ выделяются так называемые ниши – участки, внутри которых микроокружение КМ тесно контактирует с ГСК. Выделяются две различающиеся по локализации и клеточному составу ниши: периваскулярная и эндостальная (Kiel, Morrison, 2008).
Эндостальная ниша располагается вблизи эндоста (рис. 1) – соединительнотканного слоя, выстилающего внутреннюю поверхность трубчатых костей, и отличается высокой концентрацией ионов кальция (Adams et al., 2006). Основными клеточными компонентами этой ниши являются остеопрогениторные клетки, способные к дифференцировке в остеобласты и остеоциты, а также остеокласты, которые участвуют в резорбции кости (Sugiyama, Nagasawa, 2012). Остеопрогениторные клетки синтезируют остеопонтин (OPN), хемокин CXCL12 (другое название SDF-1), N-кадгерин, колониестимулирующий фактор гранулоцитов (G-CSF), тромбопоэтин, что делает их важными регуляторами гемопоэза (Nilsson et al., 2005; Anthony, Link, 2014). Данные о роли зрелых остеобластов неоднозначны: показано, что их отсутствие ведет к нарушению нормального кроветворения (Visnjic et al., 2004). С другой стороны, предполагается, что в поддержании ГСК более значительная роль принадлежит клеткам периваскулярной ниши (Morrison, Scadden, 2015).
Рис. 1.
Схема строения гематопоэтической ниши. CXCL12, SCF – секретируемыме цитокины и хемокины. ГСК – гематопоэтические стволовые клетки; c-Kit – рецептор цитокинов на поверхности ГСК; МСК – мезенхимные стромальные клетки; CAR-клетка – ретикулярная клетка, активно синтезирующая CXCL12.
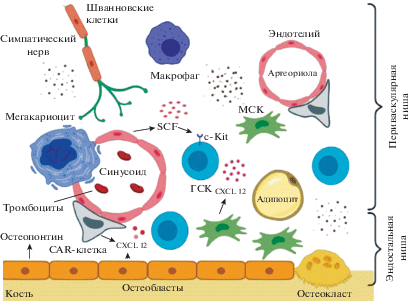
Периваскулярная ниша ассоциирована с сосудами, в том числе с венозными синусами, через которые осуществляется транспорт элементов крови. Среди компонентов ниши выделяются эндотелиальные клетки, МСК-КМ, симпатические нервы, Шванновские клетки, перициты и макрофаги (Ito et al., 2014; Morrison et al., 2015). Эндотелиальные клетки, выстилающие сосуды, синтезируют важные для ГСК факторы – CXCL12 и цитокин, фактор стволовых клеток SCF (Xu et al., 2018). МСК-КМ являются ключевыми компонентами гематопоэтической ниши за счет поддержки ГСК и способности к дифференцировке в остеогенном, адипогенном и хондрогенном направлениях (Dominici et al., 2006). МСК-КМ выделяют ряд разнообразных цитокинов и факторы, необходимые как для поддержки ГСК (CXCL12), так и для регуляции более дифференцированных гематопоэтических предшественников (GM-CSF, G-CSF) (Dazzi et al., 2006). Кроме того, в периваскулярной нише выявлена субпопуляция CXCL12-богатых CAR-клеток (CXCL12-abundant reticular cells), играющая ключевую роль в регуляции ГСК и В-лимфоцитов (Tokoyoda et al., 2004). В настоящее время некоторые исследователи выделяют отдельные периартериолярную и перисинусоидальную ниши (Ito et al, 2014).
Таким образом, микроокружение КМ, представленное различными популяциями клеток и неклеточными компонентами, обеспечивает регуляцию процессов гемопоэза. Локальные участки микроокружения, представленные периваскулярной и эндостальной нишами, создают необходимые условия для поддержки ГСК и процессов гемопоэза посредством прямых межклеточных взаимодействий, синтезируемых молекул и определенными физическими условиями (Mendelson, Frenette, 2015).
ГЕМАТООНКОЛОГИЧЕСКАЯ НИША
При развитии гематологических заболеваний микроокружение КМ изменяется под влиянием контактов с малигнизированными клетками (Чубарь и др., 2019). Нормальное кроветворение может угнетаться, а выделяемые стромой факторы привлекают и поддерживают клетки опухолей (Schepers et al., 2014). Предполагается, что еще до появления опухолевых клеток в КМ происходит формирование так называемой преметастатической ниши, создающей условия для привлечения и защиты раковых клеток. Одним из основных хемокинов, регулирующих миграцию в КМ, является CXCL12, активно синтезируемый МСК-КМ. Его рецептор, CXCR4, обнаруживается на клетках различных опухолей (Alsayed et al., 2007; Schelker et al., 2018). Опухолевые клетки адгезируют к стромальным клеткам и компонентам внеклеточного матрикса, например, фибронектину, через рецептор VLA-4 (Sanz-Rodríguez et al., 2001). МСК также могут привлекаться в опухоль из других органов, что связано с градиентом таких хемокинов, как CCL2, CCL5, CXCL12, CXCL16, а также факторов роста PDGF (тромбоцитарного), VEGF (сосудистого), IGF-1 (инсулиноподобного 1), TGFb (трансформирующего) и bFGF (фибробластов) (Hill et al. , 2017).
При лейкозах пролиферативная активность МСК-КМ снижается, а дифференцировка смещается в адипогенном направлении, что приводит к нарушению образования остеобластов (Geyh et al., 2013; Vicente López et al., 2014). МСК-КМ из опухолевого микроокружения отличаются от здоровых доноров не только фенотипически, но и генетически. Возможная роль таких мутаций в развитии гематологических заболеваний остается неясной (Garayoa et al., 2009). При сравнении транскриптомов МСК-КМ пациентов с полной ремиссией и ранним рецидивом различия не выявляются. При этом транскриптом МСК-КМ от пациентов, прошедших лечение, отличается от здоровых доноров, то есть измененный характер экспрессии генов сохраняется (Lemaitre et al., 2020).
Сходные данные об отличии опухолевого микроокружения от здоровой ниши получены и в исследовании КМ пациентов с множественной миеломой. В сравнении с контролем наблюдаются изменения в строении стромального микроокружения: увеличивается плотность микрососудов и плотность ретикулиновых волокон, сокращается число адипоцитов и площадь костных балок. Для МСК-КМ пациентов характерно снижение числа пассирований и скорости пролиферации, при этом после лечения кривая роста МСК-КМ восстанавливается до показателей здоровых доноров только у части пациентов. Кроме того, для МСК-КМ, полученных от пациентов с множественной миеломой, характерны такие черты опухоль-ассоциированного фенотипа, как синтез α-гладкомышечного актина, ассоциированной со старением β-галактозидазы (Ругаль и др., 2019; Семенова и др., 2020).
МСК ОПУХОЛИ
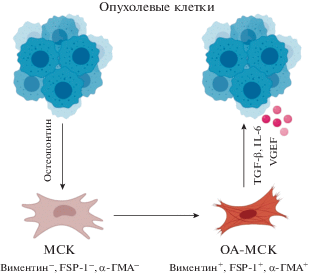
Известно, что МСК могут привлекаться в поврежденные ткани и участвовать в их регенерации (Sorrell, Caplan, 2010). Однако в опухоли МСК теряют способность к дифференцировке в мезенхимные производные и становятся МСК, ассоциированными с опухолью (ОА-МСК) (tumour-educated MSC; TA-MSC) (рис. 2). Для таких клеток характерны черты опухоль-ассоциированных фибробластов (ОАФ), в том числе синтез α-гладкомышечного актина, виментина, FSP-1, SDF-1 (Mishra et al., 2008; Castells et al., 2012; Shi et al., 2016). Предполагается, что ОА-МСК, как и ОАФ, в составе ниши обладают функциями, связанными с поддержанием роста опухоли. Активность ОА-МСК в первую очередь связана с выделением паракринных факторов, формирующих опухолевое микроокружение: факторов роста EGF (эпителиального), HGF (гепатоцитарного), IGF1 и FGF (Papait et al., 2020). Синтезируемые факторы индуцируют рост и подвижность опухоли, ее ангиогенез. Контакт опухоли и ОА-МСК связан с увеличением выживаемости опухолевых клеток и их устойчивости к лечению (Benito et al., 2011). ОА-МСК могут ремоделировать и уплотнять коллагеновый матрикс, при этом увеличивается подвижность и способность опухолевых клеток к миграции (Ghosh et al., 2020).
Рис. 2.
Взаимодействие МСК с опухолевыми клетками ведет к приобретению ими фенотипа ОА-МСК. Под влиянием факторов, выделяемых опухолевыми клетками, таких как остеопонтин, МСК приобретают фенотип ОА-МСК и начинают синтезировать виментин, фибробласт-специфический белок FSP-1 (fibroblast-specific protein 1), α-ГМА (α-гладкомышечный актин). ОА-МСК выделяют различные цитокины, в том числе IL-6 и факторы роста TGF-β и VEGF, которые поддерживают рост и резистентность опухолевых клеток, а также индуцируют ангиогенез в очаге опухоли.
Для ОА-МСК характерно снижение способности к пролиферации, усиление иммуносупрессорных свойств (André et al., 2013; Shi et al., 2016). Так, ОА-МСК при лимфомах могут привлекать моноциты, макрофаги и нейтрофилы в очаг опухоли более активно, чем МСК-КМ здоровых доноров. Этот процесс связан с синтезом лигандов рецептора CCR2 – CCL2, CCL7, CCL12 (Ren et al., 2012). Под влиянием ОА-МСК моноциты дифференцируются в макрофаги типа М2, обладающие проопухолевыми свойствами в отличие от макрофагов типа М1 (Ren et al., 2012). Макрофаги типа М2 выделяют противовоспалительные цитокины интерлейкин-10 (IL-10), TGF-β и другие (Zhang et al., 2010). Помимо опухоль-ассоциированных макрофагов, в КМ могут привлекаться миелоидные супрессорные клетки и регуляторные Т-клетки, подавляющие иммунный ответ (Ramachandran et al., 2013; Hadjiaggelidou et al., 2019). IL-10, HGF и TGF-β, выделяемые МСК-КМ, опосредуют ингибирование пролиферации Т-лимфоцитов (Di Nicola et al., 2002; Nasef et al., 2007).
В поддержке опухолей важную роль играют также проангиогенные свойства МСК-КМ, синтезирующих факторы роста VEGF, FGF-β, HGF и TGF-β (Ferrucci et al., 2014; Golay et al., 2007). Известно, что плотность сосудов микроциркуляторного русла в опухолевом очаге является одним из дополнительных прогностических факторов, а ингибирование активного сосудообразования также является приоритетным подходом в лечении заболеваний системы кроветворения (Lin et al., 2002; Pruneri et al., 2002; Семенова и др, 2020).
ОА-МСК могут дифференцироваться в α-гладкомышечный актин-положительные ОАФ, но, в отличие от них, ОА-МСК способны к более длительной пролиферации и позже вступают в процесс старения (Shi et al., 2016). ОАФ – это гетерогенная группа клеток, выявляемая в микроокружении как солидных, так и гематологических опухолей. ОАФ формируются преимущественно из фибробластов и МСК ткани, однако их источником могут быть также адипоциты, эпителиальные и эндотелиальные клетки, в которых происходит эпителиально-мезенхимный переход (Kidd et al., 2012; Shiga et al., 2015).
Такие клетки обладают сниженной способностью к пролиферации и дифференцировке, а их появление связано с синтезом TGF-β и CXCL12 (Shangguan et al., 2012). Выявляют ОАФ по таким маркерам, как виментин, десмин, FAP (белок активации фибробластов), NG2, рецепторы к PDGF и другим (Shiga et al., 2015). Эти молекулы не специфичны для ОАФ, так как могут также синтезироваться фибробластами и миофибробластами. ОАФ могут вызывать резистентность к химиотерапии, что связано с синтезом TGF-β, индуцирующим аутофагию в опухолевых клетках (Frassanito et al., 2016). Кроме того, ОАФ индуцируют ангиогенез за счет синтеза VEGF и других проангиогенных факторов (PDGF, FGF, CXCL12) (Shiga et al., 2015). Характерный для ОАФ синтез матриксных металлопротеиназ позволяет ремоделировать внеклеточный матрикс, облегчая движение опухолевых клеток. Высвобождаемые при этом белки и синтезируемые ОАФ цитокины привлекают иммунные клетки в очаг опухоли (Nii et al, 2020).
РОЛЬ НИШИ В РАЗВИТИИ ЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ
Лечение гематоонкологических заболеваний осложнено их генетической гетерогенностью, а также высоким шансом возникновения ранних рецидивов и развития лекарственной резистентности. Сохранение устойчивых к терапии клонов опухолевых клеток ведет к развитию минимальной остаточной болезни и может приводить к неблагоприятному исходу лечения. Большинство диагностических методов не детектирует опухолевые клетки, если их число меньше 109, поэтому если количество сохраняющихся в организме опухолевых клеток ниже этого порога, то результат терапии рассматривают как полную ремиссию (Meads et al., 2008).
Множественная лекарственная устойчивость может быть связана с недостаточным накоплением лекарства в клетке в связи с активацией различных помп, удаляющих лекарства, в том числе АВС-транспортеров (Лалетина и др., 2019; Boutin et al., 2020). Попадающие внутрь опухолевых клеток препараты могут инактивироваться за счет работы специфических ферментов, участвующих в метаболизме таких соединений, при этом экспрессия цитохромов Р450 характерна также для стромы (Alonso et al., 2015). При активном воздействии терапии в опухолевых клетках может нарушаться нормальный фолдинг белков, возникают повреждения в ДНК. Для их устранения активируются системы репарации ДНК и белки теплового шока, синтез которых может усиливать контакт со стромальными клетками (Nimmanapalli et al., 2008).
Микроокружение КМ играет ключевую роль в развитии лекарственной резистентности (EM-DR – environment-mediated drug resistance), которая подразделяется на лекарственную резистентность, вызванную растворимыми факторами (SFM-DR) и резистентность, опосредованную клеточной адгезией (CAM-DR) (Meads et al., 2009).
Устойчивость к терапевтическому воздействию, индуцированная клеточной адгезией, опосредуется контактами опухолевых клеток с клетками стромы или компонентами внеклеточного матрикса, например, с фибронектином, коллагеном и ламинином (Meads et al., 2009). Микроокружение также может индуцировать аутофагию в опухолевых клетках, что позволяет клеткам избегать апоптоза (Piya et al., 2017). Предполагается, что в отрыве от микроокружения опухолевые клетки снова приобретают чувствительность к лекарственным препаратам, что выражается в увеличении интенсивности апоптоза, поэтому одним из направлений развития терапии можно рассматривать разработку средств, ведущих к нарушению контактов стромы и опухоли (Hazlehurst et al., 2003; Meads et al., 2009).
В поддержке опухолевых клеток стромой КМ могут также играть роль экзосомы стромальных клеток и так называемые нанотуннели. Экзосомы стромальных клеток опухолевого микроокружения по составу отличаются от экзосом здоровой ткани, со сниженной концентрацией антиопухолевых молекул, например, miR-15a. Культивирование опухолевых клеток с такими экзосомами в присутствии лекарственных агентов повышает их выживаемость (Roccaro et al., 2013; Wang et al., 2014). Нанотуннели являются структурами на основе актина, посредством которых осуществляется транспорт как отдельных молекул, так и органелл, в том числе митохондрий, из стромальных клеток, что важно для поддержания метаболизма опухолевых клеток при действии препаратов (Omsland et al., 2017).
УСТОЙЧИВОСТЬ МСК-КМ К ХИМИОТЕРАПЕВТИЧЕСКИМ АГЕНТАМ (ЦИТОСТАТИКАМ)
Одним из основных типов клеток, контактирующих с опухолью, являются МСК-КМ, дифференцирующиеся в разные клеточные элементы стромы и участвующие в поддержке нормального кроветворения и защите малигнизированных клеток. МСК-КМ при лейкозах могут способствовать выживанию опухолевых клеток, индуцируя изменения в метаболизме, синтез антиапоптотических сигналов и экспрессию онкогенов (Mangolini, Ringshausen, 2020).
По сравнению с опухолевыми клетками лейкозов МСК-КМ менее чувствительны к терапевтическим агентам. Химиотерапевтические препараты оказывают влияние на способность МСК-КМ к миграции, адгезии и пролиферации, при этом практически не влияют на способность к дифференцировке и состав экспрессируемых маркеров (Nicolay et al., 2016a; Münz et al., 2018; Somaiah et al., 2018). Вместо апоптоза в МСК-КМ запускается процесс старения, который связан с активацией белков pRB и p53 и остановкой клеточного цикла (Mueller et al., 2006; Alessio et al., 2013). Именно такой эффект наблюдается при облучении МСК-КМ в условиях in vitro, когда клетки вступают в процесс старения, а концентрация выделяемых ими цитокинов изменяется. Так, интерлейкин-6 (IL-6) синтезируется в сходных с контролем концентрациях, а синтез VEGF, наоборот, снижается (Fekete et al., 2015). После обработки цисплатином в МСК-КМ увеличивается содержание белков теплового шока, что, как предполагается, связано с развитием лекарственной устойчивости (Nicolay et al., 2016a). При обработке МСК-КМ ингибиторами топоизомераз, токсичных для гематологических опухолей, наблюдается устойчивость к апоптозу и активация систем репарации двухцепочечных разрывов в ДНК (Hartmann, Lipp, 2006; Nicolay et al., 2016b). Таким образом, клетки опухолевого микроокружения способны пережить агрессивную терапию, а их измененные свойства используются опухолью для собственной защиты (Brenner et al., 2017; Somaiah et al., 2018).
РОЛЬ МСК-КМ В РАЗВИТИИ ЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ
Устойчивость ОА-МСК к цитостатикам позволяет им переживать курсы химиотерапии пациентов. Показано, что при этом МСК воздействуют на опухолевые клетки, повышая устойчивость последних к химиотерапевтическам агентам. Различные цитокины и другие растворимые факторы опосредуют запуск сигнальных путей в стромальных клетках, связанных с поддержанием опухоли. Основными растворимыми факторами, связанными с поддержкой лейкозов, которые выделяют МСК-КМ, являются IL-6, IGF-1, VEGF, BAFF (фактор, активирующий B-клетки), FGF, SDF1α и TNF-α (Pinto et al., 2020). При хроническом лимфоцитарном лейкозе фактор VEGF выделяется как клетками опухоли, так и МСК-КМ, но именно выделяемый стромальными клетками фактор влияет на выживание клеток лейкоза, как показано в экспериментах по сокультивированию клеток (Gehrke et al., 2011).
Развитие лейкозов связано с сигнальными путями Wnt/β-catenin и Notch, активация которых позволяет опухолевым клеткам избегать апоптоза (Yang et al., 2013; Mangolini et al., 2018). В выживании клеток В-клеточных лимфом также играет роль сигнальный путь hedgehog, лиганды которого синтезируют стромальные клетки (Dierks et al., 2007).
Одним из ключевых сигнальных путей в множественной миеломе, отличающейся пролиферацией клональных плазматических клеток в КМ, является путь IL-6/JAK/STAT3, активация которого приводит к выработке антиапоптотического фактора Bcl-Xl (Cheung, Van Ness, 2002), поэтому ингибирование IL-6 является одним из приоритетных направлений терапии (Lin et al., 2012). Интересно, что ингибиторы IL-6 действуют цитотоксически на клетки острого миелобластного лейкоза, но не на сами стромальные клетки в сходной концентрации (Golay et al., 2007).
Роль IL-6 в выживании опухолевых клеток и развитии их лекарственной резистентности показана не только для гематологических опухолей, но и для клеток эпителиальных опухолей, например, рака яичников или рака простаты (Hobisch et al., 1998; Duan et al., 2006). Аутокринный синтез IL-6 отличает клетки множественной миеломы с более низкими показателями как спонтанного, так и индуцированного дексаметазоном апоптоза, от несекретирующих IL-6 клонов (Frassanito et al., 2001). Ингибирование активности IL-6 с помощью моноклональных антител повышает цитотоксический эффект протеасомного ингибитора бортезомиба (распространенного при лечении множественной миеломы) даже в присутствии стромальных клеток, которые также синтезируют IL-6 (Bisping et al., 2003; Voorhees et al., 2007).
Механизмы развития лекарственной резистентности зависят от того, что является их основой – прямой контакт опухолевых клеток с микроокружением или различные цитокины. Показано, что кондиционной среды от МСК-КМ недостаточно для защиты опухолевых клеток от апоптоза под влиянием терапии при множественной миеломе. Но факторы, которые выделяют МСК при контакте с опухолевыми клетками, увеличивают пролиферативную активность последних (Nefedova et al., 2003).
Исследован один из путей формирования резистентности при участии ОА-МСК при множественной миеломе. Контакт рецептора CXCR5 на опухолевых клетках с хемокином CXCL13, синтезируемым МСК-КМ, повышает выживаемость клеток опухоли в присутствии протеасомного ингибитора бортезомиба, сохраняя их способность к пролиферации и миграции. При сокультивировании с МСК-КМ в клетках множественной миеломы увеличиваются уровни тирозинкиназы BTK (Bruton’s tyrosine kinase), p65, BCL-2 и MDR-1, связанных с выживаемостью опухолевых клеток и лекарственной резистентностью (Zhang et al., 2020).
ЗАКЛЮЧЕНИЕ
Механизм взаимодействий микроокружения с клетками гематологических опухолей представляет интерес в рамках вопроса о возникновении и поддержании их лекарственной резистентности. Несмотря на то, что современная терапия направлена на элиминацию малигнизированных клеток, в КМ сохраняются стромальные клетки с измененными свойствами, “обученные” опухолью для своего поддержания. Такие клетки, ярким примером которых являются МСК-КМ из опухолевого микроокружения, индуцируют образование сосудов, подавляют иммунный ответ и синтезируют антиапоптотические факторы, используемые малигнизированными клетками. Сохранение после лечения измененных МСК-КМ с относительной устойчивостью к химиотерапевтическим соединениям ведет к сохранению отдельных опухолевых клеток, которые в дальнейшем могут привести к рецидиву и не поддаваться эффективному лечению.
Таким образом, для успешной терапии гематоонкологических заболеваний необходима, кроме прочих, разработка подходов, направленных на нормализацию кроветворной ниши, которая поможет предотвратить развитие рецидивов заболеваний.
Список литературы
Лалетина Л.А., Моисеева Н.И., Климова Д.А., Ставровская А.А. 2019. Роль АВС-транспортеров в формировании лекарственной устойчивости к бортезомибу при множественной миеломе. Успехи мол. онкол. Т. 6. № 1. С. 49. (Laletina L.A., Moiseeva N.I., Klimova D.A., Stavrovskaya A.A. 2019. The role of АВС transporters in drug resistance to bortezomib in multiple myeloma. Uspekhi Mol. Oncol. V. 6. № 1. P. 49.)
Ругаль В.И., Бессмельцев С.С., Семенова Н.Ю., Грицаев С.В., Кострома И.И., Енукашвили Н.И., Чубарь А.В., Иволгин Д.А. 2019. Характеристика микроокружения костного мозга при множественной миеломе до и после терапии. Сибирский науч. мед. журн. Т. 39. № 1. С. 112. (Rugal V.I., Bessmeltsev S.S., Semenova N.Yu., Gritsaev S.V., Kostroma I.I., Enukashvili N.I., Chubar A.V., Ivolgin D.A. 2019. Characteristics of bone marrow microenvironment in multiple myeloma before and after treatment. Siberian Sci. Med. J. V. 39. № 1. P. 112.)
Семенова Н.Ю., Чубарь А.В., Енукашвили Н.И., Кострома И.И., Жернякова А.А., Артюхина З.Е., Ругаль В.И., Иволгин Д.А., Грицаев С.В., Чечеткин А.В., Бессмельцев С.С. 2020. Перестройка ключевых элементов стромального микроокружения костного мозга при множественной миеломе. Вестник гематологии. Т. 16. № 1. С. 15. (Semenova N.Yu., Chubar A.V., Enukashvili N.I., Kostroma I.I., Zhernyakova A.A., Artyukhina Z.E., Rugal V.I., Ivolgin D.A., Gritsaev S.V., Chechetkin A.V., Bessmeltsev S.S. 2020. Reconstruction of key elements of the stromal microenvironment of the bone marrow in multiple myeloma. Bull. Hematol. V. 16. № 1. P. 15.)
Чубарь А.В., Семенова Н.Ю., Ругаль В.И., Бессмельцев С.С., Котова А.В., Масленникова И.И., Иволгин Д.А., Енукашвили Н.И. 2019. Мезенхимные стромальные клетки костного мозга и их роль в формировании опухолевой ниши при онкогематологических заболеваниях. Вестник гематологии. Т. 15. № 1. С. 37. (Chubar A.V., Semenova N.Yu., Rugal V.I., Bessmeltsev S.S., Kotova A.V., Ivolgin D.A., Enukashvili N.I. 2019. Bone marrow mesenchymal stromal cells and their role in forming tumor microenvironment of oncohematological diseases. Bull. Hematol. V. 15. № 1. P. 37.)
Adams G.B., Chabner K.T., Alley I.R., Olson D.P., Szczepiorkowski Z.M., Poznansky M.C., Kos C.H., Pollak M.R., Brown E.M., Scadden D.T. 2006. Stem cell engraftment at the endosteal niche is specified by the calcium-sensing receptor. Nature. V. 439. P. 599.
Alessio N., Bohn W., Rauchberger V., Rizzolio F., Cipollaro M., Rosemann M., Irmler M., Beckers J., Giordano A., Galderisi U. 2013. Silencing of RB1 but not of RB2/P130 induces cellular senescence and impairs the differentiation potential of human mesenchymal stem cells. Cell. Mol. Life Sci. V. 70. P. 1637.
Alonso S., Su M., Jones J.W., Ganguly S., Kane M.A., Jones R.J., Ghiaur G. 2015. Human bone marrow niche chemoprotection mediated by cytochrome p450 enzymes. Oncotarget. V. 6. P. 14905.
Alsayed Y., Ngo H., Runnels J., Leleu X., Singha U.K., Pitsillides C.M., Spencer J.A., Kimlinger T., Ghobrial J.M., Jia X., Lu G., Timm M., Kumar A., Côté D., Veilleux I. et al. 2007. Mechanisms of regulation of CXCR4/SDF-1 (CXCL12)-dependent migration and homing in multiple myeloma. Blood. V. 109. P. 2708.
André T., Meuleman N., Stamatopoulos B., De Bruyn C., Pieters K., Bron D., Lagneaux L. 2013. Evidences of early senescence in multiple myeloma bone marrow mesenchymal stromal cells. PLoS One. V. 8. ID e59756. https://doi.org/10.1371/journal.pone.0059756
Anthony B.A., Link D.C. 2014. Regulation of hematopoietic stem cells by bone marrow stromal cells. Trends Immunol. V. 35. P. 32.
Benito J., Shi Y., Szymanska B., Carol H., Boehm I., Lu H., Konoplev S., Fang W., Zweidler-McKay P.A., Campana D., Borthakur G., Bueso-Ramos C., Shpall E., Thomas D.A., Jordan C.T. et al. 2011. Pronounced hypoxia in models of murine and human leukemia: High efficacy of hypoxia-activated prodrug PR-104. PLoS One. V. 6. ID e23108. https://doi.org/10.1371/journal.pone.0023108
Bisping G., Leo R., Wenning D., Dankbar B., Padró T., Kropff M., Scheffold C., Kröger M., Mesters R.M., Berdel W.E., Kienast J. 2003. Paracrine interactions of basic fibroblast growth factor and interleukin-6 in multiple myeloma. Blood. V. 101. P. 2775.
Boutin L., Arnautou P., Trignol A., Ségot A., Farge T., Desterke C., Soave S., Clay D., Raffoux E., Sarry J.E., Malfuson J.V., Lataillade J.J., Le Bousse-Kerdilès M.C., Anginot A. 2020. Mesenchymal stromal cells confer chemoresistance to myeloid leukemia blasts through Side population functionality and ABC transporter activation. Haematologica. V. 105. P. 987.
Brenner A.K., Nepstad I., Bruserud Ø. 2017. Mesenchymal stem cells support survival and proliferation of primary human acute myeloid leukemia cells through heterogeneous molecular mechanisms. Front. Immunol. V. 8. P. 106.
Castells M., Thibault B., Delord J.P., Couderc B. 2012. Implication of tumor microenvironment in chemoresistance: Tumor-associated stromal cells protect tumor cells from cell death. Int. J. Mol. Sci. V. 13. P. 9545.
Cheung W.C., Van Ness B. 2002. Distinct IL-6 signal transduction leads to growth arrest and death in B cells or growth promotion and cell survival in myeloma cells. Leukemia. V. 16. P. 1182.
Dazzi F., Ramasamy R., Glennie S., Jones S.P., Roberts I. 2006. The role of mesenchymal stem cells in haemopoiesis. Blood Rev. V. 20. P. 161.
Di Nicola M., Nicola M.Di, Carlo-Stella C., Magni M., Milanesi M., Longoni P.D., Matteucci P., Grisanti S., Gianni A.M. 2002. Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli. Blood. V. 99. P. 3838.
Dierks C., Grbic J., Zirlik K., Beigi R., Englund N.P., Guo G.R., Veelken H., Engelhardt M., Mertelsmann R., Kelleher J.F., Schultz P., Warmuth M. 2007. Essential role of stromally induced hedgehog signaling in B-cell malignancies. Nat. Med. V. 13. P. 944.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F.C., Krause D.S., Deans R.J., Keating A., Prockop D.J., Horwitz E.M. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. V. 8. P. 315.
Duan Z., Foster R., Bell D.A., Mahoney J., Wolak K., Vaidya A., Hampel C., Lee H., Seiden M.V. 2006. Signal transducers and activators of transcription 3 pathway activation in drug-resistant ovarian cancer. Clin. Cancer Res. V. 12. P. 5055.
Fekete N., Erle A., Amann E.M., Fürst D., Rojewski M.T., Langonné A., Sensebé L., Schrezenmeier H., Schmidtke-Schrezenmeier G. 2015. Effect of high-dose irradiation on human bone-marrow-derived mesenchymal stromal cells. Tissue Eng. Part C: Methods. V. 21. P. 112.
Ferrucci A., Moschetta M., Frassanito M.A., Berardi S., Catacchio I., Ria R., Racanelli V., Caivano A., Solimando A.G., Vergara D., Maffia M., Latorre D., Rizzello A., Zito A., Ditonno P., Maiorano E., Ribatti D., Vacca A. 2014. A HGF/cMET autocrine loop is operative in multiple myeloma bone marrow endothelial cells and may represent a novel therapeutic target. Clin. Cancer Res. V. 20. P. 5796.
Frassanito M.A., Cusmai A., Iodice G., Dammacco F. 2001. Autocrine interleukin-6 production and highly malignant multiple myeloma: Relation with resistance to drug-induced apoptosis. Blood. V. 97. P. 483.
Frassanito M.A., De Veirman K., Desantis V., Di Marzo L., Vergara D., Ruggieri S., Annese T., Nico B., Menu E., Catacchio I., Ria R., Racanelli V., Maffia M., Angelucci E., Derudas D. et al. 2016. Halting pro-survival autophagy by TGFβ inhibition in bone marrow fibroblasts overcomes bortezomib resistance in multiple myeloma patients. Leukemia. V. 30. P. 640.
Friedenstein A.F., Chailakhjan R.H., Lalykina K.S. 1970. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. Development. V. 3. P. 393.
Garayoa M., Garcia J.L., Santamaria C., Garcia-Gomez A., Blanco J.F., Pandiella A., Hernández J.M., Sanchez-Guijo F.M., del Cañizo M.C., Gutiérrez N.C., San Miguel J.F. 2009. Mesenchymal stem cells from multiple myeloma patients display distinct genomic profile as compared with those from normal donors. Leukemia. V. 23. P. 1515.
Gehrke I., Gandhirajan R.K., Poll-Wolbeck S.J., Hallek M., Kreuzer K.A. 2011. Bone marrow stromal cell-derived vascular endothelial growth factor (VEGF) rather than chronic lymphocytic leukemia (CLL) cell-derived VEGF is essential for the apoptotic resistance of cultured CLL cells. Mol. Med. V. 17. P. 619.
Geyh S., Öz S., Cadeddu R.P., Fröbel J., Brückner B., Kündgen A., Fenk R., Bruns I., Zilkens C., Hermsen D., Gattermann N., Kobbe G., Germing U., Lyko F., Haas R., Schroeder T. 2013. Insufficient stromal support in MDS results from molecular and functional deficits of mesenchymal stromal cells. Leukemia. V. 27. P. 1841.
Ghosh D., Mejia-Pena C., Quach N., Xuan B., Lee A.H., Dawson M.R. 2020. Senescent mesenchymal stem cells remodel extracellular matrix driving breast cancer cells to more invasive phenotype. J. Cell Sci. V. 133. ID jcs232470. https://doi.org/10.1242/jcs.232470
Golay J., Cuppini L., Leoni F., Micò C., Barbui V., Domenghini M., Lombardi L., Neri A., Barbui A.M., Salvi A., Pozzi P., Porro G., Pagani P., Fossati G., Mascagni P., Introna M., Rambaldi A. 2007. The histone deacetylase inhibitor ITF2357 has anti-leukemic activity in vitro and in vivo and inhibits IL-6 and VEGF production by stromal cells. Leukemia. V. 21. P. 1892.
Hadjiaggelidou C., Mandala E., Terpos E., Yiannaki E., Markala D., Triantafyllou T., Papatheodorou A., Gkastari V., Verrou E., Papanikolaou A., Konstantinidou P., Katodritou E. 2019. Evaluation of regulatory T cells (Tregs) alterations in patients with multiple myeloma treated with bortezomib or lenalidomide plus dexamethasone: correlations with treatment outcome. Ann. Hematol. V. 98. P. 1457.
Hartmann J.T., Lipp H.P. 2006. Camptothecin and podophyllotoxin derivatives: Inhibitors of topoisomerase I and II – Mechanisms of action, pharmacokinetics and toxicity profile. Drug Saf. V. 29. P. 209.
Hazlehurst L.A., Enkemann S.A., Beam C.A., Argilagos R.F., Painter J., Shain K.H., Saporta S., Boulware D., Moscinski L., Alsina M., Dalton W.S. 2003. Genotypic and phenotypic comparisons of de novo and acquired Melphalan resistance in an isogenic multiple myeloma cell line model. Cancer Res. V. 63. P. 7900.
Hill B.S., Pelagalli A., Passaro N., Zannetti A. 2017. Tumor-educated mesenchymal stem cells promote pro-metastatic phenotype. Oncotarget. V. 8. P. 73296.
Hobisch A., Eder I.E., Putz T., Horninger W., Bartsch G., Klocker H., Culig Z. 1998. Interleukin-6 regulates prostate-specific protein expression in prostate carcinoma cells by activation of the androgen receptor. Cancer Res. V. 58. P. 4640.
Ito K., Mar J.C., Bergman A., Frenette P.S. 2014. Arteriolar niches maintain haematopoietic stem cell quiescence. Nature. V. 502. P. 637.
Kidd S., Spaeth E., Watson K., Burks J., Lu H., Klopp A., Andreeff M., Marini F.C. 2012. Origins of the tumor microenvironment: Quantitative assessment of adipose-derived and bone marrow-derived stroma. PLoS One. V. 7. e30563. https://doi.org/10.1371/journal.pone.0030563
Kiel M.J., Morrison S.J. 2008. Uncertainty in the niches that maintain haematopoietic stem cells. Nat. Rev. Immunol. V. 8. P. 290.
Lemaitre L., Ferreira L.D.S., Joubert M.V., Avet-Loiseau H., Martinet L., Corre J., Couderc B. 2020. Imprinting of mesenchymal stromal cell transcriptome persists even after treatment in patients with multiple myeloma. Int. J. Mol. Sci. V. 21. P. 3854.
Lin B., Podar K., Gupta D., Tai Y.T., Li S., Weller E., Hideshima T., Lentzsch S., Davies F., Li C., Weisberg E., Schlossman R.L., Richardson P.G., Griffin J.D., Wood J., Munshi N.C., Anderson K.C. 2002. The vascular endothelial growth factor receptor tyrosine kinase inhibitor PTK787/ZK222584 inhibits growth and migration of multiple myeloma cells in the bone marrow microenvironment. Cancer Res. V. 62. P. 5019.
Lin L., Benson D.M., Deangelis S., Bakan C.E., Li P.K., Li C., Lin J. 2012. A small molecule, LLL12 inhibits constitutive STAT3 and IL-6-induced STAT3 signaling and exhibits potent growth suppressive activity in human multiple myeloma cells. Int. J. Cancer. V. 130. P. 1459.
Mangolini M., Götte F., Moore A., Ammon T., Oelsner M., Lutzny-Geier G., Klein-Hitpass L., Williamson J.C., Lehner P.J., Dürig J., Möllmann M., Rásó-Barnett L., Hughes K., Santoro A., Méndez-Ferrer S. et al. 2018. Notch2 controls non-autonomous Wnt-signalling in chronic lymphocytic leukaemia. Nat. Commun. V. 9. ID 3839. https://doi.org/10.1038/s41467-018-06069-5
Mangolini M., Ringshausen I. 2020. Bone marrow stromal cells drive key hallmarks of B cell malignancies. Int. J. Mol. Sci. V. 21. P. 1466.
Meads M.B., Gatenby R.A., Dalton W.S. 2009. Environment-mediated drug resistance: A major contributor to minimal residual disease. Nat. Rev. Cancer. V. 9. P. 665.
Meads M.B., Hazlehurst L.A., Dalton W.S. 2008. The bone marrow microenvironment as a tumor sanctuary and contributor to drug resistance. Clin. Cancer Research. V. 14. P. 2519.
Mendelson A., Frenette P.S. 2015. Hematopoietic stem cell niche maintenance during homeostasis and regeneration. Nat Med. V. 20. P. 833.
Mishra P.J., Mishra P.J., Humeniuk R., Medina D.J., Alexe G., Mesirov J.P., Ganesan S., Glod J.W., Banerjee D. 2008. Carcinoma-associated fibroblast-like differentiation of human mesenchymal stem cells. Cancer Res. V. 68. P. 4331.
Mondello P., Cuzzocrea S., Navarra M., Mian M. 2017. Bone marrow microenvironment is a crucial player for myelomagenesis and disease progression. Oncotarget. V. 8. P. 20 394.
Morrison S.J., Scadden D.T. 2014. The bone marrow niche for haematopoietic stem cells. Nature. V. 505. P. 327.
Mueller L.P., Luetzkendorf J., Mueller T., Reichelt K., Simon H., Schmoll H.-J. 2006. Presence of mesenchymal stem cells in human bone marrow after exposure to chemotherapy: evidence of resistance to apoptosis induction. Stem Cells. V. 24. P. 2753.
Münz F., Lopez Perez R., Trinh T., Sisombath S., Weber K.J., Wuchter P., Debus J., Saffrich R., Huber P.E., Nicolay N.H. 2018. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Sci. Rep. V. 8. ID 312. https://doi.org/10.1038/s41598-017-18862-1
Nasef A., Chapel A., Mazurier C., Bouchet S., Lopez M., Mathieu N., Sensebé L., Zhang Y., Gorin N.C., Thierry D., Fouillard L. 2007. Identification of IL-10 and TGF-β transcripts involved in the inhibition of T-lymphocyte proliferation during cell contact with human mesenchymal stem cells. Gene Expression. V. 13. P. 217.
Nefedova Y., Landowski T.H., Dalton W.S. 2003. Bone marrow stromal-derived soluble factors and direct cell contact contribute to de novo drug resistance of myeloma cells by distinct mechanisms. Leukemia. V. 17. P. 1175.
Nicolay N. H., Perez R.L., Rühle A., Trinh T., Sisombath S., Weber K.J., Ho A.D., Debus J., Saffrich R., Huber P.E. 2016a. Mesenchymal stem cells maintain their defining stem cell characteristics after treatment with cisplatin. Sci. Rep. V. 6. ID 20035. https://doi.org/10.1038/srep20035
Nicolay N.H., Rühle A., Perez R.L., Trinh T., Sisombath S., Weber K.J., Schmezer P., Ho A.D., Debus J., Saffrich R., Huber P.E. 2016b. Mesenchymal stem cells exhibit resistance to topoisomerase inhibition. Cancer Lett. V. 374. P. 75.
Nii T., Makino K., Tabata Y. 2020. A cancer invasion model of cancer-associated fibroblasts aggregates combined with TGF-β1 release system. Regener. Ther. V. 14. P. 196.
Nilsson S.K., Johnston H.M., Whitty G.A., Williams B., Webb R.J., Denhardt D.T., Bertoncello I., Bendall L.J., Simmons P.J., Haylock D.N. 2005. Osteopontin, a key component of the hematopoietic stem cell niche and regulator of primitive hematopoietic progenitor cells. Blood. V. 106. P. 1232.
Nimmanapalli R., Gerbino E., Dalton W.S., Gandhi V., Alsina M. 2008. HSP70 inhibition reverses cell adhesion mediated and acquired drug resistance in multiple myeloma. Br. J. Haematol. V. 142. P. 551.
Omsland M., Bruserud Ø., Gjertsen B.T., Andresen V. 2017. Tunneling nanotube (TNT) formation is downregulated by cytarabine and NF-κB inhibition in acute myeloid leukemia (AML). Oncotarget. V. 8. P. 7946.
Papait A., Stefani F.R., Cargnoni A., Magatti M., Parolini O., Silini A.R. 2020. The multifaceted roles of mscs in the tumor microenvironment: Interactions with immune cells and exploitation for therapy. Front. Cell Dev. Biol. V. 8. ID 447. https://doi.org/10.3389/fcell.2020.00447
Pinto V., Bergantim R., Caires H.R., Seca H., Guimarães J.E., Vasconcelos M.H. 2020. Multiple myeloma: Available therapies and causes of drug resistance. Cancers. V. 12. ID 407. https://doi.org/10.3390/cancers12020407
Piya S., Andreeff M., Borthakur G. 2017. Targeting autophagy to overcome chemoresistance in acute myleogenous leukemia. Autophagy. V. 13. P. 214.
Pruneri G., Ponzoni M., Ferreri A.J.M., Decarli N., Tresoldi M., Raggi F., Baldessari C., Freschi M., Baldini L., Goldaniga M., Neri A., Carboni N., Bertolini F., Viale G. 2002. Microvessel density, a surrogate marker of angiogenesis, is significantly related to survival in multiple myeloma patients. Br. J. Haematol. V. 118. P. 817.
Ramachandran I.R., Martne A., Pisklakova A., Condamine T., Chase T., Vogl T., Roth J., Gabrilovich D., Nefedova Y. 2013. Myeloid-derived suppressor cells regulate growth of multiple myeloma by inhibiting T cells in bone marrow. J. Immunol. V. 190. P. 3815.
Ren G., Zhao X., Wang Y., Zhang X., Chen X., Xu C., Yuan Z.R., Roberts A.I., Zhang L., Zheng B., Wen T., Han Y., Rabson A.B., Tischfield J.A., Shao C., Shi Y. 2012. CCR2-dependent recruitment of macrophages by tumor-educated mesenchymal stromal cells promotes tumor development and is mimicked by TNFα. Cell Stem Cell. V. 11. P. 812.
Roccaro A.M., Sacco A., Maiso P., Azab A.K., Tai Y.T., Reagan M., Azab F., Flores L.M., Campigotto F., Weller E., Anderson K.C., Scadden D.T., Ghobrial I.M. 2013. BM mesenchymal stromal cell-derived exosomes facilitate multiple myeloma progression. J. Clin. Invest. V. 123. P. 1542.
Sanz-Rodríguez F., Hidalgo A., Teixidó J. 2001. Chemokine stromal cell-derived factor-1α modulates VLA-4 integrin-mediated multiple myeloma cell adhesion to CS-1/fibronectin and VCAM-1. Blood. V. 97. P. 346.
Schelker R.C., Iberl S., Müller G., Hart C., Herr W., Grassinger J. 2018. TGF-β1 and CXCL12 modulate proliferation and chemotherapy sensitivity of acute myeloid leukemia cells co-cultured with multipotent mesenchymal stromal cells. Hematol. V. 23. P. 337.
Schepers K., Pietras E.M., Reynaud D., Flach J., Binnewies M., Garg T., Wagers A.J., Hsiao E.C., Passegué E. 2014. Myeloproliferative neoplasia remodels the endosteal bone marrow niche into a self-reinforcing leukemic niche. Cell Stem Cells. V. 13. P. 285.
Shangguan L., Ti X., Krause U., Hai B., Zhao Y., Yang Z., Liu F. 2012. Inhibition of TGF-β/Smad signaling by BAMBI blocks differentiation of human mesenchymal stem cells to carcinoma-associated fibroblasts and abolishes their protumor effects. Stem Cells. V. 30. P. 2810.
Shi Y., Du L., Lin L., Wang Y. 2016. Tumour-associated mesenchymal stem/stromal cells: Emerging therapeutic targets. Nat. Rev. Drug Discovery. V. 16. P. 35.
Shiga K., Hara M., Nagasaki T., Sato T., Takahashi H., Takeyama H. 2015. Cancer-associated fibroblasts: Their characteristics and their roles in tumor growth. Cancers. V. 7. P. 2443.
Somaiah C., Kumar A., Sharma R., Sharma A., Anand T., Bhattacharyya J., Das D., Deka Talukdar S., Jaganathan B. G. 2018. Mesenchymal stem cells show functional defect and decreased anti-cancer effect after exposure to chemotherapeutic drugs. J. Biomed. Sci. V. 25. ID 5. https://doi.org/10.1186/s12929-018-0407-7
Sorrell J.M., Caplan A.I. 2010. Topical delivery of mesenchymal stem cells and their function in wounds. Stem Cell Res. Ther. V. 1. ID 30. https://doi.org/10.1186/scrt30
Sugiyama T., Nagasawa T. 2012. Bone marrow niches for hematopoietic stem cells and immune cells. Inflamm Allergy Drug Targets. V. 11 P. 201.
Tokoyoda K., Egawa T., Sugiyama T., Choi B.Il, Nagasawa T. 2004. Cellular niches controlling B lymphocyte behavior within bone marrow during development. Immunity. V. 20. P. 707.
Vicente López Á., Vázquez García M.N., Melen G.J., Entrena Martínez A., Cubillo Moreno I., García-Castro J., Ramírez Orellana M., Zapata González A.G. 2014. Mesenchymal stromal cells derived from the bone marrow of acute lymphoblastic leukemia patients show altered BMP4 production: Correlations with the course of disease. PLoS One. V. 9. ID e84496. https://doi.org/10.1371/journal.pone.0084496
Visnjic D., Kalajzic Z., Rowe D.W., Katavic V., Lorenzo J., Aguila H.L. 2004. Hematopoiesis is severely altered in mice with an induced osteoblast deficiency. Blood. V. 103. P. 3258.
Voorhees P.M., Chen Q., Kuhn D.J., Small G.W., Hunsucker S.A., Strader J.S., Corringham R.E., Zaki M.H., Nemeth J.A., Orlowski R.Z. 2007. Inhibition of interleukin-6 signaling with CNTO 328 enhances the activity of bortezomib in preclinical models of multiple myeloma. Clin. Cancer Res. V. 13. P. 6469.
Wang J., Hendrix A., Hernot S., Lemaire M., De Bruyne E., Van Valckenborgh E., Lahoutte T., De Wever O., Vanderkerken K., Menu E. 2014. Bone marrow stromal cell-derived exosomes as communicators in drug resistance in multiple myeloma cells. Blood. V. 124. P. 555.
Xu C., Gao X., Wei Q., Nakahara F., Zimmerman S.E., Mar J., Frenette P. S. 2018. Stem cell factor is selectively secreted by arterial endothelial cells in bone marrow. Nat. Commun. V. 9. ID 2449. https://doi.org/10.1038/s41467-018-04726-3
Yang Y., Mallampati S., Sun B., Zhang J., Kim S.B., Lee J.S., Gong Y., Cai Z., Sun X. 2013. Wnt pathway contributes to the protection by bone marrow stromal cells of acute lymphoblastic leukemia cells and is a potential therapeutic target. Cancer Lett. V. 333. P. 9.
Zhang G., Miao F., Xu J., Wang R. 2020. Mesenchymal stem cells from bone marrow regulate invasion and drug resistance of multiple myeloma cells by secreting chemokine CXCL13. Bosnian J. Basic Medical Sci. V. 20. P. 209.
Zhang Q.Z., Su W.R., Shi S.H., Wilder-Smith P., Xiang A.P., Wong A., Nguyen A.L., Kwon C.W., Le A.D. 2010. Human gingiva-derived mesenchymal stem cells elicit polarization of M2 macrophages and enhance cutaneous wound healing. Stem Cells. V. 28. P. 1856.
Дополнительные материалы отсутствуют.
Инструменты
Цитология


