Цитология, 2022, T. 64, № 1, стр. 58-69
Лиганды рецепторов сигма-1 хлорпромазин и трифлуоперазин подавляют Cа2+-ответы в перитонеальных макрофагах крысы
Л. С. Миленина 1, *, З. И. Крутецкая 1, **, В. Г. Антонов 2, Н. И. Крутецкая 1
1 Кафедра биофизики Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Россия
2 Кафедра клинической биохимии и лабораторной диагностики Военно-Медицинской академии им. C.М. Кирова
194044 Санкт-Петербург, Россия
* E-mail: l.milenina@spbu.ru
** E-mail: z.krutetskaya@spbu.ru
Поступила в редакцию 28.09.2021
После доработки 12.10.2021
Принята к публикации 13.10.2021
- EDN: BFNRRW
- DOI: 10.31857/S0041377122010072
Аннотация
Рецепторы сигма-1 – повсеместные многофункциональные лигандрегулируемые молекулярные шапероны в мембране эндоплазматического ретикулума, имеющие уникальную историю, структуру и фармакологический профиль. Рецепторы сигма-1 связывают различные по химической структуре и фармакологическому действию лиганды и модулируют широкий спектр клеточных процессов в норме и патологии, включая процессы Ca2+-сигнализации. Для выявления участия рецепторов сигма-1 в процессах Ca2+-сигнализации в макрофагах исследовали влияние лигандов рецепторов сигма-1 нейролептиков фенотиазинового ряда хлорпромазина и трифлуоперазина на Са2+-ответы, вызываемые ингибиторами эндоплазматических Са2+-АТФаз тапсигаргином и циклопьязониковой кислотой, а также дисульфидсодержащими иммуномодуляторами глутоксимом и моликсаном в перитонеальных макрофагах крысы. С использованием флуоресцентного Са2+-зонда Fura-2АМ впервые показано, что хлорпромазин и трифлуоперазин подавляют обе фазы Са2+-ответов, индуцируемых глутоксимом, моликсаном, тапсигаргином и циклопьязониковой кислотой в перитонеальных макрофагах крысы. Полученные данные свидетельствуют об участии рецепторов сигма-1 в комплексном сигнальном каскаде, вызываемом глутоксимом или моликсаном и приводящем к увеличению внутриклеточной концентрации Са2+ в макрофагах. Результаты свидетельствуют также об участии рецепторов сигма-1 в регуляции депозависимого входа Са2+ в макрофагах.
Ион Са2+ является универсальным вторичным мессенджером, действующим в клетках микроорганизмов, растений и животных (Berridge et al., 1998; Carafoli, Krebs, 2016). Изменения в транспорте и внутриклеточной концентрации ионов Са2+, [Ca2+]i, играют ключевую роль в запуске и регуляции общих и специализированных клеточных функций, таких как пролиферация, рост, секреция, сокращение, передача нервного импульса, иммунный ответ и т.д. (Berridge et al., 2000, 2003). В клетках иммунной системы (лимфоцитах, тучных клетках, макрофагах) ионы Са2+ работают на всех стадиях жизни клетки, включая развитие, активацию, дифференцировку, продукцию цитокинов и, наконец, смерть клетки (Vig, Kinet, 2009; Trebak, Kinet, 2019).
Важными участниками процессов Са2+-сигнализации в клетках являются рецепторы сигма-1, имеющие уникальную историю, структуру, фармакологию и модулирующие широкий спектр клеточных процессов в норме и патологии (Su et al., 2010, 2016; Rousseaux, Greene, 2016; Penke et al., 2018; Schmidt, Kruse, 2019; Aishwarya et al., 2021). Международный союз общей и клинической фармакологии включил рецепторы сигма в список рецепторов только в 2013 г. как лигандрегулируемые неопиоидные внутриклеточные рецепторы (Alexander et al., 2013).
Рецепторы сигма-1 представляют собой уникальные многофункциональные лигандрегулируемые молекулярные шапероны, локализованные в мембране эндоплазматического ретикулума, на границе с митохондриями (MAM – mitochondria-associated endoplasmic reticulum membrane) (Su et al., 2010, 2016; Rousseaux, Greene, 2016; Schmidt, Kruse, 2019; Delprat et al., 2020; Aishwarya et al., 2021). Кроме того, они могут транслоцироваться к плазмалемме и взаимодействовать с ионными каналами и другими рецепторами, а также встречаются в ядерной оболочке, где участвуют в регуляции транскрипции (Su et al., 2016). Эти рецепторы экспрессированы в клетках различных типов, включая клетки иммунной системы (Rousseaux, Greene, 2016; Penke et al., 2018; Aishwarya et al., 2021).
Рецептор сигма-1 был впервые клонирован в 1996 г. из печени морской свинки (Hanner et al., 1996) и клеток хориокарциномы плаценты человека (Kekuda et al., 1996). Оказалось, что рецептор сигма-1 представляет собой белок с молекулярной массой 25 кДа, содержащий 223 аминокислоты. Аминокислотная последовательность сигма-1-рецептора человека уникальна и не имеет гомологов среди других белков млекопитающих (Hanner et al., 1996; Ossa et al., 2017). В 2016 г. в лаборатории Крузе c использованием методов кристаллографии была впервые установлена трехмерная структура сигма-1-рецептора человека (Shmidt et al., 2016; Kruse, 2017). Обнаружено, что этот рецептор является тримером, состоящим из трех идентичных протомеров. Каждый протомер содержит один трансмембранный домен (Shmidt et al., 2016, 2018; Alon et al., 2017; Ossa et al., 2017; Shmidt, Kruse, 2019).
Рецепторы сигма-1 имеют очень широкий фармакологический профиль. Их лигандами являются различные по химической структуре и фармакологическому действию соединения: антидепрессанты (флувоксамин, сертралин, имипрамин), нейролептики (галоперидол, хлорпромазин), анальгетики (пентазоцин), анксиолитики (афобазол), противосудорожные (фенитоин), противокашлевые (декстрометорфан, карбетапентан) и антигистаминные (хлорфенамин) препараты, наркотические средства (метамфетамин и кокаин) и препараты, применяемые при лечении нейродегенеративных заболеваний (амантадин, мемантин, донепезил) (Cobos et al., 2008; Maurice, Su, 2009; Chu, Ruoho, 2016; Vavers et al., 2019; Voronin et al., 2020). Из общих структурных черт лигандов следует отметить катионную аминогруппу и по меньшей мере одно ароматическое кольцо. Типичные нейролептики (галоперидол, флуфеназин, хлорпромазин, трифлуоперазин) имеют высокое сродство к рецепторам сигма-1 (Tam, Cook, 1984).
Выполняя функции шаперонов, рецепторы сигма-1 взаимодействуют с белками-мишенями (ионными каналами, рецепторами в плазмалемме и др.) и модулируют многие клеточные процессы, включая процессы Са2+-сигнализации (Su et al., 2010, 2016; Schmidt, Kruse, 2019; Pontisso, Combettes, 2021). В плазмалемме они взаимодействуют с потенциалзависимыми Ca2+-, Na+- и K+-каналами, протон-активируемыми ионными каналами (ASICs), NMDA-рецепторами, рецепторами, связанными с G-белками (мускариновыми ацетилхолиновыми рецепторами, μ-опиоидными и D1- и D2-дофаминовыми рецепторами) и другими белками-мишенями (Su et al., 2010, 2016; Schmidt, Kruse, 2019). В мембране эндоплазматического ретикулума рецептор сигма-1 взаимодействует с рецептором инозитол-1,4,5-трифосфата 3‑го типа, с другим молекулярным шапероном белком BiP (binding immunoglobulin protein) (Hayashi, Su, 2007) и Са2+-сенсором белком STIM1 (Srivats et al., 2016). Обнаружено, что взаимодействуя с рецепторами инозитол-1,4,5-трифосфата, рецепторы сигма-1 модулируют процессы Са2+-сигнализации в клетках: мобилизацию Са2+ из депо (Hayashi et al., 2000; Wu, Bowen, 2008) и вход Са2+ из наружной среды (Monnet, 2005; Hayashi, Su, 2007; Pontisso, Combettes, 2021). Выявлено их участие в регуляции депозависимого входа Са2+ в клетках (Brailoiu et al., 2016; Rosado, 2016; Srivats et al., 2016; Berlansky et al., 2021).
Ранее нами было впервые показано, что антагонист рецепторов сигма-1 нейролептик галоперидол (производное бутирофенона) значительно подавляет обе фазы Са2+-ответов, вызываемых дисульфидсодержащими иммуномодуляторами глутоксимом® (динатриевая соль окисленного глутатиона с d-металлом в наноконцентрации) и моликсаном® (комплекс глутоксима и нуклеозида инозина) (Крутецкая и др., 2017) и ингибиторами эндоплазматических Са2+-АТФаз тапсигаргином и циклопьязониковой кислотой (ЦПК) (Крутецкая и др., 2018б) в перитонеальных макрофагах крысы.
Для подтверждения участия рецепторов сигма-1 в регуляции процессов Са2+ сигнализации в макрофагах, представлялось целесообразным исследовать влияние других, структурно отличных, лигандов рецепторов сигма-1 на Са2+-ответы, индуцируемые глутоксимом и моликсаном, а также тапсигаргином (Thastrup et al., 1989) и ЦПК (Goeger et al., 1988), в перитонеальных макрофагах крысы, что и составило предмет настоящего исследования.
В экспериментах использовали лиганды рецепторов сигма-1 хлорпромазин (ХП, аминазин, торазин) (Itzhak et al., 1990; Hayashi, Su, 2004) и трифлуоперазин (ТФП, трифтазин, стелазин) (Schuster et al., 1995; Hanner et al., 1996), относящиеся к первому поколению типичных нейролептиков (антипсихотических агентов) фенотиазинового ряда и имеющие долгую историю использования в клинике для терапии шизофрении и других психических заболеваний (Dilsaver, 1993; Ayano, 2016).
МАТЕРИАЛ И МЕТОДИКА
Выделение и культивирование перитонеальных макрофагов крыс. Эксперименты проводили на культивируемых резидентных перитонеальных макрофагах крыс линии Wistar. Содержание животных и все манипуляции выполняли в соответствии с нормативными документами и требованиями Приказа Минздрава России № 267 от 19.06.03 “Об утверждении правил лабораторной практики в Российской Федерации”.
Резидентные макрофаги выделяли из перитонеальной полости крыс массой 180–250 г по традиционному методу; сразу после выделения клетки имели сферическую форму диаметром 10–20 мкм (Conrad, 1981; Randriamampita, Trautmann, 1987). Суспензию клеток помещали в бакпечатки с кварцевыми стеклами (10 × 10 мм) и культивировали в течение 1–3 сут при 37°С в среде 199 (рН 7.2), содержащей 20% сыворотки крови быка, глутамин (3%), пенициллин (100 Ед./мл) и стрептомицин (100 мг/мл). С помощью теста на α-нафтилэстеразу подтверждали, что по меньшей мере 96% клеток в монослоях являлись макрофагами (Monahan et al., 1981).
Эксперименты проводили при температуре 22–24°С через 1–2 сут после начала культивирования клеток. Кварцевые стекла с клетками помещали в экспериментальную камеру, заполненную физиологическим раствором следующего ионного состава (мМ): 140 NaCl, 5 KCl, 1 CaCl2, 1 MgCl2 и 5 HEPES-NaOH, рН 7.3–7.4. Бескальциевая среда отличалась тем, что содержала 1 мМ ЭГТА и не содержала CaCl2. Исследуемые агенты добавляли к макрофагам, находящимся в бескальциевой среде. Для инициации входа Са2+ в клетки, в среду вводили 2 мМ Са2+.
Измерение [Ca2+]i. Использовали флуоресцентный зонд Fura-2AM (Sigma-Aldrich, США). Макрофаги инкубировали в течение 45 мин в физиологическом растворе, содержащем 2 мкМ Fura-2AM, при 22–24°С. Стекла с окрашенными клетками отмывали физиологическим раствором и переносили в экспериментальную камеру флуоресцентного микроскопа Leica DM 4000B (Leica Microsystems, Германия). Возбуждение флуоресценции объекта производили при длинах волн 340 и 380 нм через объектив микроскопа. Для выделения соответствующих участков спектра использовали узкополосные оптические фильтры. Эмиссию регистрировали при длине волны 510 нм при помощи специализированной видеокамеры Leica DFC340FX. Для управления экспериментом использовали систему обработки изображения ImageJ (плагин Micro-Manager 1.4).
Результатом измерений являлось отношение интенсивностей флуоресценции Fura-2AM при облучении светом с длиной волны 340 нм к интенсивности флуоресценции при облучении светом с длиной волны 380 нм (F340/F380), где F340 – интенсивность флуоресценции Fura-2AM, связанного с Са2+, а F380 – интенсивность флуоресценции Fura-2AM, не связанного с Са2+, отражающая изменения [Ca2+]i в клетках во время измерений (Bruce, Elliott, 2000; Xie et al., 2002). Для избежания фотовыгорания измерения проводили через каждые 20 с, облучая объект в течение 2 с. В экспериментах применяли объектив с увеличением 10× и апертурой 8 мм. Значения [Ca2+]i рассчитывали по уравнению Гринкевича (Grynkiewicz et al., 1985). Статистический анализ проводили с применением t-критерия Стьюдента. Данные представлены в виде среднего и стандартного отклонения. Каждую регистрацию получали для группы из 40–50 клеток. На рисунках представлены результаты однотипных экспериментов из 6–8 независимых. Достоверными считали различия при P ≤ 0.05.
Использованные реактивы: все реактивы приобретали в фирме Sigma-Aldrich (США). Маточные растворы Fura-2AM (1 мМ), ЦПК (10 мМ) и тапсигаргина (0.5 мМ) готовили в диметилсульфоксиде. Препараты глутоксим и моликсан были от фирмы ФАРМА-ВАМ (Санкт-Петербург). Маточные растворы глутоксима (50 мг/мл), моликсана (50 мг/мл), ТФП (2 мг/мл) и ХП (25 мг/мл) готовили в воде.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние хлорпромазина и трифлуоперазина на Са2+-ответы, индуцируемые дисульфидсодержащими иммуномодуляторами. Фармакологические аналоги окисленного глутатиона (глутоксим и моликсан) используются как иммуномодуляторы и цитопротекторы в комплексной терапии бактериальных, вирусных и онкологических заболеваний (Борисов и др., 2001; Соколова и др., 2002; Антушевич и др., 2013; Толстой и др., 2019). Эти препараты оказывают комплексное влияние на процессы редокс-регуляции в клетках, однако тонкие биофизические механизмы их действия далеки от полного понимания.
В настоящей работе контрольные эксперименты показали, что инкубация макрофагов в течение 20 мин со 100 мкг/мл глутоксима (рис. 1а) или 100 мкг/мл моликсана (рис. 2а) в бескальциевой среде вызывает медленно нарастающее увеличение [Ca2+]i, отражающее мобилизацию Са2+ из внутриклеточных Са2+-депо. Через 20 мин после добавления агентов [Ca2+]i в среднем увеличивалась от базального уровня, равного 90 ± 18, до 135 ± 18 нМ (n = 7; P < 0.05) для глутоксима и 134 ± 20 нМ (n = 6; P < 0.05) для моликсана. При введении в наружную среду 2 мМ Са2+ наблюдали дальнейшее повышение [Ca2+]i, отражающее депозависимый вход Са2+ в цитозоль (рис. 1, 2). В среднем увеличение [Ca2+]i во время входа Са2+ составило 223 ± 22 нМ (n = 7; P < 0.05) и 202 ± 20 нМ (n = 6; P < 0.05) для глутоксима и моликсана соответственно.
Рис. 1.
Влияние хлорпромазина (ХП, 25 мкг/мл) и трифлуоперазина (ТФП, 2 мкг/мл) на увеличение [Ca2+]i, вызываемое глутоксимом в перитонеальных макрофагах крысы. Здесь и на рис. 2–4 по оси ординат – отношение интенсивностей флуоресценции Fura-2AM при длинах волн возбуждающего излучения 340 и 380 нм (F340/F380, отн. ед.). Условия стимуляции: а – макрофаги инкубировали в течение 20 мин в присутствии 100 мкг/мл глутоксима в номинально бескальциевой среде, затем вход Са2+ инициировали введением в наружную среду 2 мМ Са2+; б, в – макрофаги, находящиеся в бескальциевой среде, инкубировали в течение 10 мин с ХП (б) или в течение 15 мин с ТФП (в), затем добавляли 100 мкг/мл глутоксима, через 20 мин вход Са2+ инициировали введением в наружную среду 2 мМ Са2+. Здесь и на рис. 2–4 каждая регистрация получена для группы из 40–50 клеток и представляет собой типичный вариант из 6–8 независимых экспериментов.

Рис. 2.
Влияние ХП и ТФП на увеличение [Ca2+]i, вызываемое моликсаном (100 мкг/мл) в перитонеальных макрофагах крысы. а, б, в – Условия предварительной стимуляции в бескальциевой среде и последующей инициации входа Са2+ те же, что указаны в подписи к рис. 1.

В наших экспериментах впервые было обнаружено, что преинкубация перитонеальных макрофагов с 25 мкг/мл ХП в течение 10 мин до введения 100 мкг/мл глутоксима приводила к значительному подавлению как мобилизации Са2+ из депо (на 58.5 ± ± 4.6%, n = 7; P < 0.05), так и последующего депозависимого входа Са2+ в клетки (на 59.1 ± 6.1%, n = 7; P < 0.05), индуцируемых глутоксимом (рис. 1б). Предварительная инкубация клеток с 2 мкг/мл ТФП в течение 15 мин до введения 100 мкг/мл глутоксима также вызывала подавление фазы мобилизации Са2+ из депо (на 36.2 ± 5.7%, n = 8; P < 0.05) и депозависимого входа Са2+ в макрофаги (на 60.7 ± 7.1%, n = 7; P < 0.05), вызываемых глутоксимом (рис. 1в).
Сходные результаты были получены в экспериментах по влиянию ХП и ТФП на Са2+-ответы, вызываемые в макрофагах 100 мкг/мл моликсана (рис. 2б, в). Так, подавление фазы мобилизации Са2+ из депо составило в среднем 43.2 ± 8.9% (n = 8; P < 0.05) и 63.3 ± 2.4% (n = 7; P < 0.05), а подавление депозависимого входа Са2+ в макрофаги – 52.3 ± 9.1% (n = 8; P < 0.05) и 65.3 ± 5.0% (n = 7; P < 0.05) для ХП и ТФП соответственно.
Влияние фенотиазиновых нейролептиков на Са2+-ответы, индуцируемые ингибиторами эндоплазматических Са2+-АТФаз. В контрольных экспериментах мы обнаружили, что добавление 0.5 мкМ тапсигаргина к макрофагам, находящимся в бескальциевой среде, вызывает незначительное увеличение [Ca2+]i, отражающее мобилизацию Са2+ из внутриклеточных Са2+-депо (рис. 3а). В среднем увеличение [Ca2+]i во время фазы мобилизации составило 26 ± 7 нМ (n = 7; P < 0.05). При последующем введении в наружную среду 2 мМ Са2+ наблюдали депозависимый вход Са2+ в цитозоль (рис. 3а). В среднем увеличение [Ca2+]i во время входа Са2+ составило 160.2 ± 20.5 нМ (n = 7; P < 0.05). Сходные результаты мы получили при использовании 10 мкМ ЦПК (рис. 4а): в среднем увеличение [Ca2+]i во время фазы мобилизации Са2+ из депо, вызываемой ЦПК, составило 37.8 ± 9.8 нМ (n= 7; P < 0.05), а во время депозависимого входа Са2+ в макрофаги – 150.2 ± 23.7 нМ (n = 7; P < 0.05) (рис. 4а).
Рис. 3.
Влияние ХП (25 мкг/мл) и ТФП (2 мкг/мл) на Са2+-ответы, индуцируемые тапсигаргином (0.5 мкМ) в перитонеальных макрофагах крысы. а, б, в – Условия эксперимента те же, что указаны в подписи к рис. 1.
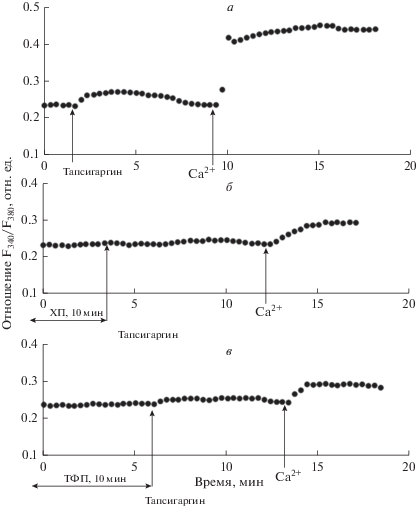
Рис. 4.
Влияние ХП (25 мкг/мл) и ТФП (2 мкг/мл) на Са2+-ответы, индуцируемые циклопьязониковой кислотой (ЦПК, 10 мкМ) в перитонеальных макрофагах крысы. а, б, в – Условия эксперимента те же, что указаны в подписи к рис. 1.

В наших экспериментах впервые было обнаружено, что преинкубация макрофагов с 25 мкг/мл ХП в номинально бескальциевой среде в течение 10 мин до введения 0.5 мкМ тапсигаргина вызывает значительное подавление обеих фаз Са2+-ответов, индуцированных тапсигаргином (рис. 3б). Так, подавление фазы мобилизации Са2+ из депо составило 59.3 ± ± 8.2% (n = 7; P < 0.05), а депозависимого входа Са2+ – 68.2 ± 10.4% (n = 7; P < 0.05). Сходные результаты были получены в экспериментах с применением 10 мкМ ЦПК (рис. 4б). Подавление ХП мобилизации Са2+ из депо составило 40.2 ± 9.1% (n = 7; P < 0.05), а подавление депозависимого входа Са2+ – 63.4 ± 11.5% (n = 7; P < 0.05).
Другой нейролептик фенотиазинового ряда ТФП также значительно подавлял обе фазы Са2+-ответов, индуцированных тапсигаргином или ЦПК. Показано, что предварительная инкубация клеток с 2 мкг/мл ТФП в течение 10 мин до введения 0.5 мкМ тапсигаргина (рис. 3в) вызывала подавление фазы мобилизации Са2+ из депо (на 59.0 ± 9.4%, n = 7; P < 0.05) и депозависимого входа Са2+ в макрофаги (на 73.5 ± 11.2%, n = 7; P < 0.05 ), вызываемых тапсигаргином (рис. 3в). Сходные данные были получены в экспериментах с применением 10 мкМ ЦПК (рис. 4в). Подавление мобилизации Са2+ из депо ТФП составило 40.1 ± 9.7% (n = 7; P < 0.05), а подавление депозависимого входа Са2+ – 60.4 ± 10.8% (n = 7; P < 0.05). Это подтверждает полученные нами ранее данные о том, что преинкубация клеток с ТФП приводит к подавлению депозависимого входа Са2+, индуцируемого ингибиторами эндоплазматических Са2+-АТФаз тапсигаргином и ЦПК, в перитонеальных макрофагах крысы (Крутецкая и др., 2018a).
Таким образом, в настоящей работе мы впервые на перитонеальных макрофагах крысы показали, что лиганды рецепторов сигма-1 нейролептики фенотиазинового ряда ХП и ТФП подавляют обе фазы Са2+-ответов, вызываемых глутоксимом или моликсаном, а также тапсигаргином и ЦПК, в перитонeальных макрофагах. Результаты согласуются с данными исследований других авторов, которые обнаружили, что лиганды рецепторов сигма-1 ХП и ТФП подавляют мобилизацию Са2+ из депо и последующий депозависимый вход Са2+, вызываемые АТФ или тапсигаргином, в клетках лейкоза человека (линия HL-60) (Harper et al., 1997; Harper, Daly, 1999). Показано также, что ХП ингибирует депозависимый вход Са2+, индуцируемый брадикинином или тапсигаргином в клетках феохромоцитомы крысы (линия PC12) (Choi et al., 2001), а преинкубация клеток с ТФП приводит к существенному подавлению депозависимого входа Са2+, вызываемого тапсигаргином, в клетках эмбриональной почки человека (линия НЕК-293) (Wang et al., 2015). Обнаружено также, что антагонисты сигма-1 рецепторов (вещества BD1063 и BD1047) ингибируют депозависимый вход Са2+, индуцируемый гистамином в эндотелиальных клетках подкожной вены ноги человека (Amer et al., 2013), а BD1063 значительно подавляет депозависимый вход Са2+, вызываемый тапсигаргином, в клетках аденокарциномы молочной железы человека (линия MCF7) (Gasparre et al., 2017). Кроме того, известно, что ХП и ТФП ингибируют потенциалзависимые Са2+-каналы в клетках разных типов. Так, ХП обратимо и дозозависимо блокирует потенциалзависимые Са2+-каналы L- и T-типов в клетках нейробластомы мыши (линия N1E-115) (Ogata, Narahashi, 1990; Ogata et al., 1990), потенциалзависимые Са2+-каналы R-типа в нейронах человека (McNaughton et al., 2001) и Са2+-каналы L-типа в клетках феохромоцитомы крысы (линия PC12) (Ito et al., 1996), а ТФП блокирует потенциалзависимые Са2+-каналы L-типа в гладкомышечных клетках крысы (Nakazawa et al., 1993) и нейронах улитки Helix aspersa (Cruzblanca et al., 1998).
Результаты настоящей и более ранних работ (Крутецкая и др., 2017, 2018в) о подавлении лигандами рецепторов сигма-1 Са2+-ответов, вызываемых глутоксимом и моликсаном в макрофагах, свидетельствуют об участии рецепторов сигма-1 в комплексном сигнальном каскаде, запускаемом глутоксимом или моликсаном и приводящем к увеличению [Ca2+]i в перитонеальных макрофагах крыс. Результаты указывают также на нежелательность совместного применения в клинической практике препаратов глутоксима или моликсана и нейролептиков фенотиазинового ряда ХП и ТФП.
Полученные нами данные свидетельствуют также об участии рецепторов сигма-1 в регуляции депозависимого входа Са2+, индуцируемого дисульфидсодержащими иммуномодуляторами и ингибиторами эндоплазматических Са2+-АТФаз, в перитонеальных макрофагах крыс и позволяют рассматривать рецепторы сигма-1 в качестве нового регуляторного компонента сигнального комплекса депозависимого входа Са2+ в макрофагах. Рецепторы сигма-1 могут влиять на депозависимый вход Са2+, модулируя связывание между основными компонентами белкового комплекса депозависимого входа Са2+ – белками STIM1 в мембране эндоплазматического ретикулума и Orai1 в плазмалемме (Srivats et al., 2016).
Результаты могут также способствовать более детальному пониманию молекулярных механизмов фармакологического действия фенотиазиновых нейролептиков. Кроме того, полученные данные могут иметь значение для терапии заболеваний, опосредованных нарушением функционирования рецепторов сигма-1. Так, известно, что изменения субклеточной локализации, экспрессии и сигнальных функций рецепторов сигма-1 приводят к развитию широкого ряда заболеваний человека (Su et al., 2010, 2016; Rousseaux, Greene, 2016; Schmidt, Kruse, 2019; Aishwarya et al., 2021). Выявлено участие этих рецепторов в патофизиологии нейропсихиатрических (шизофрении, тревожных расстройств, депрессивных состояний и деменции) (Hayashi, Su, 2004; Tsai et al., 2009, 2014; Ishikawa, Hashimoto, 2010; Hayashi, 2015; Voronin et al., 2020), нейродегенеративных (болезней Альцгеймера, Хантингтона и Паркинсона, бокового амиотрофического склероза) (Ryskamp et al., 2017, 2019; Penke et al., 2018; Hayashi, 2019; Schmidt, Kruse, 2019; Yang et al., 2019; Herrando-Grabulosa et al., 2020; Zhemkov et al., 2021), онкологических (Kim, Maher, 2017; Soriani, Rapetti-Mauss, 2017; Pontisso, Combettes, 2021) и сердечнососудистых (Stracina, Novakova, 2018; Aishwarya et al., 2021) заболеваний, болевых синдромов (Merlos et al., 2017a, 2017b) и ретинопатий (Wang et al., 2017; Smith et al., 2018). Это позволило рассматривать рецепторы сигма-1 как перспективные фармакологические мишени для терапии этих заболеваний.
В последнее время изучается также возможная роль сигма-1 рецепторов в патофизиологии короновирусной инфекции (COVID-19). Появляются данные, что рецепторы сигма-1 могут быть перспективной терапевтической мишенью при лечении пациентов с COVID-19. Полагают, что рецепторы сигма-1 регулируют ключевые механизмы адаптивного стрессового ответа клеток-хозяев и принимают участие в ранних стадиях репликации вируса (Vela, 2020; Hashimoto, 2021).
Многие перепрофилированные лекарства, включенные в схемы комплексной терапии пациентов с COVID-19, часто идентифицируются как лиганды рецепторов сигма-1. К их числу относятся нейролептики галоперидол, ХП и ТФП (Plaze et al., 2020; Vela, 2020). Полагают, что наиболее перспективным препаратом является ХП (Muric et al., 2020; Nobile et al., 2020; Plaze et al., 2020; Stip, 2020; Stip et al., 2020). Имеются данные, что катионные амфифильные соединения, к которым относятся фенотиазиновые нейролептики, имеют противовирусную активность и подавляют вход и репликацию РНК вирусов (Otręba et al., 2020; Vela, 2020; Gitahy Falcao Faria et al., 2021). Так, показано, что ХП ингибирует репликацию SARS-CoV-2 в клетках обезьяны (линия VeroE6) и клетках эпителия альвеол человека (линия A549-ACE2) (Plaze et al., 2021). Кроме того, лиганды рецепторов сигма-1 галоперидол (Hoertel et al., 2021a) и ХП (Hoertel et al., 2021b) уже прошли клинические испытания в качестве препаратов для терапии пациентов с COVID-19.
Известно также, что вирусы выработали механизмы нарушения Ca2+-гомеостаза клеток хозяев и увеличивают [Ca2+]i, поскольку Ca2+ необходим для проникновения вируса в клетку, для репликации, созревания и освобождения вируса (Zhoua et al., 2009; Chen et al., 2019). В связи с этим, блокирование вызванного вирусом увеличения [Ca2+]i путем ингибирования каналов кальциевого выброса в мембране эндоплазматического ретикулума (рецепторов инозитол-1,4,5-трифосфата и рианодиновых рецепторов) или каналов входа Ca2+ в плазмалемме (потенциалзависимых и депозависимых Ca2+-каналов) является одним из подходов в терапии вирусных инфекций (Chen et al., 2019). Так, обнаружено, что блокаторы потенциалзависимых Са2+-каналов нифедипин и амлодипин снижают смертность и уменьшают риск необходимости искусственной вентиляции легких у пожилых пациентов с COVID-19 и гипертонией (Solaimanzadeh, 2020; Zhang et al., 2020).
Таким образом, полученные нами данные о подавлении лигандами рецепторов сигма-1 (ХП и ТФП) обеих фаз Са2+-ответов, индуцируемых дисульфидсодержащими иммуномодуляторами и ингибиторами эндоплазматических Са2+-АТФаз в перитонеальных макрофагах крыс, дополнительно подтверждают многогранность эффектов производных фенотиазина и свидетельствуют в пользу терапевтического потенциала фенотиазиновых нейролептиков, как лигандов рецепторов сигма-1.
Список литературы
Антушевич А.А., Антонов В.Г., Гребенюк А.Н., Антушевич А.Е., Ладанова Т.В., Бурова Е.Б. 2013. Патофизиологические основы эффективности глутоксима как средства сопровождения лучевой терапии рака ротоглотки. Вестник Рос. Военно-мед. акад. Т. 3. № 43. С. 32. (Antushevich A.A., Antonov V.G., Grebenyuk A.N., Antushevich A.E., Ladanova T.V., Burova E.B. 2013. Pathophysiologic rationale of effectiveness of glutoxim supportive therapy add-on to radiotherapy management of oropharyngeal cancer. Vestnik Rossiiskoi Voenno-medicinskoi akademii. V. 3. № 43. P. 32.)
Борисов А.Е, Кожемякин Л.А., Антушевич А.Е, Кетлицкая О.С., Кащенко В.А., Чепур С.В., Кацалуха В.В., Васюкова Е.Л., Новиченков А.О., Мотущук И.Е. 2001. Клинико-экспериментальное обоснование регионарного и системного введения препаратов группы тиопоэтинов при циррозе печени. Вестник хирургии им. И.И. Грекова. Т. 4. № 2. С. 32. (Borisov A.E., Kozhemyakin L.A., Antushevich A.E., Ketliskaya O.S., Kashchenko V.A., Chepur S.V., Katsalucha V.V., Vasyukova E.L., Novichenkov A.O., Motushchuk I.E. 2001. Clinical and experimental grounds of the regional and systemic administration of the thiopoetin group medicines for cirrhosis of the liver. First communication. Vestnic hirurgii im. I.I. Grekova. V. 4. № 2. P. 32.)
Крутецкая З.И., Миленина Л.С., Наумова А.А., Бутов С.Н., Антонов В.Г., Ноздрачев А.Д. 2017. Антагонист рецепторов сигма-1 галоперидол подавляет Са2+-ответы в макрофагах, вызываемые глутоксимом и моликсаном. Доклады Академии наук. Т. 472. № 6. С. 723. (Krutetskaya Z.I., Milenina L.S., Naumova A.A., Butov S.N., Antonov V.G., Nozdrachev A.D. 2017. Sigma-1 receptor anta-gonist haloperidol attenuates Ca2+ responses induced by glutoxim and molixan in macrophages. Doklady Biochem. Biophys. V. 472. № 1. P. 74.)
Крутецкая З.И., Миленина Л.С., Наумова А.А., Бутов С.Н., Антонов В.Г., Ноздрачев А.Д. 2018а. Трифлуоперазин подавляет в макрофагах депозависимый вход Са2+. Доклады Академии наук. Т. 478. № 6. С. 709. (Krutetskaya Z.I., Milenina L.S., Naumova A.A., Butov S.N., Anto-nov V.G., Nozdrachev A.D. 2018a. Trifluoperazine attenuates store-dependent Ca2+ entry in macrophages. Doklady Biochem. Biophys. V. 478. № 1. P. 44.)
Крутецкая З.И., Миленина Л.С., Наумова А.А., Бутов С.Н., Антонов В.Г., Ноздрачев А.Д. 2018б. Антагонист рецепторов сигма-1 галоперидол подавляет депозависимый вход Са2+ в макрофагах. Доклады Академии наук. Т. 480. № 5. С. 613. (Krutetskaya Z.I., Milenina L.S., Naumova A.A., Butov S.N., Antonov V.G., Nozdrachev A.D. 2018b. Sigma-1 receptor antagonist haloperidol attenuates store-dependent Ca2+ entry in macrophages. Doklady Biochem. Biophys. V. 480. № 1. P. 162.)
Крутецкая З.И., Миленина Л.С., Наумова А.А., Бутов С.Н., Антонов В.Г., Ноздрачев А.Д. 2018в. Амитриптилин подавляет Са2+-ответы в макрофагах, вызываемые глутоксимом и моликсаном. Доклады Академии наук. Т. 481. № 5. С. 570. (Krutetskaya Z.I., Milenina L.S., Naumova A.A., Butov S.N., Antonov V.G., Nozdrachev A.D. 2018c. Amitriptyline attenuates Ca2+ responses induced by glutoxim and molixan in macrophages. Doklady Bioche-mistry and Biophysics. V. 481. № 1. P. 222.)
Соколова Г.Б., Синицын М.В., Кожемякин Л.А., Перельман М.И. 2002. Глутоксим в комплексной терапии туберкулеза. Антибиотики и химиотерапия. Т. 47. № 2. С. 20. (Sokolova G.B., Sinitsyn M.V., Kozhemiakin L.A., Perel’man M.I. 2002. Glutoxim in the complex treatment of tuberculosis. Antibiot. Khimioter. V. 47. № 2. P. 20.)
Толстой О.А., Цыган В.Н., Климов А.Г., Степанов А.В., Антушевич А.Е. 2019. Экспериментальная оценка эффективности препарата моликсан по восстановлению работоспособности вирусинфицированных лабораторных животных. Известия Рос. военно-мед. акад. Т. 38. № 1. С. 271. (Tolstoy O.A., Tsygan V.N., Klimov A.G., Stepanov A.V., Antushevich A.E. 2019. Experimental evaluation of the efficiency of the drug molixan on restoring the operation of virus-infected laboratory animals. Bull. Russ. Military Med. Acad. V. 38. № 1. P. 271.)
Aishwarya R., Abdullah C.S., Morshed M., Remex N.S., Bhuiyan M.S. 2021. Sigmar1’s molecular, cellular, and biological functions in regulating cellular pathophysiology. Front. Physiol. V. 12. P. 705575. https://doi.org/10.3389/fphys.2021.705575
Alexander S.P.H., Benson H.E., Faccenda E., Pawson A.J., Sharman J.L., McGrath J.C., Catterall W.A., Spedding M., Peters J.A., Harmar A.J. 2013. The concise guide to pharmacology 2013/14: overview. Br. J. Pharmacol. V. 170. P. 1449 https://doi.org/10.1111/bph.12444
Alon A., Schmidt H., Zheng S., Kruse A.C. 2017. Structural perspectives on sigma-1 receptor function. Adv. Exp. Med. B-iol. V. 964. P. 5.
Amer M.S., McKeown L., Tumova S., Liu R., AL Seymour V., Wilson L.A., Naylor J., Greenhalgh K., Hou B., Majeed Y., Turner P., Sedo A., O’Regan D. J., Li J., Bon R. S., Porter K.E., Beech D.J. 2013. Inhibition of endothelial cell Ca2+ entry and transient receptor potential channels by sigma-1 receptor ligands. Br. J. Pharmacol. V. 168. P. 1445.
Ayano G. 2016. First generation antipsychotics: pharmacokinetics, pharmacodynamics, therapeutic effects and side effects: A review. Res. Rev. J. Chem. V. 5. P. 53.
Berlansky S., Humer C., Sallinger M., Frischauf I. 2021. More than just simple interaction between STIM and Orai proteins: CRAC channel function enabled by a network of interactions with regulatory proteins. Int. J. Mol. Sci. V. 22. P. 471. https://doi.org/10.3390/ijms22010471
Berridge M.J., Bootman M.D., Lipp P. 1998. Calcium, a life and death signal. Nature. V. 395. P. 645.
Berridge M.J., Bootman M.D., Roderick H.L. 2003. Calcium signalling: dynamics, homeostasis and remodeling. Nat. Rev. Mol. Cell Biol. V. 4. P. 517.
Berridge M.J., Lipp P., Bootman M.D. 2000. The versatility and universality of calcium signalling. Nat. Rev. Mol. Cell Biol. V. 1. P. 11.
Brailoiu G.C., Deliu E., Console-Bram L.M., Soboloff J., Abood M.E., Unterwald E.M., Brailoiu E. 2016. Cocaine inhibits store-operated Ca2+ entry in brain microvascular endothelial cells: Critical role for sigma-1 receptors. Biochem. J. V. 473. P. 1.
Bruce J.I.E., Elliott A.C. 2000. Pharmacological evaluation of the role of cytochrome P450 in intracellular calcium signaling in rat pancreatic acinar cells. Brit. J. Physiol. V. 131. P. 761.
Carafoli E., Krebs J. 2016. Why calcium? How calcium became the best communicator. J. Biol. Chem. V. 291. P. 20849.
Chen X., Cao R., Zhong W. 2019. Host calcium channels and pumps in viral infections. Cells. V. 9. 94. https://doi.org/10.3390/cells9010094
Choi S.-Y., Kim Y.-H., Lee Y.-K., Kim K.-T. 2001. Chlorpromazine inhibits store-operated calcium entry and subsequent noradrenaline secretion in PC12 cells. British J. Pharmacol. V. 132. P. 411.
Chu U.B., Ruoho A.E. 2016. Biochemical pharmacology of the sigma-1 receptor. Mol. Pharmacol. V. 89. P. 142.
Cobos E.J., Entrena J.M., Nieto F.R., Cendán C.M., Del Pozo E. 2008. Pharmacology and therapeutic potential of sigma (1) receptor ligands. Curr. Neuropharmacol. V. 6. P. 344.
Conrad R.E. 1981. Induction and collection of peritoneal exudate macrophages. In: Manual of macrophages methodo-logy. N.Y.: Marcell Dekker. P. 5.
Cruzblanca H., Gamiño S.M., Bernal J., Alvarez–Leefmans F.J. 1998. Trifluoperazine enhancement of Ca2+-dependent inactivation of L-type Ca2+ currents in Helix aspersa neurons. Invert. Neurosci. V. 3. P. 269.
Delprat B., Crouzier L., Su T-P., Maurice T. 2020. At the crossing of ER stress and MAMs: A key role of sigma-1 receptor? Adv. Exp. Med. Biol. V. 1131. P. 699.
Dilsaver S.C. 1993. Antipsychotic agents: A review. Amer. Fam. Phys. V. 47. P. 199.
Gitahy Falcao Faria C., Weiner L., Petrignet J., Hingray C., Ruiz De Pellon Santamaria A., Villoutreix B.O., Beaune P., Leboyer M., Javelot H. 2021. Antihistamine and cationic amphiphilic drugs, old molecules as new tools against the COVID-19? Med. Hypotheses. V. 148: 110508. https://doi.org/10.1016/j.mehy.2021.110508
Gasparre G., Abate C., Carlucci R., Berardi F., Cassano G. 2017. The σ1 receptor agonist (+)-pentazocine increases store-operated Ca2+ entry in MCF7σ1 and SK-N-SH cell lines. Pharmacol. Rep. V. 69. P. 542.
Goeger D.E., Riley R.T., Dorner J.W., Cole R.J. 1988. Cyclopiazonic acid inhibition of the Ca2+ transport ATPase in rat skeletal muscle sarcoplasmic reticulum vesicles. Biochem. Pharmacol. V. 37. P. 978.
Grynkiewicz G., Poenie M., Tsien R.Y. 1985. A new generation of Ca2+ indicators with greatly improved fluorescence pro-perties. J. Biol. Chem. V. 260. P. 3440.
Hanner M., Moebius F.F., Flandorfer A., Knaus H.G., Striessnig J., Kempner E., Glossman H. 1996. Purification, molecular cloning, and expression of the mammalian sigma1-binding site. Proc. Natl. Acad. Sci. USA. V. 93. P. 8072. https://doi.org/10.1073/pnas.93.15.8072
Harper J.L., Daly J.W. 1999. Inhibitors of store-operated calcium channels: Imidazoles, phenothiazines, and other tricyclics. Drug Dev. Res. V. 47. P. 107.
Harper J.L., Shin Y., Daly J.W. 1997. Loperamide: A positive modulator for store-operated calcium channels? Proc. Natl. Acad. Sci. USA. V. 94. P. 14912.
Hashimoto K. 2021. Repurposing of CNS drugs to treat COVID-19 infection: Targeting the sigma-1 receptor. Eur. Arch. Psychiatry Clin. Neurosci. V. 271. P. 249. https://doi.org/10.1007/s00406-020-01231-x
Hayashi T. 2015. Sigma-1 receptor: the novel intracellular target of neuropsychotherapeutic drugs. J. Pharmacol. Sci. V. 127. P. 2.
Hayashi T. 2019. The sigma-1 receptor in cellular stress signaling. Front. Neurosci. V. 13: 733. https://doi.org/10.3389/fnins.2019.00733
Hayashi T., Maurice T., Su T.-P. 2000. Ca2+ signalling via σ1-receptors: novel regulatory mechanism affecting intracellular Ca2+ concentration. J. Pharmacol. Exper. Ther. V. 293. P. 788.
Hayashi T., Su T.-P. 2004. Sigma-1 receptor ligands: potential in the treatment of neuropsychiatric disorders. CNS Drugs. V. 18. P. 269.
Hayashi T., Su T.-P. 2007. Sigma-1 receptor chaperones at the ER-mitochondrion interface regulate Ca(2+) signaling and cell survival. Cell. V. 131. P. 596.
Herrando-Grabulosa M., Gaja-Capdevila N., Vela J.M., Navarro X. 2020. Sigma 1 receptor as a therapeutic target for amyotrophic lateral sclerosis. Br. J. Pharmacol. V. 178. P. 1336.
Hoertel N., Sanchez-Rico M., Vernet R., Jannot A.-S., Neuraz A., Blanco C., Lemogne C., Airagnes G., Paris N., Daniel Ch., Gramfort A., Lemaitre G., Bernaux M., Bellamine A., Beeker N., Limosin F. 2021a. Observational study of haloperidol in hospitalized patients with COVID-19. PLoS One. V. 16. P. e0247122. https://doi.org/10.1371/journal.pone.0247122
Hoertel N., Sanchez-Rico M.,·Vernet R., Jannot A-S., Neuraz A., Blanco C., Lemogne C., Airagnes G., Paris N., Daniel Ch., Gramfort A., Lemaitre G., Bernaux M., Bellamine A., Beeker N. 2021b. Observational study of chlorpromazine in hospita-lized patients with COVID-19. Clin. Drug Investigation. V. 41. P. 221. https://doi.org/10.1007/s40261-021-01001-0
Ishikawa M., Hashimoto K. 2010. The role of sigma-1 receptors in the pathophysiology of neuropsychiatric diseases. J. Receptor, Ligand Channel Res. V. 3. P. 25.
Ito K., Nakazawa K., Koizumi S., Liu M., Takeuchi K., Hashimoto T., Ohno Y., Inoue K. 1996. Inhibition by antipsychotic drugs of L-type Ca2+ channel current in PC12 cells. Eur. J. Pharmacol. V. 314. P. 143.
Itzhak Y., Ruhland M., Krahling H. 1990. Binding of umespirone to the sigma receptor: evidence for multiple affinity states. Neuropharmacol. V. 29. P. 181.
Kekuda R., Prasad P.D., Fei Y.J., Leibach F.H., Ganapathy V. 1996. Cloning and functional expression of the human type 1 sigma receptor (hSigmaR1). Biochem. Biophys. Res. Commun. V. 229. P. 553. https://doi.org/10.1006/bbrc.1996.1842
Kim F.J., Maher C.M. 2017. Sigma1 pharmacology in the context of cancer. Handb. Exp. Pharmacol. V. 244. P. 237.
Kruse A. 2017. Structural insights into sigma1 function. Handb. Exp. Pharm. V. 244. P. 13.
Maurice T., Su T.-P. 2009. The pharmacology of sigma-1 receptors. Pharmacol. Ther. V. 124. P. 195.
McNaughton N.C.L., Green P.J., Randall A.D. 2001. Inhibition of human α1E subunit-mediated Ca2+ channels by the antipsychotic agent chlorpromazine. Acta Physiol. Scand. V. 173. P. 401. https://pubmed.ncbi.nlm.nih.gov/28315267
Merlos M., Burgueño J., Portillo-Salido E., Plata–Salamán C.R., Vela J.M. 2017a. Pharmacological modulation of the sigma 1 receptor and the treatment of pain. Adv. Exp. Med. Biol. V. 964. P. 85. https://doi.org/10.1007/978-3-319-50174-1_8
Merlos M., Romero L., Zamanillo D., Plata-Salamán C., Vela J.M. 2017b. Sigma-1 receptor and pain. Handb. Exp. Pharmacol. V. 244. P. 131.
Monahan R.A., Dvorak H.F., Dvorak A.M. 1981. Ultrastructural localization of nonspecific esterase activity in guinea pig and human monocytes, macrophages and lymphocytes. Blood. V. 58. P. 1089.
Monnet F.P. 2005. Sigma-1 receptor as regulator of neuronal intracellular Ca2+: clinical and therapeutic relevance. Biol. Cell. V. 97. P. 878.
Muric N.N., Arsenijevic N.N., Milica M., Borovcanin M.M. 2020. Chlorpromazine as a potential antipsychotic choice in COVID-19 treatment. Front. Psychiatry. V. 11. P. 612 347. https://doi.org/10.3389/fpsyt.2020.612347
Nakazawa K., Higo K., Abe K., Tanaka Y., Saito H., Matsuki N. 1993. Blockade by calmodulin inhibitors of Ca2+ channels in smooth muscle from rat vas deferens. Br. J. Pharmacol. V. 109. P. 137.
Nobile B., Durand M., Courtet P., Van de Perre P., Nagot N., Molès J.P., Olié E. 2020. Could the antipsychotic chlorpromazine be a potential treatment for SARS-CoV-2? Schizophrenia Res. V. 223. P. 373.
Ogata N., Yoshii M., Narahashi T. 1990. Differential block of sodium and calcium channels by chlorpromazine in mouse neuroblastoma cells. J. Physiol. V. 420. P. 165.
Ogata N., Narahashi T. 1990. Potent blocking action of chlorpromazine on two types of calcium channels in cultured neuroblastoma cells. J. Pharmacol. Exp. Ther. V. 252. P. 1142.
Ossa F., Schnell J.R., Ortega–Roldan J.L. 2017. A review of the human sigma-1 receptor structure. Adv. Exp. Med. Biol. V. 964. P. 15.
Otręba M., Koґsmider L., Rzepecka–Stojko A. 2020. Antiviral activity of chlorpromazine, fluphenazine, perphenazine, prochlorperazine, and thioridazine towards RNA-viruses. A review. Europ. J. Pharmacol. V. 887. P. 173553. https://doi.org/10.1016/j.ejphar.2020.173553
Penke B., Fulop L., Szucs M., Frecska E. 2018. The role of sigma-1 receptor, and intracellular chaperone in neurodege-nerative diseases. Curr. Neuropharmacol. V. 16. P. 97.
Plaze M., Attali D., Petit A.-C., Blatzer M., Simon-Loriere E., Vinckier F., Cachia A., Chretien F., Gaillard R. 2020. Repurposing chlorpromazine to treat COVID-19: The reCoVery study. L’Encephale. V. 46. P. 169.
Plaze M., Attali D., Prot M., Petit A.-C., Blatzer M., Vinckier F., Levillayer L., Chiaravalli J., Perin-Dureau F., Cachia A., Friedlander G., Chretien F., Simon-Loriere E., Gaillard R. 2021. Inhibition of the replication of SARS-CoV-2 in human cells by the FDA-approved drug chlorpromazine. Int. J. Antimicrobial Agents. V. 57. P. 106274. https://doi.org/10.1016/j.ijantimicag.2020.106274
Pontisso I., Combettes L. 2021. Role of sigma-1 receptor in calcium modulation: possible involvement in cancer. Genes. V. 12. P. 139. https://doi.org/10.3390/genes12020139
Randriamampita C., Trautmann A. 1987. Ionic channels in murine macrophages. Cell. Biol. V. 105. P. 761.
Rosado J.A. 2016. Sigma-1 receptors: a new pathway for the modulation of store-operated calcium entry. Biochem. J. V. 473. P. e9–e10. https://doi.org/10.1042/BJ20151144
Rousseaux C.G., Greene S.F. 2016. Sigma receptors [σRs]: Bio-logy in normal and diseased states. J. Recept. Signal Transduct. V. 36. P. 327.
Ryskamp D.A., Korban S., Zhemkov V., Kraskovskaya N., Bezprozvanny I. 2019. Neuronal sigma-1 receptors: signaling functions and protective roles in neurodegenerative disea-ses. Front. Neurosci. V. 13. P. 862. https://doi.org/10.3389/fnins.2019.00862
Ryskamp D., Wu J., Geva M., Kusko R., Grossman I., Hayden M., Bezprozvanny I. 2017. The sigma 1 receptor mediates the beneficial effects of pridopidine in a mouse model of Huntington disease. Neurobiol. Dis. V. 97. P. 46.
Schmidt H.R., Betz R.M., Dror R.O., Kruse A.C. 2018. Structu-ral basis for σ1 receptor ligand recognition. Nat. Struct. Mol. Biol. V. 25. P. 981.
Schmidt H.R., Kruse A.C. 2019. The molecular function of σ receptors: past, present, and future. Trends Pharmacol. Sci. V. 40. P. 636.
Schmidt H.R., Zheng S., Gurpinar E., Koehl A., Manglik A., Kruse A.C. 2016. Crystal structure of the human σ1 receptor. Nature. V. 532. P. 527.
Schuster D.I., Arnold F.J., Murphy R.B. 1995. Purification, pharmacological characterization and photoaffinity labeling of sigma receptors from rat and bovine brain. Brain Res. V. 670. P. 14.
Smith S.B., Wang J., Cui X., Mysona B.A., Zhao J., Bollinger K.E. 2018. Sigma 1 receptor: a novel therapeutic target in retinal disease. Prog. Retin Eye Res. V. 67. P. 130. https://doi.org/10.1016/j.preteyeres.2018.07.003
Solaimanzadeh I. 2020. Nifedipine and amlodipine are associated with improved mortality and decreased risk for intubation and mechanical ventilation in elderly patients hospitalized for COVID-19. Cureus. V. 12. P. e8069. https://doi.org/10.7759/cureus.8069
Soriani O., Rapetti-Mauss R. 2017. Sigma 1 receptor and ion channel dynamics in cancer. Adv. Exp. Med. Biol. V. 964. P. 63. https://doi.org/10.1007/978-3-319-50174-1
Srivats S., Balasuriya D., Pasche M., Vistal G., Edwardson J.M., Taylor C.W., Murrell–Lagnado R.D. 2016. Sigma 1 receptors inhibit store-operated Ca2+ entry by attenuating coupling of STIM1 to Orai1. J. Cell Biol. V. 213. P. 65.
Stip E. 2020. Psychiatry and COVID-19: The role of chlorpromazine. Can. J. Psychiatry. V. 65. P. 739.
Stip E., Rizvi T.A., Mustafa F., Javaid S., Aburuz S., Ahmed N.N., Abdel Aziz K., Arnone D., Subbarayan A., Al Mugaddam F., Khan G. 2020. The large action of chlorpromazine: translational and transdisciplinary considerations in the face of COVID-19. Front. Pharmacol. V. 11. P. 577678. https://doi.org/10.3389/fphar.2020.577678
Stracina T., Novakova M. 2018. Cardiac sigma receptors – an update. Physiol. Res. V. 67. P. S561.
Su T.-P., Hayashi T., Maurice T., Buch S., Ruoho A.E. 2010. The sigma-1 receptor chaperone as an inter-organelle signaling modulator. Trends Pharmacol. Sci. V. 31. P. 557.
Su T.-P., Su T.-C., Nakamura Y., Tsai S.-Y. 2016. The sigma-1 receptor as a pluripotent modulator in living systems. Trends Pharmacol. Sci. V. 37. P. 262.
Tam S.W., Cook L. 1984. Sigma opiates and certain antipsychotic drugs mutually inhibit (+)-[3H]SKF 10,047 and [3H]haloperidol binding in guinea pig brain membranes. Proc. Natl. Acad. Sci. USA. V. 81. P. 5618.
Thastrup O., Dawson A.P., Scharff O., Foder B., Cullen P.J., Drobak B.K., Bjerrum P.J., Christensen S.B., Hanley M.R. 1989. Thapsigargin, a novel molecular probe for studying intracellular calcium release and storage. Agents Actions. V. 27. P. 17.
Trebak M., Kinet J.-P. 2019. Calcium signalling in T cells. Nat. Rev. Immunol. V. 19. P. 154.
Tsai S.-Y., Hayashi T., Mori T., Su T.-P. 2009. Sigma-1 receptor chaperones and diseases. Cent. Nerv. Syst. Agents Med. Chem. V. 9. P. 184.
Tsai S.-Y., Pokrass M.J., Klauer N.R., De Credico N.E., Su T.-P. 2014. Sigma-1 receptor chaperones in neurodegenerative and psychiatric disorders. Expert Opin. Ther. Targets. V. 18. P. 1461. https://doi.org/10.1517/14728222.2014.972939
Vavers E., Zvejniece L., Maurice T., Dambrova M. 2019. Allosteric modulators of sigma-1 receptor: a review. Front. Pharmacol. V. 10. P. 223. https://doi.org/10.3389/fphar.2019.00223
Vela J.M. 2020. Repurposing sigma-1 receptor ligands for COVID-19 therapy? Front. Pharmacol. V. 11. P. 582310. https://doi.org/10.3389/fphar.2020.582310
Vig M., Kinet J.-P. 2009. Calcium signaling in immune cells. Nat. Immunol. V. 10. P. 21.
Voronin M.V., Vakhitova Y.V., Seredenin S.B. 2020. Chaperone Sigma1R and antidepressant effect. Int. J. Mol. Sci. V. 21. P. 7088. https://doi.org/10.3390/ijms21197088
Wang L., Zhang L., Li S., Zheng Y., Yan X., Chen M., Wang H., Putney J.W., Luo D. 2015. Retrograde regulation of STIM1-Orai1 interaction and store-operated Ca2+ entry by calsequestrin. Sci. Rep. V. 5. P. 1.
Wang J., Cui X., Roon P., Saul A., Smith S.B. 2017. The role of Sigma1R in mammalian retina. Adv. Exp. Med. Biol. V. 964. P. 267.
Wu Z., Bowen W.D. 2008. Role of sigma-1 receptor c-terminal segment in inositol 1,4,5-trisphosphate receptor activation. Constitutive enhancement of calcium signaling in mcf-7 tumor cells. J. Biol. Chem. V. 283. P. 28198.
Xie Q., Zhang Y., Zhai C., Bonanno J.A. 2002. Calcium influx factor from cytochrome P-450 metabolism and secretion-like coupling mechanisms for capacitative calcium entry in corneal endothelial cells. J. Biol. Chem. V. 277. P. 16559.
Yang K., Wang C., Sun T. 2019. The roles of intracellular cha-perone proteins, sigma receptors, in Parkinson’s disease (PD) and major depressive disorder (MDD). Front. Pharmacol. V. 10. P. 528. https://doi.org/10.3389/fphar.2019.00528
Zhang L.-K., Sun Y., Zeng H., Wang Q., Jiang X., Shang W.-J., Wu Y., Li Sh., Zhang Y.-L., Hao Z.-N., Chen H., Jin R., Liu W., Li H., Peng K., Xiao G. 2020. Calcium channel blocker amlodipine besylate therapy is associated with reduced case fatality rate of COVID-19 patients with hypertension. Cell Discovery. V. 6. P. 96. https://doi.org/10.1038/s41421-020-00235-0
Zhemkov V., Geva M., Hayden M.R., Bezprozvanny I. 2021. Sigma-1 receptor (S1R) interaction with cholesterol: mechanisms of S1R activation and its role in neurodegenerative diseases. Int. J. Mol. Sci. V. 22. P. 4082. https://doi.org/10.3390/ijms22084082ps
Zhoua Y., Freyb T.K., Yanga J.J. 2009. Viral calciomics: interplays between Ca2+ and virus. Cell Calcium. V. 46. P. 1.
Дополнительные материалы отсутствуют.


