Цитология, 2022, T. 64, № 4, стр. 335-343
Коллагеновые фибриллы различного диаметра: условия формирования и основные принципы функционирования
М. Ю. Сироткина 1, Ю. А. Нащекина 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: nashchekina.yu@mail.ru
Поступила в редакцию 14.03.2022
После доработки 22.04.2022
Принята к публикации 26.04.2022
- EDN: EYZURT
- DOI: 10.31857/S0041377122040113
Аннотация
В организме коллаген является одним из основных белков внеклеточного матрикса и находится в различных тканях преимущественно в фибриллярной форме. Диаметр фибрилл коллагена с одной стороны зависит от различных химических и физических факторов, а с другой – определяет свойства тканей, в состав которых входят сами фибриллы. В работе подробно изучено влияние коллагенов различных типов, протеогликанов и неорганических веществ на диаметр фибрилл на основе коллагена I типа. Исследование факторов, влияющих на процессы фибриллообразования in vitro и in vivo, не только позволит решить фундаментальные задачи по изучению механизмов фибриллообразования, но и выявить причины нарушения формирования фибрилл, приводящие к возникновению различных заболеваний. Возможность управления процессом формирования фибрилл с заданным диаметром in vitro позволит создать тканеинженерные конструкции, имитирующие нативные ткани, вне организма.
Коллаген – один из наиболее распространенных белков во внеклеточном матриксе. Благодаря высокой биосовместимости и слабой антигенности, коллаген широко используется в качестве материала при создании тканеинженерных конструкций на основе матриц и клеток для использования в регенеративной медицине (Pawelec et al., 2016).
Среди основных качеств тканеинженерных конструкций можно выделить следующие: биосовместимость, механические характеристики, прозрачность, скорость ремоделирования. Правильно подобранная для конкретного органа совокупность свойств тканеинженерной конструкции позволяет обеспечить комфортные условия для жизнедеятельности трансплантируемых и собственных клеток организма, что позволяет достигать наилучшего терапевтического эффекта (Yamada et al., 2014).
В организме насчитывается до 30 видов различных типов коллагена, но самым распространенным из них является коллаген I типа. В тканях коллаген I типа находится в фибриллярной форме, поэтому для имитации нативной структуры ткани матрицы для культивирования клеток в основном разрабатывают из фибриллярного коллагена (Busra, Lokanathan, 2019). Основными параметрами фибрилл, влияющими на свойства матриц, являются их диаметр, а также наличие особого порядка внутрифибриллярной структуры.
Так, в многочисленных исследованиях была замечена корреляция между диаметром коллагеновых фибрилл, типом тканей, в которых они расположены, и их свойствами (Hosoyamada, Sakai, 2012; Kadler, 2017). Поэтому важнейшим условием для успешного создания in vitro тканеинженерной конструкции на основе фибриллярного коллагена для восстановления конкретного органа является необходимость учета диаметра фибрилл, характерного для тканей этого органа.
В связи с вышеизложенным цель настоящего обзора заключается в анализе различных факторов, влияющих на диаметр коллагеновых фибрилл в процессе их молекулярной сборки, а также взаимосвязи структуры фибрилл с их свойствами.
КОЛЛАГЕНОВЫЕ ФИБРИЛЛЫ И ИХ СБОРКА
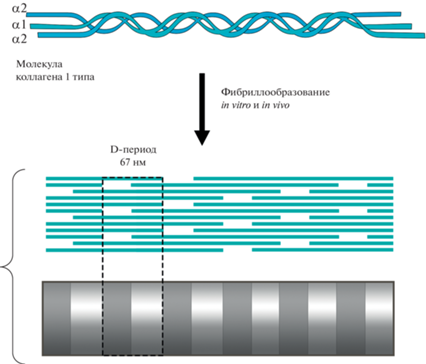
Коллаген I типа представляет собой спиральную молекулу длинной 300 нм и шириной 1.5 нм, состоящую из одной цепи α1 и двух цепей α2. На концах она имеет два неспиральных участка, которые называют теломерами. Изначально во внеклеточное пространство фибробластами синтезируется белок проколлаген, на концах которого имеются теломеры и N- и С-участки (рис. 1). Далее, под действием, протеиназ N- и С-концевые участки отщепляются и полученные коллагеновые молекулы собираются в фибриллы (Hulmes, 2009).
Сформированная фибрилла коллагена геометрически представляет собой цилиндр, диаметр которого не изменяется на всем ее протяжении (Parry, Craig, 2017). Фибрилла состоит из множества молекул коллагена, связанных за счет электростатических и гидрофобных взаимодействий, формируя исчерченную структуру, молекулы в которой располагаются со сдвигом равным 67 нм и называемым D-периодом (рис. 1) (Wess, 2009). В настоящее время существуют две гипотезы, описывающие строение фибрилл. Одна из них утверждает, что фибриллы коллагена состоят из микрофибрилл, которые располагаются друг относительно друга в виде тетрагональной решетки. Рост фибрилл в толщину осуществляется с шагом 8.5 нм (Hulmes, 2002). Другая гипотеза представляет укладку молекул коллагена в виде псевдогексагональной упаковки. Обе гипотезы имеют экспериментальное подтверждение. Их объединяет предположение, что фибрилла имеет центр с диаметром 3.2 нм и растет в соответствии с псевдогексагональной упаковкой и с шагом 3.6 нм (Parry, Craig, 2017).
Другими двумя конкурирующими гипотезами объясняется принцип формирования фибрилл in vi-vo. Одна из гипотез подразумевает рост фибрилл путем нуклеации и последующего слияния друг с другом либо латерально, либо конец к концу (Canty et al., 2005; Fang et al., 2012). Другая гипотеза формирования фибрилл описывает сборку фибрилл подобно жидким кристаллам холистического типа, которые собираются самопроизвольно. Прямого доказательства этого подхода пока не получено, но существуют косвенные признаки, доказывающие это. Например, коллаген и проколлаген при высоких концентрациях способны образовывать жидкокристаллические агрегаты в ограниченном пространстве. Коллаген, находящийся внутри клеточных везикул и высвобожденный из клетки, находится в очень высоких концентрациях (Giraud-Guille et al., 2008; Fang, 2012).
В пределах одной ткани диаметр коллагеновых фибрилл достаточно широко варьирует в зависимости от ткани и возраста организма. Так, например, эмбриональные или незрелые ткани обычно содержат разнообразные фибриллы с малым диаметром, собирающиеся в пучки. Как правило, по мере созревания средний диаметр фибрилл заметно увеличивается. А в процессе старения диаметр фибрилл снова уменьшается (Parry, Craig, 2017). В ткани фибриллы могут собираться в группы с примерно одинаковым диаметром, так называемые популяции. Популяции фибрилл коллагена обнаружены в таких тканях как связки, артерии, дерма и нервная ткань (Junqueira, 1983).
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ДИАМЕТР КОЛЛАГЕНОВЫХ ФИБРИЛЛ IN VIVO И IN VITRO
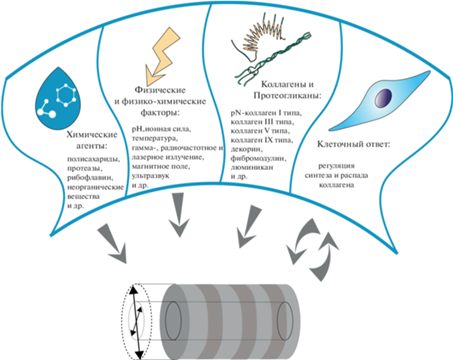
На параметры фибрилл как in vitro, так и in vivo оказывают влияние факторы как химического, так и физического характера (рис. 2). Сборка фибрилл in vitro протекает самопроизвольно при определенных условиях и зависит от концентрации коллагена в растворе, pH, ионной силы раствора и температуры (Raub, 2007). Немаловажными факторами, влияющим на процесс фибриллобразования in vivo, а также на диаметр формирующихся фибрилл, являются другие компоненты внеклеточного матрикса, такие как коллаген III типа в эмбриональных тканях, коллаген V типа в роговице, коллаген IX типа в тканях хряща, а также протеогликаны.
БЕЛКИ ВКМ КАК РЕГУЛЯТОРЫ СБОРКИ КОЛЛАГЕНОВЫХ ФИБРИЛЛ
Коллаген III типа. Коллаген III типа составляет около 10% всех коллагенов и находится на втором месте по содержанию в организме после коллагена I. Он представляет собой гомотример и состоит из трех цепей α1 (Hulmes, 2009). Коллаген III типа часто образует гетерофибриллы с колллагеном I типа и в основном располагается на поверхности фибриллы. В процессе биосинтеза коллагена III типа его обработка N-концевой протеиназой проходит медленнее, чем коллагена I типа и поэтому в ткани происходит накопление молекул с неотщепленным N-концевым участком (pN-коллаген III типа). Такие концевые участки pN-коллагена III типа, включенные в периферию фибриллы, ограничивают их дальнейший латеральный рост (Hulmes, 2002). В ткани в присутствии коллагена III типа диаметр фибрилл коллагена I типа не превышает 60 нм, в то время в отсутствие коллагена III типа диаметр фибрилл коллагена I типа может достигать 500 нм (Fleischmajer, 1990). В дерме диаметр коллагеновых фибрилл больше в более глубоких слоях, что связывают с меньшим количеством коллагена III типа (Junqueira, 1983).
Соотношение типов коллагена I и III зависит от многих условий, в том числе от типа ткани, пола и возраста. С возрастом это соотношение (I : III) становится выше (Wang, 2011). Кроме того, это соотношение различно в нормальной и рубцовой тканях (Wang, 2011). Так, в коже и тканях сердца в гетерофибриллах I/III соотношение коллагенов составляет 2 : 1 и 3 : 1 соответственно, в то время как в рубцовых тканях оно заметно выше – 5 : 1 (Li et al., 2021). Нарушение этого соотношения ведет к ухудшению механических свойств ткани. Известно, что у людей дилатационная кардиомиопатия связана с увеличением соотношения коллагена I и III типа в эндомизии и перимизии сердца (Marijianowski et al., 1995). А мутации в гене коллагена III типа ведут к возникновению синдрома Элерса–Данлоса IV типа, который несет опасность разрыва кровеносных сосудов во взрослом возрастe (Liu et al., 1997). Также у пациентов с послеоперационными грыжами в коже наблюдалось нарушение соотношения коллагенов I/III. Так у пациентов с послеоперационными и рецидивирующими грыжами соотношение коллагенов составляло 1 : 0.8, в то время как для здоровой ткани соотношение было 1.2 : 0.2 (Klinge et al., 2000).
Для тканей кожи пожилых людей характерно снижение синтеза коллагена I и III типа, что связано как со старением фибробластов, так и с их недостаточной механической стимуляцией со стороны ВКМ (Varani et al., 2006). Известно, что при заживлении раны фибриллы коллагена III типа появляются в ране на 2-е сут после повреждения, тогда как коллаген I типа – после 4-х сут (Tracy et al., 2016). Кроме того, показано, что коллаген III типа повышает гибкость и растяжимость тканей, а соотношение коллагенов I/III влияет на эластичность и скорость заживления кожи (Li et al., 2021).
Коллаген V типа. В отличие от I и III типа, у коллагена V типа перманентно сохраняется N-концевой неспиральный участок (Hulmes, 2009). Коллаген V типа относится к фибриллярным коллагенам. Это гетеротример, имеющий несколько изоформ. Несмотря на то, что молекула коллагена V типа возможна в виде различных комбинаций трех α-цепей, наиболее распространенная представляет из себя гетеротример, включающий одну цепь α1 и две α2. Коллаген V присутствует практически во всех не хрящевых тканях. В большинстве тканей его содержание составляет менее 5%, но в роговице его концентрация составляет около 20% (Hulmes, 2002).
Коллаген V типа также образует гетерофибриллы с коллагеном I типа. Тройная спираль коллагена V погружена внутрь фибриллы, а концевой участок выступает на поверхности. Такое строение гетерофибриллы в роговице позволяет сохранить равномерный диаметр фибрилл размером не более 23 нм. Следует отметить, что толщина фибрилл в роговице тесно связана с еe прозрачностью (Müller et al., 2004). Эксперименты на гетерозиготных мутантных мышах с делецией в гене Col5a1 показали серьезные нарушения фибриллогенеза в роговице. В строме роговицы увеличилось количество крупных, не равномерных по диаметру фибрилл. Но коллаген V типа не единственный фактор, влияющий на фибриллогенез. Протеогликаны также играют ключевую роль в регуляции диаметра фибрилл в роговице (Sun et al., 2011).
У людей гетерозиготная мутация в одном из генов, кодирующих коллаген V типа, ведет к классической форме синдрома Элерса−Данлоса I/II типа. Это генерализованное заболевание соединительной ткани с широким поражением тканей, характеризуется хрупкой растяжимой кожей, атрофическими рубцами, дряблостью суставов, высокой распространенностью дилатации корня аорты и другими расстройствами соединительной ткани (Steinmann, 2002).
Для гомозиготных нулевых мышей с делецией Col5a1 характерна эмбриональная летальность из-за невозможности своевременного образования фибрилл в процессе эмбриогенеза. Авторами было выдвинуто предположение, что коллаген V типа играет ключевую роль в фибриллообразовании и запускает нуклеацию фибрилл коллагена I типа, когда концентрация коллагена I типа мала (Sun et al., 2011).
Коллаген IX типа. Еще одним коллагеном, сохраняющим N-концевой участок в процессе био-синтеза, является коллаген IX типа, который также ограничивает латеральный рост фибрилл на основе коллагена II типа, например, в хрящевой ткани. Ткань гиалинового хряща выполняет амортизирующую функцию, а также является основой для будущей костной ткани. Она представляет собой гель, содержание воды в котором достигает 70–80%. Фибриллы механически сохраняют форму и препятствуют набуханию ткани. Фибриллы гиалинового хряща состоят из коллагена II типа с включением коллагенов IX и XI типов. Подобно коллагену I типа они содержат фибриллы с D-периодичностью размером 67 нм (рис. 1), однако имеют большее расстояние между молекулами и большее содержание воды (на 50–100%), чем в фибриллах коллагена I типа. Большое количество воды может быть связано с разницей в количестве гликозилированных остатков гидроксилизина в молекуле коллагена. Также поглощение воды и осмотическое давление обусловлено высоким отрицательным зарядом ткани, который, в свою очередь, связан с наличием декоринов. Присутствие коллагена IX типа обеспечивает отрицательный заряд поверхности фибрилл.
Коллаген IX типа – гетеротример, состоящий из трех разных цепей. Коллаген IX играет важную роль в ограничении латерального роста и сохранении однородности фибрилл коллагена II типа. Так, например, показано, что коллаген IX типа ограничивает диаметр фибрилл до 20 нм, который характерен для фибрилл эмбрионального или незрелого хряща. Нарушение соотношения коллагенов II и IX в ткани ведет к возникновению аномальных фибрилл. На мутантных мышах показано, что избыточная экспрессия коллагена II ведет к утолщению фибрилл, а нарушение синтеза коллагена IX ведет к аномальным фибриллам с нерегулярным диаметром. Подобные симптомы у людей наблюдаются при заболеваниях Стиклера с тяжелой формой хондродисплазии (Blaschke et al., 2000).
Коллаген IX также участвует в формировании нехрящевых тканей. Он экспрессируется во время развития организма в тканях, содержащих коллаген I, включая сухожилия (Sun et al., 2020).
Протеогликаны. Протеогликаны – это подкласс сложных белков, имеющих два семейства. Малые, богатые лейцином, протеогликаны способны связываться с коллагеном и участвуют в регуляции фибриллогенеза (Iozzo et al., 2015). Для таких протеогликанов как декорин, аспорин, фибромодулин и люмикан обнаружены участки взаимодействия с коллагеном. По некоторым данным бигликан также взаимодействует с коллагеном. Аспорин связывается с коллагеном, но не влияет на диаметр фибрилл, а воздействует на его биоминерализацию (Kalamajski, Oldberg, 2010).
Декорин, бигликан, фибромодулин и люмикан согласно некоторым исследованиям также участвуют в фибриллогенезе (Hwang, Halper, 2021). Декорин специфически связывается с доменом коллагена за счет присутствия GAG-цепи (Kalamajski, Oldberg, 2010). А LRR-повторы декорина образуют дугообразную форму и предположительно связываются с 4–6 молекулами коллагена. Взаимодействие осуществляется за счет водородных и электростатических связей (Orgel et al., 2009). Декорин контролирует латеральную агрегацию коллагеновых фибрилл и тем самым ограничивает их рост (Yoon, Halper, 2005). Кроме того, он может функционально восполнять отсутствие бигликана (Ameye, Young, 2002). Мыши с нокаутом декорина имеют хрупкую кожу и слабые сухожилия (Danielson et al., 1997). У человека мутации в гене декорина приводят к врожденной дистрофии роговицы (Bredrup et al., 2010).
Бигликан – это протеогликан, на 65% гомологичен декорину (Iozzo, Schaefer, 2015). В роговице бигликан может заменять декорин (Svensson et al., 1995). Дефицит бигликанов ведет к возникновению аномальных фибрилл в костях, дерме и сухожилиях (Ameye, Young, 2002). Бигликан регулирует фибриллогенез, но не способствует уменьшению диаметра фибрилл.
Интересно, что GAG-цепи на бигликане присутствуют только при раннем развитии фибрилл, на декорине же – до тех пор, пока не сформируются толстые фибриллы. Бигликан, а не декорин, активируется в сжатых сухожилиях, где механическое напряжение вызывает фибриллогенез коллагена. И, вероятно, бигликан способствует правильному формированию фибрилл и вместе с тем задерживает рост крупных фибрилл на ранних стадиях фибриллогенеза (Kalamajski, Oldberg, 2010; Moorehead et al., 2019).
Фибромодулин имеет два сайта связывания с коллагеном. Люмикан имеет гомологичный фибромодулину сайт связывания (Kalamajski, Oldberg, 2010). Нокаут у мышей фибромодулина приводит к остеоартриту и слабости сухожилий. А нокаут люмикана – к хрупкости кожи с помутнением роговицы (Chakravarti et al., 2000). Люмикан способен функционально заменять фибромодулин у мышей с дефицитом фибромодулина, но не наоборот (Jepsen et al., 2002). Показано, что в сухожилиях при дифиците фибромодулина наблюдаются более тонкие фибриллы. Кроме того, известно, что на ранних этапах развития сухожилий в них в большей степени представлены люмикан и бигликан, а на поздних – фибромодулин и декорин.
Остеоглицин (мимекан) также участвует в регуляции диаметра фибрилл. Показано, что мыши с нокаутом генов остеоглицина имеют фибриллы с большим диаметром как в роговице, так и в дерме (Kalamajski, Oldberg, 2010).
Кератокан – протеогликан, мутации в котором приводят к редкому заболеванию глаз, характеризующемуся плоской роговицей и еe помутнению (Huang, 2019).
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ДИАМЕТР КОЛЛАГЕНОВЫХ ФИБРИЛЛ
Физические факторы. Среди причин, вызывающих изменение диаметра фибрилл, отмечено влияние таких факторов, как время, pH, ионная сила, температура, а также стимуляция лазером, гамма-излучением, ультразвуком и магнитным полем. Вeличина pH раствора коллагена in vitro является одним из ключевых условий фибриллообразования, влияющих на диаметр фибрилл. Было изучено воздействие на микроструктурные характеристики фибрилл величины pH буферного раствора, равной 6.0, 7.0, 7.4, 8.0, и 9.0. Показано, что с повышением значения pH уменьшается диаметр фибрилл, но увеличивается их длина (Roeder, 2009). Кроме того, показано, что с повышением pH улучшается прозрачность коллагеновых матриц (Tidu et al., 2018).
Ионная сила раствора, которую можно варьировать путем добавления различного количества хлористого натрия в фосфатный буфер, также влияет на диаметр фибрилл. Показано, что при очень низкой ионной силе (при концентрации хлористого натрия 24 мМ) размер фибрилл ограничен (диаметр составляет примерно 15–20 нм). При большей ионной силе (диапазон концентрации хлористого натрия в фосфатном буфере – 127–261 мМ) фибриллы увеличиваются и собираются в пучки. Когда ионная сила достигает очень высоких значений (концентрация хлористого натрия – 529–1300 мМ), фибриллы присутствуют в растворе в двух состояниях: в виде крупных агрегатов и в виде нанофибрилл (Gobeaux et al., 2008).
Температура – еще один фактор, влияющий на диаметр фибрилл. Показано, что более низкая температура способствует формированию более толстых фибрилл. Tак, при 34°С диаметр фибрилл составляет 20–70 нм, а при 20°С – уже около 200 нм. Повышение температуры не в процессе фибриллогенеза, а путем радиочастотной обработки участков ткани ведет к слипанию фибрилл, увеличению диаметра, размыванию краев и потере исчерченного рисунка фибрилл (Roeder, 2009). Наблюдали и обратный эффект, называемой усадкой коллагена, сопровождающийся уменьшением диаметра фибрилл (Lopez, 1998).
Гамма-излучение, как известно, оказывает негативное воздействие на ткани. Исходя из этого, исследователи рассматривали изменение архитектуры коллагена. При воздействии гамма-излучения до 500 рад в течение от 1 до 8 нед. фибриллы коллагена сохраняли организацию и поперечнополосатый паттерн, но увеличивались в диаметре. При этом наблюдали повышение температуры, приводящее к усадке коллагена, которая связанa с увеличением количества поперечных связей.
Лазерная стимуляция также влияет на фибриллы коллагена. В низких дозах лазерное излучение стимулирует синтез коллагена: ускоряет фиброплазию и увеличивает количество мРНК коллагена I и III типа. Показано, что стимуляция гелий-неоновым лазером ведет к уменьшению диаметра фибрилл и увеличению плотности фибрилл. Это связано с повышенной скоростью ремоделирования сухожилия и, вместе с тем, с малым диаметром фибрилл, который наблюдается в ранней рубцовой ткани (Enwemeka et al., 1990). Увеличение диаметра фибрилл в процессе лазерной стимуляции связывают с их слипанием из-за повышения температуры, аналогично радиочастотной температурной обработке (Lopez et al., 1998).
Ультразвуковая обработка связок используется в качестве терапии для повреждeнных тканей. Чтобы исследовать влияние ультразвука на диаметр коллагеновых фибрилл, связки in vivo обрабатывали ультразвуком с частотой от 0.5 до 2 Вт/см2. В результате наблюдали нелинейный U-образный ответ, означающий, что максимальное количество толстых фибрилл отмечается при наибольшей и наименьшей интенсивности обработки (Ng, Fung, 2007). Разницу в диаметре фибрилл авторы связывают с изменением условий синтеза коллагена. Вместе с этим отмечают, что прочность связок при обработке ультразвуком с частотой от 1 до 2 Вт/см2 также является нелинейной.
Сильное магнитное поле используют в тканевой инженерии как способ создания ориентированных коллагеновых молекул и фибрилл (Torbet et al., 2007). При воздействии на коллагеновые матрицы in vitro сильным магнитным полем (с индукцией 6 и 12 Тл), отмечали рост диаметра фибрилл с усилением магнитного поля. Увеличение диаметра фибрилл объясняется легкостью объединения ориентированных фибрилл и повышенного формирования пучков с соседними фибриллами (Chen et al., 2011).
Химические факторы. На диаметр коллагеновых фибрилл in vitro и ex vivo оказывают влияние и химические агенты. Так, например, рибофлавин, который используется при лечении кератоконуса. Это заболевание характеризуется конусообразной формой роговицы глаза из-за нарушения структуры стромы. Рибофлавин в случае действия ультрафиолетового (УФ) излучения создает дополнительные сшивки в коллагене роговицы, чем позволяет сохранить целостность ткани. Роговицы, обработанные рибофлавином и УФ-излучением, имеют фибриллы большего диаметра (Choi et al., 2013).
Полисахариды, такие как гиалуроновая кислота, альгинат натрия и карбоксиметилцеллюлоза заметно влияют на диаметр фибрилл в процессе фибриллогенеза. Показано, что присутствие гиалуроновой кислоты и альгината натрия ведет к увеличению диаметра фибрилл коллагена, но не изменяет их D-периодичность (рис. 1). А присутствие карбоксиметилцеллюлозы ведет к значительному увеличению центров нуклеации фибриллогенеза и уменьшению диаметра фибрилл (Tsai et al., 2006).
Фиксирующие агенты, применяемые в препаративной обработке тканеинженерных конструкций на основе коллагена для просвечивающей электронной микроскопии, оказывают влияние на диаметр фибрилл изучаемых образцов (Akhtar, 2012). Было рассмотрено три варианта обработки ткани фиксирующими агентами. Так в ткани, зафиксированной в глутаровом альдегиде и смоле Шпора, диаметр составил около 40 нм, в глутаровом альдегиде и смоле Шпора с добавлением тетроксида осмия диаметр составил около 30 нм, в параформальдегиде и смоле LR White – около 55 нм (Akhtar, 2012).
В организме коллаген подвергается воздействию таких ферментов, как амилаза и коллагеназа. При обработке ткани этими ферментами диаметр фибрилл уменьшается. Причем под действием коллагеназы, в отличие от амилазы, в фибриллах значительно нарушается D-периодичность (Kazaili et al., 2021).
Неорганические вещества, такие как хлорид лития и ортованадат натрия, входящие в состав лекарственных препаратов, также изменяют диаметр фибрилл коллагена. Хлорид лития, психотропный препарат, оказывает многочисленные побочные эффекты на кожу и печень. Изучено влияние лития на коллагеновые фибриллы мышей. В течение 30 сут мышам вводили раствор хлорида лития в концентрации от 1.5 до 0.7 ммоль/кг, в результате структура коллагеновых фибрилл изменилась, в частности уменьшился их диаметр (Kounadi et al., 1995). Ортованадат (ванадат) натрия является одним из компонентов инъекции, используемой для лечения повреждения связок. Показано, что в результате такой терапии увеличивается диаметр фибрилл и улучшается их пространственная ориентация. Такой эффект связывают с фосфорилированием тирозина и снижением экспрессии α-SMA (α-smooth muscle actin) и, как следствие, предотвращением дифференцировки миофибробластов с последующим формированием новых коллагеновых пучков (Chen et al., 2006).
ЗАКЛЮЧЕНИЕ
В настоящей работе рассмотрены основные факторы, влияющие на процесс фибриллобразования молекулярного коллагена I типа и на свойства самих фибрилл. В организме на эти процессы влияет множество факторов, и, как продемонстрировано в литературе, основное воздействие оказывает присутствие коллагенов других типов. Как правило, уменьшение количества коллагенов III или V типов приводит к уменьшению диаметра гетерофибрилл на основе коллагена I типа. Функционирование различных тканей организма, а также различные нарушения зависят, в том числе, и от структурной организации коллагеновых фибрилл. Так, изменение эластичности кожи, прочности связок и прозрачности роговицы напрямую зависят от структурной организации и диаметра коллагеновых фибрилл. В дальнейшем необходимо изучить более детально не только факторы, но и механизмы, лежащие в основе изменения диаметра фибрилл.
Список литературы
Adachi E., Hayashi T. 1986. In vitro formation of hybrid fibrils of type V collagen and type I collagen limited growth of type I collagen into thick fibrils by type V collagen. Connect. Tiss. Res. V. 14. P. 257.
Akhtar S. 2012. Effect of processing methods for transmission electron microscopy on corneal collagen fibrils diameter and spacing. Microsc. Res. Tech. V. 75. P. 1420.
Ameye L., Young M. 2002. Mice deficient in small leucine-rich proteoglycans: novel in vivo models for osteoporosis, osteoarthritis, Ehlers-Danlos syndrome, muscular dystrophy, and corneal diseases. Glycobiology. V. 12. P. 107R.
Blaschke U., Eikenberry E., Hulmes D., Galla H., Bruckner P. 2000. Collagen XI nucleates self-assembly and limits lateral growth of cartilage fibrils. J. Biol. Chem. V. 275. P. 10370.
Bredrup C., Stang E., Bruland O., Palka B., Young R., Haavik J., Knappskog P., Rødahl E. 2010. Decorin accumulation contributes to the stromal opacities found in congenital stromal corneal dystrophy. Invest. Ophthalmol. Vis. Sci. V. 51. P. 5578.
Busra M.F.M., Lokanathan Y. 2019. Recent development in the fabrication of collagen scaffolds for tissue engineering applications: A review. Curr. Pharm. Biotechnol. V. 20. P. 992.
Canty G.E., Kadler K.E. 2005. Procollagen trafficking, processing and fibrillogenesis. J. Cell. Sci. V. 118. P. 1341.
Chakravarti S., Petrol W., Hassell J., Jester J., Lass J., Paul J., Birk D. 2000. Corneal opacity in lumican-null mice: defects in collagen fibril structure and packing in the posterior stroma. Invest. Ophthalmol. Vis. Sci. V. 41 P. 3365.
Chen J., Iosifidis M., Zhu J., Tatarintsev I., Wang J. 2006. Vanadate ingestion enhances the organization and collagen fibril diameters of rat healing medical collateral ligaments. Knee. Surg. Sports. Traumatol. Arthrosc. V. 14. P. 750.
Chen S., Hirota N., Okuda M., Takeguchi M., Kobayashi H., Hanagata N., Ikoma T. 2011. Microstructures and rheological properties of tilapia fish-scale collagen hydrogels with aligned fibrils fabricated under magnetic fields. Acta. Biomat. V. 7 P. 644.
Enwemeka C., Rodriquez O., Gall N., Walsh N. 1990. Morphometrics of collagen fibril populations in He : Ne laser photostimulated tendons. J. Clin. Laser Med. Surg. V. 8. P. 47.
Fang M., Goldstein E., Turner A., Les C., Orr B., Fisher G. Welch K., Rothman E., Banaszak Holl M. 2012. Type I collagen d-spacing in fibril bundles of dermis, tendon, and bone: Bridging between nano- and micro-level tissue hierarchy. ACS Nano. V. 6. P. 9503.
Fleischmajer R., Perlish J., Burgeson R., Shaikh-Bahai F., Timpl R. 1990. Type I and Type III collagen interactions during fibrillogenesis. Ann. N.-Y. Acad. Sci. V. 580. P. 161.
Giraud-Guille M., Mosser G., Belamie E. 2008. Liquid crystallinity in collagen. Interface Science. V. 13 P. 303.
Gobeaux F., Mosser G., Anglo A., Panine P., Davidson P., Giraud-Guille M.-M., Belamie E. 2008. Fibrillogenesis in dense collagen solutions: A physicochemical study. J. Mol. Biol. V. 376. P.1509.
Hosoyamada Y., Sakai T. 2012. Structural arrangement of collagen fibrils in the periarterial connective tissue of the kidney: their functional relevance as a structural stabilizer against arterial pressure. Anat. Sci. Int. V. 87. P. 80.
Huang C., Long X., Peng C., Lin P., Tan H., Lv W., Wu L. 2019. Novel variants in the KERA gene cause autosomal recessive cornea plana in a Chinese family: A case report. Mol. Med. Rep. V. 19. P. 4711.
Hulmes D. 2002. Building collagen molecules, fibrils, and suprafibrillar structures. J. Struct. Biol. V. 137. P. 2.
Hulmes S.D. 2009. Collagen diversity, synthesis and assembly. In: Collagen. Boston, Springer, 15–47.
Hwang, C., Halper J. 2021. Proteoglycans and diseases of soft tissues. In: Advances Exper. Med. Biol. Boston: Springer, V. 1348. P. 127.
Iozzo R., Schaefer L. 2015. Proteoglycan form and function: A comprehensive nomenclature of proteoglycans. Matrix. Biol. V. 42. P. 11.
Jepsen K., Wu F., Peragallo J., Paul J., Roberts L., Ezura Y., Oldberg A., Birk D., Chakravarti S. 2002. A syndrome of Joint Laxity and impaired tendon integrity in lumican- and fibromodulin-deficient mice. J. Biol. Chem. V. 277. P. 35е532.
Junqueira L., Montes G., Martins J., Joazeiro P. 1983. Dermal collagen distribution. Histochem. V. 79. P. 397.
Kadler K.E. 2017. Collagen fibril formation in vitro and in vivo Int. J. Exp. Path. V. 98. P. 4.
Kalamajski S., Oldberg A. 2010. The role of small leucine-rich proteoglycans in collagen fibrillogenesis. Matrix Biology. V. 29. P. 248.
Kazaili A., Abdul-Amir Al-Hindy H., Madine J., Akhtar R. 2021. Nano-scale stiffness and collagen fibril deterioration: Probing the cornea following enzymatic degradation using Peakforce-QNM AFM. Sensors. V. 21. P. 1629.
Klinge U., Si Z., Zheng H., Schumpelick V., Bhardwaj R. S., Klosterhalfen B. 2000. Abnormal collagen I to III distribution in the skin of patients with incisional hernia. Eur. Surg. Res. V. 32. P. 43.
Kounadi E., Tzaphlidou M., Fountos G., Glaros D. 1995. An electron microscopic study of collagen fibril structure after lithium treatment–II. The effects of low lithium dose and short treatment on mouse skin collagen. Micron. V. 26. P. 113.
Kuivaniemi H., Tromp G. 2019. Type III collagen (COL3A1): Gene and protein structure, tissue distribution, and associated diseases. Gene. V. 707. P. 151.
Li W., Chi N., Rathnayake R., Wang R. 2021. Distinctive roles of fibrillar collagen I and collagen III in mediating fibroblast-matrix interaction: A nanoscopic study. Biochem. Biophys. Res. Commun. V. 560. P. 66.
Liu X., Wu H., Byrne M., Krane S., Jaenisch R. 1997. Type III collagen is crucial for collagen I fibrillogenesis and for normal cardiovascular development. Proc. Natl. Acad. Sci. V. 94. P. 1852.
Lopez M., Hayashi K., Fanton G., Thabit G., Markel M. 1998. The effect of radiofrequency energy on the ultrastructure of joint capsular collagen. J. Arthr. Rel. Surg. V. 14. P. 495.
Marijianowski M., Teeling P., Mann, J., Becker A. 1995. Dilated cardiomyopathy is associated with an increase in the type I/type III collagen ratio: A quantitative assessment. J. Am. Coll. Cardiol. V. 25 P. 1263.
Moorehead C., Prudnikova K., Marcolongo M. 2019. The regulatory effects of proteoglycans on collagen fibrillogenesis and morphology investigated using biomimetic proteoglycans. J. Struct. Biol. V. 206. P. 204.
Müller L., Pels E., Schurmans L., Vrensen G. 2004. A new three-dimensional model of the organization of proteoglycans and collagen fibrils in the human corneal stroma. Exp. Eye. Res. V. 78. P. 493.
Ng G.Y., Fung D.T. 2007. The effect of therapeutic ultrasound intensity on the ultrastructural morphology of tendon repair. Ultrasound. Med Biol. V. 33. P. 1750.
Orgel J., Eid A., Antipova O., Bella J., Scott J. 2009. Decorin core protein (decoron) shape complements collagen fibril surface structure and mediates its binding. PLoS One. V. 4. P. e7028. https://doi.org/10.1371/journal.pone.0007028
Ottani V., Raspanti M., Ruggeri A. 2001. Collagen structure and functional implications. Micron. V. 32 P. 251.
Parry D., Craig S. 2017. Collagen fibrils during development and maturation and their contribution to the mechanical attributes of connective tissue. In: Collagen. V. II. Biochem. Biomech. N.Y.: RC Press. P. 2.
Pawelec K.M., Best S.M. Cameron R.E. 2016. Collagen: A network for regenerative medicine. J. Mater. Chem. B. V. 4. P. 6484.
Raub C., Suresh V., Krasieva T., Lyubovitsky J., Mih J.D., Putnam A.J., Bruce Tromberg J., George S. 2007. Noninvasive assessment of collagen gel microstructure and mechanics using multiphoton microscopy. Biophys. J. V. 92 P. 2212.
Roeder B.A. 2009. Fibril microstructure affects strain transmission within collagen extracellular matrices. J. Biomech. Eng. V. 131. P. 031004.
Steinmann B. 2002. The Ehlers-Danlos Syndrome. In: Connective tissue and its heritable disorders. N.-Y.: Wiley-Liss, Inc. P. 431.
Sun M., Chen S., Adams S., Florer J., Liu H., Kao W., Wenstrup R., Birk D. 2011. Collagen V is a dominant regulator of collagen fibrillogenesis: dysfunctional regulation of structure and function in a corneal-stroma-specific Col5a1-null mouse model. J. Cell. Sci. V. 124. P. 4096.
Sun M., Luo E.Y., Adams S.M., Adams T., Ye Y., Shetye S., Soslowsky S., Birk D. 2020. Collagen XI regulates the acquisition of collagen fibril structure, organization and functional properties in tendon. Matrix Biol. V. 94. P. 77.
Svensson L., Heineg D., Oldberg A. 1995. Decorin-binding sites for collagen type I are mainly located in leucine-rich repeats 4–5. J. Biol. Chem. V. 270. P. 20712.
Tidu A., Ghoubay-Benallaoua D., Teulon C., Asnacios S., Grieve K., Portier F., Schanne-Klein M.-C., Borderie V., Mosser G. 2018. Highly concentrated collagen solutions leading to transparent scaffolds of controlled three-dimensional organizations for corneal epithelial cell colonization. Biomater. Sci. V. 6. P. 1492.
Torbet J., Malbouyres M., Builles N., Justin V., Roulet M., Damour O., Oldbergc A., Ruggieroa F., Hulmes D. 2007. Orthogonal scaffold of magnetically aligned collagen lamellae for corneal stroma reconstruction. Biomaterials. V. 28. P. 4268.
Tracy L.E., Minasian R.A., Caterson E.J. 2016. Extracellular matrix and dermal fibroblast function in the healing wound. Adv. Wound Care (New Rochelle). V. 5. P. 119.
Tsai S.-W., Liu R.-L., Hsu F.-Y., Chen C.-C. 2006. A study of the influence of polysaccharides on collagen self-assembly: Nanostructure and kinetics. Biopolymers. V. 83. P. 381.
Varani J., Dame M., Rittie L., Fligiel S., Kang S., Fisher G., Voorhees J. 2006. Decreased collagen production in chronologically aged skin. Am. J. Pathol. V. 168 P. 1861.
Yamada S., Yamamoto K., Ikeda T., Yanagiguchi K., Hayashi Y. 2014. Potency of fish collagen as a scaffold for regenerative medicine. Biomed. Res. Int. V. 2014. P. 302932.
Yoon J., Halper J. 2005. Tendon proteoglycans: Biochemistry and function. Musculoskelet. Neuronal. Interact. V. 5. P. 22.
Young M., Bi Y., Ameye L., Chen X. 2002. Biglycan knockout mice: New models for musculoskeletal diseases. Glycoconj. J. V. 19. P. 257.
Дополнительные материалы отсутствуют.