Цитология, 2022, T. 64, № 6, стр. 523-533
Гомотипическая регуляция функциональной активности мультипотентных мезенхимных стромальных клеток: роль щелевых контактов
М. И. Ездакова 1, Д. К. Матвеева 1, Е. Р. Андреева 1, *
1 Институт медико-биологических проблем РАН
123007 Москва, Россия
* E-mail: andreeva1564@gmail.com
Поступила в редакцию 15.07.2022
После доработки 15.07.2022
Принята к публикации 17.08.2022
- EDN: WHRYEH
- DOI: 10.31857/S0041377122060037
Аннотация
Периэндотелиально расположенные мультипотентные мезенхимные стромальные клетки (МСК) рассматриваются как одно из наиболее вероятных депо, из которого МСК могут быть мобилизованы в случае повреждения тканей. В настоящей работе проанализировано, как нарушение прямой межклеточной коммуникации при ингибировании гомотипических щелевых контактов (ЩК) может влиять на свойства МСК, востребованные в процессах заживления и восстановления тканей: состояние внутриклеточных компартментов, паракринную, в частности ангиогенную активность, способность к миграции и фагоцитозу. В культивируемых митотически неактивных МСК коммуникацию через ЩК подавляли с помощью специфического ингибитора карбеноксолона. С помощью проточной цитофлуориметрии в МСК с заблокированными ЩК было показано двукратное увеличение массы митохондрий (зонд MitoTracker Green). Трансмембранный потенциал митохондрий (зонд JC-1) и уровень активных форм кислорода (измеренный с помощью зонда CM-H2DCFDA), а также активность лизосомального компартмента (зонд Ly-soTracker Green) при этом не изменялись. МСК с заблокированными ЩК менее активно мигрировали в модели раны. Способность к фагоцитозу частиц латекса была снижена. В кондиционированной среде (КС) от МСК с заблокированными ЩК по данным мультиплексного анализа уровень плейотропных цитокинов IL-6, IL-8, MCP-3 был значимо ниже. Эта КС не стимулировала ненаправленную миграцию эндотелиальных клеток и рост основных сосудов в хориоаллантоисной оболочке эмбриона перепела. Сделано предположение, что снижение эффективности прямой межклеточной коммуникации МСК−МСК in vivo может негативно отразиться как на функционировании стромальных предшественников в местах их расположения, так и на возможности их мобилизации из тканевых депо.
Мультипотентные мезенхимные стромальные клетки (МСК) вызывают значительный интерес в связи с их фундаментальной ролью в обеспечении физиологии и регенерации тканей, которая делает их важным структурным и регуляторным компонентом различных тканевых ниш (Буравкова и др., 2012; Андреева, Буравкова, 2013; Murphy et al., 2013; Murray, Péault, 2015; Сaplan, 2017; Tan et al., 2020). Многие аспекты их вовлечения в поддержание гомеостаза и ремоделирование тканей остаются неисследованными, что связано с недостаточностью знаний о функционировании МСК в локальных тканевых депо, а также о модуляции их функциональной активности при действии соответствующих стимулов. Хорошо известно, что, по крайней мере, часть МСК in vivo располагается переваскулярно, где они формируют сеть контактирующих между собой клеток (Andreeva et al., 1998). В этой сети гомотипические контакты между МСК осуществляются с участием высокоспециализированных соединений – щелевых контактов (ЩК) (Orekhov et al., 2016).
ЩК играют существенную роль в регулировании тканевого гомеостаза. Через ЩК цитозоли соседних клеток связаны напрямую, что обеспечивает перемещение вторичных мессенджеров, аминокислот, ионов кальция, глюкозы и ее метаболитов, микроРНК, малых интерферирующих РНК (siRNA) и др. непосредственно из клетки в клетку, минуя внеклеточное пространство (Harris et al., 2007; Brink et al., 2012; Greco et al., 2013). Это позволяет клеткам взаимодействовать, формируя клеточные системы с высокой степенью функциональной интеграции. Наличие интегрированной через ЩК сети обеспечивает, по-видимому, поддержание “покоящегося” (steady-state) фенотипа МСК в периваскулярных депо. Мы предположили, что снижение эффективности коммуникации через ЩК может привести к изменению функциональной активности МСК – фенотипической поляризации.
В настоящей работе мы определили, как степень гомотипической коммуникации через ЩК влияет на свойства МСК, востребованные с точки зрения реализации их регенеративного потенциала. Для этого оценивали влияние подавления коммуникации через ЩК на состояние внутриклеточных компартментов МСК, а также их паракринную, в частности ангиогенную активность, способность к миграции и фагоцитозу.
МАТЕРИАЛ И МЕТОДИКА
Клетки. В работе использовали линейные МСК (ASC52telo SCRC-4000™; ATCC, США) и эндотелиальные клетки (ЭК) (EA.hy926 CRL-2922™; ATCC, США) человека, которые культивировали в среде α-MEM и DMEM/F12 (Gibco, США) соответственно, содержащей 10% фетальной телячьей сыворотки (Hyclone, США), 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина и 2 мМ L-глутамина (ПанЭко, Россия) (далее – среды культивирования). Для остановки клеточных делений МСК предварительно обрабатывали митомицином С (1.5 мкг/мл, 18 ч; Sigma-Aldrich, США). МСК и ЭК постоянно культивировали при стандартных лабораторных условиях в СО2-инкубаторе (Sanyo, Япония).
Дизайн эксперимента. Эксперименты проводили следующим образом: после обработки митомицином МСК промывали, пассировали и рассевали в чашки Петри в полной ростовой среде из расчета 7000 кл./см2. Через 48 ч к МСК добавляли (или нет) ингибитор ЩК карбеноксолон (СВХ) (Sigma-Aldrich, США) в концентрации 100 мкг/мл на 18 ч.
Оценка эффективности коммуникации через ЩК. Использовали следующие методические подходы.
1) Нагрузка флуоресцентным зондом клеток в модели “раны” клеточного монослоя (Zachar et al., 2016). Для этого монослой МСК повреждали с помощью наконечника микропипетки. Затем добавляли краситель 6-карбоксифлуоресцеин (1 мкМ, Sigma-Aldrich, США). Этот краситель не может проходить через клеточные мембраны неповрежденных клеток. При нанесении раны краситель попадает в поврежденные клетки и из них проникает в соседние только через ЩК. Окрашенные карбоксифлуоресцеином МСК фотографировали через 1 и 6 ч после нанесения раны. Появление окрашенных карбоксифлуоресеином МСК, связанных с поврежденными клетками, свидетельствовало о наличии работающих ЩК.
2) Парашют-анализ (Parashute assay) (Talbot et al., 2018). Для подтверждения взаимодействия клеток через ЩК использовали цитоплазматический зонд кальцеин-AM (Invitrogen, США). Этот витальный краситель проникает в клетки и подвергается гидролизу под действием эстераз. Образующийся кальцеин не может выйти из клетки, но способен к перетеканию в соседние клетки через ЩК. Часть МСК окрашивали кальцеином-AM (0.1 мкг/мл). Далее МСК, содержащие кальцеин, и неокрашенные МСК (1 : 2) сокультивировали в течение 24 ч. Увеличение количества окрашенных МСК свидетельствовало о переносе кальцеина через ЩК. Для блокирования ЩК использовали специфический ингибитор карбеноксолон (СВХ, 100 мкг/мл; Sigma-Aldrich, США) в течение 3 ч.
Объем митохондриального компартмента и трансмембранный потенциал митохондрий. Объем оценивали при помощи независимого от трансмембранного потенциала митохондриального зонда MitoTracker Green (15 нг/мл; Invitrogen, США); трансмембранный потенциал митохондрий определяли с помощью зонда JC-1 (1.5 нг/мл; Invitrogen, США). Длина волны возбуждения и испускания для обоих зондов составляла соответственно 581 и 644 нм.
Состояние лизосомального компартмента и уровень АФК. Лизосомальный компартмент оценивали при помощи pH-чувствительного флуоресцентного зонда LysoTracker Green DND26 (0.5 мкл/мл; Invitrogen, США) (при длине волны возбуждения и испускания соответственно 504 и 511 нм). Активные формы кислорода (АФК) в клетках выявляли, используя зонд CM-H2DCFDA (1 мкг/мл, Invitrogen, США) (длина волны возбуждения и испускания соответственно 492–495 и 517–527 нм).
Для всех флуоресцентных зондов, использованных в работе, указаны конечные концентрации в среде с клетками.
Фагоцитарная активность МСК. Оценивали способность клеток поглощать флуоресцентные частицы латекса FluoSheres Yellow-green диаметром 0.5 мкм (Molecular Probes, США). Частицы добавляли к среде культивирования в концентрации 1 млн частиц/мл. Непосредственно перед добавлением к клеткам суспензию частиц латекса обрабатывали в течение 15 мин в ультразвуковой ванне (Сапфир, Россия) для получения гомогенной суспензии, состоящей из отдельных частиц без агрегатов. МСК (7000 кл./см2) инкубировали с частицами в течение 3 ч, после чего клетки тщательно промывали фосфатным буфером для удаления частиц с поверхности. Эффективность отмывки клеток от латексных частиц контролировали с помощью фазово-контрастного микроскопа (Leica DMIL, Германия). После промывки клетки фиксировали 4%-ным параформальдегидом в течение 20 мин, после чего тщательно промывали фосфатным буфером и заключали в монтирующую среду Fluoroshield с DAPI (Invitrogene, США). Для характеристики фагоцитарной активности вычисляли фагоцитарный индекс – долю МСК, фагоцитировавших латексные частицы. Подсчет производили с помощью флуоресцентного инвертированного микроскопа Nikon Eclipse Ti-U (Япония). В каждом эксперименте анализировали 200 клеток в трех технических повторах.
Иммуноцитохимия. Для выявления на МСК основного белка ЩК коннексина 43 (Сх43) использовали непрямое иммунофлуоресцентное мечение. Клетки фиксировали в 4%-ном параформальдегиде и окрашивали первичными мышиными моноклональными антителами к Сх43 (Abcam, Великобритания) и затем вторичными антителами козы против иммуноглобулинов мыши, мечеными AlexaFluor 488 (Имтек, Россия). После окрашивания покровные стекла с МСК монтировали на предметное стекло при помощи среды для заключения препаратов с добавлением красителя DAPI (Fluoroshield с DAPI; Sigma-Aldrich, США).
МСК анализировали на флуоресцентном инвертированном микроскопе Nikon Eclipse Ti-U, лазерном сканирующем микроскопе Zeiss LSM 900, (Zeiss, Германия) и проточном цитофлуориметре Cytoflex S (BeckmanCoulter, США), оснащенном лазерами с длиной волны 488 и 640 нм.
Ненаправленную (в отсутствие хемоаттрактантного стимула) миграцию в монослойных культурах МСК и ЭК (после добавления кондиционированной среды (КС) от МСК) оценивали in vitro через 6 ч после нанесения экспериментальной раны по уменьшению площади, свободной от клеток. Площадь закрытия (мм2) представляла собой разность между начальным (сразу после нанесения повреждения) и конечным размером раны. Измерение площадей поводили с использованием программного обеспечения NIS-elements AR версии 3.21 (Nikon, Япония).
Оценка транскрипционной активности генов. Использовали полимеразную цепную реакцию в реальном времени (ПЦР-РВ). МСК лизировали с помощью реагента QIAzol (Qiagen, США). Концентрацию и чистоту полученной РНК оценивали с помощью спектрофотометра NanoDrop 2000c (Thermo Scientific, США) по уровню поглощения при длине волн 260/280 нм. Далее на матрице РНК синтезировали кДНК с использованием Quantitech Reverse Transcription Kit (Qiagen, США) в соответствии с инструкцией производителя. Для определения уровня экспрессии генов использовали набор реактивов для проведения ПЦР-РВ в присутствии SYBR Green 1. Для определения относительного изменения уровня экспрессии целевых генов в качестве гена домашнего хозяйства использовали ген гипоксантин фосфорибозилтрансферазы (HPRT1). Специфичность проводимой реакции определялась с помощью анализа кривой плавления продуктов амплификации в диапазоне от 55 до 95°С с шагом в 1 градус. Методом ПЦР-РВ определяли транскрипционную активность генов GJA1, GLUT1, TUBB, RhoA, RocK1, IL-6, IL-8, МСР-1 и VEGF с помощью соответствующих праймеров (Qiagen, США), на приборе MX300P (Stratagen, США).
Содержание паракринных медиаторов. Медиаторы в образцах КС определяли с помощью MILLIPLEX MAP (HumanCytokine/Chemokine Magnetic Bead Panel-Premixed 41 Plex-Immunology Multiplex Assay) (Merck, Германия).
Оценку ангиогенной активности проводили с использованием in ovo модели (формирование сосудистой сети в хориоаллантоисной оболочке (ХАО) эмбриона японского перепела Coturnix coturnix japonica). КС от МСК наносили на хориоаллантоисную оболочку на 24 ч, контролем служила полная ростовая среда. Объем вводимого образца составлял 0.025 см3 на 1 г веса эмбриона вместе с зародышевыми оболочками. Затем образцы фиксировали и фотографировали на стереомикроскопе ZeissStemi 2000-C (Zeiss, Германия) с камерой для захвата изображения Canon G9 (Canon, Япония). На изображениях определяли число ветвей и число основных сосудов, с использованием программного обеспечения AngioQuant (www.cs.tut.fi) (Udartseva et al., 2019). Яйца японского перепела предоставлены виварием ИМБП РАН (Москва).
Статистическая обработка. В качестве характеристики полученных выборок использовали среднее значение и стандартное отклонение. Использовали пакет программ MicrosoftExcel 2010 и Statistica 7.0 и непараметрический критерий Манна−Уитни (для малых и средних выборок, n ≤ 30) при выбранном уровне значимости P ≤ 0.05.
РЕЗУЛЬТАТЫ
На рис. 1а представлены результаты иммуноцитохимического выявления основного белка ЩК – Сх43 на поверхности МСК. Как на интактных МСК, так и на МСК с блокированными с помощью специфического ингибитора карбеноксолона (СВХ) ЩК, обнаружено присутствие Сх43 в виде специфических структур – коннексиновых бляшек. Ингибирование работы ЩК не влияло на представленность и расположение коннексиновых бляшек на поверхности МСК и на транскрипционную активность гена GJA1, кодирующегоСх43 (рис. 1б).
Рис. 1.
Экспрессия основного белка щелевых контактов (ЩК) коннексина 43 (Сх43) на МСК и транскрипционная активность соответствующего гена. а – Иммуноцитохимическое выявление Сх43 на МСК; репрезентативные микрофотографии, флуоресцентная микроскопия; Сх43 в составе коннексиновых бляшек локализован на поверхности МСК и в местах контактов МСК−МСК (белые стрелки), ядра МСК докрашены DAPI; масштабный отрезок: 20мкм, увел. об.: 20×. б – Транскрипционная активность гена GJA1, кодирующего Сх43; уровень транскрипции нормализован на значение экспрессии гена домашнего хозяйства HPRT1. СВХ – карбеноксолон, специфический ингибитор ЩК. Представлены результаты, полученные в интактных МСК (−СВХ) и в МСК с блокированными ЩК (+СВХ).

В монослое МСК связаны друг с другом работающими ЩК, что демонстрируется в экспериментах с нагрузкой ЩК-специфичным красителем 6-карбоксифлуоресцеином в модели экспериментальной раны (рис. 2а). Данные флуоресцентной микроскопии подтверждаются с помощью проточной цитофлуориметрии с использованием парашют-анализа (см. раздел “Материал и методика”). Для этого неокрашенные МСК (70% популяции) (рис. 2б: −CBX, кривая 1) и МСК, содержащие кальцеин (30% популяции) (рис. 2б: +CBX: кривая 2), сокультивировали 3 ч и затем анализировали на проточном цитофлуориметре. Для полуколичественной оценки уровня кальцеина в МСК использовали среднюю интенсивность флуоресценции (СИФ). В неокрашенных МСК СИФ составила (2.0 ± 0.0) × 103 отн. ед. СИФ в МСК, содержащих краситель, была равна (5400.0 ± 500.0) × × 103 отн. ед. После взаимодействия кальцеин-содержащих и неокрашенных МСК можно было видеть, что сформировалась популяция, в которой все клетки содержали кальцеин. Распределение клеток по интенсивности флуоресценции было близким к нормальному (рис. 2б: −СВХ, кривая 3), СИФ составила (1900.0 ± 300.0) × 103 отн. ед. Значения СИФ были ниже, чем в исходных окрашенных клетках, но существенно выше, чем в неокрашенных МСК, что подтвердило перетекание кальцеина через ЩК из окрашенных клеток в неокрашенные.
Рис. 2.
Функционально-активные ЩК в МСК. а – Флуоресцентный ЩК-специфичный карбоксифлуоресцеин, введенный в МСК при повреждении монослоя, распространяется через работающие ЩК; белыми стрелками отмечены поврежденные МСК, ярко окрашенные карбоксифлуоресцеином; прерывистая линия показывает область клеток, в которые краситель проник через ЩК; флуоресцентная микроскопия, репрезентативные микрофотографии: масштабный отрезок: 50 мкм; увел. об.: 10×. б – Функционально-активные ЩК в МСК, проточная цитофлуориметрия, парашют-анализ, репрезентативные гистограммы распределения МСК неокрашенных (1),окрашенных кальцеином-АМ (2) и смешанная популяция 1 и 2 (3). Кальцеин перетек из окрашенных МСК в неокрашенные через работающие ЩК. СВХ – карбеноксолон, специфический ингибитор ЩК; −СВХ – интактные МСК; +СВХ – МСК с блокированными ЩК.

После блокирования с помощью СВХ функциональная активность ЩК в МСК снижалась существенно. Практически полностью ингибировался перенос карбоксифлуоресцеина в модели раны (рис. 2а: +СВХ). Парашют-анализ выявил уменьшение эффективности переноса кальцеина. Гистограмма распределения интенсивности флуоресеценции в популяции после взаимодействия кальцеин-содержащих и неокрашенных МСК с заблокированными ЩК была представлена кривой с двумя пиками (рис. 2б: +СВХ, кривая 3). Часть окрашенных МСК, составлявшая примерно треть популяции, имела исходно высокий уровень флуоресценции (СИФ: (6070.0 ± 200.0) × 103 отн. ед.) (рис. 2б: +СВХ, кривая 3, пик справа). Другие две трети популяции были окрашены гораздо слабее (СИФ: (8.0 ± 0.2) × 103 отн. ед.) (рис. 2б: +СВХ, кривая 3, пик слева).
После блокирования ЩК в МСК через 96 ч увеличилась (по сравнению с интактными МСК) в 2 раза масса митохондрий (объем митохондриального компартмента), выявленная с помощью красителя MitoTracker Green (рис. 3а). Трансмембранный потенциал митохондрий (определенный с помощью зонда JC-1) (рис. 3б) и содержание внутриклеточных АФК в МСК не зависели от эффективности работы ЩК (рис. 3в), но ингибирование ЩК привело к увеличению транскрипции переносчика глюкозы GLUT1 (рис. 3г). Блокирование ЩК не повлияло на активность лизосомального компартмента, выявляемого с помощью зонда LysoTracker Green (рис. 3д).
Рис. 3.
Влияние блокирования щелевых контактов с помощью ингибитора карбеноксолона (СВХ) на состояние внутриклеточных компартментов МСК: массы митохондрий (ММ, а), трансмембранного потенциала (ТП) митохондрий (б), содержания АФК (в), уровня транскрипции гена переносчика глюкозы GLUT1 (г; данные нормализованы на значение экспрессии гена домашнего хозяйства HPRT1) и лизосомального компартмента (ЛК, д). По вертикали – средняя интенсивность флуоресценции митохондриально-селективного красителя MitoTracker Green (а) или JC-1 (б), АФК-чувствительного зонда СМ-H2DCFDA (в) и pH-чувствительного лизосомного красителя LysoTracker Green (д). Представлены средние значения и стандартные отклонения, n = 4. Результаты получены в интактных МСК (−СВХ) и в МСК с блокированными ЩК (+СВХ).

Таким образом, ингибирование коммуникации через ЩК привело к изменению состояния внутриклеточных компартментов, что отразилось на фукциональной активности МСК.
В случае МСК с ингибированными ЩК площадь открытой раны через 6 ч после нанесения была больше, чем в МСК с работающими ЩК (Р < 0.05) (рис. 4а, б), что свидетельствовало о снижении скорости миграции МСК. При этом не выявлено изменения активности генов, кодирующих белок цитоскелета (TUBB) и белки сигнального пути Rho/ROCK (RhoA, Rock1), контролирующего перестройки цитоскелета (рис. 4в).
Рис. 4.
Влияние блокирования ЩК с помощью ингибитора карбеноксолона (СВХ) на функциональную активность МСК. а – Ненаправленная миграция МСК в модели раны монослоя; фазово-контрастная микроскопия, репрезентативные микрофотографии; прерывистая линия показывает границы раны (поврежденного монослоя) в точке “0”; масштабный отрезок: 50 мкм, увел. об.: 10×. б – Эффективность закрытия раны; представлены средние значения и стандартные отклонения, n = 4, (*) – различия достоверны при Р < 0.05. в – Транскрипционная активность генов, кодирующих тубулин (TUBB) и белки-регуляторы миграции (RhoA, Rock1), данные нормализованы на значение экспрессии гена домашнего хозяйства HPRT1, n = 3. г – Фагоцитарный индекс, показаны средние значения и стандартные отклонения для доли МСК, захвативших частицы латекса, n = 4, (*) – различия достоверны при Р < 0.05. Результаты получены получены в интактных МСК (−СВХ) и в МСК с блокированными ЩК (+СВХ).

Для оценки фагоцитарной активности к МСК добавляли флуоресцентные частицы латекса. Способность к захвату частиц латекса после ингибирования контактов снижалась практически в два раза: доля фагоцитирующих МСК составила 35% в контроле и 18% в МСК с ингибированными контактами (рис. 4г).
Ангиогенные эффекты КС от МСК с работающими и заблокированными ЩК оценивали по влиянию на ненаправленную миграцию в экспериментальной ране в монокультурах ЭК (рис. 5а, б) и в модели формирования сосудистой сети в ХАО эмбриона перепела (рис. 5в–д).
Рис. 5.
Ангиогенные эффекты кондиционированной среды от МСК с работающими и заблокированными ЩК в моделях in vitro и in ovo. а – Ненаправленная миграция эндотелиальных клеток (ЭК) в модели раны монослоя; фазово-контрастная микроскопия, репрезентативные микрофотографии; прерывистой линией показаны границы поврежденного монослоя в точке “0”; масштабный отрезок: 50 мкм, об.: 10×. б – Эффективность закрытия раны ЭК; представлены средние значения и стандартные отклонения, n = 4; отличие от значений в контроле (среда культивирования,*) и от значений для интактных МСК (−СВХ, #) достоверно при Р < 0.05. в – Сосудистая сеть в хориоаллантоисной оболочке (ХАО) эмбриона перепела, стрелками указаны основные сосуды (1) и ветви (2); микроскопия в светлом поле, репрезентативная микрофотография; масштабный отрезок: 1мм, об.: 6×. г, д – Число основных сосудов и ветвей соответственно: показан прирост по сравнению с контролем (средой культивирования); отличие от значений в контроле (*) и от значений для интактных МСК (−СВХ, #) достоверно при Р < 0.05. е – дифференциальная экспрессия генов, кодирующих ангиогенные медиаторы; показана кратность отличий в МСК с блокированными ЩК по сравнению с интактными МСК, n = 3. ж – Содержание ангиогенных медиаторов (IL-6, IL‑8, GRO, МСР-3, VEGF, FGF-2) в кондиционированной среде МСК. Представлены средние значения и стандартные отклонения, n = 4; отличия между МСК с заблокированными контактами (+СВХ) и интактными МСК (−СВХ) достоверны при Р < 0.05 (*).
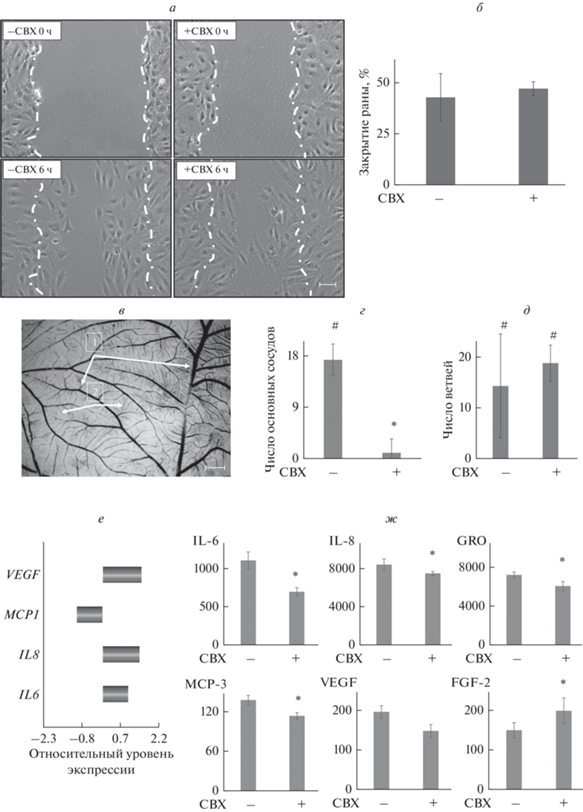
Эффективность закрытия раны ЭК была одинаковой при культивировании в КС от МСК с работающими или заблокированными ЩК (рис. 5б).
Через 24 ч после добавления среды культивирования (контроль) или КС от интактных МСК в сосудистой сети ХАО стало больше как основных сосудов, так и ветвей. Эффект при добавлении КС был более выраженным. Превышение над значениями в контроле составило 20% (Р = 0.0476 и Р = 0.0286 для основных сосудов и ветвей соответственно) (рис. 5г, д). При использовании КС от МСК с ингибированными ЩК не выявлено прироста основных сосудов в ХАО (Р = 0.699) (рис. 5г), тогда как прирост ветвей был таким же, как при действии КС от интактных МСК (20%, Р = 0.0222).
Транскрипционная активность генов МСК, кодирующих плейотропные ангиогенные цитокины IL-6, IL-8 и МСР-1, а также основной ангиогенный медиатор – фактор роста соcудистого эндотелия VEGF, не изменялась в МСК с заблокированными ЩК (рис. 5е). При этом содержание ангиогенных медиаторов IL-6, IL-8, GRO, МСР-3 в КС от МСК понижалось, что могло быть причиной выявленных эффектов (рис. 5е). Снижение уровня VEGF носило характер тенденции, но было отмечено увеличение уровня другого медиатора – фактора роста фибробластов (FGF-2). Такое изменение секреторного профиля, по-видимому, и определило уменьшение ангиогенной активности КС от МСК с ингибированными ЩК.
ОБСУЖДЕНИЕ
Как известно, МСК образуют различные типы соединений, таких как адгезионные и щелевые контакты, туннельные микротрубочки (Batra et al., 2012; Plotnikov et al., 2015; Успенская и др., 2021). Мы сосредоточили внимание на ЩК, т.к. именно этот способ коммуникации позволяет клеткам обмениваться метаболитами и сигнальными молекулами, минуя внеклеточное пространство, и таким образом может осуществляться модификация активности клеток в пределах популяции. Ранее мы показали, что физическое уменьшение степени гомотипических контактов МСК приводит к поляризации их фенотипа (Ездакова и др., 2020). МСК при низкой плотности и, соответственно, малом количестве физических контактов, имели более высокие уровни трансмембранного потенциала митохондрий и эндогенных АФК, менее закисленный лизосомальный компартмент, а также продуцировали существенно больше растворимых медиаторов, обладающих иммунорегуляторной и ангиогенной активностью. Возник вопрос, как снижение функциональной коммуникации через высокоспециализированные структуры, такие как ЩК, при сохранении уровня физических контактов повлияет на фенотипическую поляризацию МСК?
После ингибирования ЩК в МСК нами выявлено увеличение объема митохондриального компартмента, при этом не изменялись трансмембранный потенциал митохондрий и уровень внутриклеточных АФК. Изменение массы митохондрий рассматривается как индикатор происходящих внутри клетки изменений. С одной стороны, увеличение массы митохондрий может быть свидетельством преобладания анаболических процессов над катаболическими, что сопровождается усилением биогенеза митохондрий (Lamb et al., 2015). С другой стороны, есть данные, позволяющие интерпретировать увеличение массы митохондрий как защитный ответ клеток на имевший место стресс, в частности повреждение митохондрий. Так, показано увеличение этого показателя после действия ионизирующего излучения (Limoli et al., 2003), пероксида водорода (Lee et al.,2005), антибиотиков (Manchini et al., 2005), цитостатиков (Cupler et al., 1995) и статинов (Lee et al., 2000). Логично предположить, что в наших экспериментах снижение эффективности прямых межклеточных коммуникаций оказалось стрессом для МСК. Усиление биогенеза митохондрий в этом случае можно интерпретировать как адаптивную реакцию. Еще одним проявлением ответа на стресс на уровне клеточного метаболизма можно считать повышение транскрипции переносчика глюкозы, что может указывать на увеличение гликолитической составляющей в метаболизме АТФ.
Блокирование ЩК привело к изменению функциональной активности МСК. Выявленное замедление ненаправленной миграции МСК после ингибирования ЩК оказалось неожиданным. Ранее было показано, что снижение коммуникации через ЩК за счет подавления транскрипции Сх43 приводит к стимуляции миграции. При этом было выявлено увеличение транскрипции генов, кодирующих белки, ассоциированныe с репарацией тканей: нескольких матриксных металлопротеиназ, факторов TGF-β1 и проангиогенного VEGF-A, тогда как гены, молекулы которых ассоциированы с фиброзом (про-коллаген I типа, сократительные белки), были ингибированы. В эти изменения вовлечены сигнальные пути ERK1/2, GSK3α/β, TGF-β и транскрипционные факторы AP1, SP1 (Tarzemany et al., 2015). В нашей работе ингибирование работы ЩК не сопровождалось снижением транскрипции белка Сх43 и уменьшением количества коннексиновых бляшек на поверхности МСК, с чем, по-видимому, и было связано отсутствие стимуляции миграции МСК с заблокированными ЩК. Это наблюдение может представлять интерес с точки зрения возможности направленного воздействия на функционирование ЩК-интегрированных клеточных систем.
Помимо снижения миграции мы обнаружили уменьшение фагоцитарного индекса после ингибирования ЩК в МСК. Подобный эффект был ранее описан в результате нокдауна Сх43 и последующего подавления работы ЩК в клетках внутриглазной трабекулярной сети (Li et al., 2020). Кроме того, ингибирование Сх43 с помощью малых интерферирующих мНРК вызывало снижение фагоцитоза в макрофагах. Этот эффект авторы объяснили тем, что Cx43 связан с цитоскелетными белками и необходим для реорганизации F-актинового цитоскелета и RhoA-зависимого захвата фагоцитируемых частиц (Anand et al., 2008).
Фенотипическая поляризация МСК при снижении коммуникации через ЩК, помимо замедления миграции и подавления фагоцитоза, сопровождалась снижением продукции паракринных медиаторов, что привело к ослаблению ангиогенных эффектов КC от МСК. Ранее после ингибирования ЩК в культивируемых стромальных клетках эндометрия человека было показано снижение продукции VEGF-A, что рассматривалось как одна из причин снижения ангиогенеза в эндометрии (Yu et al., 2011). В нашей работе при анализе паракринного профиля КС выявлена тенденция к снижению уровня основного ангиогенного медиатора VEGF, играющего центральную роль в стимуляции пролиферации и миграции ЭК, а также наблюдалось снижение содержания нескольких хемокинов: IL-8, IL-6, GRO, MCP-3.
Хемокины играют важную роль в регуляции процессов ангиогенеза. IL-8 – первый из хемокинов, для которых показана прямая проангиогенная активность за счет стимуляции миграции ЭК, а также опосредованная –путем усиления продукции VEGF и фактора роста фибробластов FGF-2 (Li et al., 2003). Похожими эффектами обладает и плеотропный IL-6: за счет стимулирования синтеза и секреции VEGF он активирует процессы миграции и пролиферации ЭК, что обеспечивает формирование сосудистой сети (Papetti, Herman, 2002; Wei et al., 2003). Кроме того, IL-6 повышает экспрессию Ang-2. Этот медиатор вызывает антиангиогенные эффекты, способствует гибели клеток эндотелия и регрессии сосудов. Но действуя синергично с VEGF, он содействует образованию новых кровеносных сосудов, опосредуя взаимодействия между эндотелиальными и периваскулярными клетками, усиливая эффект проангиогенных белков (Wei et al., 2003; Kayakabe et al., 2012).
Кроме того, еще ряд факторов роста и цитокинов, таких как GRO-α, вызывают опосредованные проангиогенные эффекты через усиление продукции основных регуляторов сосудообразования (Caunt et al., 2006). Семейство моноцитарных хемотактических протеинов также вовлечено в регуляцию роста сосудов. В частности, продемонстрировано, что MCP-3 стимулирует миграцию МСК, тем самым индуцируя ангиогенез (Bousquenaud et al., 2012). Поскольку в наших экспериментах содержание перечисленных выше медиаторов значимо снижалось, это может объяснять отсутствие действия на продукцию VEGF, стимуляцию миграции ЭК в модели раны, а также снижение эффективности формирования сосудистой сети in ovo при использовании КС от МСК с заблокированными ЩК.
Таким образом, снижение эффективности прямой межклеточной коммуникации МСК−МСК может рассматриваться как стрессовая ситуация, приводящая к ухудшению интеграционной целостности клеточной системы МСК в локальных тканевых депо и поляризации фенотипа МСК. В связи с этим представляется актуальным анализ того, как факторы микроокружения МСК могут повлиять на эффективность коммуникации. В частности, есть данные о подавлении ЩК при гипергликемии (Muto et al., 2014) и повышенном уровне воспалительных медиаторов (Dorshkind et al., 1993; Duffy et al., 2000; Chanson et al., 2005). Возможно, что подобные эффекты могут вызватьcя также острым гипоксическим стрессом или депривацией факторов роста, возникающими при повреждении тканей. Подобного рода нарушения могут негативно отразиться как на функционировании МСК в местах их расположения, так и на возможности их мобилизации из тканевых депо.
Список литературы
Андреева Е.Р., Буравкова Л.Б. 2013. Паракринная активность мультипотентных мезенхимальных стромальных клеток и ее особенности в условиях гипоксии. Физиол. человека. Т. 39. № 3. С. 104. (Andreeva E.R., Buravkova L.B. 2013. Paracrine activity of multipotent mesenchymal stromal cells and its modulation in hypoxia. Human Physiol. 2013. V. 39. № 3. P. 315. https://doi.org/10.7868/S0131164613030041)
Буравкова Л.Б., Андреева Е.Р., Григорьев А.И. 2012. Роль кислорода как физиологического фактора в проявлении функциональных свойств мультипотентных мезенхимальных стромальных клеток человека. Физиол. человека. Т. 38. № 4. С. 1. (Buravkova L.B., Andreeva E.R., Grigoriev A.I. 2012. The impact of oxygen in physiological regulation of human multipotent mesenchymal cell functions. Hum. Physiol. V. 38. № 4. P. 444.)
Ездакова М.И., Зорникова К.В., Буравков С.В., Андреева Е.Р. 2020. Функциональная активность непролиферирующих мезенхимных стромальных клеток, культивируемых в различной плотности. Клет. тех. биол. мед. № 4. С. 247. (Ezdakova M.I., Zornikova K.V., Buravkov S.V., Andreeva E.R. 2021. Functional activity of non-proliferating mesenchymal stromal cells cultured at different densities. Bull. Exper. Biol. Med. V. 170. P. 537. https://doi.org/10.47056/1814-3490-2020-4-247-254)
Успенская Ю.А., Малиновская Н.А., Салмина А.Б. 2021. Межклеточный транспорт митохондрий: молекулярные механизмы и роль в поддержании энергетического гомеостаза в тканях. Цитология. Т. 63. № 6. С. 513. (Uspenskaya Yu.A., Malinovskaya N.A., Salmina A.B. 2021. Intercellular mitochondrial transfer: molecular mechanisms and role in maintaining the energy homeostasis in tissues. Tsitologiya. V. 63. № 6. P. 513. https://doi.org/10.31857/S0041377121060110)
Anand R.J., Dai S., Gribar S.C., Richardson W., Kohler J.W., Hoffman R.A., Branca M.F., Li J., Shi X.H., Sodhi C.P., Hackam D.J. 2008. A role for connexin43 in macrophage phagocytosis and host survival after bacterial peritoneal infection. J. Immunol. V. 181. P. 8534. https://doi.org/10.4049/jimmunol.181.12.8534
Andreeva E.R., Pugach I.M., Gordon D., Orekhov A.N. 1998. Continuous subendothelial letwork formed by pericyte-like cells in human vascular bed. Tiss. Cell. V. 30. P.127. https://doi.org/10.1016/s0040-8166(98)80014-1
Batra N., Kar R., Jiang J.X. 2012. Gap junctions and hemichannels in signal transmission, function and development of bone. Biochim. Biophys. Acta. V. 1818. P. 1909. https://doi.org/10.1016/j.bbamem.2011.09.018
Bousquenaud M., Schwartz C., Léonard F., Rolland-Turner M., Wagner D., Devaux Y. 2012. Monocyte chemotactic protein 3 is a homing factor for circulating angiogenic cells. Cardiovasc. Res. V. 94. P. 519. https://doi.org/10.1093/cvr/cvs140
Brink P.R., Valiunas V., Gordon C., Rosen M.R., Cohen I.S. 2012. Can gap junctions deliver? Biochim. Biophys. Acta. V. 1818 P. 2076. https://doi.org/10.1016/j.bbamem.2011.09.025
Caplan A.I. 2017. Mesenchymal stem cells: time to change the name! Stem Cells Transl. Med. V. 6. P. 1445. https://doi.org/10.1002/sctm.17-0051
Castellano P., Eugenin E.A. 2014. Regulation of gap junction channels by infectious agents and inflammation in the CNS. Front. Cell Neurosci. V. 8. P. 122. https://doi.org/10.3389/fncel.2014.00122
Caunt M., Hu L., Tang T., Brooks P.C., Ibrahim S., Karpatkin S. 2006. Growth-regulated oncogene is pivotal in thrombin-induced angiogenesis. Cancer Res. V. 66. P. 4125. https://doi.org/10.1158/0008-5472.CAN-05-2570
Chanson M., Derouette J.P., Roth I., Foglia B., Scerri I., Dudez T., Kwak B.R. 2005. Gap junctional communication in tissue inflammation and repair. Biochim. Biophys. Acta. V. 1711. P. 197. https://doi.org/10.1016/j.bbamem.2004.10.005
Cupler E.J., Danon M.J., Jay C., Hench K., Rapka M., Dalakos M.C. 1995. Early features of zidobudine-associated myopathy: histopathological findings and clinical correlations. ActaNeuropathol. V. 90. P. 1. https://doi.org/10.1007/BF00294452
Dorshkind K., Green L., Godwin A., Fletcher W.H. 1993. Connexin-43-type gap junctions mediate communication between bone marrow stromal cells. Blood. V. 82. P. 38.
Duffy H.S., John G.R., Lee S.C., Brosnan C.F., Spray D.C. 2000. Reciprocal regulation of the junctional proteins claudin-1 and connexin43 by interleukin-1beta in primary human fetal astrocytes. J. Neurosci. V. 20. P. RC114. https://doi.org/10.1523/JNEUROSCI.20-23-j0004.2000
Greco S.J., Rameshwar P. 2013. Analysis of the transfer of circulating microRNA between cells mediated by gap junction. Methods Mol. Biol. V. 1024. P. 87. https://doi.org/10.1007/978-1-62703-453-1_7
Harris A.L. 2007. Connexin channel permeability to cytoplasmic molecules. Prog. Biophys. Mol. Biol. V. 94. P. 120. https://doi.org/10.1016/j.pbiomolbio.2007.03.011
Kayakabe K., Kuroiwa T., Sakurai N., Ikeuchi H., Kadiombo A.T., Sakairi T., Nojima Y. 2012. Interleukin-6 promotes destabilized angiogenesis by modulating angiopoietin expression in rheumatoid arthritis. Rheumatol. V. 51. P. 1571. https://doi.org/10.1093/rheumatology/kes093
Lamb R., Bonuccelli G., Ozsvári B., Peiris-Pagès M., Fiorillo M., Smith D.L., Bevilacqua G., Mazzanti C.M., McDonnell L.A., Naccarato A.G., Chiu M., Wynne L., Martinez-Outschoorn U.E., Sotgia F., Lisanti M.P. 2015. Mitochondrial mass, a new metabolic biomarker for stem-like cancer cells: understanding WNT/FGF-driven anabolic signaling. Oncotarget. V. 6. P. 30453. https://doi.org/10.18632/oncotarget.5852
Lee C.F., Liu C.Y., Hsieh R.H., Wei Y.H. 2005. Oxidative stress-induced depolymerization of microtubules and alteration of mitochondrial mass in human cells. Ann. NY Acad. Sci. V. 1042. P. 246. https://doi.org/10.1196/annals.1338.027
Lee C., Yin P.H., Lu C.Y., Chi C.W., Wei Y.H. 2000. Increase of mitochondrial DNA in response to oxidative stress in human cells. Biochem. J. V. 348. P. 425.
Li A., Dubey S., Varney M.L., Dave B.J., Singh R.K. 2003. IL-8 directly enhanced endothelial cell survival, proliferation, and matrix metalloproteinases production and regulated angiogenesis. J. Immunol. V. 170. P. 3369. https://doi.org/10.4049/jimmunol.170.6.3369
Li X., Nagy J.I., Li D., Acott T.S., Kelley M.J. 2020. Gap junction connexin43 is a key element in mediating phagocytosis activity in human trabecular meshwork cells. Int. J. Physiol. Pathophysiol. Pharmacol. V. 12. P. 25
Limoli C.L., Giedzinski E., Morgan W.F., Swarts S.G., Jones G.D.D., Hyun W. 2003. Persistent oxidative stress in chromosomally unstable cells. Cancer Res. V. 63. P. 3107.
Mancini M., Anderson B.O., Caldwell E., Sedghinasab M., Paty P.B., Hockenbery D.M. 2005. Mitochondrial proliferation and paradoxical membrane depolarization during terminal differentiation and apoptosis in a human colon carcinoma cell line. J. Cell Biol. V. 138. P. 449. https://doi.org/10.1083/jcb.138.2.449
Murphy M.B., Moncivais K., Caplan A.I. 2013. Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine. Exper. Mol. Med. V. 45. P. 54. https://doi.org/10.1038/emm.2013.94
Murray I.R., Péault B. 2015. Mesenchymal stem cells – where do they come from and is it important? BMC Biol. V. 13. P. 99. https://doi.org/10.1186/s12915-015-0212-7
Orekhov A.N., Andreeva E.R., Bobryshev Y.V. 2016. Cellular mechanisms of human atherosclerosis: role of cell-to-cell communications in subendothelial cell functions. Tissue Cell. V. 48. P. 25. https://doi.org/10.1016/j.tice.2015.11.002
Papetti M., Herman I.M. 2002. Mechanisms of normal and tumor-derived angiogenesis. Am. J. Physiol.: Cell Physiol. V. 282. P. C947. https://doi.org/10.1152/ajpcell.00389.2001
Plotnikov E.Y., Babenko V.A., Silachev D.N., Zorova L.D., Khryapenkova T.G., Savchenko E.S., Pevzner I.B., Zorov D.B. 2015. Intercellular transfer of mitochondria. Biochemistry (Mosc). V. 80. P. 542. https://doi.org/10.1134/S0006297915050041
Talbot J., Brion R., Lamora A., Mullard M., Morice S., Heymann D., Verrecchia F. 2018. Connexin43 intercellular communication drives the early differentiation of human bone marrow stromal cells into osteoblasts. J. Cell. Physiol. V. 233. P. 946. https://doi.org/10.1002/jcp.25938
Tan L., Liu X., Dou H., Hou Y. 2020. Characteristics and regulation of mesenchymal stem cell plasticity by the microenvironment-specific factors involved in the regulation of MSC plasticity. Genes Dis. V. 9. P. 296. https://doi.org/10.1016/j.gendis.2020.10.006
Tarzemany R., Jiang G., Larjava H., Häkkinen L. 2015. Expression and function of connexin 43 in human gingival wound healing and fibroblasts. PLoS One. V. 10. P. e0115524. https://doi.org/10.1371/journal.pone.0115524
Udartseva O.O., Zhidkova O.V., Ezdakova M.I., Ogneva I.V., Andreeva E.R., Buravkova L.B., Gollnick S.O. 2019. Low-dose photodynamic therapy promotes angiogenic potential and increases immunogenicity of human mesenchymal stromal cells. J. Photochem. Photobiol. B. V. 199. P. 111596. https://doi.org/10.1016/j.jphotobiol.2019.111596
Wei L.H., Kuo M.L., Chen C.A., Chou C.H., Lai K.B., Lee C.N., Hsieh C.Y. 2003. Interleukin-6 promotes cervical tumor growth by VEGF-dependent angiogenesis via a STAT3 pathway. Oncogene. V. 22. P. 1517. https://doi.org/10.1038/sj.onc.1206226
Yu J., Wu J., Bagchi I.C., Bagchi M.K., Sidell N., Taylor R.N. 2011. Disruption of gap junctions reduces biomarkers of decidualization and angiogenesis and increases inflammatory mediators in human endometrial stromal cell cultures. Mol. Cell. Endocrinol. V. 344. P. 25. https://doi.org/10.1016/j.mce.2011.04.011
Zachar L. Bačenková D., Rosocha J. 2016. Activation, homing, and role of the mesenchymal stem cells in the inflammatory environment. J. Inflamm. Res. V. 9. P. 231. https://doi.org/10.2147/JIR.S121994
Дополнительные материалы отсутствуют.
Инструменты
Цитология


