Цитология, 2023, T. 65, № 3, стр. 283-294
Наночастицы диоксида титана подавляют энтоз в культуре аденокарциномы молочной железы человека MCF-7
О. П. Кисурина-Евгеньева 1, *, М. А. Савицкая 1, Д. С. Смешнова 1, Г. Е. Онищенко 1
1 Биологический факультет Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: evgengeva@mail.ru
Поступила в редакцию 31.10.2022
После доработки 09.02.2023
Принята к публикации 21.02.2023
- EDN: VCHENQ
- DOI: 10.31857/S0041377123030045
Аннотация
Наночастицы TiO2 широко применяются в промышленности, фармакологии, медицине. В последнее время предлагается использовать наночастицы TiO2 для адресной доставки химиотерапевтических препаратов, что может привести к увеличению локальной концентрации TiO2 и оказать влияние на протекающие в опухоли процессы, в т.ч. на энтоз (внедрение одной опухолевой клетки в другую). В настоящей работе проведено исследование влияния наночастиц TiO2 (частиц минерала анатаз размером менее 25 нм и частиц, состоящих из смеси анатаза и рутила, размером менее 75 нм в концентрации 1, 10 или 100 мкг/мл в течение 72 ч) на процесс энтоза в культуре клеток аденокарциномы молочной железы человека MCF-7. Культивирование клеток в присутствии разных типов наночастиц TiO2 замедляет пролиферацию и вызывает уменьшение числа энтозов. Элементный анализ с помощью аналитической электронной микроскопии выявил присутствие TiO2 в эндосомном компартменте, в цитозоле и во внеклеточном пространстве. Методом иммунохимического окрашивания показано, что оба типа наночастиц TiO2 в концентрации 10 мкг/мл нарушают образование адгезивных контактов, в т.ч. и на ранних стадиях энтоза. Воздействие частиц анатаза индуцирует транслокацию белка р53 в ядра клеток. В целом, использованные в работе наночастицы TiO2 ингибируют энтоз в клетках культуры MCF-7, нарушая адгезивные контакты и препятствуя процессу внедрения. Однако можно предположить, что нарушение адгезивных контактов способно усиливать подвижность опухолевых клеток и метастазирование.
В настоящее время нанотехнологии являются одним из приоритетных направлений развития науки и техники. Наночастицы (от 1 до 100 нм) различного происхождения широко используются в медицине и в промышленности. К таким наночастицам относится диоксид титана (TiO2), применяемый в фармакологии при изготовлении оболочек таблетированных препаратов, при изготовлении декоративной косметики, в производстве красок и т.д. (Fage et al., 2016). В природе TiO2 существует в трех формах: рутил, анатаз и брукит (Rossi et al., 2010). Наиболее инертен среди них рутил. Анатаз, в отличие от всех остальных форм, является наиболее реакционно-способным из-за наличия фотокаталитических свойств (Hurum et al., 2005). Цитотоксичность наночастиц TiO2 была показана на различных типах культивируемых клеток. Наночастицы TiO2 вызывали генерацию активных форм кислорода и окислительный стресс (Sayes et al., 2006; Hanot-Roy et al., 2016), ацетилирование белков (Sund et al., 2014), изменение фосфопротеома белков, регулирующих процессы апоптоза, внутриклеточного транспорта, воспаления (Biola-Clier et al., 2020), повреждение ДНК и активацию апоптоза (Lagopati et al., 2014; Wang et al., 2015; Trang et al., 2021), а также нарушение структуры адгезивных контактов (Setyawati et al., 2013).
Как было показано, при попадании наночастиц TiO2 в организм при разных способах их введения они накапливаются в тканях почек, печени, легких, головного мозга. Наночастицы оказывали кратковременный токсический эффект, вызывая воспалительную реакцию в легких (Warheit et al., 2006), гистопатологические и функциональные нарушения в тканях печени и почек (Wang et al., 2007). Однако значимого токсического эффекта наночастиц TiO2in vivo обнаружено не было. В связи с этим, в последнее время разрабатываются способы клинического использования наночастиц TiO2 в терапии опухолей (в т.ч. на модели клеток аденокарциномы молочной железы MCF-7) для адресной доставки химиотерапевтических препаратов (Zeng et al., 2015; Ding et al., 2016). Побочным эффектом адресной доставки химиотерапевтических препаратов с использованием наночастиц TiO2 может являться влияние собственно наночастиц на различные процессы, проходящие в опухолевых тканях, в т.ч. стимулирующих опухолевую прогрессию. Одним из таких процессов является энтоз.
Энтоз представляет собой внедрение одной клетки эпителиального происхождения в другую клетку. Внедрение происходит за счет образования адгезивных контактов и работы актомиозиновой системы внедряющейся клетки. Внедрившаяся клетка может со временем покинуть энтозную вакуоль или подвергнуться лизосомно-опосредованной деградации, что приводит к уменьшению числа опухолевых клеток. С другой стороны, внедрившаяся клетка может служить источником питательных веществ для энтозной (наружной) клетки (Overholtzer et al., 2007; Garanina et al., 2017), способствуя ее выживанию. Кроме того, и наружная, и внедрившаяся клетка могут вступить в митоз (Krishna, Overholtzer, 2016; Кисурина-Евгеньева и др., 2018). Наличие крупной вакуоли нарушает нормальное завершение митоза энтозной клетки, что приводит к появлению полиплоидных клеток и повышению генетической нестабильности опухоли (Krajcovic et al., 2011; Garanina et al., 2017). Таким образом, энтоз может как способствовать, так и препятствовать развитию опухоли.
Целью работы является оценка влияния наночастиц диоксида титана (TiO2) на протекание процесса энтоза в клетках культуры аденокарциномы молочной железы человека (MCF-7). При этом использовали два типа наночастиц: анатаз, ≤25 нм (далее А25) и смесь анатаза и рутила, ≤75 нм (далее АР75).
МАТЕРИАЛ И МЕТОДИКА
Клетки и наночастицы TiO2. Клетки культуры MCF-7 (аденокарцинома молочной железы человека) получены из НИИ канцерогенеза Российского онкологического научного центра им. Н.Н. Блохина (Москва). Клетки выращивали в среде DMEM (ПанЭко Россия), содержащей 10% фетальной сыворотки крупного рогатого скота (PAA Laboratories, Австрия) и 80 мг/мл гентамицина (ПанЭко) при 37°C и 5% CO2. Клетки высаживали в чашки Петри на покровные стекла в концентрации 200 тыс./мл. Через 24 ч к клеткам добавляли наночастицы TiO2 в форме анатаза размером менее 25 нм (далее А25) (Sigma, 637254, США) или наночастицы, состоящие из смеси анатаза и рутила, с размером менее 75 нм (далее АР75) (Sigma, 13463-67-7, США). Культивирование клеток в присутствии наночастиц проводили в течение трех сут. Концентрация наночастиц TiO2 составляла 1, 10 или 100 мкг/мл.
Морфологический анализ. Клетки фиксировали 96% этанолом (–20°С) и окрашивали гематоксилином и эозином по стандартной методике. На полученных свето-микроскопических препаратах по морфологическим признакам считали число энтозов (энтотический индекс, в %), митозов (митотический индекс, в %) и апоптозов (апоптотический индекс, в %) (n = 3000 клеток в каждом из 3-х биологических повторов эксперимента; на графиках указаны средние значения и их ошибка). На этих же препаратах (для концентрации наночастииц 10 мкг/мл) оценивали влияние наночастиц на увеличение числа клеток в процессе культивирования (до внесения наночастиц и через 3 сут после внесения). Число клеток считали, используя объектив с увеличением 40× в 10 полях зрения (в 3-х биологических повторах, по 40 полей зрения в каждом, на графиках указаны значения среднего и ошибка среднего).
Иммуноцитохимия и обработка изображений. Для выявления белков β-катенина и р53 клетки фиксировали 4%-ным формальдегидом (02194047-CF, MP Biochemicals, Франция), приготовленным на 0.1 M фосфатно-солевом буферном растворе (PBS) рН 7.2, обрабатывали 0.1%-ным Тритоном Х100 (Sigma, США) и отмывали в 0.1 M PBS рН 7.2. Адгезивные контакты окрашивали мышиными моноклональными антителами против белка β-катенина (C7207; Sigma, США) в течение 30 мин при 37°C. Для выявления белка р53 клетки окрашивали мышиными моноклональными антителами против белка р53 (Р5813; Sigma, США) 30 мин при 37°C. В качестве вторых антител использовали антитела против иммуноглобулина мыши, конъюгированные с Alexa Fluor-488 (Invitrogen, США), окрашивали 30 мин при 37°C. Ядра клеток докрашивали красителем DAPI (0.1 мкг/мл) (Sigma, США) 10 мин при комнатной температуре и в темноте.
Препараты анализировали с помощью люминесцентного микроскопа Axiovert 200M (Carl Zeiss Inc., Германия). Для Alexa Fluor-488 и DAPI использовали спектры возбуждения/испускания 496/519 и 358/460 соответственно. Для последующей статистической обработки использовали одинаковое время экспозиции в каждом эксперименте. Снимки обрабатывали с помощью программ Adobe Photoshop и ImageJ/Fiji. Измерение длины адгезивных контактов проводили с использованием программного оборудования Vision Bio® Analyze (Россия). На изображении измеряли общий периметр клеток (Р) и длину L межклеточного прикрепления по окрашиванию антителами против белка β-катенина, число измерений n в контроле и в эксперименте составляло 90 и 50 соответственно. Анализировали отношение периметра клетки к протяженности адгезивных контактов (Р/L).
Интенсивность флуоресценции белка р53 в ядрах также измеряли с использованием программного оборудования (Vision Bio® Analyze, Россия). Оценивали интенсивность флуоресценции в ядре и в таком же объеме цитоплазмы (фон). Затем с помощью программы Excel вычитали фон, значения интенсивности флуоресценции ядер в усл. ед. ранжировали по возрастанию и делили на три группы: слабо-флуоресцирующие (0–30), средне-флуоресцирующие (30–60) и ярко-флуоресцирующие (60–90). Число проанализированных клеток в контроле – 1467 шт., в присутствии наночастиц А25 в концентрации 1 и 10 мкг/мл – 538 и 114 соответственно, в присутствии 1 и 10 мкг/мл АР – 184 и 143 соответственно.
Эксперименты по анализу длины адгезивных контактов и накоплению р53 в ядрах клеток проводили в двух биологических повторах, затем выборки объединяли. На графиках указывали среднее значение и стандартное отклонение.
Трансмиссионная электронная микроскопия (ТЭМ). Для ультраструктурного анализа клеток с помощью ТЭМ клетки культивировали в присутствии наночастиц TiO2 (А25 или А75 в концентрации 10 мкг/мл 3 сут). Клетки фиксировали 2.5%-ным глутаровым альдегидом на 0.1 M буфере PBS рН 7.2 30 мин, обезвоживали и заключали в эпон 812 по стандартной методике. В процессе проводки клетки дофиксировали 1%-ным раствором осмия на 0.1 M буфере PBS рН 7.2 и контрастировали 1.5%-ным раствором уранилацетата в 70%-ном этаноле. Ультратонкие срезы толщиной 60 нм изготавливали с помощью алмазного ножа на ультрамикротоме LKB II (Швеция). Для лучшей визуализации наночастиц дополнительное контрастирование срезов не проводили. Полученные срезы анализировали на трансмиссионном электронном микроскопе JEM-1011 (JEOL, Япония) и аналитическом трансмиссионном электронном микроскопе JEM-2100 (JEOL, Япония). Элементный анализ наночастиц проводили с использованием метода энерго-дисперсионной спектрометрии (ЭДС) характеристического рентгеновского излучения, основанном на регистрации рентгеновских фотонов, испускаемых образцами при их облучении пучком электронов, и измерении их энергий энерго-дисперсионным спектрометром (Oxford Instruments Inca X-Max 8 mm2, Великобритания). Обработку результатов проводили с использованием программного оборудования Inca (Oxford Instruments, Великобритания).
Статистическая обработка. Построение графиков и гистограмм проводили в программе Microsoft Office Excel 2007. Для проверки гипотезы о различии средних в контроле и экспериментальной группе использовали критерий Манна–Уитни (для малых выборок) или t-критерий Стьюдента с подтверждением нормальности распределения. Различие считали статистически достоверным при p ≤ 0.05. Поскольку энтоз представляет собой редкое явление, при статистической обработке данных, полученных при исследовании энтозных клеток, стандартное отклонение не определяли; при этом указывали число проанализированных энтозов.
РЕЗУЛЬТАТЫ
Распределение наночастиц TiO2 в клетках MCF-7. Электронная микроскопия. Для того чтобы убедиться в накоплении наночасти TiO2, как в форме А25, так и АР75, в клетках MCF-7, было проведено электронно-микроскопическое исследование. В клетках были обнаружены скопления электронно-плотных частиц (рис. 1). Элементный анализ показал, что выявленные электронно-плотные частицы содержали в своем составе титан (рис. 2). Наночастицы разной природы имели разную морфологию: наночастицы А25 выглядели как мелкие и равномерно распределенные электронно-плотные частицы, в то время как АР75 представляли собой гранулы разного размера (рис. 2).
Рис. 1.
Электронно-плотные частицы в клетках MCF-7, культивировавшихся в присутствии наночастиц TiO2 А25 (а) и АР75 (б). Стрелки указывают на электронно-плотные частицы.
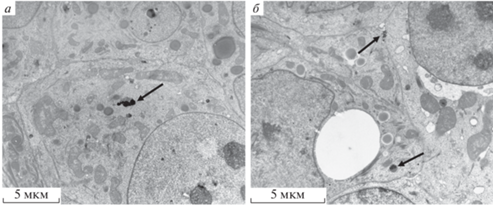
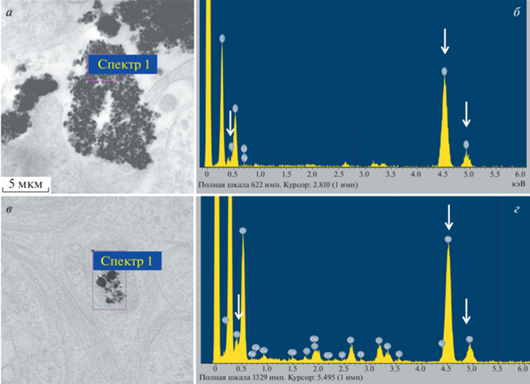
Рис. 2.
Наночастицы TiO2 (10 мкг/мл) А25 и АР75 в клетках культуры MCF-7 (элементный анализ). а, в – Электронно-микроскопическая фотография наночастиц TiO2 в форме анатаза (25 нм) и анатаза с рутилом (75 нм) соответственно. б, г – Энергодисперсионный спектр области (спектр 1 и спектр 2 соответственно); по оси абцисс — энергия рентгеновского излучения, кэВ, по оси ординат – интенсивность характеристического рентгеновского излучения; стрелками отмечены пики, характерные для TiO2, концентрация наночастиц – 10 мкг/мл.
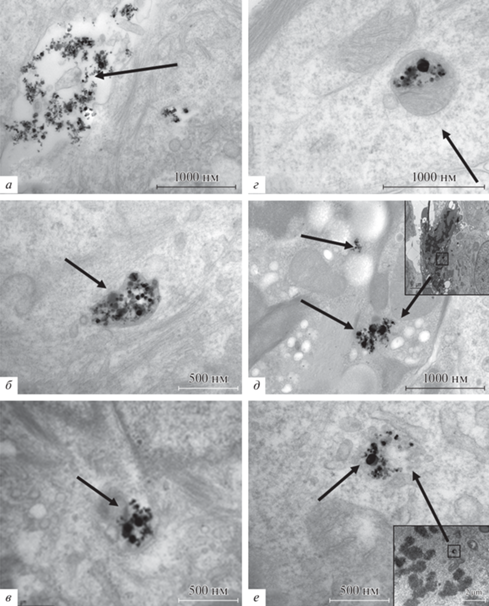
Наночастицы А25 и АР75 формировали агрегаты как снаружи, так и внутри клеток (рис. 3). В клетках наночастицы обнаруживали чаще всего внутри везикул (рис. 3б), что указывает на проникновение их в клетку путем эндоцитоза. Везикулы на электронно-микроскопическом уровне характеризовались разной морфологией. Часть везикул с наночастицами TiO2 имела однородное содержимое и, по-видимому, принадлежала к компартменту ранних эндосом (рис. 3б). Другая часть везикул содержала мембранные структуры, и, вероятно, принадлежала к компартменту поздних эндосом (мультивезикулярных телец) (рис. 3г). В некоторых случаях наночастицы располагались небольшими агрегатами свободно в цитоплазме (рис. 3в, д, е). Наночастицы присутствовали и в апоптотических клетках (рис. 3д). Кроме того, наночастицы, свободно лежащие в цитоплазме, были обнаружены в митотической клетке (рис. 3е).
Рис. 3.
Наночастицы TiO2 в клетках культуры MCF-7, культивировавшихся 3 сут в присутствии частиц АР75 (10 мкг/мл). Трансмиссионная электронная микроскопия. Локализация наночастиц (стрелки): а – во внеклеточном пространстве, б – в ранней эндосоме, в – в цитоплазме, г – в поздней эндосоме, д – в цитоплазме апоптотической клетки, е – в цитоплазме митотической клетки; на врезках д, е представлено малое увеличение клетки.
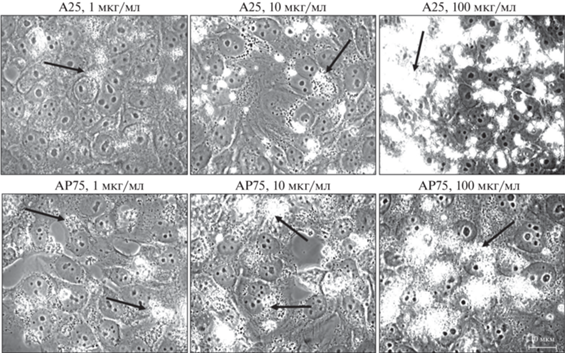
Митотический, апоптотический и энтотический индексы при воздействии наночастиц TiO2. Для оценки влияние наночастиц на культивируемые клетки MCF-7 были измерены митотический, апоптотический и энтотический индексы на препаратах, окрашенных гематоксилином и эозином (рис. 4а). Воздействие обеих форм наночастиц TiO2 в концентрации 10 и 100 мкг/мл вызывало уменьшение митотического индекса и увеличение апоптотического индекса по сравнению с контролем (p ≤ 0.05 по Манну–Уитни). Апоптотический индекс в присутствии наночастиц А25, 100 мкг/мл был выше по сравнению с АР75 в той же концентрации (p ≤ 0.05 по Манну–Уитни). Для оценки влияния наночастиц на рост культуры был проведен подсчет клеток на единицу площади (рис. 4б). Анализ проводили только для концентрации наночастиц 10 мкг/мл, т.к. именно в этих условиях апоптотический и митотический индексы изменяются достоверно. В контроле в течении 3-х сут число клеток увеличивалось почти в три раза. В присутствии наночастиц (10 мкг/мл) это число возрастало менее чем в два раза. Таким образом, воздействие наночастиц TiO2, начиная с концентрации 10 мкг/мл, вызывает уменьшение митотического индекса, возрастание апоптотического индекса и, в целом, приводит к замедлению роста культуры. Хотя TiO2 (100 мкг/мл) образует агрегаты на поверхности клеток (рис. 5), сохраняется митотическая активность и нет значительной гибели клеток.
Рис. 4.
Влияние наночастиц TiO2 в разной концентрации в течении 3 сут на пролиферативную активность, выживаемость и энтоз клеток MCF-7. а – Изменение митотического (МИ), апоптотического (АИ) и энтотического (ЭИ) индексов в клетках; А25 — наночастицы анатаза размером 25 нм, АР75 — смесь наночастиц анатаза и рутила размером 75 нм; (*) – различия относительно к достоверны при р ≤ 0.05 (критерий Манн–Уитни); б – изменение числа клеток при культивировании в присутствии наночастиц TiO2 (10 мкг/мл); К1 и К2 – количество клеток через 24 ч культивирования перед добавлением наночастиц и через 3 сут культивирования соответственно; по вертикали указано количество клеток в усл. ед. относительно К2; (*) – различия относительно К1 достоверны при р ≤ 0.05 (критерий Манн–Уитни); (**) – различия относительно К1 и эксперимента достоверны при р ≤ 0.05 (критерий Манн–Уитни); указаны значения среднего и его ошибки (n = 3).
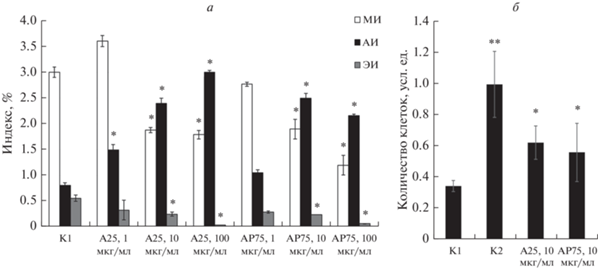
Энтотический индекс при добавлении в среду культивирования наночастиц А25 и АР75 дозозависимо уменьшался по сравнению с контролем (рис. 4а). В присутствии 100 мкг/мл наночастиц и одного, и другого типа встречались единичные картины “клетка-в-клетке”, что указывает на подавление процесса энтоза.
Рис. 5.
Общий вид клеток MCF7 в присутствии наночастиц TiO2 (А25 и АР75) в разных концентрациях. Фазовый контраст. Стрелки указывают на агрегаты наночастиц. Масштабный отрезок: 10 мкм.
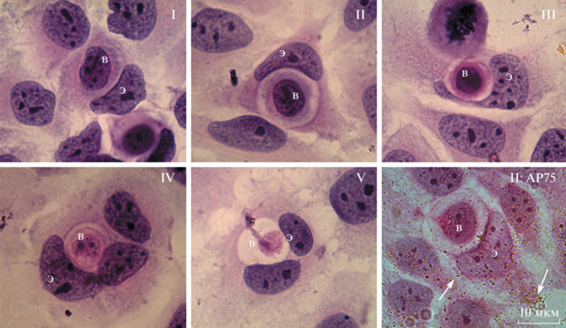
Влияние наночастиц TiO2 на прохождение энтоза в клетках MCF-7. В клетках MCF-7 в контроле процесс энтоза можно подразделить на 5 стадий (Garanina et al., 2017) (рис. 6). На первой стадии внедряющаяся клетка плотно контактирует с внешней (энтозной) клеткой. Признаки деградации внедрившейся клетки не выявляются. На второй стадии внедрившаяся клетка начинает терять контакты с мембраной энтозной вакуоли. На третьей стадии свободное пространство внутри энтозной вакуоли четко выражено и внедрившаяся клетка более не имеет контактов с ее мембраной. Размер внедрившейся клетки уменьшается, хроматин начинает конденсироваться и ядро деформируется. На четвертой стадии ядро внедрившейся клетки значительно сжимается, клетка заметно уменьшается в размерах, ее содержимое деградирует. На пятой заключительной стадии внутри энтозной вакуоли выявляются полностью деградировавшие остатки внедрившейся клетки. В присутствии наночастиц TiO2 морфология клеток на разных стадиях энтоза была сходна с контролем (рис. 6).
Рис. 6.
Стадии энтоза I–V в контрольных клетках MCF-7 и в присутствие 10 мкг/мл АР75 на стадии II (II: АР75). Световая микроскопия, окрашивание гематоксилином и эозином. Э – энтозная клетка, В – внедрившаяся клетка. Стрелка указывает на наночастицы.
Подсчет числа энтозных клеток, находящихся на разных стадиях, показал (табл. 1), что в присутствии наночастиц TiO2 (А25 и АР75) в концентрации 1 мкг/мл уменьшалась доля клеток на начальных этапах энтоза, что может указывать на нарушение процесса внедрения. Кроме того, увеличивалась доля клеток на III стадии, что может указывать на замедление деградации внедрившейся клетки. Необходимо отметить, что энтоз является редким событием, что делает невозможным полноценную статистическую обработку данных. При более высоких концентрациях наночастиц TiO2 встречались единичные энтозы, что не позволило провести какой-либо анализ.
Таблица 1.
Частота встречаемости различных стадий энтоза в клетках MCF-7 в контроле и в присутствии 1 мкг/мл наночастиц TiO2 (А25 и АР75) в течение 3 сут
| Воздействие наночастиц |
Доля клеток на стадии энтоза, % | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Нет, контроль (n = 100) |
12 | 25 | 36 | 14 | 13 |
| A25 (n = 68) |
1.5 | 12 | 54.5 | 15 | 18 |
| АР75 (n = 86) |
3.5 | 10.5 | 50 | 22 | 14 |
Адгезивные контакты клеток в присутствии наночастиц TiO2. Падение энтотического индекса и уменьшение числа энтозов на I и II стадиях может указывать на нарушение процесса внедрения. По данным из литературы известно, что для успешного внедрения необходимо формирование адгезивных контактов между клетками (Overholtzer, Brugge, 2008; Sun et al., 2014). Для выявления влияния наночастиц TiO2 на протяженность адгезивных контактов, было проведено иммуноцитохимическое окрашивание β-катенина.
В контроле адгезивные контакты выявлялись по всей периферии контактирующих клеток и имели четкие границы (рис. 7б). В присутствии наночастиц TiO2 изменялся характер окрашивания антителами к β-катенину. В монослое клеток присутствовали участки, в которых окрашивание либо полностью отсутствовало, либо сохранялось на небольшом протяжении межклеточной границы (рис. 7в, г). Подобные нарушения были отмечены в присутствии наночастиц как А25, так и АР75, начиная с концентрации 1 мкг/мл. Для подтверждения данных имуноцитохимии была измерена длина адгезивных контактов. Как видно из приведенной на рис. 7а гистограммы, воздействие наночастиц TiO2 уменьшало протяженность межклеточных контактов, при этом наночастицы АР75 оказывали большее повреждающее действие, чем наночастицы А25 при тех же концентрациях.
Рис. 7.
Адгезивные контакты клеток MCF-7 в присутствии 10 мкг/мл наночастиц TiO2 (А25 или АР75). а – Изменение протяженности адгезивных контактов клеток при воздействии наночастиц в разной концентрации; по оси ординат – отношение протяженности P периметра клетки к протяженности межклеточного контакта L (P/L); указаны среднее значение и стандартное отклонение выборки (n = 90 и n = 50 соответственно в контроле и эксперименте); (*) – различия относительно контроля достоверны при р ≤ 0.05 (по t-критерию Стьюдента). б, в, г – Иммуноцитохимическое выявление β-катенина (зеленый сигнал); энтозы представлены в отдельных врезках, Э – энтозная клетка, В – внедрившаяся клетка, стрелка указывает на адгезивный контакт между энтозной и внедрившейся клетками; б – контроль, в, г, – воздействие 10 мкг/мл наночастиц TiO2 (А25 или АР75), ядра клеток докрашены DAPI (синий сигнал).
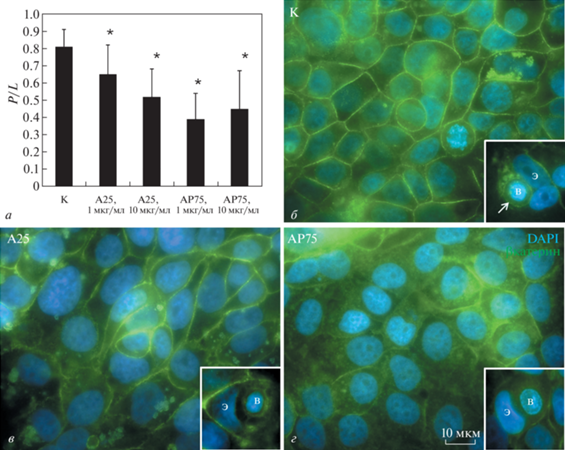
Анализ протяженности адгезивных контактов на I и II стадиях энтоза показал нарушение их формирования (рис. 7в, г, врезки) в присутствии наночастиц TiO2, в то время как в контроле адгезивные контакты на начальных стадиях энтоза выявляются на всем протяжении энтозной вакуоли (рис. 7б, врезка).
Распределение белка р53 при воздействии наночастиц TiO2 в клетках MCF-7. Белок р53 является одним из основных регуляторов клеточного цикла. При различных повреждениях клеток он перемещается в ядро и работает в качестве фактора транскрипции генов, вызывающих остановку клеточного цикла и активацию либо систем репарации, либо апоптотической гибели клетки (Чумаков, 2007). Так как воздействие наночастиц TiO2 вызывало уменьшение митотического индекса и возрастание апоптотического индекса, мы проанализировали распределение р53 в контроле и в присутствии наночастиц TiO2.
Иммуноцитохимическое окрашивание в контроле выявило небольшое количество слабо-флуоресцирующих ядер клеток (рис. 8б). При воздействии наночастиц А25 (10 мкг/мл) наблюдали увеличение доли ярко флуоресцирующих ядер (рис. 8в). В присутствии наночастиц АР75 (10 мкг/мл) картина распределения и интенсивности флуоресценции была сходна с контролем (рис. 8г).
Рис. 8.
Распределение белка р53 в ядрах клеток MCF-7 в контроле (К) и в присутствии 10 мкг/мл наночастиц TiO2 (А25 и АР75). а – Распределение клеток по интенсивности флуоресценции (ИФ, усл. ед.) антител против белка р53; показаны три группы клеток с ИФ 0–30, 30–60 и 60–90; указаны среднее значение и стандартное отклонение выборки; (*) – различие с К достоверно при р ≤ 0.05 (t-критерий Стьюдента). б, в, г – Иммуноцитохимическое выявление белка р53 (зеленый цвет) в клетках MCF-7, ядра клеток докрашены DAPI (синий сигнал).
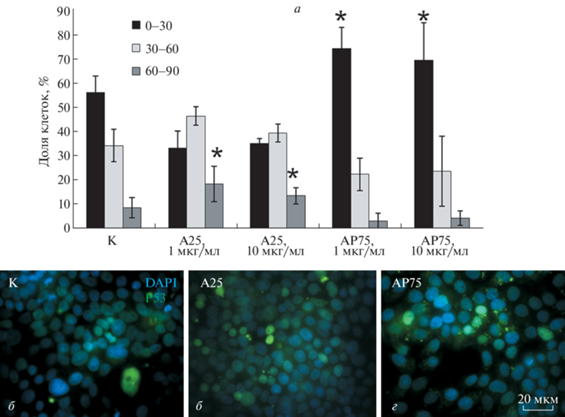
Измерение интенсивности флуоресценции ядер клеток показало, что в контроле чаще встречались слабо-флуоресцирующие ядра (рис. 8а). В присутствии АР75 увеличивалась доля слабо-флуоресцирующих ядер. В то же время при воздействии наночастиц А25 в концентрации 1 и 10 мкг/мл было обнаружено значительное увеличение доли ярко- и средне-флуоресцирующих ядер по сравнению с контролем (p ≤ ≤ 0.05 по t-критерию). Таким образом, только наночастицы А25 вызывают перемещение фактора транскрипции р53 в ядра клеток, что может приводить к остановке клеточного цикла и активации программы апоптоза.
В процессе энтоза р53 обнаруживается как в ядрах энтозных клеток, так и в ядрах внедрившихся клеток. В контроле меньше половины ядер энтозных клеток содержали р53 (12 из 34). Среди ядер внедрившихся клеток (на I, II и III стадиях), наоборот, преобладали р53-содержащие (16 из 25). В присутствии титановых наночастиц встречаются р53 положительные ядра как энтозных, так и внедрившихся клеток. В связи с небольшим количеством проанализированных клеток выделить какую-либо закономерность распределения р53 не представляется возможным (табл. 2).
Таблица 2.
Наличие белка р53 в ядрах энтозных (Э) и внедрившихся (В) клеток в присутствии наночастиц TiO2
| Наночастицы TiO2 | Э-клетки (I и II стадии) |
В-клетки | ||
|---|---|---|---|---|
| р53+ | р53− | р53+ | р53− | |
| Нет, контроль (n = 34) |
12 | 22 | 16 | 9 |
| А25, 1 мкг/мл (n = 5) |
4 | 1 | 3 | 1 |
| А25, 10 мкг/мл (n = 5) |
2 | 3 | 2 | 2 |
| АР75, 1 мкг/мл (n = 9) |
1 | 8 | 0 | 4 |
| АР75, 10 мкг/мл (n = 5) |
0 | 4 | 3 | 1 |
ОБСУЖДЕНИЕ
Проведенная работа показала, что в присутствии наночастиц TiO2 в культуре клеток МСФ7 происходит незначительное увеличение апоптотического индекса и падение митотического индекса. Начиная с концентрации 10 мкг/мл, апоптотический индекс превышает митотический, что приводит к замедлению роста культуры. Увеличение апоптотического идекса может быть опосредовано выходом поглощенных клеткой наночастиц из везикул эндосомного компартмента в цитозоль. Электронно-микроскопические данные подтверждает наличие наночастиц в цитозоле. Выход из эндосомного компартмента по данным из литературы может быть связан со способностью наночастиц TiO2 окислять липиды и нарушать целостность мембран (Sydor et al., 2020). По другим данным наночастицы TiO2 увеличивают рН внутри лизосомы, что приводит к разрыву мембраны в результате осмотического набухания лизосом (Frohlich, 2013). В дальнейшем такие наночастицы могут перемещаться в ядро, где они оказывают повреждающее воздействие на ДНК (Sayes et al., 2006).
Мы предполагаем, что свободно лежащие наночастицы, выявляемые нами на электронно-микроскопических изображениях, могут быть случайно захвачены в состав ядра при формировании ядерной оболочки в процессе митоза, или пассивно проходить через ядерные поры. Наночастицы анатаза обладают меньшими размерами (<25 нм) по сравнению с наночастицами анатаз-рутил (<75 нм), облегчающими их проникновение через ядерную пору, что может объяснять больший апоптотический индекс, наблюдаемый в нашем исследовании. Кроме того, перемещение р53 в ядра клеток также наблюдается именно в присутствии наночастиц анатаза.
В ядре р53 может активировать транскрипцию проапоптотических генов, вызывая увеличение апоптотического индекса, или генов ингибиторов клеточного цикла, что приводит к падению митотического индекса (Чумаков, 2007). Более крупные наночастицы АР75 возможно не способны проникать через ядерную пору и повреждать ДНК, поэтому мы не наблюдаем перемещения р53 в ядро. Тем не менее, в присутствии этих наночастиц также происходит увеличение апоптотического индекса и падение митотического индекса. Возможно, механизм активации апоптоза и замедления клеточного цикла в данном случае не связаны с работой р53. В целом первая часть работы показала, что частицы А25 обладают большей повреждающей способностью, чем АР75. Повышенное (по сравнению с контролем) накопление р53 в ядрах клеток при воздействии анатазных наночастиц может являться механизмом активации клеточной гибели.
Воздействие наночастиц TiO2, как А25, так и АР75, приводит к значительному уменьшению числа энтозов в клетках MCF-7. Наиболее вероятной причиной является нарушение начальных этапов внедрения клеток, о чем свидетельствует уменьшение числа энтозов, находящихся на I стадии. В литературе имеются данные, что наночастицы TiO2 связываются с внеклеточными доменами кадгеринов, вследствие чего кадгерины удаляются с мембраны путем эндоцитоза (Setyawati et al., 2013), и адгезивные контакты разрушаются. Таким образом, внедряющаяся клетка оказывается неспособной взаимодействовать с энтозной клеткой. Однако если рассматривать действие наночастиц TiO2 на опухолевую ткань в целом, то повреждение адгезивных контактов может приводить к нарушению контактов между клетками, усилению их подвижности и росту метастазирования.
Уменьшение числа энтозов может быть также связано с падением митотического индекса. Показано, что клетки, закончившие митоз, обладают повышенной способностью к внедрению (Кисурина-Евгеньева и др., 2018; Durgan et al., 2018). Так как TiO2 снижает митотическую активность клеток, число таких событий уменьшается.
Увеличение содержания в популяции энтозов на III стадии может указывать на замедление деградации внедрившейся клетки в присутствии наночастиц TiO2. Длительное сохранение энтозной вакуоли увеличивает вероятность вступления наружной клетки в митоз, проходящий с нарушением цитокинеза и заканчивающийся образованием полиплоидной клетки (Krajcovic et al., 2011). Снижение митотической активности в присутствии TiO2 может нивелировать этот эффект. При этом важную роль может играть р53, регулирующий прохождение клеток по клеточному циклу. Ранее нами было показано, что в культуре клеток MCF-7 фактор р53 обнаруживается чаще в ядрах энтозных и внедрившихся клеток, чем в культуре в целом. При этом позитивно окрашены были ядра у 26% энтозных клеток и у 22% внедрившихся клеток (Кисурина и др., 2018). В настоящей работе в контроле р53 чаще выявлялся в ядрах внедрившихся клеток, чем в ядрах энтозных клеток. Повышенная частота встречаемости р53-положительных ядер среди внедрившихся клеток может быть связана с тем, что (по последним данным из литературы) клетки с повреждениями ДНК чаще внедряются, инициируя процесс энтоза (Liang et al., 2021). В присутствии А25, по сравнению с АР75, чаще встречаются р53-положительные ядра как среди энтозных, так и среди внедрившихся клеток, что может указывать на повреждающий эффект этих наночастиц.
Таким образом, можно заключить, что воздействие наночастиц TiO2 на культуру опухолевых клеток молочной железы приводит к подавлению энтоза. Так как наличие энтозов может приводить к полиплоидизации клеток (Krajcovic et al., 2011), наночастицы TiO2 оказывают положительное влияние на генетическую стабильность в популяции. Кроме того, в присутствии наночастиц TiO2, замедляется пролиферация опухолевых клеток. В целом, полученные результаты демонстрируют, что наночастиц TiO2 могут быть использованы в адресной доставке химиотерапевтических препаратов.
Список литературы
Кисурина-Евгеньева О.П., Хашба Л.А., Савицкая М.А., Онищенко Г.Е. 2018. Энтоз и клеточный цикл в культуре опухолевых клеток. Цитология. Т. 60. № 9. С. 693. (Kisurina-Evgenieva O.P., Khashba L.A., Mamichev I.A., Savitskaya M.A., Onishchenko G.E. 2019. Entosis and cell cycle in tumor cell culture. Cell. Tissue Biol. V. 13. P. 8.). https://doi.org/10.1134/S1990519X19010073
Чумаков П.М. 2007. Белок р53 и его универсальные функции в многоклеточном организме. Успехи биол. химии. Т. 47. С. 3. (Chumakov P. M. 2007. Versatile functions of p53 protein in multicellular organisms. Biochemistry (Mosc). V. 72. № 13. P.1399.) https://doi.org/10.1134/s0006297907130019
Biola-Clier M., Gaillard J.-C., Rabilloud T., Armengaud J., Carriere M. 2020. Titanium dioxide nanoparticles alter the cellular phosphoproteome in A549 cells. Nanomaterials. V. 10. P. 185. https://doi.org/10.3390/nano10020185
Ding L., Li J., Huang R., Liu Z., Li C., Yao S., Wang J., Qi D., Li N., Pi J. 2016. Salvianolic acid B protects against myocardial damage caused by nanocarrier TiO2; and synergistic anti-breast carcinoma effect with curcumin via codelivery system of folic acid-targeted and polyethylene glycol-modified TiO2 nanoparticles. Int. J. Nanomedicine. V. 11. P. 5709. https://doi.org/10.2147/IJN.S107767
Durgan J., Tseng Y.Y., Hamann J.C., Domart M.C., Collinson L., Hall A., Overholtzer M., Florey O. 2017. Mitosis can drive cell cannibalism through entosis. Elife. V. 6. P. e27134. https://doi.org/10.7554/eLife.27134
Fage S.W., Muris J., Jakobsen S. S., Thyssen J.P. 2016. Titanium: a review on exposure, release, penetration, allergy, epidemiology, and clinical reactivity. Contact Dermatitis. V. 74. P. 323. https://doi.org/10.1111/cod.12565
Frohlich E. 2013. Cellular targets and mechanisms in the cytotoxic action of non-biodegradable engineered nanoparticles. Curr. Drug Metab. V. 14. P. 976. https://doi.org/10.2174/1389200211314090004
Garanina A.S., Kisurina-Evgenieva O.P., Erokhina M.V., Smirnova E.A., Factor V.M., Onishchenko G.E. 2017. Consecutive entosis stages in human substrate-dependent cultured cells. Sci. Rep. V. 7. P. 12555. https://doi.org/10.1038/s41598-017-12867-6
Hanot-Roy M., Tubeuf E., Guilbert A., Bado-Nilles A., Vigneron P., Trouiller B., Braun A., Lacroix G. 2016. Oxidative stress pathways involved in cytotoxicity and genotoxicity of titanium dioxide (TiO2) nanoparticles on cells constitutive of alveolo-capillary barrier in vitro. Toxicol. In Vitro. V. 33. P. 125. https://doi.org/10.1016/j.tiv.2016.01.013
Hurum D.C., Gray K.A., Rajh T., Thurnauer M.C. 2005. Recombination pathways in the degussa P25 formulation of TiO2: surface versus lattice mechanisms. J. Phys. Chem. V. 109. P. 977. https://doi.org/10.1021/jp045395d
Krajcovic M., Johnson N.B., Sun Q., Normand G., Hoover N., Yao E., Richardson A.L., King R.W., Cibas E.S., Schnitt S.J., Brugge J.S., Overholtzer M. 2011. A non-genetic route to aneuploidy in human cancers. Nat. Cell Biol. V. 13. P. 324. https://doi.org/10.1038/ncb2174
Krishna S., Overholtzer M. 2016. Mechanisms and consequences of entosis. Cell Mol. Life Sci. V. 73. P. 2379. https://doi.org/10.1007/s00018-016-2207-0
Lagopati N., Tsilibary E.-P., Falaras P., Papazafiri P., Pavlatou E.A., Kotsopoulou E., Kitsiou1 P. 2014. Effect of nanostructured TiO2 crystal phase on photoinduced apoptosis of breast cancer epithelial cells. Int. J. Nanomedicine. V. 9. P. 3219. https://doi.org/10.2147/IJN.S62972
Liang J., Niu Z., Zhang B., Yu X., Zheng Y., Wang C., Ren H., Wang M., Ruan B., Qin H., Zhang X., Gu S., Sai X., Tai Y., Gao L., et al. 2021. p53-dependent elimination of aneuploid mitotic offspring by entosis. Cell Death. Differ. V. 28. P. 799. https://doi.org/10.1038/s41418-020-00645-3
Overholtzer M., Brugge J.S. 2008. The cell biology of cell-in-cell structures. Nature Rev. Mol. Cell Biol. V. 9. P. 796. https://doi.org/10.1038/nrm2504
Overholtzer M., Mailleux A.A., Mouneimne G., Normand G., Schnitt S.J., King R.W., Cibas E.S., Brugge J.S. 2007. A nonapoptotic cell death process, entosis, that occurs by cell-in-cell invasion. Cell. V. 131. P. 966. https://doi.org/10.1016/j.cell.2007.10.040
Rossi E.M., Pylkkänen L., Koivisto A.J., Vippola M., Jensen K.A., Miettinen M., Sirola K., Nykäsenoja H., Karisola P., Stjernvall T., Vanhala E., Kiilunen M., Pasanen P., Mäkinen M., Hämeri K., et al. 2010. Airway exposure to silica-coated TiO2 nanoparticles induces pulmonary neutrophilia in mice. Toxicol. Sci. V. 113. P. 422. https://doi.org/10.1093/toxsci/kfp254
Sayes C.M., Wahi R., Kurian P.A., Liu Y., West J.L., Ausman K.D., Warheit D.B., Colvin V.L. 2006. Correlating nanoscale titania structure with toxicity: a cytotoxicity and inflammatory response study with human dermal fibroblasts and human lung epithelial cells. Toxicol. Sci. V. 92. P. 174. https://doi.org/10.1093/TOXSCI/KFJ197
Sayes C.M., Wahi R., Kurian P.A., Liu Y., West J.L., Ausman K.D., Warheit D.B., Colvin V.L. 2006. Correlating nanoscale titania structure with toxicity: a cytotoxicity and inflammatory response study with human dermal fibroblasts and human lung epithelial cells. Toxicol. Sci. V. 92. P. 174. https://doi.org/10.1093/toxsci/kfj197
Setyawati M.I., Tay C.Y., Chia S.L., Goh S.L., Fang W., Neo M.J., Chong H.C., Tan S. M., Loo S. C.J., Ng K.W., Xie J.P., Ong C.N., Tan N.S., Leong D.T. 2013. Titanium dioxide nanomaterials cause endothelial cell leakiness by disrupting the homophilic interaction of VE–cadherin. Nat. Commun. V. 4. P. 1673. https://doi.org/10.1038/ncomms2655
Sun Q., Cibas E.S., Huang H., Hodgson L., Overholtzer M. 2014. Induction of entosis by epithelial cadherin expression. Cell Res. V. 24. P. 1288. https://doi.org/10.1038/cr.2014.137
Sund J., Palomäki J., Ahonen N., Savolainen K., Alenius H., Puustinen A. 2014. Phagocytosis of nano-sized titanium dioxide triggers changes in protein acetylation. J. Proteomics. V. 108. P. 469. https://doi.org/10.1016/j.jprot.2014.06.011
Sydor M.J., Anderson D.S., Steele H.B.B., Ross J.B.A., Holian A. 2020. Effects of titanium dioxide and zinc oxide nano-materials on lipid order in model membranes. Biochim. Biophys. Acta Biomembr. V. 1862. P. 183313. https://doi.org/10.1016/j.bbamem.2020.183313
Trang N.T.K., Dong V.P., Hoon Y. 2021. Cellular effects of ultraviolet-radiated reduced-titanium dioxide nanoparticles on human hypopharyngeal adenocarcinoma cells. J. Nanosci. Nanotechnol. V. 21. P. 3656. https://doi.org/10.1166/jnn.2021.19172
Wang J., Zhou G., Chen C., Yu H., Wang T., Ma Y., Jia C., Gao Y., Li B., Sun J., Li Y., Fang Jiao, Zhao Y., Chai Z. 2007. Acute toxicity and biodistribution of different sized titanium dioxide particles in mice after oral administration. Toxicol. Lett. V. 168. P. 176. https://doi.org/10.1016/j.toxlet.2006.12.001
Wang Y., Cui H., Zhou J., Li F., Wang J., Chen M., Liu Q. 2015. Cytotoxicity, DNA damage, and apoptosis induced by titanium dioxide nanoparticles in human non-small cell lung cancer A549 cells. Environ. Sci. Pollut. Res. Int. V. 22. P. 5519. https://doi.org/10.1007/s11356-014-3717-7
Warheit D.B., Webb T.R., Sayes C.M., Colvin V.L., Reed K.L. 2006. Pulmonary instillation studies with nanoscale TiO2 rods and dots in rats: toxicity is not dependent upon particle size and surface area. Toxicol. Sci. V. 91. P. 227. https://doi.org/10.1093/toxsci/kfj140
Zeng L., Pan Y., Tian Y., Wang X., Ren W., Wang S., Lu G., Wu A. 2015. Doxorubicin-loaded NaYF 4: Yb/Tm–TiO2 inorganic photosensitizers for NIR-triggered photodynamic therapy and enhanced chemotherapy in drug-resistant breast cancers. Biomaterials. V. 57. P. 93. https://doi.org/10.1016/j.biomaterials.2015.04.006
Дополнительные материалы отсутствуют.


