Цитология, 2023, T. 65, № 3, стр. 259-272
ХАРАКТЕРИСТИКА КЛЕТОК МИКРОГЛИИ ЛИНИИ SIM-A9 – НОВЫЕ ДАННЫЕ
Д. А. Шапошникова 1, *, Е. Ю. Москалева 1, Ю. П. Сёмочкина 1, О. В. Высоцкая 1, О. В. Комова 2, Е. А. Насонова 2, И. В. Кошлань 2
1 НИЦ “Курчатовский институт”
123182 Москва, Россия
2 Объединенный институт ядерных исследований
141980 Дубна, Россия
* E-mail: dasha-shap13@mail.ru
Поступила в редакцию 15.11.2022
После доработки 03.12.2022
Принята к публикации 03.12.2022
- EDN: VDTYOW
- DOI: 10.31857/S0041377123030082
Аннотация
SIM-A9 – линия спонтанно иммортализованных клеток микроглии мыши, полученных из головного мозга новорожденных мышат линии С57BL/6. Цель настоящей работы – характеристика микроглии мыши линии SIM-A9 по соотношению клеток с фенотипом покоящейся и активированной микроглии в культуре, анализ экспрессии маркеров стволовых (прогениторных) клеток CD133 и нестина, рецепторов факторов роста CSF-1R и EGFR, а также анализ кариотипа этой линии. Использованы методы световой микроскопии, иммуноцитохимии в сочетании с проточной цитометрией и ОТ-ПЦР для анализа морфологии, фенотипа и уровня экспрессии генов провоспалительных цитокинов и метод mFISH для анализа кариотипа. Впервые показано, что клетки линии SIM-А9 экспрессируют высокий уровень белка TSPO, маркеров CD68, CD11b и CD45high на поверхностной мембране клеток, что соответствует фенотипу активированной микроглии. Несмотря на это, клетки линии отвечают дополнительной активацией в ответ на стимуляцию ЛПС, которая приводит к повышению экспрессии генов провоспалительных цитокинов IL-1β, TNFα, IL-6 и образованию высокого уровня активных метаболитов кислорода и азота. Показано, что клетки линии SIM-A9 экспрессируют маркеры стволовых и прогениторных клеток CD133+ и нестин, что позволяет рассматривать их как ранние низко дифференцированные прогениторные клетки, несмотря на их фенотип, соответствующий активированной микроглии. Обнаружено также, что клетки линии SIM-A9 экспрессируют рецепторы двух факторов роста CSF-1 и EGF – CSF-1R и EGFR, что свидетельствует о возможности стимуляции пролиферации клеток SIM-A9 по двум альтернативным механизмам под действием соответствующих факторов. У клеток SIM-A9 установлен гипотетраплоидный кариотип с большим числом структурных и количественных аномалий хромосом.
Клетки микроглии ЦНС человека и мыши образуются в период раннего эмбрионального развития из миелоидных клеток-предшественников костного мозга. Во взрослом организме пул микроглии поддерживается на постоянном уровне благодаря сбалансированным процессам пролиферации и гибели клеток путем апоптоза, и за время жизни организма микроглия обновляется целиком несколько раз (Askew et al., 2016). В процессе развития головного мозга эмбриона микроглия участвует в ремоделировании синапсов и регуляции ангиогенеза, во взрослом организме – в устранении неактивных нейронов и синапсов, в регуляции нейрогенеза, в ремоделировании сосудистой сети ЦНС (например, при инсульте), в развитии реакций клеточного иммунитета и воспаления (Eyo et al., 2013).
Таблица 1.
Антитела, использованные при иммуноцитохимическом окрашивании антигенов клеток линии SIM-A9
| Антиген:краситель | Описание антигена | Вид (изотип) |
Источник литературы |
|---|---|---|---|
| CD11b:PE | Мембранный белок, гликопротеин из надсемейства интегринов, продукт гена ITGAM, альфа-субъединица интегрина αMβ2 (MAC-1) | Крыса/IgG2b, κ | Jurga et al., 2020 |
| CD45:AlexaFluor488 | Пан-лейкоцитарный антиген; экспрессируется как на покоящейся (на низком уровне), так и на активированной (на высоком уровне) микроглии | Крыса/IgG2b, κ | Becher et al., 1996 |
| Iba1 | Внутриклеточный Са-связывающий белок, связанный с реорганизацией актина – белка цитоскелета микроглии | Кролик/IgG | Sasaki et al., 2001 |
| CD68:BV-421 | Скавенджер-рецептор; связывает окисленные липопротеины низкой плотности и участвует в элиминации дебриса, в фагоцитозе, в том числе миелина | Крыса/IgG2a, κ | Waller et al., 2019 |
| CD68:AlexaFluor488 | Крыса/IgG2a | ||
| PBR (TSPO 18кДа):AlexaFluor488 | Транслоказа наружной мембраны митохондрий с мол. массой 18 кДа; ранее белок был известен как рецептор бензодиазепинов. Представлен на активированной микроглии и, в меньшей мере, на активированных астроцитах | Крыса/IgG | Liu et al., 2014 |
| CD115:AlexaFluor647 | Рецептор макрофагального колониестимулирующего фактора – CSF-1R | Крыса/IgG2a,κ | Stanley et al., 2014 |
| TMEM119 | Трансмембранный белок 119, маркер микроглии | Кролик/IgG | Bennett et al., 2016 |
| CD133:PE | Проминин-1, трансмембранный гликопротеин, маркер стволовых клеток | Крыса/IgG2a, λ | Coskun et al., 2008 |
| Нестин | Белок промежуточных филаментов VI типа, маркер прогениторных клеток, ранее считался маркером нейрональных стволовых клеток | Курица/IgY | Bernal, et al., 2018 |
| EGFR:FITC | Рецептор эпидермального фактора роста | Мышь/IgG1 | Jones et al., 2014 |
| Иммуноглобулины кролика:AlexaFluor647 | Вторичные антитела козы к иммуноглобулинам кролика | Коза/IgG | – |
| Иммуноглобулины цыпленка:AlexaFluor568 | Вторичные антитела козы к иммуноглобулинам цыпленка | Коза/IgG | – |
В мозге микроглия может присутствовать в различных состояниях: выделяют покоящуюся и активированную микроглию. Клетки покоящейся микроглии имеют большое количество разветвленных отростков, экспрессируют маркеры CD11b, CD40, CD45low, CD80, CD86, F4/80, Iba1, ТМЕМ119, СCXCR3, CCR9, CSF-1R, C5aR. При активации клетки приобретают амебоидную или округлую форму и фенотип CD11b+/CD45high (Askew et al., 2016). В качестве еще одного маркера активированной микроглии и, в меньшей мере, активированных астроцитов, предлагают анализировать присутствие белка-транслоказы наружной мембраны митохондрий с молекулярной массой 18 кДа, получившего название TSPO (Bonsack et al., 2018). Активированные клетки микроглии секретируют активные формы азота (АФА) и кислорода (АФК), провоспалительные цитокины и хемокины, что приводит к развитию нейровоспаления и повреждению нейронов под действием факторов воспаления (Bachiller et al., 2018). Клетки активированной микроглии, кроме того, могут непосредственно повреждать нейроны с участием системы комплемента (Kalm et al., 2015). Хроническая активация микроглии под действием эндогенных факторов, сопровождающаяся длительным нейровоспалением, лежит в основе патогенеза многих нейродегенеративных заболеваний, включая болезнь Альцгеймера (Onyango et al., 2021).
В изучении ответа микроглии на действие разных стимулов и препаратов важную роль играет возможность использования культивируемых клеток. Описаны линии микроглии человека (HMO6) и мыши (EOC, HAPI, BV2, SIM-A9), полученные как при трансфекции определенных онкогенов (v-myc в случае HMO6, v-raf/v-myc в случае BV2), так и в результате спонтанной иммортализации (Blasi et al., 1990; Stansley et al., 2012; Nagamoto-Combs et al., 2014). Показано, что клетки этих линий сохраняли основные свойства первичной микроглии (Stansley et al., 2012; Nagamoto-Combs et al., 2014).
SIM-A9 – спонтанно иммортализованные клетки микроглии, получены из ткани коры головного мозга новорожденных мышат линии С57BL/6 и подробно охарактеризованы авторами (Nagamoto-Combs et al., 2014), которые показали, что эти клетки экспрессировали маркеры Iba1 и CD68, специфичные для макрофагов и микроглии; кроме того, они обладали фагоцитарной активностью, отвечали на стимуляцию липополисахаридом (ЛПС) и бета-амилоидом активацией сигнальных каскадов с участием тирозинпротеинкиназы и NFκB и секрецией TNFα, повышением активности индуцируемой синтазы оксида азота и циклооксигеназы-2. Стимуляция клеток IL-4 повышала уровень аргиназы-1. Таким образом, авторы показали, что клетки линии SIM-A9 способны отвечать на про- и противовоспалительные стимулы формированием фенотипа про- и противовоспалительной микроглии (Nagamoto-Combs et al., 2014). Эти свойства позволили рассматривать полученную линию SIM-A9 в качестве альтернативы первичной микроглии для исследования механизмов развития нейродегенеративных заболеваний и состояний, обусловленных развитием нейровоспаления, и изучения эффективности потенциальных терапевтических препаратов, способных регулировать про- и противовоспалительную активность микроглии. Однако кариотип полученной линии SIM-A9 изучен не был.
При анализе микроглии часто возникает необходимость оценивать соотношение покоящихся и активированных клеток. Линия SIM-A9 не была охарактеризована по этим параметрам, хотя высокий уровень CD68 и спонтанной секреции цитокина TNFα могут свидетельствовать о спонтанной активации части этих клеток. Кроме того, остается неисследованным вопрос об экспрессии маркеров стволовых (прогениторных клеток), таких как CD133 и нестин, и рецепторов таких ключевых факторов роста, как рецептор колониестимулирующего фактора-1 (CSF-1R) и рецептор эпидермального фактора роста EGF (EGFR).
CSF-1R (CD115) локализован на поверхностной мембране клеток и относится к семейству рецепторов факторов роста CSF-1/тромбоцитарный фактор роста. Он распознает лиганды CSF-1 и IL-34 – цитокины, которые контролируют пролиферацию клеток микроглии и макрофагов. Они связываются с внеклеточным доменом CSF-1R, индуцируют димеризацию рецептора и его аутофосфорилирование рецепторной тирозинпротеинкиназой по остаткам тирозина. Этот процесс приводит к каскаду внутриклеточных сигналов, которые регулируют пролиферацию, выживание и функции клеток-мишеней. Связывание CSF-1 с CSF-1R активирует такие сигнальные пути, как JAK–STAT, PI3K–AKT, ERK1/2 (Han et al., 2022).
EGFR, как и CSF-1R, является членом семейства тирозинкиназных рецепторов плазматической мембраны, которые контролируют такие важные функции, как рост, дифференцировку, апоптоз, адгезию и миграцию (Jones, Rappoport, 2014). EGFR представлен на многих типах клеткок в центральной и периферической нервной системе, связан с выполнением нейротрофических функций в ЦНС и участвует в регуляции активности глиальных клеток мозга (Douglas et al., 2009). В настоящее время этот рецептор привлекает большое внимание в качестве терапевтической мишени из-за его участия в активации микроглии (Yan et al., 2019; Mansour et al., 2022). Связывание EGFR с такими лигандами, как EGF и TNFα, вызывает активацию микроглии путем трансактивации митоген-активируемой протеинкиназы (MAPK) и других нижестоящих сигнальных путей (Fischer et al., 2006), а ингибирование сигнального пути EGFR–MAPK подавляет воспалительную реакцию микроглии и связанное с ней вторичное повреждение нейронов после повреждения спинного мозга (Qu et al., 2012).
В связи с вышесказанным цель настоящей работы состояла в характеристике микроглии мыши линии SIM-A9 по соотношению к клеткам с фенотипом покоящейся и активированной микроглии в культуре, анализ экспрессии маркеров стволовых (прогениторных) клеток CD133 и нестина, рецепторов факторов роста CSF-1R и EGFR и анализ кариотипа этой линии.
МАТЕРИАЛ И МЕТОДИКА
Материалы и реактивы. Культуральная среда DMEM/F12, сыворотка лошади, гентамицин (Gibco, США), фетальная сыворотка крупного рогатого скота (HyClone, США), сыворотка козы (Biosera, Франция), бычий сывороточный альбумин (Amresco, США), раствор Хенкса, фосфатно солевой буфер (ПанЭко, Россия), пластиковая культуральная посуда (Corning, США), ЭДТА и ЭГТА (AppliChem, Германия), Triton X-100 (Fluka, США), ЛПС (Sigma-Aldrich, США), MitoSox-Red и 6-карбокси-2',7'-дихлордигидрофлуоресцеин диацетат (carboxy-H2DCFDA, C400) (Molecular Probes, США), 4-амино-5-метиламино-2',7'-дифторфлуоресцеин диацетат (DAF-FM, Thermo Fisher Scientific, США), параформальдегид (Panreac, EC), реактивы ExtractRNA, qPCRmix-HS SYBR и синтез праймеров для ПЦР (Евроген, Россия).
Использовали следующие антитела: к CD11b:PE, CD45:AlexaFluor488, CD115:AlexaFluor647, к нестину (Biolegend, США), к Iba1 и TMEM119 (Abcam, Великобритания), CD68 (BD Biosciences, США), TSPO 18 кДа:AlexaFluor488, CD133:PE (Miltenyi Biotec, Германия), EGFR:FITC (BD Biosciences, США); вторичные антитела козы к IgG кролика:AlexaFluor647 (Molecular Probes, США), вторичные антитела козы к IgG цыпленка:AlexaFluor568 (Invitrogen, США).
Культивирование клеток SIM-A9. Клетки микроглии мыши линии SIM-A9 культивировали в среде DMEM/F12, содержащей 10% инактивированной фетальной сыворотки крупного рогатого скота, 5% инактивированной лошадиной сыворотки и 50 мкг/мл гентамицина, в пластиковых культуральных флаконах в СО2-инкубаторе при 37°С в увлажненной атмосфере, содержащей 5% СО2. Для пересева клетки линии SIM-A9 снимали с подложки с помощью фосфатного солевого буферного раствора (PBS), содержащего 1 ммоль/л ЭДТА, 1 ммоль/л ЭГТА и 1 мг/мл глюкозы. Пересев клеток проводили 2 раза в неделю по достижении 80–90% конфлюэнтности.
Активация клеток SIM-A9 введением ЛПС. Клетки микроглии SIM-A9 активировали ЛПС, полученным из Escherichia coli. Маточный раствор (1 мг/мл в PBS) хранили при −20°С; рабочий раствор готовили в среде для культивирования после его размораживания непосредственно перед экспериментом.
Определение активных форм кислорода и азота. Маточные растворы флуоресцентных красителей готовили в ДМСО: 20 ммоль/л 6-карбокси-2',7'-дихлордигидрофлуоресцеин диацетата (carboxy-H2DCFDA, C400) для окрашивания всех АФК, 5 ммоль/л 4-амино-5-метиламино-2',7'-дифторфлуоресцеин диацетата (DAF-FM) для определения АФА (NO) и 5 ммоль/л MitoSox-Red для выявления супероксиданиона. Рабочие растворы красителей готовили в растворе Хенкса. Для определения общего содержания АФК и АФА живые клетки окрашивали в течение 40 мин при 37°С, для определения супероксиданиона – 10 мин при 37°С. После окрашивания клетки отмывали в растворе PBS, осадок ресуспендировали в PBS и до измерений держали при 4°С. Флуоресценцию клеток анализировали на проточном цитофлуориметре BD FACSCalibur (BD Biosciences, США), оснащенном аргоновым лазером с длиной волны 488 нм и диодным красным лазером с длиной волны 635 нм (Ресурсный центр клеточной и молекулярной биологии, НИЦ “Курчатовский институт”) с использованием программного обеспечения “CellQuest™” (BD Biosciences, США). В каждом образце анализировали 10 тыс. клеток.
Фенотипирование клеток линии SIM-A9. Для окрашивания поверхностных белков CD11b, CD45 и CD68 клетки отмывали PBS и окрашивали прямыми антителами к данным антигенам (табл. 1 ) в течение 30 мин при 4°С. Далее клетки отмывали PBS, фиксировали в растворе 2%-ного параформальдегида в PBS 10 мин при комнатной температуре, отмывали и ресуспендировали в PBS. Фактор CSF-1R идентифицировали в фиксированных клетках при окрашивании в течение 30 мин при 4°С. При окрашивании клеток антителами к внутриклеточным белкам Iba1, CD68, TSPO и нестину (табл. 1 ) клетки отмывали от среды культивирования, фиксировали 2%-ным раствором параформальдегида 10 мин, отмывали, пермеабилизировали в течение 10 мин в PBS, содержащем 0.1% Тритона X-100 (Fluka, США) и 5% козьей сыворотки (Biosera, Франция) (при окрашивании Iba1, CD11b и нестина) или 1% бычьего сывороточного альбумина (в случае TSPO); затем добавляли антитела к белку Iba1 и к нестину и инкубировали 60 мин при комнатной температуре, далее отмывали от антител и инкубировали со вторичными антителами, конъюгированными с Alexa Fluor 647 для окрашивания Iba1 и с Alexa Fluor 568 для окрашивания нестина в течение 60 мин, после чего отмывали и ресуспендировали в PBS. Окрашивание клеток антителами к внутриклеточному белку CD68 производили прямыми антителами в течение 60 мин при комнатной температуре. Для оценки содержания белка TSPO клетки окрашивали прямыми антителами при комнатной температуре в течение 45 мин.
Антигены TMEM119, EGFR и CD133 идентифицировали на нефиксированных клетках SIM-A9. При анализе трансмембранного белка TMEM119 проводили непрямое окрашивание, а для определения белков EGFR и CD133 использовали прямые антитела. Все антитела использовали в разведении, рекомендованном фирмой-изготовителем. Флуоресценцию клеток анализировали на проточном цитофлуориметре BD FACSCalibur (BD Biosciences, США), оснащенном аргоновым лазером с длиной волны 488 нм и диодным красным лазером с длиной волны 635 нм (Ресурсный центр клеточной и молекулярной биологии, НИЦ “Курчатовский институт”) с использованием программного обеспечения “CellQuest™” (BD Biosciences, США). В каждом образце анализировали 10 тыс. клеток.
Анализ экспрессии мРНК генов цитокинов в клетках линии SIM-A9. Общую РНК из клеток выделяли фенол-хлороформенным методом, используя реактив ExtractRNA в соответствии с инструкцией изготовителя (Евроген, Россия). Анализ относительной экспрессии мРНК исследуемых генов проводили с помощью полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) как описано ранее (Москалева и др., 2022). Экспрессию мРНК генов цитокинов определяли методом ПЦР в режиме реального времени с использованием красителя SYBR Green I на амплификаторе CFX96 TouchTM (Bio-Rad, США). ПЦР проводили в реакционной смеси qPCRmix-HS SYBR с конечным объемом 25 мкл, в реакцию вносили 2 мкл реакционной смеси после ревертирования, содержащую кДНК и 7.5 пкмоль каждого из пары праймеров: mTNFα: прямой 5'-aaatggcctccctctcatc-3' и обратный 5'-tttgagatccatgccgttg-3'; mIL-1β: прямой 5'-acctgttctttgaagttgacg-3' и обратный 5'-gaaaagaaggtgctcatgtcc-3'; mIL-6: прямой 5'-gaggcttaattacacatgttc-3' и обратный 5'-aggcaaatttcctggttatatccagtt-3'; mGAPDH: прямой 5'-cagcctcgtcccgtagaca-3' и обратный 5'-ttcccgttgatgacaagcttc-3'.
Временной и температурный режим ПЦР для mIL-1β, mIL-4, mTGFβ и mGAPDH: 95°С – 15 с (первый шаг – 5 мин), 62°С – 20 с, 72°С – 40 с, 45 циклов ПЦР; для mTNFα: 95°С – 15 с (первый шаг – 5 мин), 54°С – 15 с, 72°С – 45 с, 45 циклов ПЦР. Измерение уровня флуоресценции проводили на каждом цикле при температуре 72°С. Результаты анализировали с использованием программы Bio-Rad CFX Manager 2.0. Уровень экспрессии мРНК генов mTNFα, mIL-1β и mIL-6 в клетках микроглии SIM-A9 измеряли относительно экспрессии конститутивного гена mGAPDH и выражали как 2–∆Сt, где ∆Ct = Ctцитокина − CtGAPDH, Ct − пороговый уровень флуоресценции, соответствующий номеру цикла ПЦР исследуемого образца, в котором флуоресценция отличается от фонового шума. Относительный уровень экспрессии генов в обработанных ЛПС клетках рассчитывали по отношению к среднему значению для контрольного образца, который принимали за единицу.
Анализ кариотипа клеток линии SIM-A9 с помощью метода многоцветной флуоресцентной гибридизации in situ (mFISH). Кариотип клеток анализировали, используя mFISH пробы 21XMouse (MetaSystems, Германия) для окраски полного генома. Окраску делящихся клеток на стадии метафазы проводили по методике производителя, хромосомы идентифицировали и анализировали с использованием программ ISIS/mFISH (MetaSystems, Германия), которые генерируют “псевдоцвета” на основании уникальных комбинаций 5 флуорохромов для идентификации каждой пары хромосом и структурных перестроек между ними. Структурные перестройки хромосом (аберрации – АХр) классифицировали по системе mPAINT (Cornforth, 2001). АХр делили на простые разрывы хромосом (ацетрики и укороченные), простые обмены, происходящие из двух разрывов в двух хромосомах (дицентрики, транслокации, кольца, хроматидные обмены) и комплексные аберрации, состоящие из трех и более разрывов в двух и более хромосомах. Для описания структурных и количественных аномалий хромосом было проанализировано 50 клеток SIM-A9 .
Статистическая обработка. Статистическую обработку результатов проводили по методу Стьюдента с использованием компьютерной программы “OriginPro”. Все данные представлены в виде средних значений и стандартной ошибки среднего. Различия считали статистически значимыми при p < 0.05.
Рис. 1.
Гистограммы прямого/бокового светорассеяния (СР) клеток микроглии мыши линии SIM-A9 (а) и уровня антигенов Iba1/CD68 (б) и CD11b/CD45 (в). Представлены данные проточной цитометрии с использованием соответствующих флуоресцентно меченных антител (Alexa, PE или Brilliant Violet). Приведены гистограммы одного из трех типичных экспериментов. ИФ – интенсивность флуоресценции здесь и на рис. 1–3, 6, 7.
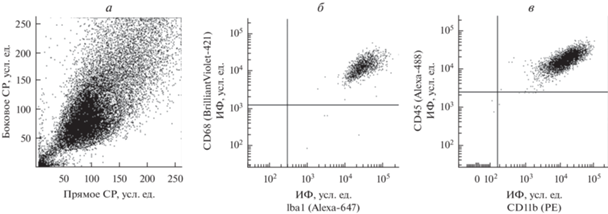
Рис. 2.
Гистограмма уровня белка СD68 на поверхностной мембране клеток SIM-A9. Горизонтальной линией отмечена субпопуляция окрашенных CD68+ клеток, цифрами указано их количество. Левый пик – аутофлуоресценция, правый – окрашенные клетки. Приведены данные одного из трех типичных экспериментов.
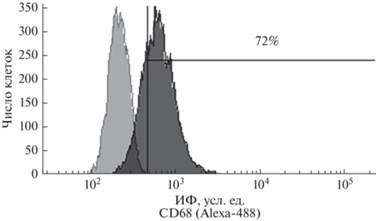
Рис. 3.
Гистограммы уровня маркеров TMEM119 (а) и TSPO (б) в клетках линии SIM-A9. Горизонтальной линией отмечена субпопуляция окрашенных на TMEM119 (а) и TSPO (б) клеток, цифрами указано их количество. Левый пик – аутофлуоресценция, правый – окрашенные клетки. Приведены данные одного из трех типичных экспериментов.
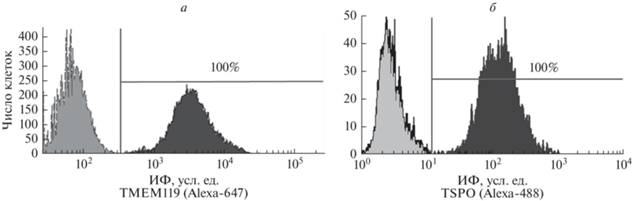
Рис. 4.
Микрофотографии культуры клеток линии SIM-A9 в контроле (а) и через 24 ч после активации ЛПС в концентрации 5 (б) и 500 (в) нг/мл. Фазовоконтрастная микроскопия. Цифрами указана доля клеток удлиненной формы с отростками (показаны стрелками). * – отличия доли клеток в культуре после действия ЛПС от контрольной культуры статистически значимы при p < 0.05. Увел. об.: 40×.
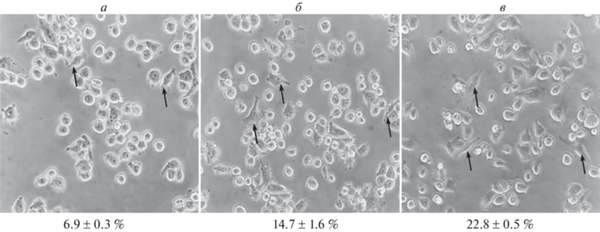
Рис. 5.
Уровень экспрессии мРНК генов TNFα (а), IL-1β (б) и IL-6 (в) в клетках микроглии линии SIM-A9 через 6 и 24 ч после стимуляции ЛПС в разной концентрации.
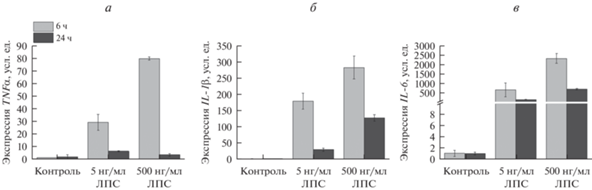
Рис. 6.
Уровень активных форм кислорода (а), митохондриального супероксиданиона (б) и оксида азота (в) в контрольных клетках SIM-A9 (левая колонка) и обработанных 500 нг/мл ЛПС (правая колонка). Гистограммы получены с помощью проточной цитометрии после окрашивания клеток с флуоресцентными витальными красителями.
Горизонтальными линиями отмечены субпопуляции окрашенных на соответствующий маркер клеток, цифрами указано их количество. Левый пик – аутофлуоресценция, правый – окрашенные клетки. Приведены данные одного из трех типичных экспериментов.
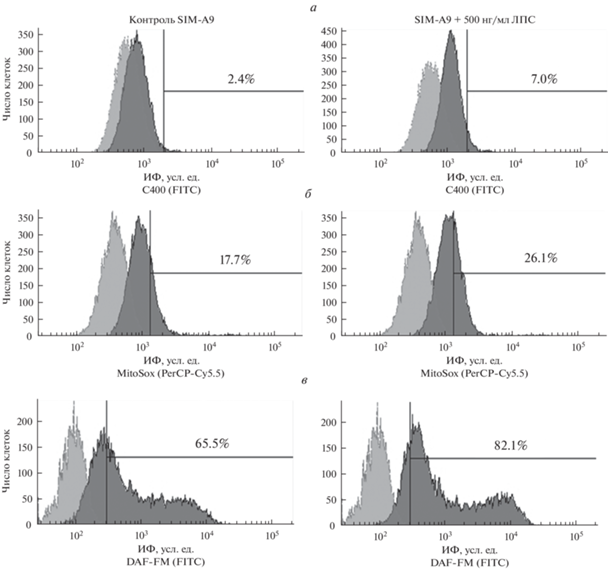
Рис. 7.
Уровень CD133 (а), нестина (б), рецепторов CSF-1R (в) и EGFR (г) в клетках микроглии линии SIM-A9. Проточная цитометрия после окрашивания клеток с использованием соответствующих антител, конъюгированных с флуоресцентной меткой (PE, APC или FITC). Горизонтальными линиями отмечены субпопуляции окрашенных на соответствующий маркер клеток, цифрами указано их количество. Левый пик – аутофлуоресценция, правый – окрашенные клетки. Приведены данные одного из трех типичных экспериментов.
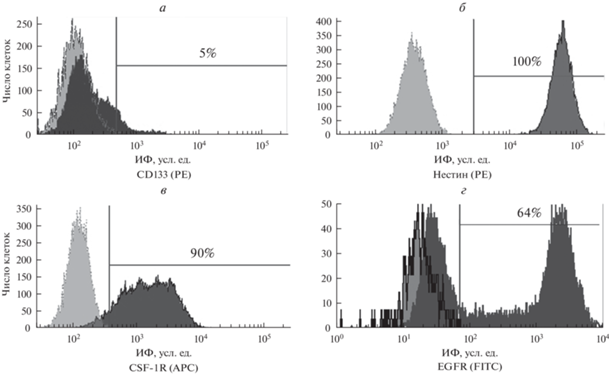
Рис. 8.
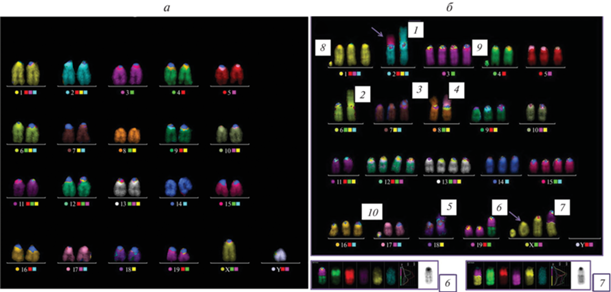
Кариотип 21XY нормальных клеток костного мозга мыши линии С57Bl/6 (а) и типичная кариограмма клеток SIM (б; в данном случае содержится всего 60 хромосом). б – Цифрами 1—10 отмечены маркерные хромосомы; 1, 2, 3, 4, 5 – слияния по центромере двух хромосом номер 2, 6, 8, хромосом 8 и 17 и двух хромосом 18 соответственно; цифры 6 и 7 – транслокации 19*–4–9 и 11*–X (* означает часть хромосомы, несущую центромеру); 8 и 9 – сильно укороченные хромосомы 1 и 4; 10 – отдельная центромера; стрелками показаны дополнительные спонтанные АХр: слияние по центромере хромосом 2 и 15 и укороченная Х-хромосома с ацентрическим фрагментом. На врезке внизу более детально представлены транслокации 6 и 7.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ экспрессии маркеров покоящейся и активированной микроглии в клетках линии SIM-A9. Ранее при иммуноцитохимическом окрашивании с использованием соответствующих антител и световой микроскопии (Nagamoto-Combs et al., 2014) было показано присутствие в клетках SIM-A9 внутриклеточных маркеров микроглии – белков Iba1 и CD68, которые экспрессируются как покоящимися, так и активированными клетками. Однако при этом наблюдали клетки с разной интенсивностью окрашивания этих антигенов. В то же время, высокий уровень экспрессии CD68 может свидетельствовать о присутствии в культуре активированных клеток микроглии.
Для анализа содержания покоящихся и активированных клеток в культуре микроглии SIM-A9 проводили их иммуноцитохимическое окрашивание флуоресцентно мечеными антителами к поверхностным маркерам CD11b и CD45 с последующей проточной цитометрией образцов. По данным светорассеяния показано, что культура представлена одной популяцией клеток (рис. 1а). При этом все клетки культуры экспрессировали не только молекулы Iba1 и CD68 (рис. 1б), но и CD11b и высокий уровень CD45 (рис. 1в), и имели, таким образом, фенотип CD11b/CD45high, что соответствует активированной микроглии.
CD68 – трансмембранный белок, уровень которого повышается при воспалении и при активации микроглии ЛПС и IFN-γ, что показано для клеток микроглии мыши линии BV-2 (Wong et al., 2005). Известно, что в процессе активации макрофагов происходит передислокация основного пула молекул CD68 из внутриклеточных компартментов на поверхностную мембрану клеток (Ramprasad et al., 1996).
При окрашивании антигена CD68 на поверхностной мембране непермеабилизированных клеток SIM-A9 этот маркер обнаружен на мембране 72% клеток (рис. 2), что также соответствует фенотипу активированной микроглии.
Для подтверждения и дополнения полученных результатов клетки линии SIM-A9 были охарактеризованы с использованием еще одного маркера микроглии, белка TMEM119, и маркера активированной микроглии (макрофагов) белка TSPO. TMEM119 – специфический маркер микроглии, и в настоящее время Tmem119 классифицируется как один из генов-маркеров фенотипа M0 микроглии мышей, который не экспрессируется нейральными клетками (Bohnert et al., 2020).
В отличие от TMEM119, белок-транслоказа TSPO, ранее известный как рецептор бензодиазепина, используется в качестве маркера активированной по провоспалительному пути микроглии при нейровоспалении (Pannell et al., 2020). При анализе этих маркеров обнаружено, что все клетки микроглии линии SIM-A9 экспрессируют белки TMEM119 и TSPO (рис. 3а, б соответственно), что соответствует активированной микроглии.
Таким образом, в результате проведенного исследования показан высокий уровень содержания таких маркеров активированной микроглии, как белок CD68 на поверхностной мембране клеток и внутриклеточный белок TSPO на наружной мембране митохондрий, а также соответствие клеток линии SIM-A9 фенотипу CD11b/CD45high. Эти данные позволяют однозначно констатировать, что интактные клетки этой линии имеют фенотип активированной микроглии.
Характеристика активации клеток микроглии SIM-A9 под действием ЛПС. ЛПС является классическим индуктором провоспалительной активации микроглии, которая сопровождается усилением фагоцитоза, повышением секреции провоспалительных цитокинов, хемокинов и АФК и АФА (Lively, Schlichter, 2018). В связи с тем, что ранее была показана активация клеток микроглии линии SIM-A9 под действием ЛПС (Nagamoto-Combs et al., 2014), на следующем этапе работы мы исследовали воздействие этого агента на морфологию клеток SIM-A9, экспрессию генов провоспалительных цитокинов и уровень содержания АФК и АФА. При анализе экспрессии ряда маркеров, упомянутых выше, в клетках микроглии SIM-A9 через 24 ч после обработки 5 нг/мл ЛПС активированные клетки имели такой же фенотип, как и контрольные (см. рис. 1, 3), то есть, 100% клеток, обработанных ЛПС, были положительными по маркерам CD68, Iba1, CD11b, CD45, TSPO и TMEM119 (данные не показаны). Таким образом, 24-часовое воздействие ЛПС на клетки SIM-A9 не изменяет их фенотип.
При исследовании морфологии клеток SIM-A9 после активации ЛПС показано, что клетки контрольной культуры, не подвергавшиеся воздействию данного агента, имеют преимущественно округлую форму и небольшое количество клеток удлиненной формы с отростками (рис. 4а). При культивировании клеток SIM-A9 в присутствии 5 и 500 нг/мл ЛПС доля клеток удлиненной формы с отростками возрастает за 24 ч до 14.7 ± 1.6 и 22.8 ± 0.5% соответственно против 6.9 ± 0.3% в контроле (рис. 4б, в). Таким образом, в присутствии ЛПС изменяется морфология части клеток линии SIM-A9, среди которых увеличивается доля удлиненных клеток с отростками.
Другие авторы ранее показали, что активация клеток SIM-A9 под действием 2.5 нг/мл ЛПС сопровождается увеличением секреции TNFα (Nagamoto-Combs et al., 2014). Мы провели исследование уровня экспрессии генов провоспалительных цитокинов в аналогичных условиях и показали, что ЛПС стимулирует повышение экспрессии мРНК генов провоспалительных цитокинов в клетках линии SIM-A9 (рис. 5а–в). Культивирование клеток в присутствии этого агента приводило к увеличению экспрессии мРНК mTNFα до 80 раз, mIL-1β – до 280 раз, mIL-6 – до 2000 раз через 6 ч после воздействия ЛПС в дозе 500 нг/мл. При действии ЛПС в концентрации 5 нг/мл также обнаружено усиление экспрессии цитокинов, но в меньшей степени.
Через 24 ч культивирования в присутствии ЛПС уровень экспрессии мРНК mTNFα, mIL-1β и mIL-6 снижался, но превышал уровень контроля в 20, 2.5 и 3 раза соответственно при концентрации ЛПС 500 нг/мл (рис. 5а–в). Аналогичное снижение экспрессии мРНК цитокинов через 24 ч наблюдали после добавления ЛПС в концентрации 5 нг/мл (рис. 5а–в).
Активация микроглии сопровождалась также и повышением продукции АФК и АФА. Так, показано (Nagamoto-Combs et al., 2014), что стимуляция клеток SIM-A9 ЛПС в дозе 2.5 нг/мл стимулирует продукцию оксида азота, активирует индуцибельную NO-синтазу и циклооксигеназу.
В настоящей работе мы исследовали способность клеток SIM-A9 отвечать на активацию ЛПС увеличением образования АФК и АФА при использовании красителей С400 (для анализа внутриклеточных АФК), MitoSox (для анализа митохондриального супероксид-аниона) и DAF-FM (для анализа оксида азота) с помощью проточной цитофлуориметрии. Полученные результаты представлены на рис. 6. Показано, что контрольные клетки характеризуются спонтанной продукцией АФК и АФА (рис. 6а–в). Активация клеток ЛПС приводила к увеличению образования всех исследованных метаболитов. Высокий уровень АФК и АФА, обнаруженный в контрольных клетках, коррелирует с фенотипом клеток SIM-A9, соответствующим активированной микроглии. При этом под воздействием ЛПС секреция этих метаболитов возрастала, что свидетельствует о дальнейшей функциональной активации клеток.
Генерация АФК и АФА происходит в норме в процессе жизнедеятельности клеток. Они имеют важное регуляторное значение: в зависимости от концентрации могут индуцировать или ингибировать процессы дифференцировки клеток, например, гемопоэтических и нейральных стволовых клеток, а также участвовать в регуляции апоптоза, синтеза цитокинов и влиять на пролиферацию этих клеток или индуцировать их гибель (Новиков и др., 2014). Поэтому можно полагать, что секреция АФК и АФА клетками микроглии, возрастающая при активации ЛПС, может оказывать воздействие на соседние клетки, эффект от которого будет зависеть от концентрации этих метаболитов.
Анализ экспрессии маркеров стволовых клеток и прогениторных клеток в культуре SIM-A9. Для определения количества стволовых клеток (СК), присутствующих в культуре SIM-A9, исследовали содержание CD133+-клеток. Трансмембранный гликопротеин CD133 – широко используемый маркер для идентификации СК из нормальных и опухолевых тканей. Показано (Prater et al., 2021), что CD133+-клетки из смешанной культуры коры головного мозга были способны продуцировать пул CD45+/CD11b+-микроглии in vitro и in vivo. При исследовании этого антигена в клетках линии SIM-A9 обнаружено, что размер субпопуляция клеток CD133+ составил 5.0 ± 1.1% (рис. 7а).
Присутствие клеток CD133+ в линии микроглии мыши позволяет полагать, что это СК, из которых образуются прогениторные активно пролиферирующие клетки микроглии.
Маркером СК, клеток-предшественников различных типов, в том числе нейронов, астроцитов и олигодендроцитов является нестин (Michalczyk et al., 2005). При исследовании содержания нестин+-клеток в культуре SIM-A9 показано, что 100% клеток линии экспрессируют этот маркер (рис. 7б). Это позволяет заключить, что культура клеток SIM-A9 представлена в основном прогениторными клетками.
Показано (Elmore et al., 2014; Huang et al., 2018), что восстановление пула резидентной микроглии в мозге мышей после ее истощения при действии ингибитора рецептора CSF-1 (препарата PLX5622) происходит в результате репопуляции и сопровождается появлением нестин+-клеток микроглии. При этом авторы убедительно доказали, что эти клетки происходят из сохранившихся после действия ингибитора клеток микроглии, а не из нестин+-нейральных СК, из которых образуются нейрональные клетки, астроциты и олигодендроциты. Действительно, нестин долгое время считался маркером только нейральных СК, из которых в процессе дифференцировки образуются нейроны, астроциты и олигодендроциты (Bernal, Arranz, 2018).
В настоящее время нестин обнаружен в культурах пролиферирующих СК разных типов и скорее является маркером пролиферирующих прогениторных клеток. Делящаяся микроглия мозга (Takamori et al., 2009; Askew et al., 2017) и сетчатки (Wohl et al., 2011) временно экспрессирует нестин во время репопуляции и развития воспалительной реакции. Известно, что фармакологические ингибиторы CSF-1R являются универсальным инструментом воздействия на пролиферацию микроглии (Green et al., 2020); ингибирование CSF-1R может снижать пролиферацию микроглии и модулировать ее фенотип при нейровоспалении, например, при прогрессирующем рассеянном склерозе (Hagan et al., 2020).
Специфичность таких ингибиторов не абсолютна. Так, показано (Lei et al., 2020), что PLX5622, наиболее эффективный из ингибиторов CSF-1R, влияет не только на микроглию, но также приводит к долговременным изменениям в миелоидных и лимфоидных компартментах костного мозга, селезенки и крови в результате подавления пролиферации соответствующих клеток-предшественников, экспрессирующих этот рецептор. Важно, что такие клеточные популяции, как правило, восстанавливаются после удаления агента, ингибирующего CSF-1R: в мозге репопуляция удаленной микроглии происходит в течение недели после прекращения действия ингибитора благодаря пролиферации сохранившихся клеток микроглии, которые экспрессируют нестин, а затем дифференцируются в микроглию, не содержащую нестин.
Таким образом, в клетках линии SIM-A9 обнаружено присутствие 5% CD133+-СК и высокий уровень экспрессии нестина во всех клетках. Это свидетельствует о том, что несмотря на фенотип активированных клеток микроглии, культура клеток линии SIM-A9 представлена низко дифференцированными прогениторными клетками микроглии.
Характеристика экспрессии рецепторов факторов роста на клетках микроглии линии SIM-A9. Пролиферация клеток микроглии может активироваться при связывании соответствующих лигандов с рецептором фактора CSF-1 (CSF-1R), CD115 и с рецептором фактора EGF (EGFR). Поэтому было проведено исследование присутствия этих рецепторов на поверхностной мембране клеток линии SIM-A9.
При анализе экспрессии CSF-1R в клетках линии SIM-A9 мы обнаружили, что доля CSF-1R+-клеток составляет 93.0 ± 2.4% популяции (рис. 7в).
Рецептор EGF вовлечен в регуляцию пролиферации клеток многих типов. Кроме того, показана его роль и в процессе активации и миграции первичной микроглии мыши (Coniglio et al., 2012). Для определения уровня экспрессии EGFR на поверхностной мембране клеток микроглии SIM-A9 было проведено окрашивание клеток антителами к этому антигену. В культуре обнаружено две субпопуляции клеток: часть клеток не имела, или имела очень низкий уровень этого антигена, а субпопуляция клеток EGFR+ составляла 62.0 ± 3.1% (рис. 7г).
Ранее EGFR был обнаружен и в клетках микроглии мыши линии BV-2. Активация этих клеток морфином приводила к пропорциональному дозе и времени увеличению уровня экспрессии CD11b, уровня фосфорилирования EGFR и протеинкиназы ERK1/2, миграции клеток и продукции цитокинов IL-1β и TNFα; активация миграции и продукции провоспалительных цитокинов ингибировалась при блокировании сигнального пути EGFR под действием низкомолекулярного ингибитора этого рецептора AG1478 (Qu et al., 2012, 2015; Yang et al., 2021). Таким образом, в настоящее время накапливаются убедительные доказательства того, что ингибирование сигнального пути EGFR/ERK может представлять новый способ подавления активации микроглии, и присутствие EGFR на клетках линии SIM-A9, показанное в настоящей работе, позволяет использовать эти клетки для исследования эффективности таких ингибиторов.
Полученные нами результаты позволяют предположить существование, помимо классического пути стимуляции пролиферации клеток микроглии линии SIM-A9 через рецептор CSF-1R, и альтернативного механизма, связанного с активацией рецептора EGFR.
Анализ кариотипа клеток линии SIM-A9. Использованный в данной работе для анализа кариотипа метод mFISH позволяет точно идентифицировать каждую пару хромосом и воссоздать кариотип линии. На рис. 8а представлен нормальный кариотип мыши линии С57Bl/6 (21, XY), полученный при исследовании клеток костного мозга. Спонтанные АХр отсутствуют.
Типичные кариограммы клеток линии SIM-A9 показаны на рис. 8б. При цитогенетическом анализе клеток этой линии обнаружен сильно измененный кариотип с большим числом транслокаций и других перестроек хромосом, а также количественных аномалий. Обнаружен относительно стабильный гипотетраплоидный женский мышиный кариотип: число хромосом на метафазу варьировало от 50 до 61, выявлено около 12 постоянных маркерных аномалий, таких как слияние хромосом по центромере (рис. 8б, хромосомы 1–5), транслокации (рис. 8б, хромосомы 6–7), включая комплексную мультитранслокацию (рис. 8б, см. цифру 6), возможно присутствие ацетрических мелких фрагментов или очень сильно редуцированных хромосом (рис. 8б, хромосомы 8–9), и отдельно лежащих центромер (рис. 8б, см. цифру 10). Число копий хромосом варьировало от 2 до 5. Более того, свыше 95% клеток имели неклональные структурные АХр, такие как хромосомные и хроматидные разрывы, транслокации и дицентрики (стрелки на рис. 8б).
В связи с тем, что все клетки линии SIM-A9 имеют структурные и количественные аномалии (такие как потеря и “лишние” копии хромосомы) и АХр, мы констатируем высокую хромосомную нестабильность линии. Значительные спонтанные хромосомные нарушения, выявленные в клетках линии SIM-A9, сходны с таковыми большинства иммортализованных клеточных линий и линий опухолевых клеток.
Итак, совокупность полученных результатов позволяет сделать следующее заключение. В настоящей работе впервые показано, что клетки линии SIM-А9 экспрессируют высокий уровень белка TSPO, маркеров CD68 и CD11b/CD45high на поверхностной мембране клеток, что соответствует признакам активированной микроглии. Несмотря на это, клетки этой линии отвечают дополнительной активацией в ответ на стимуляцию ЛПС, которая приводит к повышению экспрессии генов провоспалительных цитокинов IL-1β, TNFα, IL-6 и образованию высокого уровня АФК и АФА. Клетки линии SIM-A9 экспрессируют маркеры стволовых и прогениторных клеток CD133+ и нестин, что позволяет рассматривать клетки этой линии как ранние низко дифференцированные прогениторные клетки, несмотря на их фенотип, соответствующий активированной микроглии. Клетки линии SIM-A9 экспрессируют рецепторы двух факторов роста CSF-1 и EGF – CSF-1R и EGFR, что свидетельствует о возможности стимуляции пролиферации клеток SIM-A9 по двум альтернативным механизмам под действием соответствующих факторов. Кариотип клеток SIM-A9 характеризуется хромосомной нестабильностью, свойственной всем иммортализованным и опухолевым линиям. Выявленные структурные и количественные аномалии хромосом могут определять фенотипические и функциональные особенности этой линии.
Таким образом, полученные данные позволяют рассматривать линию SIM-A9 в качестве альтернативы первичной микроглии для исследования механизмов развития нейродегенеративных заболеваний и состояний, обусловленных развитием нейровоспаления и изучения эффективности потенциальных терапевтических препаратов, способных регулировать про- и противовоспалительную активность микроглии.
Список литературы
Москалева Е.Ю., Родина А.В., Семочкина Ю.П., Высоцкая О.В. 2022. Анализ маркеров окислительного повреждения нейронов и нейровоспаления в отдаленный период после γ-облучения головы мышей в разных дозах Радиационная биология. Радиоэкология. Т. 62 № 2. С. 171. (Moskaleva E.Yu., Rodina A.V., Semochkina Ju.P., Vysotskaya O.V. 2022. Analysis of neurons damage and level of neuroinflammation late after γ-irradiation of mice head at different doses. Radiacionnaja biologija. Radioekologija. V. 62 № 2. Р. 171.) https://doi.org/10.31857/S0869803122020059
Новиков В.Е., Левченкова О.С., Пожилова Е.В. 2014. Роль активных форм кислорода в физиологии и патологии клетки и их фармакологическая регуляция. Обзоры по клинической фармакологии и лекарственной терапии. Т. 12. № 4. С. 13. (Novikov V.E., Levchenkova O.S., Pozhilova Y.V. 2014. Role of reactive oxygen species in cell physiology and pathology and their pharmacological regulation. Rev. Clin. Pharmacol. Drug Ther. Vol. 12. № 4. P. 13.) https://doi.org/10.17816/RCF12413-21
Askew K., Li K., Olmos-Alonso A., Garcia-Moreno F., Liang Y., Richardson P., Tipton T., Chapman M.A., Riecken K., Beccari S., Sierra A., Molnár Z., Cragg M.S., Garaschuk O., Perry V.H., Gomez-Nicola D. 2017. Coupled proliferation and apoptosis maintain the rapid turnover of microglia in the adult brain. Cell Rep. V. 18. P. 391. https://doi.org/10.1016/j.celrep.2016.12.041
Bachiller S., Jiménez-Ferrer I., Paulus A., Yang Y., Swanberg M., Deierborg T., Boza-Serrano A. 2018. Microglia in neurological diseases: a road map to brain-disease dependent-inflammatory response. Front. Cell Neurosci. V. 12. P. 488. https://doi.org/10.3389/fncel.2018.00488
Becher B., Antel J.P. 1996. Comparison of phenotypic and functional properties of immediately ex vivo and cultured human adult microglia. Glia. V. 18. P. 1. https://doi.org/10.1002/(SICI)1098-1136(199609)18:1<1::AID-GLIA1>3.0.CO;2-6
Bennett M.L., Bennett F.C., Liddelow S.A., Ajami B., Zamanian J.L., Fernhoff N.B., Mulinyawe S.B., Bohlen C.J., Adil A., Tucker A., Weissman I.L., Chang E.F., Li G., Grant G.A., Hayden Gephart M.G., Barres B.A. 2016. New tools for studying microglia in the mouse and human CNS. Proc. Natl. Acad. Sci. USA. V. 113. P. 1738. https://doi.org/10.1073/pnas.1525528113
Bernal A., Arranz L. 2018. Nestin-expressing progenitor cells: function, identity and therapeutic implications. Cell. Mol. Life Sci. V. 75. P. 2177. https://doi.org/10.1007/s00018-018-2794-z
Blasi E., Barluzzi R., Bocchini V., Mazzolla R., Bistoni F. 1990. Immortalization of murine microglial cells by a v-raf/v-myc carrying retrovirus. J. Neuroimmunol. V. 27. P. 229. https://doi.org/10.1016/0165-5728(90)90073-V
Bohnert S., Seiffert A., Trella S., Bohnert M., Distel L., Ondruschka B., Monoranu C.M. 2020. TMEM119 as a specific marker of microglia reaction in traumatic brain injury in postmortem examination. Int. J. Legal Med. V. 134. P. 2167. https://doi.org/10.1007/s00414-020-02384-z
Bonsack F., Sukumari-Ramesh S. 2018. TSPO: an evolutionarily conserved protein with elusive functions. Int. J. Mol. Sci. V. 19. P. 1694. https://doi.org/10.3390/ijms19061694
Cornforth M.N. 2001. Analyzing radiation-induced complex chromosome rearrangements by combinatorial painting. Radiat. Res. V. 155. P. 643. https://doi.org/10.1007/978-1-4939-9432-8_15
Coniglio S.J., Eugenin E., Dobrenis K., Stanley E.R., West B.L., Symons M.H., Segall J.E. 2012. Microglial stimulation of glioblastoma invasion involves epidermal growth factor receptor (EGFR) and colony stimulating factor 1 receptor (CSF-1R) signaling. Mol. Med. V. 18. P. 519. https://doi.org/10.2119/molmed.2011.00217
Coskun V., Wu H., Blanchi B., Tsao S., Kim K., Zhao J., Biancotti J.C., Hutnick L., Krueger R.C. Jr., Fan G., de Vellis J., Sun Y.E. 2008. CD133+ neural stem cells in the ependyma of mammalian postnatal forebrain. Proc. Natl. Acad. Sci. USA. V. 105. P. 1026. https://doi.org/10.1073/pnas.0710000105
Douglas M.R., Morrison K.C., Jacques S.J., Leadbeater W.E., Gonzalez A.M., Berry M., Logan A., Ahmed Z. 2009. Off-target effects of epidermal growth factor receptor antagonists mediate retinal ganglion cell disinhibited axon growth. Brain. V. 132. P. 3102. https://doi.org/10.1093/brain/awp240
Elmore M.R., Najafi A.R., Koike M.A., Dagher N.N., Spangenberg E.E., Rice R.A., Kitazawa M., Matusow B., Nguyen H., West B.L., Green K.N. 2014. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain. Neuron. V. 82. P. 380. https://doi.org/10.1016/j.neuron.2014.02.040
Eyo U.B., Dailey M.E. Microglia: key elements in neural development, plasticity, and pathology. 2013. J. Neuroimmune Pharmacol. V. 8. P. 494. https://doi.org/10.1007/s11481-013-9434-z
Fischer O.M., Hart S., Ullrich A. 2006. Dissecting the epidermal growth factor receptor signal transactivation pathway. Methods Mol. Biol. V. 327. P. 85. https://doi.org/10.1385/1-59745-012-X:85
Green K.N., Crapser J.D., Hohsfield L.A. 2020. To kill a microglia: A case for CSF1R inhibitors. Trends Immunol. V. 41. P. 771. https://doi.org/10.1016/j.it.2020.07.001
Hagan N., Kane J.L., Grover D., Woodworth L., Madore C., Saleh J., Sancho J., Liu J., Li Y., Proto J., Zelic M., Mahan A., Kothe M., Scholte A.A., Fitzgerald M. 2020. CSF1R signaling is a regulator of pathogenesis in progressive MS. Cell Death Dis. V. 11. P. 904. https://doi.org/10.1038/s41419-020-03084-7
Han J., Chitu V., Stanley E.R., Wszolek Z.K., Karrenbauer V.D., Harris R.A. 2022. Inhibition of colony stimulating factor-1 receptor (CSF-1R) as a potential therapeutic strategy for neurodegenerative diseases: opportunities and challenges. Cell. Mol. Life Sci. V. 79. P. 219. https://doi.org/10.1007/s00018-022-04225-1
Huang Y., Xu Z., Xiong S. 2018. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nat. Neurosci. V. 21. P. 530. https://doi.org/10.1038/s41593-018-0090-8
Jenkins S.J., Ruckerl D., Thomas G.D., Hewitson J.P., Duncan S., Brombacher F., Maizels R.M., Hume D.A., Allen J.E. 2013. IL-4 directly signals tissue-resident macrophages to proliferate beyond homeostatic levels controlled by CSF-1. J. Exper. Med. V. 210. P. 2477. https://doi.org/10.1084/jem.20121999
Jones S., Rappoport J.Z. 2014. Interdependent epidermal growth factor receptor signalling and trafficking. Int. J. Biochem. Cell. Biol. V. 51. P. 23. https://doi.org/10.1016/j.biocel.2014.03.014
Jurga A.M., Paleczna M., Kuter K.Z. 2020. Overview of general and discriminating markers of differential microglia phenotypes. Front. Cell Neurosci. V. 14. P. 198. https://doi.org/10.3389/fncel.2020.00198
Kalm M., Andreasson U., Björk-Eriksson T., Zetterberg H., Pekny M., Blennow K., Pekna M., Blomgren K. 2016. C3 deficiency ameliorates the negative effects of irradiation of the young brain on hippocampal development and learning. Oncotarget. V. 7. P. 19382. https://doi.org/10.18632/oncotarget.8400
Lei F., Cui N., Zhou C., Chodosh J., Vavvas D.G., Paschalis E.I. 2020. CSF1R inhibition by a small-molecule inhibitor is not microglia specific; affecting hematopoiesis and the function of macrophages. Proc. Natl. Acad. Sci. USA. V. 22. P. 23336. https://doi.org/10.1073/pnas.1922788117
Lively S., Schlichter L.C. 2018. Microglia responses to pro-inflammatory stimuli (LPS, IFNγ + TNFα) and reprogramming by resolving cytokines (IL-4, IL-10). Front. Cell Neurosci. V. 12. P. 215. https://doi.org/10.3389/fncel.2018.00215
Liu G.J., Middleton R.J., Hatty C.R., Kam W.W., Chan R., Pham T., Harrison-Brown M., Dodson E., Veale K., Banati R.B. 2014. The 18 kDa translocator protein, microglia and neuroinflammation. Brain Pathol. V. 24. P. 631. https://doi.org/10.1111/bpa.12196
Mansour H.M., Fawzy H.M., El-Khatib A.S., Khattab M.M. 2022. Repurposed anti-cancer epidermal growth factor receptor inhibitors: mechanisms of neuroprotective effects in Alzheimer’s disease. Neural Regen. Res. V. 17. P. 1913. https://doi.org/10.4103/1673-5374.332132
Michalczyk K., Ziman M. 2005. Nestin structure and predicted function in cellular cytoskeletal organisation. Histol. Histopathol. V. 20. P. 665. https://doi.org/10.14670/HH-20.665
Muñoz-Garcia J., Cochonneau D., Télétchéa S., Moranton E., Lanoe D., Brion R., Lézot F., Heymann M.F., Heymann D. 2021. The twin cytokines interleukin-34 and CSF-1: masterful conductors of macrophage homeostasis. Theranostics. V. 11. P. 1568. https://doi.org/10.7150/thno.50683
Nagamoto-Combs K., Kulas J., Combs C.K. 2014. A novel cell line from spontaneously immortalized murine microglia. J. Neurosci. Methods. V. 15. P. 187. https://doi.org/10.1016/j.jneumeth.2014.05.021
Onyango I.G., Jauregui G.V., Čarná M., Bennett J.P. Jr., Stokin G.B. 2021. Neuroinflammation in Alzheimer’s Disease. Biomedicines. V. 9. P. 524. https://doi.org/10.3390/biomedicines9050524
Pannell M., Economopoulos V., Wilson T.C., Kersemans V., Isenegger P.G., Larkin J.R., Smart S., Gilchrist S., Gouverneur V., Sibson N.R. 2020. Imaging of translocator protein upregulation is selective for pro-inflammatory polarized astrocytes and microglia. Glia. V. 68. P. 280. https://doi.org/10.1002/glia.23716
Prater K.E., Aloi M.S., Pathan J.L., Winston C.N., Chernoff R.A., Davidson S., Sadgrove M., McDonough A., Zierath D., Su W., Weinstein J.R., Garden G.A. 2021. A Subpopulation of microglia generated in the adult mouse brain originates from Prominin-1-expressing progenitors. J. Neurosci. V. 41. P. 7942. https://doi.org/10.1523/JNEUROSCI.1893-20.2021
Qu W.S., Liu J.L., Li C.Y., Li X., Xie M.J., Wang W., Tian D.S. 2015. Rapidly activated epidermal growth factor receptor mediates lipopolysaccharide-triggered migration of microglia. Neurochem. Int. V. 90. P. 85. https://doi.org/10.1016/j.neuint.2015.07.007
Qu W.S., Tian D.S., Guo Z.B., Fang J., Zhang Q., Yu Z.Y., Xie M.J., Zhang H.Q., Lü J.G., Wang W. 2012. Inhibition of EGFR/MAPK signaling reduces microglial inflammatory response and the associated secondary damage in rats after spinal cord injury. J. Neuroinflammation. V. 9. P. 178. https://doi.org/10.1186/1742-2094-9-178
Ramprasad M.P., Terpstra V., Kondratenko N., Quehenberger O., Steinberg D. 1996. Cell surface expression of mouse macrosialin and human CD68 and their role as macrophage receptors for oxidized low density lipoprotein. Proc. Natl. Acad. Sci. USA. V. 93. P. 14833. https://doi.org/10.1073/pnas.93.25.14833
Sasaki Y., Ohsawa K., Kanazawa H., Kohsaka S., Imai Y. 2001. Iba1 is an actin-cross-linking protein in macrophages/microglia. Biochem. Biophys. Res. Commun. V. 286. P. 292. https://doi.org/10.1006/bbrc.2001.5388
Stanley E.R., Chitu V. 2014. CSF-1 receptor signaling in myeloid cells. Cold Spring Harb. Perspect Biol. V. 6. P. a021857. https://doi.org/10.1101/cshperspect.a021857
Stansley B., Post J., Hensley K. 2012. A comparative review of cell culture systems for the study of microglial biology in Alzheimer’s disease. J. Neuroinflammation. V. 9. P. 115. https://doi.org/10.1186/1742-2094-9-115
Takamori Y., Mori T., Wakabayashi T., Nagasaka Y., Matsuzaki T., Yamada H. 2009. Nestin-positive microglia in adult rat cerebral cortex. Brain Res. V. 1270. P. 10. https://doi.org/10.1016/j.brainres.2009.03.014
Waller R., Baxter L., Fillingham D.J., Coelho S., Pozo J.M., Mozumder M., Frangi A.F., Ince P.G., Simpson J.E., Highley J.R. 2019. Iba-1-/CD68+ microglia are a prominent feature of age-associated deep subcortical white matter lesions. PLoS One. V. 25. P. e0210888. https://doi.org/10.1371/journal.pone.0210888
Wohl S.G., Schmeer C.W., Friese T., Witte O.W., Isenmann S. 2011. In situ dividing and phagocytosing retinal microglia express nestin, vimentin, and NG2 in vivo. PLoS One. V. 6. P. e22408. https://doi.org/10.1371/journal.pone.0022408
Wong A.M., Patel N.V., Patel N.K., Wei M., Morgan T.E., de Beer M.C., de Villiers W.J., Finch C.E. 2005. Macrosialin increases during normal brain aging are attenuated by caloric restriction. Neurosci. Lett. V. 390. P. 76. https://doi.org/10.1016/j.neulet.2005.07.058
Yan P., Wu X., Liu X., Cai Y., Shao C., Zhu G. 2019. A Causal relationship in spinal cord injury rat model between microglia activation and EGFR/MAPK detected by overexpression of microRNA-325-3p. J. Mol. Neurosci. V. 68. P. 181. https://doi.org/10.1007/s12031-019-01297-w
Yang Y., Sun Y., Hu R., Yan J., Wang Z., Li W., Jiang H. 2021. Morphine promotes microglial activation by upregulating the EGFR/ERK signaling pathway. PLoS One. V. 16 P. e0256870. https://doi.org/10.1371/journal.pone.0256870
Дополнительные материалы отсутствуют.


