Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 491, № 1, стр. 59-63
МНОГОУРОВНЕВАЯ ФЛУКТУАЦИОННАЯ ДИНАМИКА ПОЛИМЕРНЫХ ГЕЛЕЙ
В. Л. Кононенко 1, *, Л. В. Юрина 1, М. А. Розенфельд 1
1 Федеральное государственное бюджетное учреждение науки Институт биохимической физики
им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: vlkononenko@gmail.com
Поступила в редакцию 19.12.2019
После доработки 08.04.2020
Принята к публикации 11.04.2020
Аннотация
В рамках единого экспериментального подхода при изучении динамического рассеяния света в гелях полиакриламида и фибрина впервые исследована флуктуационная динамика полимерных гелей параллельно на двух уровнях – соразмерном масштабу полимерной сетки геля и микроскопическом в этом масштабе. Обнаружены длиннопериодные флуктуации структуры сетки с характерными временами в диапазоне ∼10–70 мин, в ходе которых микродинамика полимерных нитей сетки в масштабе времени 0.1–106 мкс остается практически неизменной. Установлены пределы применимости приближения «замороженных» неоднородностей структуры, широко используемого при изучении микродинамики гелей. Развитый подход может стать основой для расширения круга исследований динамики полимерных гелей.
Анализ исследований и разработок в области “мягкой материи” позволяет заключить, что изделия и технологии широкого спектра применений, основанные на использовании гелевых систем, станут одной из основ техносферы и быта уже в ближайшем будущем [1]. Это обусловливает необходимость фундаментальных исследований гелевых структур. Одним из важнейших направлений является изучение флуктуационной динамики (ФД) гелей, в том числе, полимерных гелей (ПГ).
Определяющей особенностью ПГ является наличие нескольких уровней пространственной организации, принципиально различающихся по масштабу, структуре и механике. Это обусловливает соответствующую иерархию флуктуационной динамики ПГ. В масштабе собственной структуры (∼0.5–20 мкм), ПГ представляет собой нерегулярную трехмерную сетку из полимерных нитей разной геометрии и разной степени связанности в точках пересечений. На микроскопическом (в этом масштабе) уровне ∼1–100 нм ФД ПГ обусловлена тепловым возбуждением колебаний индивидуальных нитей сетки, а также коллективных колебаний сетки, сходных с фононными модами в неупорядоченных твердых телах. Установлено, что микродинамика ПГ формально подобна динамике многокомпонентной системы броуновских частиц в вязкой жидкости [2–4]. При этом ряд особенностей микродинамики ПГ зависит от строения и от специфики силовых взаимодействий структурных элементов конкретного геля, что позволяет использовать ФД в целях диагностики [3, 5].
Естественно полагать, что на уровне собственной структуры геля соответствующая динамика отражает процессы перестроек и флуктуаций геометрии и структуры сетки. В отличие от микродинамики ПГ, указанная динамика изучена слабо, поскольку при изучении микродинамики обычно используется концепция “замороженных” неоднородностей концентрации, иными словами, трехмерной структуры геля [3, 5]. Такое приближение адекватно лишь для ограниченных интервалов времени. Их длительность зависит от специфики структуры и определяющих взаимодействий гелевой сетки, поэтому может сильно варьировать среди гелей разной природы.
Так, особый класс ПГ составляют биогели, типичными представителями которых являются гели фибрина (ФГ) [6]. Определяющей структурно-механической особенностью ФГ является гиперэластичность трехмерной фибриновой сетки: она обратимо выдерживает почти трехкратное удлинение [6]. Другой существенной особенностью биогелей являются, в ряде случаев, функционально обусловленные флуктуации структуры сетки во времени. Этого же можно ожидать и для гелей, разрабатываемых для практических применений, прежде всего, гелей с управляемой структурой.
Целью данной работы является изучение динамики медленных флуктуационных изменений гелевых структур на примере гелей полиакриламида (ПАА) и фибриногена. Для этого использован метод динамического рассеяния света (ДРС) [3, 7]. Метод ДРС дает уникальную возможность исследования динамики гелевой структуры на обоих уровнях – структурно соразмерном и микроскопическом – в рамках единого эксперимента.
Статическое и динамическое рассеяние света с длиной волны 633 нм в геле под углом 173° регистрировали прибором Malvern Zetasizer Nano S (Великобритания) с термостатированием при 25°С. Гели объемом 1 см3 приготавливали путем смешивания реактивов в измерительной кювете до помещения ее в прибор, и последующего инкубирования (1 ч при 37°С). Для получения необходимой концентрации ПАА геля 30% водный раствор смеси акриламид : метиленбисакриламид (29:1) разбавляли дистиллированной водой. Полимеризацию инициировали добавлением 10 мкл 10% раствора аммония персульфата (APS) и 1.5 мкл тетраметилэтилендиамина (TEMED). Фибриновые гели получали смешиванием 950 мкл раствора фибриногена (выделен согласно [8]) в 44 ммоль Hepes, 0.15 M NaCl, 5 ммоль CaCl2, pH 7.4 с 50 мкл раствора тромбина 1 NIH/мкл. Образование геля проверяли наклонами кюветы.
Нормированные корреляционные функции (КФ) флуктуаций интенсивности рассеиваемого излучения g(2)(τ) регистрировали в диапазоне 0.5–4 × 106 мкс времени задержки τ с помощью программы Zetasizer в форме [g(2)(τ) – 1] (рис. 1, 2). Одновременно регистрировались величины начальных амплитуд КФ в форме $\sigma _{I}^{2}$ = ${{g}^{{(2)}}}(0) - 1$ [3, 9], а также средней интенсивности ${{\left\langle I \right\rangle }_{T}}$ попадающего на приемник рассеиваемого излучения. Каждая КФ была, в разных экспериментах, средним от 3 до 17 последовательных измерений. Общая продолжительность регистрации изменений $\sigma _{I}^{2}$ и ${{\left\langle I \right\rangle }_{T}}$ доходила до 2.5 ч.
Рис. 1.
Наборы из десяти зависимостей [g(2)(τ) – 1], последовательно зарегистрированных с интервалом ∼3 мин для ПАА гелей с концентрациями (слева направо) 2 (а), 4 (б) и 8 (в) % w/v. На вставках – те же зависимости, нормированные на их первые значения.
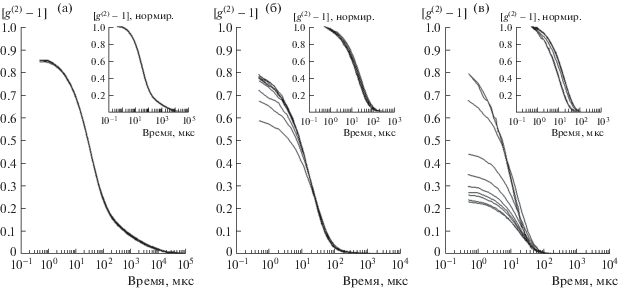
Рис. 2.
1 – наборы из десяти зависимостей [g(2)(τ) – 1], последовательно зарегистрированных с интервалом ∼1.5 мин для ФГ с концентрациями 1 мг/мл (верхние графики) и 2 мг/мл (нижние графики). 2 – те же зависимости, нормированные на их первые значения.
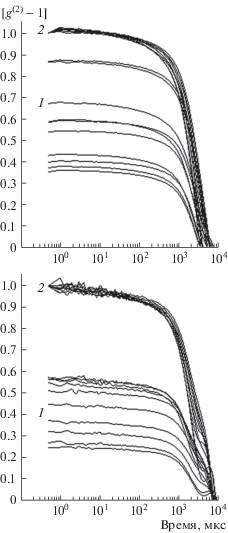
На рис. 1 и рис. 2 для каждого геля приведен репрезентативный набор последовательно измеренных КФ, а также результаты нормирования этих КФ на величины $\sigma _{I}^{2}$. Большой разброс формы исходных КФ свидетельствует о протекающих в геле изменениях. Зависимость от концентрации, наиболее заметная для ПАА гелей (рис. 1) показывает, что само наличие, а также степень выраженности таких изменений зависят от крупномасштабной структуры геля. Однако графики нормированных КФ практически совпадают (рис. 1, 2). Поскольку форма КФ в области 0.1–106 мкс определяется микродинамикой гелевой сетки [3–5, 9], это доказывает неизменность микродинамики в ходе крупномасштабных изменений структуры.
Для сопоставительного изучения обоих уровней динамики геля выполнена пролонгированная регистрация одновременно формы КФ ДРС и величины ${{\left\langle I \right\rangle }_{T}}$ для 256 точек с интервалом 34 с. Как показывает рис. 3, где приведены типичные данные, для ФГ 1 мг/мл и ПАА 8% w/v зарегистрированы медленные противофазные изменения величин ${{\left\langle I \right\rangle }_{T}}$ и $\sigma _{I}^{2}$ вокруг практически постоянных средних значений. В геле ФГ 1 мг/мл присутствуют и короткопериодные осцилляции (рис. 3). Качественно иная картина быстрых хаотических всплесков величин ${{\left\langle I \right\rangle }_{T}}$ и $\sigma _{I}^{2}$ характерна для ПАА геля меньшей концентрации – 2% w/v, однако и здесь заметна противофазность их изменений. Для всех гелей, согласно кросс-корреляционным функциям (рис. 4, пунктирные кривые), изменения ${{\left\langle I \right\rangle }_{T}}(t)$ и $\sigma _{I}^{2}(t)$ высоко коррелированы: на 87, 88 и ∼70%.
Рис. 3.
Зависимости от времени нормированной на максимальное значение величины ${{\left\langle I \right\rangle }_{T}}$ (сплошные толстые линии) и величины $\sigma _{I}^{2}$ (пунктирные линии) для (сверху вниз) ФГ 1 мг/мл и ПАА гелей 8 и 2% w/v. Сплошная тонкая кривая вверху – сумма двух первых гармоник частотного спектра $\sigma _{I}^{2}(t)$ для ФГ 1 мг/мл.
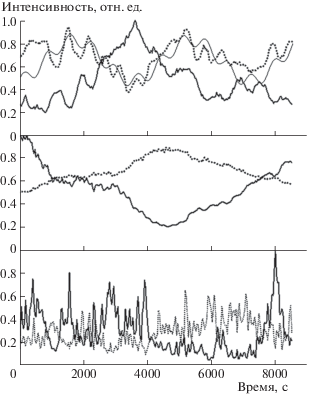
Рис. 4.
Автокорреляционные функции изменений $\sigma _{I}^{2}(t)$ (сплошные линии) и кросс-корреляционные функции изменений ${{\left\langle I \right\rangle }_{T}}(t)$и $\sigma _{I}^{2}(t)$ (пунктирные линии) для (сверху вниз) ФГ 1 мг/мл и ПАА гелей 8 и 2% w/v.
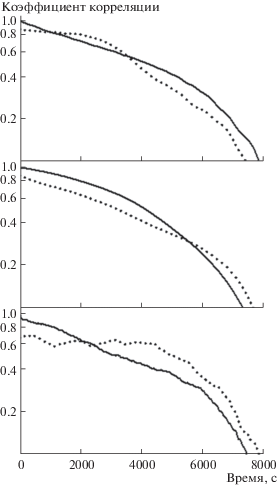
Для оценки характерных времен τeff наблюдаемых изменений рассчитаны нормированные на единицу автокорреляционные функции (АКФ) временных зависимостей ${{\left\langle I \right\rangle }_{T}}(t)$ и $\sigma _{I}^{2}(t)$ (рис. 4), а также их частотные спектры. Величину τeff можно оценить по наклону линейного участка АКФ (рис. 4) в масштабе (lgАКФ vs. τ), а также по формуле ${{\tau }_{{{\text{eff}}}}}$ = $\int {{\text{АКФ}}(\tau )d\tau } $. Для ФГ 1 мг/мл оценка τeff по наклону линейного участка составила 1 ч 40 мин для ${{\left\langle I \right\rangle }_{T}}(t)$ и $\sigma _{I}^{2}(t)$, а интегральная оценка дала 1 ч 2 мин для ${{\left\langle I \right\rangle }_{T}}(t)$ и 1 ч 10 мин для $\sigma _{I}^{2}(t)$. Оценка периодов основного изменения и быстрых осцилляций $\sigma _{I}^{2}(t)$ (рис. 3) путем Фурье-анализа составила, соответственно, 1 ч 1 мин и ∼10–12 мин. Для геля ПАА 8% w/v интегральные оценки τeff составили 1 ч 4 мин для ${{\left\langle I \right\rangle }_{T}}(t)$ и 1 ч 16 мин для $\sigma _{I}^{2}(t)$. Для геля ПАА 2% w/v оценка τeff по наклону линейного участка АКФ $\sigma _{I}^{2}(t)$ составила 1 ч 22 мин, а интегральные оценки составили 52 мин для ${{\left\langle I \right\rangle }_{T}}(t)$ и 1 ч 2 мин для $\sigma _{I}^{2}(t)$.
Зависимость $\sigma _{I}^{2}$ от общей интенсивности рассеянного излучения ${{\left\langle I \right\rangle }_{T}}$ при регистрации ДРС в гелях обусловлена их неоднородностью в масштабах длины волны света и рассеивающего объема в приборе ДРС. Величина ${{\left\langle I \right\rangle }_{T}}$ определяется вкладом статического рассеяния на крупных малоподвижных элементах структуры геля типа узлов полимерной сетки и иных неоднородностей распределения вещества [3, 5, 9]. Вклад в ${{\left\langle I \right\rangle }_{T}}$ от статического рассеяния ${{\left\langle {{{I}_{{{\text{dyn}}}}}} \right\rangle }_{T}}$ на мелких элементах структуры типа нитей сетки, быстрые движения которых регистрируются при ДРС и которые определяют величину $\sigma _{I}^{2}$, относительно мал. В приближении “замороженности” малоподвижных неоднородностей в геле [3, 9] была получена зависимость $\sigma _{I}^{2} = X(2 - X)$, где $X = {{\left\langle {{{I}_{{{\text{dyn}}}}}} \right\rangle }_{T}}\left\langle I \right\rangle _{T}^{{ - 1}}$. Противофазное изменение $\sigma _{I}^{2}(t)$ и ${{\left\langle I \right\rangle }_{T}}(t)$, зарегистрированное в наших экспериментах, подтверждает эту зависимость. Сам факт этих изменений показывает, что даже в неизменных внешних условиях приближение “замороженных” неоднородностей концентрации геля [3, 9] справедливо лишь для ограниченных промежутков времени, в данном случае, порядка нескольких минут. Длительность этих промежутков определяется динамикой структуры геля и соотношением размеров неоднородностей (в частности, ячейки полимерной сетки) с размерами рассеивающего объема прибора. Средний размер неоднородностей в ПАА гелях при концентрации акриламида ∼7–15% w/v оценивается в 100–200 нм [10, 11], а средний размер ячейки фибриновых гелей, аналогичных исследованным нами – в ∼500 нм [6, 12]. Рассеивающий объем в приборе Zetasizer Nano S, аппроксимируемый эллипсоидом ∼55 × 55 × × 570 мкм3, радикально превосходит эти размеры. Поэтому можно заключить, что флуктуации ${{\left\langle I \right\rangle }_{T}}$ и связанные с этим изменения $\sigma _{I}^{2}$ обусловлены изменениями размеров и расположения неоднородностей в больших объемах, т.е. отражают динамику структуры геля в целом.
Проведенные эксперименты являются первыми исследованиями многоуровневой динамики полимерных гелей как взаимосвязанной системы динамики структуры гелевой сетки и микродинамики элементов, образующих эту сетку. Установлена возможность длиннопериодных квазиравновесных флуктуаций структуры сетки с характерными временами в диапазоне ∼10–70 мин, в ходе которых микродинамика полимерных нитей сетки в масштабе времени 0.1–106 мкс остается практически неизменной. Впервые непосредственно зарегистрировано противофазное изменение $\sigma _{I}^{2}(t)$ и ${{\left\langle I \right\rangle }_{T}}(t)$. Это является прямым подтверждением зависимости $\sigma _{I}^{2} = X(2 - X)$, одной из основных в широко используем приближении “замороженных” неоднородностей при изучении микродинамики гелей методом ДРС. Вместе с тем, полученные оценки τeff флуктуаций $\sigma _{I}^{2}(t)$ и ${{\left\langle I \right\rangle }_{T}}(t)$ указывают границы адекватности этого приближения.
БЛАГОДАРНОСТИ
Авторы признательны сотрудникам лаборатории реологии полимеров ИНХС РАН за методические консультации и плодотворные обсуждения.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Исследование выполнено в рамках бюджетного финансирования по государственному заданию (тема 0084-2014-0001).
Список литературы
Utkan D., Ali K. Gels Handbook: Fundamentals, Properties, Applications. Vol. 3. London: World Scientific Publishing Company, 2016. 1172 p.
Tanaka T., Hocker L.O., Benedek G.B. // J. Chem. Phys. 1973. V. 59. № 9. P. 5151–5159.
Shibayama M., Norisuye T. // Bull. Chem. Soc. Jpn. 2002. V. 75. № 4. P. 641–659.
Vyshivannaya O.V., Laptinskaya T.V., Makhaeva E.E., Khokhlov A.R. // Polymer Science, Ser. A. 2012.V. 54. № 9. P. 693–706.
Ngai T., Wu C., Chen Y. // J. Phys. Chem. B. 2004. V. 108. № 18. P. 5532–5540.
Litvinov R.I., Weisel J.W. // Matrix Biol. 2017. V. 60–61. P. 110–123.
Stetefeld J., McKenna S.A., Patel T.R. // Biophys. Reviews. 2016. V. 8. № 4. P. 409–427.
Yurina L.V., Vasilyeva A.D., Indeykina M.I., Bugrova A.E., Biryukova M.I., Kononikhin A.S., Nikolaev E.N., Rosenfeld M.A. // Free Radical Research. 2019. V. 53. № 4. P. 430–455.
Fang L., Brown W. // Macromolecules. 1992. V. 25. № 25. P. 6897–6903.
Basu A., Wen Q., Mao X., Lubensky T.C., Janmey P.A., Yodh A.G. // Macromolecules. 2011. V. 44. № 6. P. 1671–1679.
Lee C.H., Crosby A.J., Emrick T., Hayward R.C. // Macromolecules. 2014. V. 47. № 2. P. 741–749.
Weigandt K.M., White N., Chung D., Ellingson E., Wang Y., Fu X., Pozzo D.C. // Biophys. J. 2012. V. 103. № 11. P. 2399–2407.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


