Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 491, № 1, стр. 20-24
Получение наночастиц элементного бора методом ультразвуковой обработки в водной среде и их применение в бор-нейтронозахватной терапии
С. А. Успенский 1, 2, П. А. Хаптаханова 1, 2, *, А. А. Заборонок 3, 4, Т. С. Куркин 1, О. Ю. Волкова 5, Л. В. Мечетина 5, А. Н. Таранин 5, В. В. Каныгин 4, А. Мацумура 3, С. Ю. Таскаев 6
1 Институт синтетических полимерных материалов Российской академии наук (ИСПМ РАН)
Москва, Россия
2 Московский физико-технический институт (МФТИ)
Долгопрудный, МО, г. Россия
3 Университет Цукубы
3058-8575 г. Цукуба, 1-1-1 Теннодай, Япония
4 Новосибирский государственный университет (НГУ)
Новосибирск, Россия
5 Институт молекулярной и клеточной биологии Сибирского отделения Российской академии наук
г. Новосибирск, Россия
6 Институт ядерной физики им. Г.И. Будкера Сибирского отделения Российской академии наук
(ИЯФ СО РАН)
г. Новосибирск, Россия
* E-mail: khaptakhanova@ispm.ru
Поступила в редакцию 05.03.2020
После доработки 03.04.2020
Принята к публикации 05.04.2020
Аннотация
Описан метод получения наночастиц элементного бора размером меньше 100 нм с применением ультразвукового диспергирования в жидкой среде и последующего каскадного фракционирования. Полученные наночастицы бора были применены в качестве мишенного агента для бор-нейтронозахватной терапии. По результатам экспериментального доклинического исследования бор-нейтронозахватной терапии с применением синтезированных наночастиц бора было установлено, что облучение потоком нейтронов в течение 1 ч клеток глиомы человека Т98G, предварительно инкубированных в среде с наночастицами бора (10, 20, 40 м.д. в пересчете на изотоп бор-10), ведет к значительному подавлению их жизнеспособности.
Одной из прикладных задач в терапии рака является разработка новых препаратов для повышения эффективности лечения онкологических заболеваний. Частицы элементного бора – потенциально новая форма мишенного препарата для противораковой методики бор-нейтронозахватной терапии (БНЗТ), благодаря высокому содержанию атомов бора в одной частице. БНЗТ – это бинарный радиотерапевтический метод, основанный на реакциях захвата и деления ядер при облучении стабильного нерадиоактивного изотопа бора-10 тепловыми нейтронами с образованием высокоэнергетичных альфа-частиц и ядер лития [1–4]. Селективное накопление препарата на основе бора-10 в необходимой терапевтической концентрации (10 млрд атомов бора-10 на 1 клетку) внутри пораженной области и последующее облучение нейтронами приводят к направленному разрушению заданной области благодаря выделению энергии ядерной реакции в пределах одной клетки [4].
В данной работе впервые методом ультразвукового диспергирования в жидкой среде и последующего каскадного фракционирования получены наночастицы элементного бора размером менее 100 нм. Впервые проведена оценка возможности использования полученных таким способом наночастиц бора в качестве мишенного агента нового типа для БНЗТ, который характеризуется отсутствием токсичности и обеспечивает достаточное накопление бора-10 в исследуемой клеточной линии. Исследована жизнеспособность борсодержащей и интактной опухолевой клеточной линии глиомы человека T98G после облучения эпитепловыми нейтронами на ускорительном источнике в Институте ядерной физики СО РАН (г. Новосибирск). Впервые показано, что облучение опухолевых клеток линии T98G, культивируемых в ростовых средах в присутствии наночастиц элементного бора в концентрации 10, 20 и 40 м.д. в пересчете на изотоп бор-10, уменьшает ее колониеобразующую способность по сравнению с контролем (содержание наночастиц бора 0 м.д.).
В технологической практике получение частиц элементного бора в основном осуществляют методами химического осаждения из газовой фазы (ХОГФ) [5]. Следует отметить, что методы ХОГФ позволяют получать порошки элементного бора, в гранулометрическом составе которых преобладают частицы с широким распределением по размерам (от 0.5 до 20 мкм). Подобные материалы оказываются неприменимы в качестве мишеней для БЗНТ, поскольку соответствующие борсодержащие препараты для доклинических исследований применяются в виде растворов или коллоидных систем [6] с размером дисперсной фазы не более 100 нм.
В настоящей работе показано, что современные ультразвуковые технологии могут быть успешно применены для усовершенствования технологичных методов ХОГФ. Установлено, что ультразвуковая обработка позволяет диспергировать частицы спекшегося порошка бора до размеров нанометрового диапазона. При этом использование воды в качестве дисперсионной среды является одним из главных преимуществ при последующем изготовлении препаратов БНЗТ для доклинических исследований.
Получение наночастиц элементного бора проводили по следующей схеме [7]: в стеклянный стакан помещали 0.1 г мелкодисперсного порошка элементного бора (аморфный бор, марка Б99В, производитель AVIOBOR: массовая доля бора не менее 99%, средний размер дисперсии частиц 0.5–4 мкм) и добавляли 25.0 мл бидистиллированной воды. При продолжительном воздействии ультразвуком (УЗ) (τI = 360 мин) на исходную микронную дисперсию бора, а также каскадного фракционирования, была получена фракция частиц 100–250 нм – стадия I (рис. 1а). При дальнейшем воздействии УЗ на фракцию частиц в интервале размеров 100–250 нм (τII = 160 мин), были получены наноразмерные частицы бора в интервале 50–70 нм – стадия II. Воздействие ультразвука на фракцию 50–70 нм в течение τIII = 180 мин приводит к образованию нанодисперсии 5–15 нм – стадия III-А. При диспергировании фракции 50–70 нм в течение τIII = 250 мин образуется дисперсия сферических наночастиц в интервале размеров 5–10 нм – стадия III-В (рис. 1б, 1в).
Рис. 1.
Распределение частиц бора по размерам после первой (а), и третьей (б) стадии УЗ-обработки. Микрофотография частиц бора после третьей стадии УЗ-обработки (в).
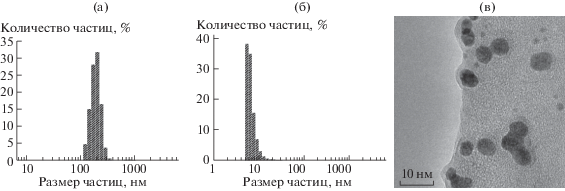
Процесс диспергирования проводили при помощи ультразвукового генератора (“Инлаб”, Россия) с погружным зондом из титанового сплава, с выходной мощностью 0.63 кВт. На каждой стадии процесса дробления распределение частиц по размерам в гидрозолях бора определяли методом динамического светорассеяния на анализаторе Zetatrac (Microtrac, США). Исследования размера и формы частиц на конечной стадии ультразвукового диспергирования проводили с помощью просвечивающего электронного микроскопа Hitachi Н-800, Япония (×40000).
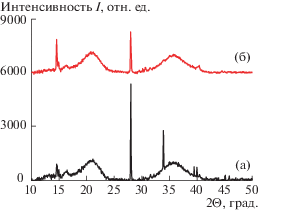
Структуру наночастиц бора исследовали методом рентгеновской дифракции с использованием дифрактометра Bruker D8 Advance (Германия), CuKα-излучение (λ = 1.5418 нм), Ni-фильтр, фокусирующий Ge-монохроматор, детектор LYNXEY. Измерения проводили в режиме съемки “на просвет” в диапазоне углов рассеяния 2θ = = 10°–50°, с вращением образца со скоростью 90 об./мин. Перед проведением рентгенографических измерений образцы гидрозолей бора замораживались в жидком азоте и высушивались с помощью лиофильной сушки Alpha 2-4 LSC (Martin Christ, Германия) для получения высокодисперсного порошка, навеска которого помещалась между слоями пленки аморфного полиэтилентерефталата. Обработку рентгенограмм (нормировку, учет некогерентного и фонового рассеяния) проводили с помощью программ DIFFRAC EVA и Origin 15 Pro.
На рис. 2 представлены дифрактограммы порошков бора до УЗ-обработки (рис. 2а) и после третьей стадии (рис. 2б). Представленные данные свидетельствуют о том, что в структуре частиц элементный бор находится в аморфном состоянии (гало на 2θ = 17°–24° и 30°–42°), как до УЗ-обработки, так и после трех ее стадий. Наряду с аморфным элементным бором в структуре частиц наблюдаются примеси поликристаллической борной кислоты. В исходном порошке примеси борной кислоты имеют кристаллическую решетку триклинной сингонии с рефлексами 010 (2θ = 14.60°), 100 (2θ = 14.98°) и 002 (2θ = 28.02°). УЗ-обработка, предположительно, приводит к частичному растворению борной кислоты в процессе кавитационного дробления частиц, и ее повторной кристаллизации при высушивании гидрозоля после трех стадий УЗ-обработки с образованием гексагональной решетки (рефлексы 100 (2θ = 14.50°), 003 (2θ = 27.97°) и 201 (2θ = 30.72°)).
Представленные результаты свидетельствуют о том, что многостадийная УЗ-обработка является эффективным и легко масштабируемым способом получения наночастиц элементного бора.
Поскольку основное действие наночастиц бора направлено на терапию рака при облучении нейтронами, были проведены следующие биологические тесты: определение цитотоксичности наночастиц бора, накопление бора в онкоклетках и оценка эффективности БНЗТ при помощи клоногенного анализа.
Модельные эксперименты были выполнены на опухолевой клеточной линии глиомы человека T98G, часто используемой в исследованиях действия ионизирующего излучения, в том числе нейтронного [8]. Клетки глиомы человека T98G были предоставлены Институтом цитологии Российской академии наук (г. Санкт-Петербург), культивировались в среде Iscove’s DMEM (IMDM, SIGMA 17633 с L-глютамином и 25 mH HEPES буфером) с добавлением 10% эмбриональной бычьей сыворотки (Thermo Scientific HyClone SV30160.03 HyClone UK Ltd.) при температуре 37°C в атмосфере с 5% CO2.
Цитотоксичность препарата на основе наночастиц бора определялась с помощью колориметрического теста Cell Titer 96 AQueous One Solution (Корпорация Promega, Мэдисон). 4 × 104 клеток T98G помещали в каждую лунку 96-луночного планшета в 100 мкл среды и инкубировали в течение 24 ч. Среду заменяли средой с наночастицами бора (размер частиц 5–10 нм) в концентрациях 0–250 мкг бора/мл и далее инкубировали в течение 24 ч. Затем среду удаляли и клетки промывали буферным раствором. 2 мл раствора 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолия (MTS) с PMS (Cell Titer 96 AQueous One Solution) смешивали с 10 мл среды и добавляли в количестве 100 мкл в каждую лунку. Планшеты инкубировали в течение 2 ч и затем помещали в оптический анализатор Multiscan FC (Thermofisher Scientific, США) и измеряли оптическую плотность при длине волны 490 нм. Данные представлены как доля выживших клеток, инкубированных с препаратом, относительно клеток, инкубированных без препарата (табл. 1).
Таблица 1.
Оценка цитотоксичности наночастиц бора для клеточной линии T98G; эффективность колониеобразующей способности клеточной линии T98G в присутствии наночастиц (НЧ) бора после нейтронного облучения; оценка накопления наночастиц бора в клетках T98G
| № | Концентрация наночастиц бора, мкг/мл среды | Эффективность колониеобразования T98G, инкубированная с НЧ бора, после нейтронного облучения, % | Оценка цитотоксичности T98G, инкубированная с НЧ бора, % | Оценка накопления наночастиц бора в T98G, методом ИСП‑АЭС, мкг/мл среды |
|---|---|---|---|---|
| 1 | 0 | 100.0 | 100.0 | 0.0 |
| 2 | 50 (бор-10:10 м.д.) | 84.5 | 92.0 | 48.5 |
| 3 | 100 (бор-10:20 м.д.) | 52.0 | 88.0 | 98.6 |
| 4 | 150 (бор-10:30 м.д.) | 40.0 | 86.0 | 145.0 |
| 5 | 200 (бор-10:40 м.д.) | 29.0 | 84.0 | 197.5 |
| 6 | 250 (бор-10:50 м.д.) | 23.0 | 85.0 | 246.0 |
Данные цитотоксичности показали низкую токсичность наночастиц в диапазоне концентраций бора до 250 м.д. (мкг/мл раствора среды) – бор-10:50 м.д., который в разы перекрывает требуемый терапевтический диапазон (∼20 м.д.), что подтвердило пригодность наночастиц для дальнейших экспериментов по нейтронному облучению.
Количественный анализ содержания бора в клетках T98G проводили методом атомно-эмиссионной спектроскопии в индуктивно-связанной плазме (ИСП-АЭС) на приборе iCAP 6500 (Thermo Fisher Scientific, Waltham, США) [2]. Инкубацию клеток с наночастицами бора (размер частиц 5–10 нм) проводили в ростовой среде в течение 24 ч. После инкубации клетки промывали забуференным физиологическим раствором (PBS), снимали с пластиковой подложки 0.05% раствором трипсина (Trypsin-EDTA, Nacalai Tesque, Inc.). Затем образцы с наночастицами бора кипятили в 70%-ной азотной кислоте в течение 3 ч до образования борной кислоты, которую детектировали на приборе. Для калибровки прибора использовали стандартные растворы борной кислоты с известными концентрациями (Boron Standard for ICP, TraceCERT, 1000 мг Н3ВО3/л Н2О, Sigma) (табл. 1).
Наночастицы бора накапливаются в клетках глиомы T98G в значительном количестве при экспозиции в среде с концентрацией бора-10 40 мкг/мл до 3.9 мкг/106 клеток, что существенно превышает значения накопления борфенилаланина: BPA (бор-10), 0.37 мкг/106 клеток.
Экспериментальное доклиническое исследование синтезированных наночастиц бора, приближенное к реальным клиническим условиям, было проведено на ускорительном источнике эпитепловых нейтронов [9] в Институте Ядерной Физики СО РАН (г. Новосибирск). Параметры облучения: ток протонного пучка для нейтроногенерирующей мишени 1.8 мА; энергия 2.0 МэВ; флюенс нейтронов 7.2 × 1011 см–2. С помощью клоногенного анализа установлено, что облучение нейтронами предварительно инкубированных в среде с наночастицами бора (10, 20, 40 м.д. в пересчете на бор-10) опухолевых клеток в течение 1 ч, ведет к значительному подавлению их жизнеспособности (табл. 1).
Результаты исследований в данной работе в дальнейшем могут быть использованы для производства терапевтических препаратов для БНЗТ на основе стабильного изотопа бора-10.
Список литературы
Neutron Capture Therapy. Principles and Applications. W. A.G. Sauerwein, A. Wittig, R. Moss, Y. Nakagawa, Eds. Springer-Verlag, Heidelberg, 2012.
Ali F., Hosmane N.S., Zhu Y. // Molecules J. 2020. V. 25. P. 828.
Zaboronok A., Yamamoto T., Nakai K., et al. // Applied Radiation and Isotopes. J. 2015. V. 106. P. 181–184.
Barth R.F., Mi P., Yang W. Cancer Commun. (Lond). 2018. V. 38. № 1. P. 35.
Hutchinson M., Widom M. // Computer Physics Commun. 2012. V. 183. № 7. P. 1422–1436.
Nakamura H., El-Zaria M.E., Ban H.S. // Chem. Eur. J. 2010. V. 16. № 5. P. 1543–1552.
Успенский С.А., Хаптаханова П.А., Заборонок А.А., Куркин Т.С. и др. // RU Patent № 2019117707 (решение о выдаче 30.01.2020), 2020 г.
Yoshida F., Matsumura A., Shibata Y., et al. // Cancer Lett. J. 2002. V. 187. № 1–2. P. 135–141.
Таскаев С.Ю. // Физика элементарных частиц и атомного ядра. 2019. Т. 50. № 5. С. 657–669.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах