Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 492-493, № 1, стр. 128-133
Электрохимическое расщепление графита в сверхкритических средах
А. А. Никифоров 1, М. С. Кондратенко 1, *, О. О. Капитанова 1, М. О. Галлямов 1, 2
1 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
2 Институт элементоорганических соединений
им. А.Н. Несмеянова Российской академии наук
Москва, Россия
* E-mail: kondratenko@polly.phys.msu.ru
Поступила в редакцию 07.04.2020
После доработки 17.04.2020
Принята к публикации 27.04.2020
Аннотация
Впервые была показана возможность электрохимической интеркаляции аниона тетрафторбората в графит из сверхкритического электролита на основе диоксида углерода, ацетонитрила в качестве сорастворителя и соли тетрабутиламмония тетрафторбората.
Графен и графеноподобные материалы рассматривают как перспективный материал для широкого класса задач, например: создания “чернил” с различной электрической проводимостью в зависимости от способа синтеза для двумерной и трехмерной печати при создании гибких электронных устройств (солнечных элементов, транзисторов, мемристоров и др.), газоразделительных мембран, биосенсоров, “умной одежды” [1–3], в качестве проводящих и армирующих добавок и матриц в аккумуляторах и композитах [4] и т.д. В связи с этим актуальной задачей на сегодняшний день является разработка синтеза графена и графеноподобных материалов с контролируемыми физико-химическими свойствами (состав, структура, морфология) [4]. Синтез графена и графеноподобных материалов основан на увеличении межплоскостного расстояния, ослаблении Ван-дер-Ваальсовых сил взаимодействия между графеновыми слоями с последующим расслаиванием графита. Для этого, как правило, используют химическое окисление неорганическими окислителями [5]. Этот подход приводит к нарушению структуры графита, его окислению и требует очистки продукта от кислоты с последующим восстановлением материала. Электрохимические методы, основанные на интеркаляции ионов (т.е. заполнении ионами межплоскостных расстояний в графите) в водных [6] и безводных [7] электролитах с расслаиванием интеркалированного графита, позволяют сделать синтез быстрее, но тоже требуют очистки продукта от электролита. Для получения графена без очистки применяют также синтетические подходы на основе расщепления графита в сверхкритической среде, с обработкой ультразвуком, резкой декомпрессией [8], но обычно такие подходы характеризуется низким выходом тонкослойного (менее 5 слоев) продукта. Таким образом, на данный момент не существует быстрого и эффективного метода синтеза графена/оксида графена, и поэтому поиск таких методов является актуальной задачей. Для ее решения мы предлагаем объединить два подхода и осуществлять синтез графена путем электрохимического окисления в сверхкритическом электролите. Благодаря их синергии, процесс получения графена, как можно ожидать, станет более эффективным и быстрым.
Важным преимуществом в использовании интеркаляции именно в сверхкритическом электролите в синтетическом плане является отсутствие необходимости стадии отмывки интеркалированного графита от электролита, так как после декомпрессии возможно получить сухой образец. Как правило, необходимая стадия очистки интеркалированного графита от избытков растворителя после жидкофазной интеркаляции приводит к частичной либо полной деинтеркаляции. В связи с этим анализ ступени интеркаляции материала проводят в мокром образце. При этом остатки растворителя создают неудобства при работе с образцом, а также дают фон на спектрах комбинационного рассеяния (КР). Более того, при электрохимическом расслаивании в жидком электролите из-за поверхностного натяжения происходит разрыв на границе “погруженный/не погруженный в электролит графит” и, как следствие, потеря контакта с токосъемником, что существенно уменьшает выход продукта реакции. В нашем эксперименте в силу отсутствия поверхностного натяжения границ раздела в сверхкритическом электролите потери контакта не происходит на протяжении всего синтеза.
В настоящей работе впервые разработан подход для электрохимической интеркаляции аниона тетрафторбората (BF4)– в графит в сверхкритическом электролите.
В качестве электролита использовали сверхкритический диоксид углерода с добавлением ацетонитрила в качестве сорастворителя с предварительно растворенной в нем солью тетрабутиламмония тетрафторбората (ТБАТФБ). Объем аниона (BF4)– в несколько раз меньше по сравнению с объемом катиона (C4H9)4N+, в связи с чем именно интеркаляция катиона приводит к необратимому нарушению структуры графита, в отличие от интеркаляции анионом [9]. Поэтому изучали интеркаляцию анионов. Диоксид углерода является неполярным растворителем, поэтому для диссоциации солей необходим сорастворитель. В качестве сорастворителя был выбран ацетонитрил, поскольку по сравнению с метанолом для двухкомпонентной смеси ацетонтрила и диоксида углерода необходимы меньшие давления для образования однофазной системы [10].
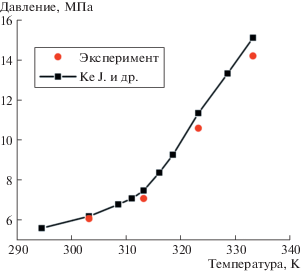
Эксперименты по изучению фазового поведения трехкомпонентного электролита в зависимости от температуры и давления проводили путем фиксации точек фазового разделения системы в оптической ячейке высокого давления. Полученные результаты хорошо согласуются с литературными данными [10, 11]. Согласно полученной фазовой диаграмме (рис. 1) и литературным данным, при давлении выше 7 МПа и при температуре 343 K трехкомпонентная система следующего состава: 18 мМ ТБАТФБ, 2.1 М ацетонитрила в диоксиде углерода, – находится в однофазном сверхкритическом состоянии.
Рис. 1.
Фазовая диаграмма смеси тетрабутиламмония тетрафторбората (18 мМ), ацетонитрила (2.1 М) в диоксиде углерода и сопоставление экспериментальных данных с литературными [11].
Эксперименты по электрохимической интеркаляции проводили в двухэлектродной ячейке высокого давления объемом 13 мл, изготовленной из нержавеющей стали. В качестве противоэлектрода и электрода сравнения использовали корпус самой ячейки. В качестве рабочего электрода был выбран электрод из высокоориентированного пиролитического графита (ВОПГ, или HOPG). Использовали высокоориентированный пиролитический графит, предоставленный Центром перспективных технологий (Россия), с мозаичностью 1.7 ± 0.5°. Интеркаляцию проводили в потенциостатическом режиме.
Морфология электрода после электрохимической обработки в cверхкритическом СО2 существенно изменяется. Из литературных данных известно, что электрохимическая интеркаляция графита анионом тетрафторбората в ацетонитриле по первой ступени приводит к увеличению расстояния между графитовыми слоями с 3.35 Å до 5 ± 0.3 Å [5], благодаря чему объем анода увеличивается менее чем в 2 раза. Объем электродов на основе ВОПГ в нашем эксперименте увеличивается более чем на порядок (рис. 2). Такое эффективное расслаивание рабочего электрода в объеме связано не только с интеркаляцией в графит аниона тетрафторбората, но и с расщеплением графита в результате декомпрессии при переходе из сверхкритического состояния к н. у. Дефектность и ступень интеркаляции рабочего электрода были исследованы методом спектроскопии комбинационного рассеяния, а также сопоставлены с величиной заряда, протекшего в ходе синтеза. Спектры комбинационного рассеяния углеродных материалов исследовали с помощью КР-микроскопа Renishaw InVia Raman Microscope (Великобритания). Для возбуждения использовали лазер с длиной волны 633 нм. Излучение фокусировали на образце в пятно диаметром порядка 1 мкм при помощи 100× объектива. Обработку спектров КР проводили в программном пакете Wire 3.4. Анализ спектров КР электродов, подвергавшихся потенциостатической интеркаляции при различных значениях потенциала, показал, что степень интеркаляции растет при увеличении последнего. В спектре КР образца графита (рис. 3) после приложения потенциала наблюдаются две моды полосы G: Gi – мода при низких частотах (∼1584 см–1), связанная с колебаниями атомов углерода, не граничащих с интеркалятом, и Gb – мода при высоких частотах (∼1610 см–1), связанная с колебаниями атомов углерода, граничащих с интеркалятом. Вклад моды Gb пропорционален числу ионов, интеркалированных в графит, причем для первой ступени интеркаляции характерна только мода Gb. В нашем эксперименте численное значение ступени интеркаляции было определено, согласно [8], по формуле:
где Ii и Ib соответствуют интенсивностям пиков Gi и Gb.Рис. 2.
Оптическое изображение образца ВОПГ до (на вставке к рисунку) и после потенциостатической интеркаляции тетрафторборат аниона в сверхкритическом электролите на основе раствора тетрабутиламмония тетрафторбората в смеси ацетонитрил/СО2 при потенциале рабочего электрода 10 В относительно противоэлектрода. Время интеркаляции 1 ч.

Рис. 3.
Данные КР спектроскопии электрода из ВОПГ до и после потенциостатической интеркаляции аниона тетрафторбората в сверхкритическом электролите на основе смеси ацетонитрил/СО2 при разных потенциалах рабочего электрода относительно противоэлектрода (объединен с электродом сравнения) (λ = 633 нм). Температура электролита 40°С, давление 48 МПа.
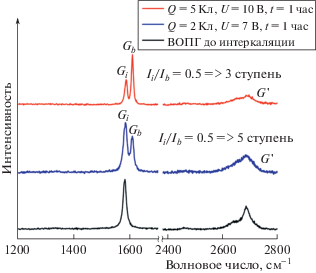
Увеличение разности потенциалов приводит к существенному уменьшению соотношения Ii /Ib и, как следствие, увеличению степени интеркаляции (табл. 1). Следует отметить, что в спектрах КР с различных точек образца наблюдался разброс в значении ступени интеркаляции: от неинтеркалированных участков у края термоусадочной пленки, используемой для крепления образцов и ограничивающей изменение объема образца, до участков с наибольшей степенью интеркаляции вдали от нее. В табл. 1 приведены наблюдаемые значения ступени интеркаляции вдали от точки крепления вблизи свободного края образца. По данным КР-спектроскопии удалось достичь 3-й ступени интеркаляции аниона (BF4)– в межслоевое пространство графита при разности потенциалов 10 В между рабочим электродом и противоэлектродом.
Таблица 1.
Анализ данных КР для графита в процессе электрохимической обработки в сверхкритическом электролите
| Номер образца | Разность потенциалов, В | Время экспозиции, ч | Оценка ступени интеркаляции | Оценка эффективности по заряду, % |
|---|---|---|---|---|
| 1 | 6 | 1 | – | 0 |
| 2 | 7 | 1 | 5 | ~100 |
| 3 | 10 | 1 | 3 | 40 |
| 5 | 10 | 5 | 3 | 2 |
Эффективность процесса интеркаляции по заряду η оценивали по формуле:
где Q – протекший в ходе экспозиции заряд, Q1st – заряд, который бы потребовался для достижения первой ступени интеркаляции в расчете, что на 1 анион приходится 25 атомов углерода, n – ступень интеркаляции.Несмотря на рост степени интеркаляции с увеличением разности потенциалов эффективность по заряду, напротив, снижается (табл. 1). Так, при разности потенциалов 10 В, эффективность не превышает 30% и падает с увеличением времени экспозиции. По всей видимости, это связано с протекающими побочными процессами: восстановлением CO2 до CO и (COO)$_{2}^{{2 - }}$ на противоэлектроде [13], диффузией и дальнейшим окислением образующихся продуктов на рабочем электроде. Кроме этого, при столь высокой разности потенциалов может происходить окисление электролита. При этом при напряжении 7 В вклад побочных процессов, по-видимому, несущественен и эффективность по заряду близка к 100%. Однако при этом сама интеркаляция протекает существенно медленнее, что проявляется в уменьшении степени интеркаляции (более высокая ступень) при фиксированном времени потенциостатической экспозиции образца. При разности потенциалов 6 В и меньше, изменений в морфологии образцов ВОПГ и их КР спектрах не наблюдается, т.е. интеркаляция не происходит.
Важно отметить, что отсутствие D моды (частота 1350 см–1) в образцах после электрохимической обработки в сверхкритическом электролите свидетельствует о сохранении качества графита и отсутствии дефектов вследствие окисления. Также заметим, что при повторных измерениях КР спектроскопии того же образца спустя сутки вид спектров не изменялся, что доказывает стабильность интеркалированного графита в процессе хранения и малость или отсутствие на образцах остаточных капель компонент растворителя. Это выгодно отличает предложенный подход от двухступенчатого электрохимического расслаивания в водных электролитах, где, во-первых, в процессе постепенного высыхания растворителя спектры КР интеркалированного по первой-второй ступеням графита быстро меняются со временем из-за деинтеркаляции, а, во-вторых, протекающее вследствие электролиза водных растворов окисление графита, как было показано ранее [6], неизбежно приводит к существенному падению электропроводности получаемых продуктов.
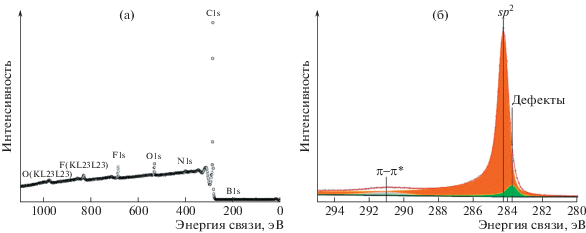
Содержание аниона (ВF4)– в графите после интеркаляции в сверхкритическом электролите определяли методом рентгеновской фотоэлектронной спектроскопии (РФЭС). РФЭ-спектры получали с помощью спектрометра PHI Quantera II (США), оснащенного монохроматическим источником рентгеновского излучения Al Kα (энергия 1486.6 эВ) и нейтрализатором для снятия наведенного заряда. Обработку фотоэлектронных спектров проводили при помощи программного пакета UNIFIT 2014. Пики аппроксимировали сверткой функций Гаусса и Лоренца с одновременной оптимизацией параметров фона. Оптимизацию параметров фона осуществляли по алгоритму Маквардта–Левенберга. Содержание каждого атома рассчитывали из площадей соответствующих им пиков с учетом коэффициентов элементной чувствительности. В обзорном фотоэлектронном спектре образца графита после электрохимической интеркаляции в сверхкритическом электролите наблюдаются пики углерода, фтора и бора (рис. 4а). На каждые 248 атомов C приходится 1 анион (BF4)–, что соответствует 10-й ступени интеркаляции и не согласуется с приведенными выше данными КР спектроскопии, по которым графит интеркалирован по 3-й ступени. Однако важно отметить, что рабочая область при измерении КР спектров порядка 3.14 мкм2, в то время как РФЭС примерно 30 000 мкм2. Как было описано ранее, мы связываем расхождение данных КР и РФЭС с градиентом интеркаляции рабочего электрода от места его крепления к токосъемнику до края образца. На обзорном РФЭ спектре (рис. 4а) присутствуют пики кислорода и азота, обусловленные поверхностными загрязнениями. Асимметрия пика C1s (рис. 4б) свидетельствует об успешном интеркаляционном процессе после обработки [14], наличие небольшого пика около 283.8 эВ связано с дефектами, причиной возникновения которых могут быть как интеркаляционные процессы, так и декомпрессия. Однако вклад этого пика относительно пика sp2 (284.3 эВ) не существенен, откуда можно судить о малом вкладе в дефектность образца процесса интеркаляции в сверхкритическом электролите.
Рис. 4.
РФЭ спектры: обзорный (а) и C1s (б) для графита после интеркаляции в сверхкритическом электролите.
Таким образом, впервые была показана возможность интеркаляции (ВF4)– в ВОПГ в сверхкритическом электролите на основе диоксида углерода, ацетонитрила и тетрабутиламмония тетрафторбората. В дальнейшем планируется модернизировать электрохимическую ячейку добавлением отдельного электрода сравнения для контроля потенциала рабочего электрода и уменьшения влияния побочных процессов на эффективность экспозиции, расслоение интеркалированного графита с помощью ультразвука и изучение морфологии получаемых продуктов.
Список литературы
Ma J., Wang P., Dong L. Highly conductive, mechanically strong graphene monolith assembled by three-dimensional printing of large graphene oxide // J. Colloid Interface Sci. 2019. V. 534. P. 12–19. https://doi.org/10.1016/j.jcis.2018.08.096
Karim N., Afroj S., Tan S., et al. All Inkjet-Printed Graphene-Silver Composite Ink on Textiles for Highly Conductive Wearable Electronics Applications // Sci. Rep. 2019. V. 9. № 1. P. 8035. https://doi.org/10.1038/s41598-019-44420-y
Parvez K., Worsley R., Alieva A., et al. Water-based and inkjet printable inks made by electrochemically exfoliated graphene // Carbon. 2019. V. 149. P. 213–221. https://doi.org/10.1016/j.carbon.2019.04.047
Lin L., Peng H., Liu Z. Synthesis challenges for graphene industry // Nat. Mater. 2019. V. 18. P. 520–524. https://doi.org/10.1038/s41563-019-0341-4
He P., Gu H., Wang G., et al. Kinetically Enhanced Bubble-Exfoliation of Graphite toward High-Yield Preparation of High-Quality Graphene // Chem. Mater. 2017. V. 29. № 20. P. 8578–8582. https://doi.org/10.1021/acs.chemmater.7b02752
Yu P., Lowe S.E., Simon G.P., et al. Electrochemical exfoliation of graphite and production of functional graphene // Curr. Opin. Colloid Interface Sci. 2015. V. 20. № 5–6. P. 329–338. https://doi.org/10.1016/j.cocis.2015.10.007
Cooper A.J., Wilson N.R., Kinloch I.A., et al. Single stage electrochemical exfoliation method for the production of few-layer graphene via intercalation of tetraalkylammonium cations // Carbon. 2014. V. 66. P. 340–350. https://doi.org/10.1016/j.carbon.2013.09.009
Wang W., Gai Y., Song N., et al. Highly Efficient Production of Graphene by an Ultrasound Coupled with a Shear Mixer in Supercritical CO2 // Ind. Eng. Chem. Res. 2018. V. 57. № 49. P. 16701–16708. https://doi.org/10.1021/acs.iecr.8b04113
Ruch P.W., Hahn M., Rosciano F., et al. In situ X-ray diffraction of the intercalation of (C2H5)4N+ and BF$_{4}^{ - }$ into graphite from acetonitrile and propylene carbonate based supercapacitor electrolytes // Electrochim. Acta 2007. V. 53. № 3. P. 1074–1082. https://doi.org/10.1016/j.electacta.2007.01.069
Bartlett P.N., Cook D.C., George M.W., et al. Phase behaviour and conductivity study on multi-component mixtures for electrodeposition in supercritical fluids // Phys. Chem. Chem. Phys. 2010. V. 12. № 2. P. 492–501. https://doi.org/10.1039/b918981e
Ke J., Su W., Howdle S.M., et al. Electrodeposition of metals from supercritical fluids // Proc. Natl. Acad. Sci. 2009. V. 106. № 35. P. 14768–14772. https://doi.org/10.1073/pnas.0901986106
Zabel H., Solin S.A. Graphite Intercalation Compounds. Berlin: Springer-Verlag, 1990. V. 1. P. 179. https://doi.org/10.1007/978-3-642-75270-4
Abbott A.P., Eardley C.A. Electrochemical Reduction of CO2 in a Mixed Supercritical Fluid // J. Phys. Chem. B 2000. V. 104. № 4. P. 775–779. https://doi.org/10.1021/jp9932867
Wertheim G.K., Van Attekum P.T.Th.M., Basu S. Electronic structure of lithium graphite // Solid State Commun. 1980. V. 33. № 11. P. 1127–1130. https://doi.org/10.1016/0038-1098(80)91089-3
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


