Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 494, № 1, стр. 5-8
Металлокомплексные бактерициды со свойствами детергентов
Академик РАН А. Ю. Цивадзе 1, А. Я. Фридман 1, А. К. Новиков 1, И. Я. Полякова 1, М. П. Шабанов 1, *
1 Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии
им. А.Н. Фрумкина Российской академии наук
Москва, Россия
* E-mail: sha444@yandex.ru
Поступила в редакцию 17.07.2020
После доработки 21.08.2020
Принята к публикации 04.09.2020
Аннотация
В настоящем сообщении представлены данные о возможности создания новых не имеющих аналогов металлокомплексных бактерицидов со свойствами детергентов. Они способны необратимо подавлять бактериофаги, бактерии кишечной группы, вирионы, кокки, сальмонеллу, трихомонаду, споры Becreus в загрязнениях, содержащих жиры на поверхностях различных материалов, с одновременной их отмывкой. В дозах, летальных для патогенов, бактерицид безопасен для микрофлоры, животных и человека. Полученные результаты представляются актуальными в связи с ситуацией COVID-19 и возможными ухудшениями эпидемиологической обстановки.
ВВЕДЕНИЕ
В настоящее время известны бактерицидные комплексы [Cu(AС)NH3]X и Cu(Ida)NH3, где АС– ‒ анионы аминокислот, а Ida2‒ – анион С-замещенных иминодиуксусных кислот (продукты из гидролизатов белоксодержащих отходов), X = = Cl‒, 1/2(SO$_{4}^{{2 - }}$) [1]. Средства на их основе используются для обработки осадков очистных сооружений, могильников, в санитарной технике и в товарах бытовой химии взамен хлорных окислительных средств. Действие комплексов основано на реакциях
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И РЕЗУЛЬТАТЫ
Для синтеза использовали поликомплесоны российского производства с содержанием иминодиацетатных производных полимукосахаридов (преимущественно гиалуроновых и сиаловых кислот) – 47.6%, иминодиацетатных производных триглицеридов жирных кислот – 52.4%, общее содержание иминодиацетатных групп – 2.67 ммоль/г в пересчете на сухое вещество [2].
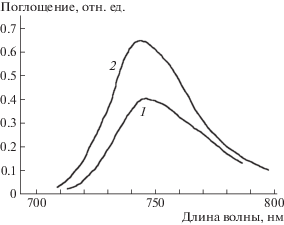
БД были синтезированы действием на поликомплексоны раствора аммиачнохлоридного комплекса меди с концентрацией 2 моль/л, равной содержанию L в поликомплексоне. На рис. 1 приведены спектры поглощения раствора БД и раствора Cu(Ida)NH3. На спектрах присутствует полоса поглощения около 745 нм, относящаяся к T2g → Eg переходу в атомах меди. Волновое число этого перехода зависит от состава координационной сферы и формы координационного полиэдра. Следовательно, строение координационных сфер в БД и в Cu(Ida)NH3 близки.
Стандартные токсиколого-гигиенические испытания БД были проведены на подопытных животных (крысы, мыши, кролики). Установлено, что БД ‒ вещество четвертого класса опасности (малоопасные вещества). Полулетальная доза ЛД50 составляет 12.5 г/кг и не вызывает раздражения слизистых оболочек, дыхательных путей и кожных покровов, не оказывает общего токсического действия.
Зараженные среды готовили на основе смеси осадка иловых карт городских очистных сооружений и очистных сооружений свинокомплексов. Смесь имела резкий фекальный запах. Бактериальный состав был установлен по стандартным методикам санитарно-бактериологических исследований объектов окружающей среды методами посевов на кровяную среду и на среду Эндо [3], а также методом фазово-контрастной микроскопии с использованием камеры Горяева (Россия). В смеси идентифицированы: бактериофаги (вирусы с оболочкой и без нее), кишечная палочка, стрептококк, микрококки, диплококки, стафилококк, энтерококк, кишечная амеба, сальмонелла, трихомонада, споры, клостридиум. Общая обсемененность около 1 × 1014 ед./мкл. Смесь вместе с кулинарным жиром (ГОСТ 28414-89) диспергировали в мясопептонный бульон с заваренным крахмалом [4]. Среды имели резкий гнилостно-фекальный запах. Общее содержание липидов в средах, определенное экстракционным методом, приведено в табл. 1. Среды слоем около 3 мм наносили на пластинки (1 × 1 см) из стекла, пластика, никеля стали, керамической плитки и бетона, инкубировали при 35°С в течение часа и выдерживали на воздухе до формирования плотного покрытия. Загрязнения имели резкий запах, не смывались горячей водой. Их поверхность была гидрофобной. На загрязнения с помощью дозатора порциями наносили раствор БД, содержащий 0.5 моль/л групп Cu(Ida)NH3. При нанесении раствор БД впитывался в загрязнение. В ходе процесса обработки снижалась интенсивность выделения летучих веществ с резким запахом. Обработку проводили до исчезновения фекального запаха, что являлось признаком прекращения дыхания микроорганизмов. Обработанное загрязнение смывали водой и измеряли микробную обсемененность. Установлено, что в смыве не было живых микроорганизмов. Следовательно, дозы, при которых прекращалось дыхание микроорганизмов, соответствовали летальным, а исчезновение запаха можно использовать как надежный экспресс-тест эффективности обработки. Значения летальных доз меди в БД в зависимости от содержания липидов приведены в табл. 1.
Таблица 1.
Летальные дозы БД в смыве загрязнений с разным содержанием жира
| Жир, %, сухой остаток | Доза БД, мг/кг | ||||
|---|---|---|---|---|---|
| стекло | пластик | сталь | керамическая плитка | бетон | |
| 10 | 0.75–0.77 | 0.76–0.78 | 0.74–0.75 | 0.78–0.8 | 0.82–0.85 |
| 20 | 0.83–0.86 | 0.84–0.86 | 0.79–0.83 | 0.98–1.06 | 1.15–1.18 |
| 30 | 0.92–0.97 | 0.94–0.99 | 922–1.27 | 1.30–1.33 | 1.53–1.40 |
Из таблицы видно, что значения дозы коррелируют с содержанием липидов. Для непористых поверхностей ‒ стекла, металла и пластика ‒ дозы меньше, чем для пористых – керамической плитки и бетона.
Эффективность обезжиривания поверхности при бактерицидной обработке была оценена методом ИК-спектроскопии на примере никелевой пластины, как наиболее трудно отмываемой от жиров. На рис. 2 приведен ИК спектр среды поверхности никелевой пластины, орошенной раствором, и спектр этой пластины после смыва.
Рис. 2.
ИК-спектры поверхности никелевой пластины с загрязнением (1) и поверхности пластины после его смыва (2).
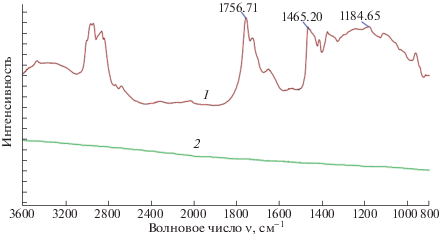
В спектре поверхности пластины с загрязнением присутствуют полосы в области 3400–3200 см–1, соответствующие колебаниям молекулярных групп в целлюлозе и крахмале, полосы в области 1760 и 1184 см‒1, соответствующие колебаниям в липидах, и полоса 1463 см‒1, соответствующая колебаниям в белках, присутствующих в загрязнениях. После смыва на ИК спектре эти полосы отсутствуют, то есть пластина отмыта от загрязнения.
Исследования показали, что БД является одновременно бактерицидом и детергентом. Как отмечалось выше, раствор БД при обработке загрязненной поверхности впитывается в загрязнение. На рис. 3 приведена микрофотография поверхности обеззараженного загрязнения с содержанием липидов 35% на никелевой пластине до его смывания. Видно, что поверхность неоднородна и на ней просматриваются частицы. По-видимому, при действии раствора БД производные триглицеридов как бифильные молекулы внедряются в частички из жиров. Это обеспечивает диффузию производных полимукосахаридов в загрязнения, приводящую к их деструкции и распаду на частицы. Вероятно, что из цепей полимукосахаридов, в частности производных гиалуроновой кислоты с молекулярной массой 5‒15 млн Да, вокруг частиц формируются гидрофильные оболочки. Это обеспечивает отторжение загрязнения от поверхности. При диффузии комплексы CuLNH3 контактируют с колониями бактерий, связывая белковые структуры вирусов, токсинов и протеаз. В этом случае расход БД будет возрастать пропорционально содержанию липидов.
В настоящее время в условиях пандемии существенно увеличилось использование хлорсодержащих дезинфицирующих средств [4, 5]. Главным образом используются хлорная известь, гипохлорит натрия, дихлоргексидин и подобные [6, 7]. Для повышения эффективности их сочетают с жесткими поверхностно-активными веществами [8]. Использование таких средств в больших масштабах, очевидно, приведет к существенным превышениям содержания токсических веществ, в том числе диоксинов [9], как в объектах прямого контакта с населением, так и в стоках коммунальных отходов. В этом плане БД может быть перспективным в качестве доступной основы безопасных для человека средств специальной промышленной санированной обработки объектов, в которых могут быть депонированы вирусы и патогены, а также для разработки ассортимента бытовых средств с бактерицидным эффектом для уборки помещений, чистки санитарной и кухонной техники и мытья посуды. В настоящее время авторы совместно с потенциальными производителями разработали документацию на производство БД и рецептуры средств на его основе.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Tsivadze A.Yu., Fridman A.Ya. Wasteless processing of renewable protein and carbohydrate-containing waste into consumer good / In: Handbook of Ecomaterials. Editors Torres-Martínez L.M., Kharissova O.V., Kharisov B.I. Shringer. 2017. P. 1‒33. https://doi.org/10.1007/978-3-319-48281-1_123-1
Цивадзе А.Ю., Фридман А.Я., Максимов А.Л., Новиков А.К., Полякова И.Я., Горбунов А.М., Петрухина Н.Н., Шабанов М.П. Детергент из иминодиацетатных производных жиров и полимукосахаридов щелочных гидролизатов белоксодержащих отходов // Журнал прикладной химии. 2020. Т. 93. № 3. С. 327‒333. https://doi.org/10.31857/S0044461820030032
МУК 4.2.796–99. Методы санитарно-паразитологических исследований. Минздрав России. Москва. 2000. С. 19‒32.
Wang J., Shen J., Ye D., Yan X., Zhang Y., Yang W., Li X., Wang J., Zhang L., Pan L. Disinfection technology of hospital wastes and wastewater: Suggestions for disinfection strategy during coronavirus Disease 2019 (COVID-19) pandemic in China // Environmental Pollution. 2020. V. 262. 114665. https://doi.org/10.1016/j.envpol.2020.114665
Kály-Kullai K., Wittmann M., Noszticzius Z., Rosivall L. Can chlorine dioxide prevent the spreading of coronavirus or other viral infections? Medical hypotheses // Physiology international. 2020. V. 107. P. 1‒11. https://doi.org/10.1556/2060.2020.00015
Gercina A., Amorim K.S., Mota Santana L.A. COVID-19: affordable alternatives of household disinfectants for community // Public Health. 2020. V. 182. P. 51‒52. https://doi.org/10.1016/j.puhe.2020.01.015
Binder L., Högenauer C., Langner C. Gastrointestinal effects of an attempt to disinfect from COVID-19 // Histopathology. 2020. P. 1–2. https://doi.org/10.1111/his.14137
Bolfoni M.R., Ferla M.S., Sposito O.S., Giardino L., Jacinto R., Pappen F. Effect of a surfactant on the antimicrobial activity of sodium hypochlorite solutions // Brazilian Dental Journal. 2014. V. 25. № 5. P. 416‒419. https://doi.org/10.1590/0103-6440201300049
Yari S., Moshammer H., Asadi F.A., Mosavi Jarrahi A. Side effects of using disinfectants to fight COVID-19 // Asian Pacific Journal of Environment and Cancer. 2020. V. 3. № 1. P. 9‒13. https://doi.org/10.31557/apjec.2020.3.1.9-13
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах