Доклады Российской академии наук. Химия, науки о материалах , 2022, T. 503, № 1, стр. 3-8
Полимеризация 2-(перфторгексилэтил)метакрилата в СК СО2 в присутствии 2-циано-2-пропилдитиобензоата
К. Е. Чекуров 1, А. И. Барабанова 1, *, И. В. Благодатских 1, О. В. Вышиванная 1, А. В. Муранов 1, А. С. Перегудов 1, академик РАН А. Р. Хохлов 1, 2
1 Институт элементоорганических соединений
им. А.Н. Несмеянова Российской академии наук
119991 Москва, Россия
2 Московский государственный университет
имени М.В. Ломоносова, Физический факультет
119234 Москва, Россия
* E-mail: barabanova@polly.phys.msu.ru
Поступила в редакцию 20.12.2021
После доработки 07.02.2022
Принята к публикации 05.03.2022
- EDN: BLVHCA
- DOI: 10.31857/S2686953522020042
Аннотация
Впервые изучена радикальная полимеризация 2-(перфторгексилэтил)метакрилата (ФГЭМА), инициированная динитрилом азобисизомасляной кислоты, в присутствии коммерчески доступного агента передачи цепи 2-циано-2-пропилдитиобензоата в трифтортолуоле (ТФТ) и в среде сверхкритического диоксида углерода (СК СО2). Найдены условия, при которых полимеризация ФГЭМА в ТФТ или в СК СО2 протекает в гомогенных условиях как процесс с обратимой передачей цепи по механизму присоединения−фрагментации.
Фторсодержащие полимеры, благодаря своим уникальным свойствам (термостойкость, коррозионная стойкость, высокая инертность к агрессивным средам и к УФ-излучению, низкий коэффициент трения и пр.), активно используются для создания новых высокотехнологичных материалов, таких как функциональные мембраны, медицинские материалы, омнифобные покрытия, биосенсоры и др. [1–6]. Однако существенным препятствием для синтеза фторполимеров является их низкая растворимость в большинстве органических растворителей, за исключением токсичных и запрещенных для применения в промышленном производстве хлор- и фторуглеводородов (ХФУ). Одним из решений данной проблемы является использование для синтеза фторполимеров вместо ХФУ − экологически чистых сверхкритических сред, среди которых наиболее предпочтительным является дешевый, негорючий, нетоксичный и не требующий регенерации сверхкритический диоксид углерода (СК СО2) [7, 8]. Впервые о синтезе фторполимеров радикальной полимеризацией в растворе СК СО2 сообщили ДеСимоне и соавт. [9–12]. Однако для создания современных материалов с требуемыми свойствами нужны фторсодержащие полимеры с различной топологией (блок-сополимеры, графт-сополимеры, звездообразные сополимеры и др.) и с определенными молекулярно-массовыми характеристиками. Для направленного синтеза таких полимеров в настоящее время применяются методы радикальной полимеризации с обратимой дезактивацией [12–15] и, в частности, радикальной полимеризации с обратимой передачей цепи по механизму присоединения−фрагментации (ОПЦ-полимеризация) [13, 14]. Об успешном синтезе (со)полимеров на основе фторметакрилатов с помощью ОПЦ-полимеризации сообщается в работах [16–22]. Ли и соавт. осуществили синтез фторсодержащих диблок-сополимеров (ДС) на основе 2,2,2-трифторэтилметакрилата и метилметакрилата с использованием кумилдитиобензоата (КТБ) в качестве ОПЦ-агента [16]. Хьюо и соавт. [17] получили амфифильные тройные сополимеры полимеризацией 2-диэтиламиноэтилметакрилата (ДМАЭМА), бензилметакрилата (БМА) и перфтороктилэтилметакрилата в присутствии 4-циано-4-[(тиобензоил)-сульфанил]пентановой кислоты (ЦПДТБ). В другой работе тех же авторов [18] сообщается о получении тройных блок-сополимеров ДМАЭМА с БМА и 2-(перфторгексилэтил)метакрилатом (ФГЭМА) полимеризацией в присутствии ЦПДТБ. Ванг и соавт. [19] синтезировали ДС на основе перфторгептилметилметакрилата и 4-гидроксифенола в гексафторизопропаноле с 2-циано-2-пропил-дитиобензоатом (ЦПТБ) в качестве ОПЦ-агента. Полученные сополимеры с объемной долей звеньев 4-гидроксифенола f = 0.4–0.69 имели среднечисловую молекулярную массу Mn = 2.2–9.5 кДа и индекс полидисперсности Mw/Mn = 1.08–1.12. Детальное исследование ОПЦ-полимеризации 2,2,3,3-тетрафторпропилметакрилата в присутствии различных ОПЦ-агентов, выполненное Григорьевой и соавт. [20], показало, что реакция протекает по механизму ОПЦ-полимери-зации при добавлении 2-циано-2-пропилдоде-цилтритиокарбоната (ЦПДТ) и 4-циано-4-[(додецилсульфанилтиокарбонил)сульфанил]пентановой кислоты (ЦДТПА), причем значения констант передачи цепи Сп для этих ОПЦ-агентов не очень высоки и составляют Сп = 1.6 для ЦПДТ и Сп = 3.2 для ЦДТПА. В работе [21] сообщается об исследовании кинетики ОПЦ-полимеризации пентафторфенилметакрилата в присутствии двух ОПЦ-агентов: ЦПДТБ и КТБ в диоксане. Показано, что в обоих случаях величины Mn полимеров растут с конверсией мономера (вплоть до q = = 75% для КТБ и до q = 45% для ЦПДТБ), а полученные полимеры характеризуются низкими значениями индекса полидисперсности (Mw/Mn < 1.3 для КТБ и <1.15 для ЦПДТБ), что указывает на контролируемый характер полимеризации. Mya и соавт. исследовали ОПЦ-полимеризацию гексафторбутилметакрилата (ГкФБМА) и получили ДС ГкФБМА с поли(пропиленгликоль)акрилатом (ПГА) в присутствии ЦПТБ в трифтортолу-оле (ТФТ) [22]. Насколько нам известно, исследования ОПЦ-полимеризации фтормономеров в среде СК СО2 ограничены пока исследованием ОПЦ-полимеризации фторированных метакрилатов в присутствии некоммерческого агента передачи цепи (ОПЦ-агент) S,S-дипентафторбензилтритиокарбоната [23].
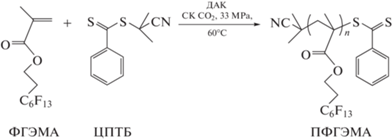
В настоящей работе мы впервые изучили ОПЦ-полимеризацию ФГЭМА в СК СО2 в присутствии коммерчески доступного ОПЦ-агента – ЦПТБ (рис. 1). Полимеризацию проводили при концентрациях ФГЭМА = 0.5 и 1 моль л–1 в присутствии инициатора – динитрила азобисизомасляной кислоты (ДАК) ([ДАК] = 1.85 × 10–3 моль л–1) в СК СО2 при 60°С и давлении Р = 33 МПа в присутствии ЦПТБ и мольном соотношении [ЦПТБ]/[ДАК] = 1–4. Для сравнения эффективности ЦПТБ при полимеризации ФГЭМА в СК СО2 проводилась полимеризация ФГЭМА в растворе ТФТ при 60°С ([ФГЭМА] = 1 моль л–1, [ДАК] = 4 × 10–3 моль л–1, [ЦПТБ]/[ДАК] = 2.5) (табл. 1).
Таблица 1.
Условия полимеризации ФГЭМА в ТФТ и в СК СО2 и молекулярно-массовые характеристики полученных полимеров. В шифре для ПФГЭМА буквы “Т” и “СК” обозначают растворитель, в котором проводили полимеризацию мономера, − ТФТ и СК СО2 соответственно
| Образец ПФГЭМА | [ФГЭМА], моль л–1 | [ЦПТБ]/[ДАК] | Время, ч | q, % | Mn × 10–3 | Mw/Mn | ||
|---|---|---|---|---|---|---|---|---|
| Теор. | ЯМР | ГПХ | ||||||
| Т1 | 1.0 | 2.5 | 4 | 26 | 11.5 | 16.6 | 20.9 | 1.22 |
| Т2 | 1.0 | 2.5 | 5 | 42 | 18.4 | 23.2 | 26.0 | 1.19 |
| Т3 | 1.0 | 2.5 | 7 | 54 | 23.6 | 28.1 | 29.1 | 1.18 |
| Т4 | 1.0 | 2.5 | 8 | 62 | 27.0 | 29.4 | 30.3 | 1.17 |
| СК1 | 0.5 | 2 | 48 | 28 | 16.6 | 27.3 | 32.2 | 1.18 |
| СК2 | 1.0 | 2 | 36 | 23 | 26.9 | 32.7 | 42.3 | 1.2 |
| СК3 | 1.0 | 2 | 42 | 33 | 38.8 | 44.6 | 53.2 | 1.22 |
| СК4 | 1.0 | 2 | 48 | 40 | 47.0 | 50.5 | 54.0 | 1.22 |
| СК5 | 1.0 | 1 | 48 | 37 | 86.7 | 78.1 | 79.3 | 1.25 |
| СК6 | 1.0 | 4 | 48 | 39 | 23.0 | 27.5 | 32.2 | 1.17 |
Условия синтеза и молекулярно-массовые характеристики полученных полимеров приведены в табл. 1. Конверсию ФГЭМА q определяли гравиметрически. $M_{n}^{{{\text{теор}}}}$ полимера рассчитывали по уравнению (1):
(1)
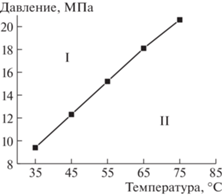
$M_{n}^{{{\text{теор}}}} = {{M}_{{{\text{ЦПТБ}}}}} + \frac{{q{{{\left[ {{\text{ФГЭМА}}} \right]}}_{0}}{{М}_{{{\text{ФГЭМА}}}}}}}{{{{{\left[ {{\text{ЦПТБ}}} \right]}}_{0}}}},$Полимеризация ФГЭМА как в СК СО2, так и в ТФТ протекала в гомогенных условиях. Области растворимости ПФГЭМА в CO2 оценивали путем определения точек помутнения в реакторе высокого давления переменного объема с прозрачными сапфировыми смотровыми окнами производства Sitec. Масса полимера составляла 0.5% от массы CO2. Точки помутнения при заданной температуре регистрировались визуально, когда при медленном снижении давления со скоростью 0.05 МПа с–1 раствор из-за фазового разделения становился мутным. Фазовая диаграмма растворимости системы ПФГЭМА–СК СО2 приведена на рис. 2. Для оценки растворимости ПФГЭМА в СК СО2 выбрали образец Т4, который имеет наиболее высокую молекулярную массу в серии полимеров, полученных в ТФТ. Хорошую растворимость гомополимеров перфторалкил(мет)акрилатов в СК СО2 также наблюдали в работах [9, 24].
Рис. 2.
Фазовая диаграмма смеси СК СО2 и ПФГЭМА (Т4). Область I – гомогенный раствор, область II – двухфазная система.
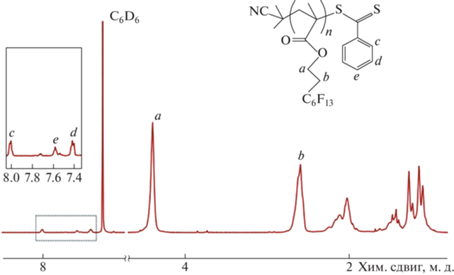
Полученные полимеры были охарактеризованы методами спектроскопии 1Н ЯМР и гель-проникающей хроматографии (ГПХ).
Спектры 1Н ЯМР регистрировали на спектрометре AvanceTM 600 (Bruker, Германия), рабочая частота по протонам 600.22 МГц. Химические сдвиги определены относительно остаточного сигнала C6H6 в С6D6 (7.27 м. д.) и пересчитаны в шкалу ТМС. Точность определения химических сдвигов не хуже 0.001 м. д.
На рис. 3 показан спектр 1H ЯМР ПФГЭМА (Т4). Сигналы с химическими сдвигами при 4.40 и 2.59 м. д. относятся к –СН2-группам в боковой цепи. Кроме того, в спектре синтезированного полимера можно наблюдать уширенные сигналы от пяти фенильных протонов: два орто-протона (8.01 м. д.), один пара-протон (7.58 м. д.) и два мета-протона (7.42 м. д.), относящихся к стабилизирующей концевой дитиобензоатной группе ЦПТБ. Сигнал при 1.97 м. д., относящийся к шести метильным протонам –CH3 уходящей группы ОПЦ-агента, перекрывается уширенным сигналом протонов основной полимерной цепи в ПФГЭМА и поэтому отдельно не обнаруживается. Появление сигналов фенильных протонов дитиобензоатной группы указывает на включение фрагментов ЦПТБ в цепи ПФГЭМА. Этот вывод подтверждается также тем, что все синтезированные ПФГЭМА были окрашены в розовый цвет, характерный для ЦПТБ.
$M_{n}^{{{\text{ЯМР}}}}$определяли из соотношения интегральных интенсивностей сигналов –СН2-группы в боковой цепи при 4.40 м. д. и сигналов орто-протонов фенильной группы ЦПТБ при 8.01 м. д. в спектрах 1Н ЯМР ПФГЭМА (рис. 3), используя уравнение (2):
(2)
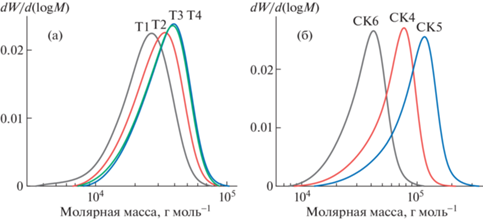
$M_{n}^{{{\text{ЯМР}}}} = \frac{{{{H}_{{\text{C}}}}{{М}_{{{\text{ФГЭМА}}}}}}}{{{{H}_{{\text{F}}}}}},$На рис. 4а показаны кривые молекулярно-массового распределения (ММР) продуктов полимеризации ФГЭМА в ТФТ и в СК СО2.
Анализ проводили на хроматографе Agilent 1200 с рефрактометрическим детектором и колонкой PLgelMiniMix-C и предколонкой PLmixC, в качестве элюента использована смесь ТФТ : ДМФА (9 : 1 по объему), скорость потока 0.3 мл м–1, температура 25°С, калибровка по полистирольным стандартам (ПС).
Независимо от природы растворителя для обеих изученных систем кривые ММР являются унимодальными, а средние молекулярные массы (ММ) растут с увеличением конверсии мономера (q) (табл. 1, рис. 5). Индексы полидисперсности Mw/Mn продуктов полимеризации ФГЭМА в ТФТ и СК CO2 составляют величину порядка 1.20 (табл. 1), что характерно для продуктов радикальной полимеризации с обратимой дезактивацией [12]. Незначительное снижение Mw/Mn с 1.22 до 1.17 с ростом конверсии от 26 до 62% в среде ТФТ близко к погрешности эксперимента, однако согласуется с тенденцией, характерной для контролируемой радикальной полимеризации.
Рис. 5.
Зависимости $M_{n}^{{{\text{теор}}}}$ (1), $M_{n}^{{{\text{ГПХ}}}}$ (2), $M_{n}^{{{\text{ЯМР}}}}$ (3) и Mw/Mn (4) с ростом конверсии ФГЭМА при синтезе в ТФТ (а) и в СК CO2 (б).
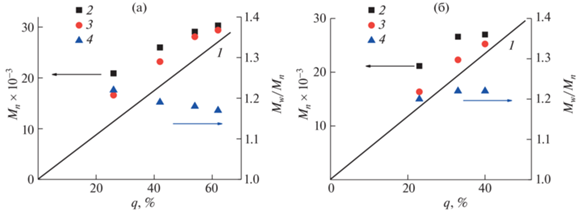
Значения $M_{n}^{{{\text{ЯМР}}}}$ и $M_{n}^{{{\text{ГПХ}}}}$ хотя и растут непрерывно с конверсией мономера, но превышают теоретические величины, рассчитанные по (1) (рис. 5, табл. 1), что может быть обусловлено тем, что исходный ЦПТБ довольно медленно расходуется при полимеризации ФГЭМА как в ТФТ, так и в СК СО2. Как видно из рис. 5, исчерпание ЦПТБ при полимеризации в СК СО2 происходит быстрее (при q ≈ 40%), чем при полимеризации в ТФТ (при q ≈ 60%). Более высокая активность ЦПТБ в СК СО2 может быть связана с повышенной эффективностью инициирования при распаде ДАК в СК СО2 [9]. Экспериментальные значения Mn, определенные методом ГПХ относительно ПС, несколько превышают значения $M_{n}^{{{\text{ЯМР}}}}$, что, вероятно, связано с различием в гидродинамических объемах между ПС и ПФГЭМА в использованном растворителе. Аналогичная ситуация наблюдалась в работе Жирар и соавт. [25] при исследовании полимеризации винилиденфторида в 1,1,1,3,3-пентафторбутане в присутствии о‑этилдитиокарбоната метилового эфира 2-меркаптопропионовой кислоты.
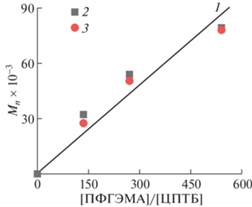
Из рис. 6 видно, что зависимость экспериментальных значений $M_{n}^{{{\text{ГПХ}}}}$ и $M_{n}^{{{\text{ЯМР}}}}$ для ПФГЭМА от отношения [ФГЭМА]/[ЦПТБ] при примерно одинаковой конверсии является линейной (коэффициент корреляции 0.95), как и прогнозируется теоретически в соответствии с (1).
Рис 6.
Зависимость $M_{n}^{{{\text{теор}}}}$ (1), $M_{n}^{{{\text{ГПХ}}}}$ (2) и $M_{n}^{{{\text{ЯМР}}}}$ (3) от мольного отношения [ФГЭМА]/[ЦПТБ] для полимеризации ФГЭМА в СК СО2; q ≈ 40%, [ДАК] = 1.0 × × 10–2 моль л–1, Т = 60°С.
Таким образом, полученные результаты позволяют сделать вывод о том, что полимеризация ФГЭМА с ЦПТБ в качестве ОПЦ-агента в СК СО2 протекает в гомогенных условиях по механизму ОПЦ-полимеризации. Сравнение молекулярно-массовых характеристик полимеров, полученных при похожих условиях ОПЦ-полимеризацией ФГЭМА в СК СО2 и в ТФТ, показало, что эффективность ЦПТБ в СК СО2 выше его эффективности при проведении реакции в ТФТ, что делает использование экологически чистого заменителя фторуглеводородов в процессах получения фторсодержащих полимеров, протекающих по механизму ОПЦ-полимеризации, более предпочтительным не только с точки зрения соответствия принципам “зеленой химии”.
Список литературы
Mitra D., Kang E.-T., Neoh K.G. // ACS Appl. Polym. Mater. 2021. V. 3. P. 2233−2263. https://doi.org/10.1021/acsapm.1c00125
Chekurov K.E., Barabanova A.I., Blagodatskikh I.V., Lokshin B.V., Kondratenko M.S., Gallyamov M.O., Peregudov A.S., Khokhlov A.R. // J. Appl. Polym. Sci. 2021. V. 138. Article 49714. https://doi.org/10.1002/app.49714
Chekurov K.E., Barabanova A.I., Blagodatskikh I.V., Lokshin B.V., Peregudov A.S., Abramchuk S.S., Khokhlov A.R. // Dokl. Chem. 2019. V. 484. № 2. P. 33–36. https://doi.org/10.1134/S0012500819020010
Zefirov V.V., Lubimtsev N.A., Stakhanov A.I., Elmanovich I.V., Kondratenko M.S., Lokshin B.V., Gal-lyamov M.O., Khokhlov A.R. // J. Supercrit. Fluids. 2018.V. 133. № 1. P. 30–37. https://doi.org/10.1016/j.supflu.2017.09.020
Yampolskii Yu.P., Belov N.A., Alentiev A.Yu. // Russ. Chem. Rev. 2019. V. 88. № 4. P. 387–405. https://doi.org/10.1070/RCR4861
Melnikov P.V., Aleksandrovskaya A.Yu., Safonov A.V., Po-pova N.M., Spitsin B.V., Naumova A.O., Zaitsev N.K. // Mendeleev Commun. 2020. V. 30. P. 453–455. https://doi.org/10.1016/j.mencom.2020.07.015
Arita T., Beuermann S., Buback M., Vana P. // Macromol. Mater. Eng. 2005. V. 290. P. 283–293. https://doi.org/10.1002/mame.200400274
Alekseev E.S., Alentiev A.Yu., Belova A.S., Bogdan V.I., Bogdan T.V., Bystrova A.V., Gafarova E.R., Golubeva E.N., Grebenik E.A., Gromov O.I., Davankov V.A., Zlotin S.G., Kiselev M.G., Koklin A.E., Kononevich Yu.N., Lazh-ko A.E., Lunin V.V., Lyubimov S.E., Martyanov O.N., Mishanin I.I., Muzafarov A.M., Nesterov N.S., Nikola-ev A.Yu., Oparin R.D., Parenago O.O., Parenago O.P., Pokusaeva Ya.A., Ronova I.A., Solovieva A.B., Temni-kov M.N., Timashev P.S., Turova O.V., Filatova E.V., Philippov A.A., Chibiryaev A.M., Shalygin A.S. // Russ. Chem. Rev. 2020. V. 89. № 12. P. 1337–1427. https://doi.org/10.1070/RCR4932
DeSimone J., Guan M.Z., Elsbernd C.S. // Science. 1992. V. 257. P. 945–947. https://doi.org/10.1126/science.257.5072.945
Combes J.R., Guan Z., DeSimone J.M. // Macromolecules.1994. V. 27. P. 865–867. https://doi.org/10.1021/ma00081a036
Du L., Kelly J.Y., Roberts G.W., DeSimone J.M. // J. Supercrit. Fluids. 2009. V. 47. P. 447–457. https://doi.org/10.1016/j.supflu.2008.11.011
Jenkins A.D., Jones R.G., Moad G. // Pure Appl. Chem. 2009. V. 82. P. 483–491. https://doi.org/10.1351/PAC-REP-08-04-03
Wang X., Shen L., An Z. // Prog. Polym. Sci. 2018. V. 83. P. 1–27. https://doi.org/10.1016/j.progpolymsci.2018.05.003
Moad G., Rizzardo E., Thang S.H. // Aust. J. Chem. 2012. V. 65. P. 985–1076.https://doi.org/10.1071/CH12295
Grishin D.F., Grishin I.D. // Russ. Chem. Rev. 2021. V. 90. № 2. P. 231–264. https://doi.org/10.1070/RCR4964
Li G., Xu A., Geng B., Yang S., Wu G., Zhang S. // J. Fluor. Chem. 2014. V. 165. P. 132–137. https://doi.org/10.1016/j.jfluchem.2014.06.029
Huo M., Zeng M., Li D., Liu L., Wei Y., Yuan J. // Macromolecules. 2017. V. 50. № 20. P. 8212–8220.https://doi.org/10.1021/acs.macromol.7b01629
Huo M., Zhang Y., M. Zeng M., Liu L., Wei Y., Yuan J. // Macromolecules. 2017. V. 50. № 20. P. 8192–8201. https://doi.org/10.1021/acs.macromol.7b01437
Wang C., Li X., Deng H. // ACS Macro Lett. 2019. V. 8. № 4. P. 368–373. https://doi.org/10.1021/acsmacrolett.9b00178
Grigoreva A., Polozov E., Zaitsev S. // J. Fluor. Chem. 2020. V. 232. Article 109484. https://doi.org/10.1016/j.jfluchem.2020.109484
Eberhardt M., Théato P. // Macromol. Rapid Commun. 2005. V. 26. № 18. P. 1488–1493. https://doi.org/10.1002/marc.200500390
Mya K.Y., Lin E.M.J., Gudipati C.S., Gose H.B.A.S., He C. // J. Phys. Chem. B. 2010. V. 114. № 28. P. 9128–9134. https://doi.org/10.1021/jp102919t
Chen J.G., Feng X., Wang M.X., Shen S.K., Li Y., Wang W., Liu Z.T., Liu Z.W., Jiang J.Q., Lu J. // J. Polym. Sci. A. Polym. Chem. 2015. V. 54. P. 825–834. https://doi.org/10.1002/pola.27919
Mawson S., Johnston K.P., Combes J.R., DeSimone J.M. // Macromolecules. 1995. V. 28. P. 3182–3191. https://doi.org/10.1021/ma00113a021
Girard E., Marty J.-D., Ameduri B., Destarac M. // ACS MacroLett. 2012. V. 1. P. 270−274. https://doi.org/10.1021/mz2001143
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах