Доклады Российской академии наук. Химия, науки о материалах , 2022, T. 503, № 1, стр. 9-15
Структура и биологические свойства 2-фенилгидразоновых производных тиазолопиримидинов
А. С. Агарков 1, *, Э. Р. Габитова 2, Ф. Б. Галиева 1, А. С. Овсянников 1, А. Д. Волошина 1, А. К. Ширяев 3, И. А. Литвинов 1, С. Е. Соловьева 1, член-корреспондент РАН И. С. Антипин 1
1 Институт органической и физической химии
им. А.Е. Арбузова – обособленное структурное подразделение ФИЦ “Казанский научный центр Российской академии наук”
420111 Казань, Россия
2 Казанский (Приволжский) федеральный университет
420008 Казань, Россия
3 Самарский государственный технический университет
443100 Самара, Россия
* E-mail: artem.agarkov.95.chem@mail.ru
Поступила в редакцию 09.02.2022
После доработки 11.03.2022
Принята к публикации 21.03.2022
- EDN: LCPVUP
- DOI: 10.31857/S2686953522020029
Аннотация
Синтезирован ряд 2-фенилгидразоновых производных тиазоло[3,2-a]пиримидинов и проведено исследование их структуры и биологической активности. Структура полученных соединений подтверждена данными 1Н и 13C ЯМР-спектроскопии и рентгеноструктурного анализа. Установлено, что для синтезированных производных характерна гидразонная форма, а также Z-конфигурация относительно C=N-связи. Показана низкая цитотоксичность синтезированных соединений в отношении нормальных и опухолевых клеточных линий.
Тиазоло[3,2-a]пиримидины являются перспективными структурными фрагментами для разработки лекарственных веществ, в том числе и противораковых препаратов [1–3]. Строение этих гетероциклов напоминает пурин, что может быть использовано в конструировании структур, активно связывающихся с биологическими мишенями. В литературе известны гидразоновые производные как гетероциклической, так и алициклической природы, проявляющие бактериостатическую активность, а также противотуберкулезное, жаропонижающее, обезболивающее и противоопухолевое действие [4]. В связи с этим представляет интерес изучение структуры и биологических свойств производных, включающих как тиазолопиримидиновый, так и гидразоновый фрагменты.
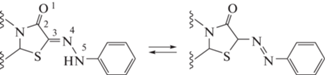
Тиазоло[3,2-a]пиримидиноны имеют нуклеофильный центр – метиленовую группу, обладающую повышенными кислотными свойствами из-за сопряжения образующегося карбаниона с карбонильной группой, что дает возможность введения различных функциональных групп путем взаимодействия с электрофильными реагентами [5–9]. Ранее нами был разработан метод синтеза фенилгидразоновых производных тиазоло[3,2-a]пиримидина [8] с использованием соли диазония в качестве электрофильного реагента. Однако ряд важных вопросов структуры полученных соединений, связанных с возможностью существования двух таутомеров (азо-гидразонная таутомерия) [10–12] и двух геометрических изомеров (Z и E) относительно C=N- или N=N-связей, остались открытыми.
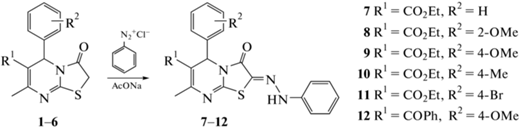
В настоящей работе был синтезирован ряд производных тиазолопиримидинов 7−12 (схема 1), содержащих 2-фенилгидразоновый фрагмент, в которых варьировались заместители как в ароматическом кольце (2-OMe, 4-OMe, 4-Me, 4-Br), так и при шестом атоме углерода гетероцикла.
Для соединений такого типа характерна азо-гидразонная таутомерия и, следовательно, возможность образования двух таутомеров (схема 2). Одной из целей работы стало определение количества таутомеров и их соотношения в растворе и кристаллической фазе.
Для решения данного вопроса были получены экспериментальные данные ЯМР-спектроскопии. Во всех спектрах 1H ЯМР синтезированных соединений наблюдается одинаковый набор сигналов, что свидетельствует о существовании в растворе одного таутомера. В табл. 1 приведены спектральные данные синтезированных соединений 7−12, зарегистрированные в ДМСО-d6. В спектрах присутствуют наборы сигналов в характерных областях, в частности, мультиплетов ароматических протонов, синглетов метильной и метиновых протонов, а также триплет и мультиплет сложноэфирной группировки. Мультиплетный характер сигнала обусловлен наложением двух квадруплетов друг на друга. Этот факт вызван близостью метиленовой группы к асимметрическому атому углерода C5. Однако в слабопольной части спектра присутствует синглет, который можно приписать как к протону группы CH, так и к протону группы NH. Наблюдаемая величина химического сдвига указывает на наличие в данных соединениях скорее гидразонной, чем азо-группы. Стоит отметить, что химический сдвиг данного протона сильно зависит от протоноакцепторности используемого растворителя: 7−9 м. д. в CDCl3 [8] и около 11 м. д. в ДМСО-d6, что также свидетельствует об образовании гидразона. Дополнительным аргументом в пользу гидразонного фрагмента являются спектры 13C DEPT ЯМР, в которых не наблюдалось положительного сигнала метинового атома углерода.
Таблица 1.
Спектральные характеристики соединений 7−12
| Соединение | 1H ЯМР (Avance “Bruker”, 600 МГц, ДМСО-d6, δ, м. д., J, Гц) |
|---|---|
| 7 | 1.12−1.14 (3H, т, J 6.8 Гц, CH3), 2.40 (3H, с, CH3), 4.03−4.10 (2H, м, CH2), 6.03 (1H, с, CH), 6.98−7.01 (1H, м, Hаром.), 7.24−7.36 (9H, м, Hаром.), 10.93 (1H, с, NH) |
| 8 | 1.11−1.13 (3H, т, J 6.8 Гц, CH3), 2.46 (3H, с, CH3), 3.63 (3H, с, CH3), 4.13−4.19 (2H, м, CH2), 5.75 (1H, с, CH), 6.89−7.10 (4H, м, Hаром.), 7.24−7.40 (5H, м, Hаром.), 10.91 (1H, с, NH) |
| 9 | 1.12−1.14 (3H, т, J 6.8 Гц, CH3), 2.39 (3H, с, CH3), 3.65 (3H, с, CH3), 4.05−4.10 (2H, м, CH2), 6.12 (1H, с, CH), 6.90−6.92 (2H, м, Hаром.), 6.99−7.12 (3H, м, Hаром.), 7.25−7.27 (2H, м, Hаром.), 7.30−7.38 (2H, м, Hаром.), 10.95 (1H, с, NH) |
| 10 | 1.12−1.14 (3H, т, J 6.8 Гц, CH3), 2.11 (3H, с, CH3), 2.39 (3H, с, CH3), 4.06−4.10 (2H, м, CH2), 6.17 (1H, с, CH), 7.02−7.12 (3H, м, Hаром.), 7.29−7.33 (6H, м, Hаром.), 10.93 (1H, с, NH) |
| 11 | 1.13−1.15 (3H, т, J 6.8 Гц, CH3), 2.45 (3H, с, CH3), 4.00−4.06 (2H, м, CH2), 6.00 (1H, с, CH), 6.98−7.00 (1H, м, Hаром.), 7.22−7.23 (2H, м, Hаром.), 7.25−7.27 (2H, м, Hаром.), 7.30−7.33 (2H, м, Hаром.), 7.55−7.57 (2H, м, Hаром.), 10.96 (1H, с, NH) |
| 12 | 1.70 (3H, с, CH3), 3.36 (3H, с, CH3), 3.63 (3H, с, CH3), 6.23 (1H, с, CH), 6.85−6.88 (1H, м, Hаром.), 6.95−7.00 (3H, м, Hаром.), 7.21−7.26 (3H, м, Hаром.), 7.30−7.33 (2H, м, Hаром.), 7.45−7.49 (2H, м, Hаром.), 7.58−7.62 (3H, м, Hаром.), 10.90 (1H, с, NH) |
Для однозначного определения структуры исследуемых соединений пригодный для РСА монокристалл соединения 11 был получен медленным испарением растворителя из этанольного раствора. Данные РСА полностью согласуются с данными ЯМР-спектроскопии. В табл. 2 проведено сравнение экспериментальных длин связей фрагмента O=C−C=N−NH.
Таблица 2.
Длины связей d фрагмента O=C−C=N−NH в соединении 11
| Связьа | Экспериментальное значение d, Å | Связь | Литературные данные [13] d, Å |
|---|---|---|---|
| O1−C2 | 1.210(2) | C−O | 1.43 |
| C=O | 1.21 | ||
| C2−C3 | 1.477(2) | C−C | 1.54 |
| C=C | 1.34 | ||
| C3−N4 | 1.279(2) | C−N | 1.47 |
| C=N | 1.28 | ||
| N4−N5 | 1.328(2) | N−N | 1.45 |
| N=N | 1.24 |
а Нумерация атомов соответствует схеме 2.
Результаты РСА соединения 11 депонированы в Кембриджской базе кристаллоструктурных данных, номер депозита CCDC 2153713.
Из данных табл. 2 видно, что длина связи между атомами тиазольного атома углерода C3 и азота N4, составляет 1.279(2) Å, что соответствует двойной связи С=N, и подтверждает наличие одного таутомера – гидразонной формы. Но обращает на себя внимание тот факт, что длины связей С2−С3 (1.477(2) Å) и N4−N5 (1.328 Å) являются более короткими по сравнению с соответствующими одинарными связями (1.54 и 1.45 Å соответственно), что свидетельствует о наличии сопряжения в этом фрагменте, включая фенильное кольцо при атоме N5. Плоская конформация фрагмента молекулы, включающего гидразонную группу, пятичленный гетероцикл и фенильное кольцо, благоприятна для такого сопряжения (схема 3).
Геометрия молекулы и фрагмент кристаллической упаковки соединения 11 приведены на рис. 1.
Рис. 1.
(а) Геометрия независимой части кристалла соединения 11. Эллипсоиды анизотропных смещений приведены с вероятностью 50%. Для разупорядоченной молекулы этанола показано основное положение (с более высокой заселенностью позиций атомов). (б) Фрагмент упаковки кристалла соединения 11. Проекция вдоль оси b. Н-связи показаны пунктиром.
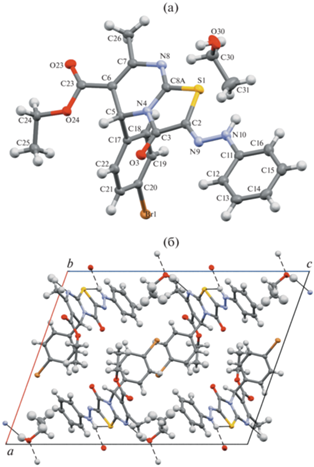
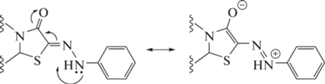
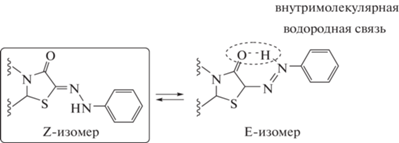
Интересно отметить, что данное соединение имеет Z-конфигурацию, хотя с термодинамической точки зрения должен быть более выгодным E-изомер из-за возможного образования внутримолекулярной водородной связи N−H···O, приводящей к его стабилизации (схема 4).
Образование Z-изомера вызвано тем, что N−H-связь участвует во внутримолекулярном водородном связывании не с более жестким атомом кислорода (схема 4), а с мягким атомом серы (рис. 2). Кроме того, N−H-связь образует водородную связь с сольватной молекулой этанола. Это достаточно редкий супрамолекулярный мотив формирования внутримолекулярных водородных связей в кристаллической фазе.
Рис. 2.
Система водородных связей в кристалле соединения 11 (центросимметричный димер). Н-связи показаны пунктиром.
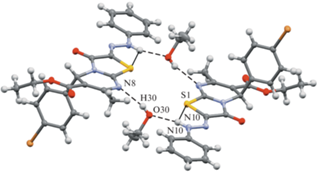
Основываясь на данных метода РСА, соединение 11 в кристаллической фазе имеет водородную связь нескольких типов: внутримолекулярная N−H···S, межмолекулярная между молекулами этанола и лиганда N−H···O, межмолекулярная между лигандом и симметрически зависимой молекулой этанола О−H···N (табл. 3).
Таблица 3.
Данные о водородном связывании в кристаллической фазе в соединении 11
| Внутримолекулярная водородная связь N10−H10…S1 | ||
|---|---|---|
| Номера атомова | Межатомное расстояние, Å | Угол, град. |
| N10−H10 | 0.86 | 107 |
| H10···S1 | 2.74 | |
| N10···S1 | 3.1066(17) | |
| Межмолекулярная водородная связь O30−H30···N8 | ||
| O30−H30 | 0.76(3) | 164.(3) |
| H30···N8 | 2.08(3) | |
| O30···N8 | 2.823(2) | |
| Межмолекулярная водородная связь N10–H10···O30 | ||
| N10−H10 | 0.86 | 165 |
| H10···O30 | 1.99 | |
| N10···O30 | 2.830(2) | |
| Внутримолекулярная водородная связь N10−H10···S1 | ||
| N10/H10 | 0.86 | 107 |
| H10/S1 | 2.74 | |
| N10/S1 | 3.1066(17) | |
| Межмолекулярная водородная связь N8−H30···O30 | ||
| O30/H30 | 0.76(3) | 164.(3) |
| H30/N8 | 2.08(3) | |
| O30/N8 | 2.823(2) | |
| Межмолекулярная водородная связь N10−H10···O30 | ||
| N10/H10 | 0.86 | 165 |
| H10/O30 | 1.99 | |
| N10/O30 | 2.830(2) | |
а Нумерация атомов соответствует рис. 2.
Для выявления возможных областей биологической активности синтезированных соединений было проведено компьютерное моделирование с помощью сервиса PASSоnline [14]. Наличие фенилгидразонового фрагмента, видимо, обеспечивает наибольшую вероятность проявления активности в отношении ингибирования инсулиназы и фосфатазы, которые играют ключевую роль в регуляции клеточного цикла и чрезмерно экспрессируется при многих видах рака.
В связи с этим полученные соединения 7−11 были исследованы на цитотоксичность в отношении нормальных и опухолевых клеточных линий человека. Оценка их цитотоксического действия проводилась путем подсчета жизнеспособных клеток с помощью многофункциональной системы Cytell Cell Imaging (GE Helthcare Life Science, Швеция) с использованием приложения Cell Viability BioApp, которое позволяет точно подсчитать количество клеток, оценить их жизнеспособность на основании интенсивности флуоресценции.
Из данных табл. 4 видно, что соединения 7−11, содержащие как тиазолопиримидиновый, так и гидразоновый фрагменты, практически не проявляют цитотоксического действия на изученные линии клеток. Данный факт согласуется с прогнозом сервиса PASSоnline, в соответствии с которым вероятность проявления исследуемой активности составляла всего 40−70%. Стоит отметить, что синтезированные соединения являются нетоксичными и в отношении нормальных клеточных линий.
Таблица 4.
Цитотоксичность синтезированных производных в отношении нормальных и опухолевых клеточных линий
| Соединение | Концентрация полумаксимального ингибирования IC50, μM | ||||
|---|---|---|---|---|---|
| Опухолевые клеточные линии | Нормальные клеточные линии | ||||
| M-HeLaа | MCF-7б | РС3в | HuTu 80г | Chang liverд | |
| 7 | 82.6 ± 7.6 | 67.3 ± 5.3 | 60.1 ± 5.4 | >100 | 94.0 ± 8.2 |
| 8 | >100 | >100 | >100 | >100 | 70.1 ± 6.7 |
| 9 | 75.5 ± 6.4 | 69.7 ± 5.2 | 91.6 ± 8.3 | 96.2 ± 8.3 | 94.0 ± 7.9 |
| 10 | 94 ± 8.4 | 70.3 ± 5.5 | >100 | >100 | 97.0 ± 8.3 |
| 11 | >100 | >100 | >100 | >100 | >100 |
| Доксорубицине | 3.0 ± 0.1 | 3.0 ± 0.2 | 2.6 ± 0.2 | − | 3.0 ± 0.2 |
а Эпителиоидная карцинома шейки матки. б Аденокарцинома F-протоков молочной железы. в Клеточная линия аденокарциномы предстательной железы. г Аденокарцинома двенадцатиперстной кишки. д Клетки печени человека. е Противоопухолевый антибиотик антрациклинового ряда, широко используемый в качестве препарата сравнения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворители очищали по описанным методикам [15]. Все реактивы (Acros, Alfa Aesar) использовали без дальнейшей очистки. Синтез исходных 1,2,3,4-тетрагидропиримидин-2-тионов и тиазоло[3,2-a]пиримидинов был осуществлен по известным литературным методикам [16, 17 ] .
Чистоту соединений контролировали методом тонкослойной хроматографии на пластинках Silufol UV 254 с визуализацией в ультрафиолетовой лампе VL-6.LC (трубка 6W–254 нм). Точки плавления были определены на плавильном столике BOETIUS с устройством визуализации РНМК 05.
ИК-спектры были записаны на ИК-спектрометре Bruker Vector 22 в таблетках KBr в диапазоне волновых чисел 400–4000 см–1.
MALDI масс-спектры высокого разрешения регистрировали на масс-спектрометре Ultraflex III TOF/TOF (Bruker Daltonik GmbH, Германия) в режиме рефлектрона (разрешение 10 000) с использованием Nd:YAG лазера, λ = 266 нм. Относительная ошибка определения точной массы составила 3.9 м. д. Образцы на мишень наносили методом “сухой капли”. Раствор п-нитроанилина в ацетонитриле (p-NA) (0.5 мкл, 10 мг мл–1) и 0.5 мкл смеси образца в CHCl3 (0.5 мкл, 1 мг мл−1) последовательно наносили на металлическую мишень MTP AnchorChipTM и испаряли. Данные обрабатывали программами Flex Control (Bruker Daltonik GmbH, Германия) и FlexAnalysis 3.0 (Bruker Daltonik GmbH, Германия). Масс-спектры высокого разрешения с ионизацией электрораспылением (HRESI-MS) были получены на приборе Agilent iFunnel 6550 Q-TOF LC/MS. Газ-носитель – азот, температура 300°C, расход носителя 12 л мин−1, давление в распылителе 275 кПа, напряжение в воронке 3500 В, капиллярное напряжение 500 В, режим записи общего ионного тока, диапазон масс 100−3000 м с–1, скорость сканирования 7 спектров/с. Спектры 1H и 13C ЯМР были записаны в растворах ДМСО-d6 и CDCl3 с использованием сигнала растворителя в качестве внутреннего эталона.
Методика синтеза 2-фенилгидразонов тиазоло[3,2-а]пиримидинов 11 и 12. Холодный раствор нитрита натрия (1 ммоль) в воде (3 мл) добавляли по капля к суспензии гидрохлорида анилина (1 ммоль) в воде (5 мл) при перемешивании и температуре 0−5°C в течение 1ч. Полученный раствор хлорида фенилдиазония (1 ммоль) добавляли по каплям при перемешивании при 0−5°C в холодной раствор соответствующего тиазо-ло[3,2-а]пиримидина 5 или 6 (1 ммоль) и ацетата натрия (1.1 ммоль) в этиловом спирте (10 мл). Смесь перемешивали при комнатной температуре в течение еще 2 ч, а затем разбавляли водой. Сырой осадок отфильтровывали, промывали водой и перекристаллизовывали из этилового спирта.
Этил (Z)-7-метил-5-(4-бромфенил)-3-оксо-2-(2-фенилгидразинелиден)-2,3-дигидро-5H-тиазоло[3,2-а]пиримидин-6-карбоксилат (11). Выход 65%, кристаллы желтого цвета, Тпл. 165−167°C. Rf (CHCl3 : EtOH = 98 : 2) 0.45. ИК (KBr, ${v}$, см−1): 3220 (NH), 1741 (C=O), 1712 (C=O). m/z (MALDI): 499.2 [M+]. 1H ЯМР: 1.12−1.14 (3H, т, J 6.8 Гц, CH3), 2.39 (3H, с, CH3), 4.00−4.06 (2H, м, CH2), 6.00 (1H, с, CH), 6.98−7.00 (2H, м, Наром.), 7.22−7.23 (2H, м, Наром.), 7.25−7.27 (2H, м, Наром.), 7.30−7.33 (2H, м, Наром.), 7.55−7.57 (2H, м, Наром.), 10.96 (1H, с, NH).13C ЯМР (ДМСО-d6, 100.62 МГц, 298 K) 14.0, 29.7, 57.4, 61.3, 115.4, 123.0, 124.6, 128.3, 128.6, 129.6, 130.0, 130.5, 131.0, 133.1, 142.8, 148.6, 152.6, 154.8. HRESI-MS, m/z [M + H]+: 499.0431, 500.0459, 501.0414, 502.044 (найдено); 499.0434, 500.0468, 501.0414, 502.0448 (вычислено для C22H20BrN4O3S+).
Этил (Z)-6-бензоил-5-(2-метоксифенил)-7-ме- тил-2-(2-фенилгидразинелиден)-5H-тиазоло[3,2-а]пи-римидин-3(2H)-он (12). Выход 65%, кристаллы желтого цвета, Тпл. 178−180°C. Rf (CHCl3 : EtOH = = 98 : 2) 0.5. ИК (KBr, ${v}$ см−1): 3247 (NH), 1735 (C=O), 1715 (C=O). m/z (MALDI): 484.3 [M+]. 1H ЯМР: 1.70 (3H, с, CH3), 3.36 (3H, с, CH3), 3.63 (3H, с, CH3), 6.23 (1H, с, CH), 6.85−6.88 (1H, м, Наром.), 6.95−7.00 (3H, м, Наром.), 7.21−7.26 (3H, м, Наром.), 7.30−7.33 (2H, м, Наром.), 7.45−7.49 (2H, м, Наром.), 7.58−7.62 (3H, м, Наром.), 10.90 (1H, с, NH). 13C ЯМР (ДМСО-d6, 100.62 МГц, 298 K): 20.5, 55.7, 58.3, 112.4, 114.0, 121.2, 122.6, 127.8, 128.0, 131.2, 131.5, 131.9, 133.6, 139.8, 142.4, 148.6, 152.6, 154.8, 158.5, 167.3, 187.4. Найдено, %: C, 66.78: H, 5.63; N, 11.32; O, 9.84; S, 6.43. HRESI-MS, m/z [M + + H]+: 483.1481, 484.1513 (найдено); 483.1485, 484.1519 (вычислено для C27H23N4O3S+).
Рентгеноструктурное исследование кристалла соединения 11 выполняли на автоматическом трехкружном дифрактометре Bruker D8 QUEST с двумерным детектором PHOTON III и микрофокусной рентгеновской трубкой IμS DIAMOND (λ[MoKα] = 0.71073 Å) при 100(2) K. Сбор и обработку дифракционных данных проводили использованием пакета программ APEX3.
Для проведения экспериментов использовали опухолевые культуры клеток М-HeLa клон 11 (эпителиоидная карцинома шейки матки, сублиния HeLa, клон M-HeLa), HuTu 80 – аденокарциномы двенадцатиперстной кишки человека из коллекции Института цитологии РАН (Санкт-Петербург); PC3 − клеточная линия аденокарциномы предстательной железы из ATCC (American Type Cell Collection, USA; CRL 1435); клетки печени человека (Chang liver) из коллекции и НИИ вирусологии РАМН (Москва). Цитотоксическое действие определяли путем подсчета жизнеспособных клеток с помощью многофункциональной системы Cytell Cell Imaging (GE Helthcare Life Science, Швеция), используя приложение Cell Viability BioApp, которое позволяет точно подсчитать количество клеток, оценить их жизнеспособность на основании интенсивности флуоресценции. Для культивирования клеток использовали стандартную питательную среду “Игла” производства Московского института полиомиелита и вирусных энцефалитов им. М.П. Чумакова фирмы “ПанЭко” с добавлением 10% эмбриональной телячьей сыворотки и 1% заменимых аминокислот (NEAA). Рассев клеток проводили на 96-луночную панель фирмы “Eppendorf” в концентрации 100 тыс. кл./мл в каждую лунку в объеме 150 мкл среды и культивировали в СО2-инкубаторе при 37°С. Культуральную среду отбирали через 24 ч после посадки клеток в лунки, а в лунки вносили по 150 мкл растворов изучаемого препарата в заданных разведениях. Разведения соединений готовили непосредственно в ростовой питательной среде с добавлением 5% ДМСО для улучшения растворимости. Цитотоксическое действие исследуемых соединений определяли в концентрациях 1−100 мкМ. Расчет IC50, концентрации препарата, вызывающей торможение роста клеток на 50%, выполняли с помощью программы MLA−“Quest Graph™ IC50 Calculator”.
Таким образом, синтезирован ряд 2-фенилгидразоновых производных тиазоло[3,2-a]пиримидинов, в том числе две новые структуры (11, 12), установлена их структура. Методом РСА показано, что данные производные находятся в гидразонной форме и Z-конфигурации относительно C=N-связи. Синтезированные соединения не являются цитотоксичными ни к опухолевым, ни нормальным клеточным линиям.
Список литературы
Keshari A.K., Singh A.K., Saha S. // Mini-Rev. Med. Chem. 2017. V. 17. P. 1488–1499. https://doi.org/10.2174/1389557517666170216142113
Chen L., Jin Y., Fu W., Xiao S., Feng S., Fang B., Gu Y., Li C., Zhao Y., Liu Z., Liang G. // ChemMedChem. 2017. V. 12. P. 1022–1032. https://doi.org/10.1002/cmdc.201700175
Kashyap S.J., Sharma P.K., Garg V.K., Dudhe R., Kumar N. // J. Adv. Sci. Res. 2011. V. 2. P. 18−24.
Kajal A., Bala S., Sharma N., Kamboj S., Saini V. // Int. J. Med. Chem. 2014. V. 2014. Article ID 761030. https://doi.org/10.1155/2014/761030
Lashmanova E.A., Rybakov V.B., Shiryaev A.K. // Synthesis. 2016. V. 48. № 22. P. 3965−3970. https://doi.org/10.1055/s-0035-1562459
Ширяев А.К., Барановская Н.С., Ерёмин М.С. // Химия гетероцикл. соед. 2012. Т. 48. С. 1662−1667.
Ширяев А.К., Колесникова Н.Г., Кузнецова Н.М., Лашманова Е.А. // Химия гетероцикл. соед. 2013. Т. 49. С. 1812−1817.
Lashmanova E.A., Kirdyashkina A.I., Slepukhin P.A., Shiryaev A.K. // Tetrahedron Lett. 2018. V. 59. № 12. P. 1099−1103. https://doi.org/10.1016/j.tetlet.2018.02.014
Lashmanova E.A., Agarkov A.S., Rybakov V.B., Shirya-ev A.K. // Chem. Heterocycl. Compd. 2019. V. 55. № 12. P. 1217−1221. https://doi.org/10.1007/s10593-019-02604-4
Pavlovic G., Racane L., Cicak H., Tralic-Kultnovic V. // Dyes Pigm. 2009. V. 83. № 3. P. 354−362. https://doi.org/10.1016/j.dyepig.2009.06.002
Ozen A.S., Doruker P., Aviyente V. // J. Phys. Chem. A. 2007. V. 111. № 51. P. 13506−13514. https://doi.org/10.1021/jp0755645
Ball P., Nicholls C.H. // Dyes Pigm. 1982. V. 3. № 1. P. 5−26. https://doi.org/10.1016/0143-7208(82)80010-7
Rumble J. CRC Handbook of Chemistry and Physics. (102nd Ed.). CRC Press, 2021. 1624 p.
PASSOnline [Internet]. Way2Drug: Understanding Chemical-Biological Interactions. http://www.way2drug.com/PASSOnline/index.php (Ссылка активна на 19.01.2022).
Armarego W.L.F., Chai C.L.L. Purification of Laboratory Chemicals. Oxford: Elsevier, 2009. 743 p.
Jetti S.R., Bhatewara A., Kadre T., Jain S. // Chin. Chem. Lett. 2014. V. 25. № 3. P. 469−473. https://doi.org/10.1016/j.cclet.2013.12.022
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах