Доклады Российской академии наук. Химия, науки о материалах , 2022, T. 503, № 1, стр. 16-20
Люминесценция ионов тербия в водных растворах сополимеров стиролсульфоната натрия с 4-метакрилоиламидосалициловой кислотой
Т. Н. Некрасова 1, Н. А. Нестерова 1, *, А. И. Фишер 1, 2, И. И. Гаврилова 1, А. П. Катасонова 1, член-корреспондент РАН Е. Ф. Панарин 1
1 Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный Технологический институт (Технический университет)
190013 Санкт-Петербург, Россия
* E-mail: lab.2305@mail.ru
Поступила в редакцию 25.11.2021
После доработки 21.02.2022
Принята к публикации 28.02.2022
- EDN: LLJGAO
- DOI: 10.31857/S2686953522020054
Аннотация
Синтезированы водорастворимые сополимеры стиролсульфоната натрия и 4-метакрилоиламидосалициловой кислоты состава 93/7 мол. % и исследовано их взаимодействие с ионами тербия и гадолиния с целью получения люминесцирующих зондов, перспективных для визуализации их в биомедицинских исследованиях. Показано, что в водных растворах в интервале концентраций сополимера 0.15–1.7 мг мл–1 и соотношении [Tb3+]/[СОО–] = 1 образуются водорастворимые люминесцирующие металлополимерные комплексы с длительностью свечения 823 мкс. При частичной замене в комплексе ионов Tb3+ на ионы Gd3+ формируются биметаллические комплексы с интенсивной люминесценцией.
Развивающаяся в настоящее время пандемия коронавируса стимулирует поиск новых противовирусных средств как среди низкомолекулярных, так и среди водорастворимых высокомолекулярных веществ. Среди полимеров высокий интерес исследователей вызывают полианионы, в частности сульфосодержащие полимеры, например, полистиролсульфонат натрия (поли-ССNa), поливинилсульфонат натрия и др., которые активны в отношении различных вирусов (гриппа, ВИЧ, герпеса, бешенства и др.) [1, 2]. Для биовизуализации клеток, вирусов, тканей и биологических процессов в последнее время используют металлополимерные комплексы лантаноидов − Eu3+, Tb3+ [3–6].
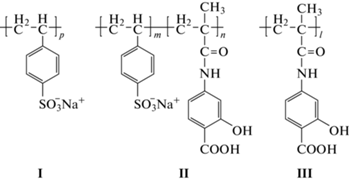
Для исследования взаимодействия полистиролсульфоната натрия (I) с вирусами и клетками в данной работе осуществлен синтез сополимера (II) стиролсульфоната натрия (ССNa) с 4-метакрилоиламидосалициловой кислотой (МАСК). Объекты исследования представлены на рис. 1. На их основе изучены условия формирования люминесцирующих комплексов ионов Tb3+ в водных растворах. 4-Аминосалициловая кислота является противотуберкулезным препаратом, а ее полимерные производные образуют люминесцирующие комплексы с Eu3+, Tb3+ [7, 8]. То есть синтезированный сополимер обладает полифункциональной биологической активностью.
Рис. 1.
Структурные схемы объектов исследования. Полистиролсульфонат натрия (I), сополимер стиролсульфоната натрия с 4-метакрилоиламидосалициловой кислотой (II), полиметакрилоиламидосалициловая кислота (III).
Сополимер и гомополимеры получали методом радикальной (со)полимеризации в растворах (ДМФА, ДМСО) в присутствии динитрила азобисизомасляной кислоты (ДАК) в качестве инициатора при 65°С в течение 24 ч. Выделяли полученные полимеры диализом против воды с последующей лиофильной сушкой. Молекулярные массы рассчитывали исходя из значений характеристической вязкости по формуле [η] = 1.17 × 10–2М0.69 для полистиролсульфоната натрия [9]: для I молекулярная масса составила 31 × 103, для сополимера II − 84 × 103. Содержание МАСК, используемой в качестве метки хелата для получения люминесцирующего зонда, определенное УФ-спектрофотометрически в сополимере составило 7 мол. %.
Исследовали водные растворы с концентрацией сополимера 1.5 и 0.12 мг мл–1 и рН 8−9. Соотношение [COO−]/[Tb3+] варьировали добавлением раствора TbСl3 (с = 5 × 10−4 моль л–1) к раствору сополимера.
Спектры поглощения растворов регистрировали на спектрофотометре СФ256 УВИ (ООО “ЛОМО Фототоника”, Россия). Спектры возбуждения и люминесценции растворов записывали на спектрофлуориметре LS100 (фирма “PTI”, Канада). Время жизни возбужденного состояния комплекса Tb3+ с сополимером II (τфосф,) определяли из кинетической кривой спада интенсивности фосфоресценции. Измерения проводили в термостатируемой ячейке при 25°С в кварцевой кювете с длиной оптического пути 1 см.
На рис. 2а приведены спектры поглощения водных растворов (со)полимеров I, II, III в интервале длин волн 220−400 нм. В спектрах поглощения раствора сополимера II (рис. 2а, спектр 1) присутствует полоса λмакс = 265 нм, обусловленная π–π* электронными переходами в ароматическом кольце. Эта полоса представляет собой суперпозицию двух полос I (λмакс = 262 нм, рис. 2а, спектр 2), и III (λмакс = 267 нм, рис. 2а, спектр 3). На рис. 2б приведены спектры возбуждения и люминесценции сополимера II.
Рис. 2.
(а) УФ-спектры водных растворов исследуемых (со)полимеров – сополимер (ССNa–МАСК) (спектр 1), поли-МАСК (спектр 2), поли-ССNa (спектр 3); (б) спектры возбуждения (черная кривая) λэм = 402 нм и люминесценции (зеленая кривая) сополимера (ССNa−МАСК), λвозб = 302 нм, рН 8.5.

На рис. 3 приведены спектры возбуждения и люминесценции ионов Tb3+ в растворе сополимера II при разных концентрациях сополимера.
Рис. 3.
Спектры возбуждения (черные кривые) λэм = 544 нм и люминесценции Tb3+ (зеленые кривые) в растворе сополимера (ССNa–МАСК) при концентрациях сополимера: 1.57 мг мл–1 (1) и 0.12 мг мл–1 (2). [Tb3+]/[COO–] = 1. λвозб = = 335 нм (1), λвозб = 310 нм (2). Значения I для кривых 1' и 2' умножены на коэффициент 5.0.

При сравнении рис. 2а и 3 видно, что спектры возбуждения и поглощения растворов комплекса Tb3+/II и исходного раствора сополимера II различаются по форме и, кроме того, в отличие от спектров поглощения растворов II, существенно изменяются с изменением концентрации сополимера. В комплексах лантаноидов соотношение между полосами, обусловленными поглощением лиганда и поглощением иона лантаноида, зависит не только от их молярных коэффициентов поглощения, но и от эффективности сенсибилизации люминесценции [6]. Существенное изменение формы спектров возбуждения при уменьшении концентрации сополимера указывает на перестройку внутренней сферы комплекса, связанную с изменением числа СОО–-групп и молекул воды, координированных Tb3+.
В спектрах возбуждения при с = 1.57 мг мл–1 присутствует одна полоса с λмакс = 335 нм, в то время как при с = 0.12 мг мл–1 в спектре появляются полосы с максимумами 227, 258, 268, 296, 310 нм (рис. 3, спектры 1, 2). Наблюдаемый эффект влияния концентрации обусловлен конкуренцией в связывании ионов Tb3+ звеньями стиролсульфоната и МАСК. Стиролсульфонат как анион сильной кислоты слабо координирует ионы Tb3+, поэтому при концентрации сополимера II сII ≥ 1.5 мг мл–1 они в основном связываются звеньями МАСК. Но так как константы образования комплексов ионов лантаноидов с карбоксильными группами находятся в интервале (1 × 104)−(1 × 106) [10], то при разбавлении раствора равновесие смещается в сторону формирования “координационно ненасыщенных” комплексов типа Tb3+(COO–)3 – n (n = 1, 2).
Измерения времен жизни τфосф возбужденного состояния комплексов Tb3+ с сополимером II определяли из кинетических кривых спада интенсивности фосфоресценции. Кинетические кривые описываются двухэкспоненциальной зависимостью c τфосф = 823 и 157 мкс, значения предэкспоненциального множителя составляют 0.92 и 0.08 соответственно. Основываясь на проведенных в работе [11] расчетах, можно предположить, что полимерный комплекс Tb3+/II может содержать примерно до 4 молекул воды.
В спектрах фотолюминесценции растворов Tb3+ с сополимером II для исследованных концентраций (рис. 3) наряду с полосами 495, 545, 587, 622 нм, характерными для Tb3+, обусловленными переходами 5D4 → 7Fj (j = 6, 5, 4, 3), присутствует полоса люминесценции МАСК λ = 402 нм, что указывает на неполноту передачи энергии с триплетного уровня лиганда на резонансный уровень Tb3+. Известно, что если внутрисистемный перенос недостаточно эффективен, то частичная замена люминесцирующих ионов на ионы Gd3+ может способствовать возрастанию интенсивности люминесценции ионов лантаноидов [12–14]. Макромолекулярные комплексы Gd3+ помимо использования в МРТ перспективны для одновременного проведения МРТ и направленных терапевтических процедур [15], а также могут быть совмещены с другими способами визуализации.
На рис. 4 приведено изменение интенсивности люминесценции комплекса Tb3+/II, нормированной к 1 при [Tb3+] = 4 × 10–5 моль л–1, при добавлении ионов Gd3+ (черные квадраты). Соотношение [Tb3+]/[Gd3+] изменяли от 0.6 до 16, уменьшая концентрацию Tb3+, но сохраняя при этом общую концентрацию ионов Tb3+ и Gd3+ постоянной и равной 4 × 10–5 моль л–1. Для сравнения в тех же координатах приведена зависимость для Tb3+/II без Gd3+ (сплошная кривая).
Рис. 4.
Изменение интенсивности люминесценции ($I_{{544}}^{{{\text{отн}}}}$), нормированной к 1 при [Tb3+] = 4 × 10–5 моль л–1, раствора комплекса Tb3+/II при добавлении ионов Gd3+ (черные квадраты 2), и аналогичная зависимость − в отсутствие ионов Gd3+ (сплошная кривая 1) при изменении концентрации Tb3+.

Из рис. 4 видно, что добавление Gd3+ не влияет на люминесценцию Tb3+ при всех соотношениях [Tb3+]/[Gd3+]. Возможно, это вызвано тем, что либо Gd3+ связывается звеньями стиролсульфоната, либо Gd3+, замещая Tb3+ в комплексе с II, создает дополнительную ступень передачи энергии электронного возбуждения на излучающий уровень Tb3+, что способствует усилению люминесценции, компенсируя уменьшение концентрации комплексов Tb3+/МАСК в сополимере.
Таким образом, формирование комплексов сополимера (ССNa–МАСК) с ионами Tb3+, а также биметаллических комплексов Tb3+ и Gd3+ с сополимером II открывает перспективы создания водорастворимых полимерных полифункциональных биологически активных веществ с противовирусной активностью, содержащих зонды с оптическими и магнитно-резонансными свойствами, для диагностики и визуализации клеток, органов и тканей.
Список литературы
Anderson R.A., Feathergill K., Diao X., Cooper M., Kirkpatrick R., Spear P., Waller D.P., Chany C., Doncel G.F., Herold B., Zaneveld L.J. // J. Androl. 2000. V. 21. № 6. P. 862−875. https://doi.org/10.1002/j.1939-4640.2000.tb03417.x
Контаров Н.А., Ермакова А.А., Гребенкина Н.С., Юминова Н.В., Зверев В.В. // Вопросы вирусологии. 2015. Т. 60. № 4. С. 5−9.
Bünzli J.-C.G. // J. Lumin. 2016. V. 170. № 3. P. 866–878. https://doi.org/10.1016/j.jlumin.2015.07.033
Leonard J.P., Nolan C.B., Stomeo F., Gunnlaugsson T. // Top. Curr. Chem. 2007. P. 1–43. https://doi.org/10.1007/128_2007_142
Yan Y., Zhang J., Ren L., Tang C. // Chem. Soc. Rev. 2016. V. 45. № 19. P. 5232−5263. https://doi.org/10.1039/c6cs00026F
Utochnikova V.V. // Coord. Chem. Rev. 2019. V. 398. Article 113006. https://doi.org/10.1016/j.ccr.2019.07.003
Gao B., Zhang W., Zhang Z., Lei Q. // J. Lumin. 2012. V. 132 № 8. P. 2005–2011. https://doi.org/10.1016/j.jlumin.2012.01.055
Du C., Ma L., Xu Y., Zhao Y., Jiang C. // Eur. Polym. J. 1998. V. 34. № 1. P. 23−29. https://doi.org/10.1016/S0014-3057(97)00080-3
Pavlov G.M., Zaitseva I.I., Gubarev A.S., Gavrilova I.I., Panarin E.F. // Russ. J. Appl. Chem. 2006. 79. P. 1490–1493. https://doi.org/10.1134/S1070427206090187
Janicki R., Mondry A., Starynowicz P. // Coord. Chem. Rev. 2017. V. 340. P. 98–133. https://doi.org/10.1016/j.ccr.2016.12.001
Arnaud N., Georges J. // Spectrochim. Acta, Part A. 2003. V. 59. № 8. P. 1829–1840. https://doi.org/10.1016/s1386-1425(02)00414-6
Ermolaev V.L., Sveshnikova E.B. // Russ. Chem. Rev. 2012. V. 81. № 9. P. 769–789. https://doi.org/10.1070/RC2012v081n09ABEH004259
Dai T.-T., Liu L., Tao D.-L., Li S.-G., Zhang H., Cui Y.-M., Wang Y.-Z., Chen J.-T., Zhang K., Sun W.-Z., Zhao X.-Y. // Chin. Chem. Lett. 2014. V. 25. № 6. P. 892−896. https://doi.org/10.1016/j.cclet.2014.03.007
Уточникова В.В., Кузьмина Н.П. // Коорд. химия. 2016. Т. 42. № 10. С. 640–656. https://doi.org/10.7868/S0132344X16090073
Cho H.K., Cho H-J., Lone S., Kim D.-D., Yeum J.H., Cheong I.W. // J. Mater. Chem. 2011. V. 21. P. 15486− 15493. https://doi.org/10.1039/c1jm11608h
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


