Доклады Российской академии наук. Химия, науки о материалах , 2023, T. 510, № 1, стр. 35-39
Дипинодиазафлуорены как реагенты для селективной экстракции палладия, золота и рутения
Д. В. Зубричева 1, Е. С. Васильев 1, С. Н. Бизяев 1, В. Д. Тихова 1, А. В. Ткачев 1, *
1 Федеральное государственное бюджетное учреждение науки Новосибирский институт органической химии
им. Н.Н. Ворожцова Сибирского отделения Российской академии наук (НИОХ СО РАН)
630090 Новосибирск, Российская Федерация
* E-mail: atkachev@nioch.nsc.ru
Поступила в редакцию 28.06.2022
После доработки 15.11.2022
Принята к публикации 18.11.2022
- EDN: OUSPBB
- DOI: 10.31857/S2686953522600362
Аннотация
Дипинодиазафлуорены – гибридные нопинан-аннелированные гетероциклы, молекулы которых включают гетероциклическое ядро 4,5-диазафлуорена, конденсированное с фрагментами терпенового углеводорода, способны селективно экстрагировать палладий (88–100%), золото (42–96%) и рутений (8–19%) при однократной экстракции из кислых водных растворов (рН 1.2), содержащих сложные смеси 3d-элементов и благородных металлов.
ВВЕДЕНИЕ
Природные ресурсы благородных металлов ограничены, их истощение критически опасно для современной цивилизации, поскольку эти металлы используются во многих важных технологиях. Интенсивное промышленное использование драгоценных металлов на протяжении десятилетий привело к тому, что антропогенные отходы становятся важными источниками этих ценных элементов [1]. Металлы платиновой группы и золото представляют особый интерес для вторичной переработки [2], поскольку некоторые из них в настоящее время используются в автомобильных катализаторах [3, 4], катализаторах риформинга [5, 6], а также в электрическом и электронном оборудовании, и экологически приемлемая экономическая переработка имеет большое значение [7].
Извлечение благородных металлов из промышленных отходов различного происхождения обычно осуществляется путем выщелачивания с последующей экстракцией органическим растворителем в виде комплексных соединений [8]. Однако гидрометаллургические процессы такого типа приводят к образованию кислых водных растворов сложных смесей металлов, и селективное извлечение Au, Pd или Pt из такой матрицы является весьма непростой задачей [9–14]. Несмотря на множество испробованных веществ, в настоящее время не существует универсальных экстрагентов, которые бы удовлетворяли всем требованиям (селективность, экстракционная емкость, растворимость, доступность и т.д.), поэтому исследования в этом направлении интенсивно развиваются.
Здесь мы сообщаем о результатах исследования извлечения благородных металлов новой группой перспективных экстрагентов, химическая структура которых включает хелатирующий фрагмент 4,5-диазафлуорена, конденсированный с фрагментами α-пинена – природного монотерпенового углеводорода. Наличие терпеновых фрагментов придает лиганду и получаемым из него комплексам повышенную липофильность, что важно для экстракции в системе жидкость−жидкость при использовании водных растворов солей металлов и органических растворителей.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что 4,5-диазафлуорен является перспективным бидентатным лигандом, обеспечивающим образование комплексов с разнообразными металлами [15–21], в том числе и с благородными [22–26]. Мы синтезировали ряд гибридных нопинан-аннелированных молекул 1−6, в которых гетероциклическое ядро 4,5-диазафлуорена конденсировано с молекулами терпенового углеводорода − α-пинена (рис. 1).
Отличие таких структур – производных дипинодиазафлуорена – от множества известных производных 4,5-диазафлуорена заключается в их высокой липофильности, которая обеспечивается наличием в составе молекулы гидрофобных пространственно нагруженных углеводородных фрагментов терпеновых молекул. Соединения 1−6 обладают значительной гидрофобностью и легко растворяются в малополярных органических растворителях.
Соединения 1−6 протестировали в качестве экстрагентов для переходных металлов. Для этой цели использовали кислый водный раствор, содержащий смесь щелочных (Li, Na, K) и переходных металлов (CrVI, MnII, FeIII, CoII, CuII, ZnII, RuIII, RhIII, IrIII, PtIV, AuIII, PdII) в 0.01 М соляной кислоте (по 1 ppm каждого металла). Противоионами были Cl− и ${\text{NO}}_{3}^{ - }$, так как стандартные растворы для приготовления тестируемых смесей использовались в виде азотнокислых и солянокислых растворов.
Оказалось, что соединения 1−6 способны избирательно экстрагировать некоторые благородные металлы (Pd, Au, Ru) из сложных смесей (рис. 2). Несмотря на то что дипинодиазафлуорены способны образовывать комплексы с другими переходными металлами [27, 28], в наших экспериментах экстракции других металлов не происходило. Вероятно, при достаточно высокой кислотности водных растворов смеси металлов (pH ≈ 1) и непродолжительном времени экстракции (10 мин) комплексы других металлов с дипинодиазафлуоренами 1−6, кроме Pd, Au и Ru, оказываются неустойчивыми, либо кинетика их образования является медленной.
Рис. 2.
Степень экстракции (%E) элементов из кислого водного раствора (pH 1.2), содержащего щелочные металлы (Li, Na, K), 3d-элементы (Cr, Mn, Fe, Co, Cu, Zn) и благородные металлы (Ru, Rh, Pd, Ir, Pt, Au) в результате однократной экстракции под действием растворов соединений 1−6 в CHCl3 при 298 K.
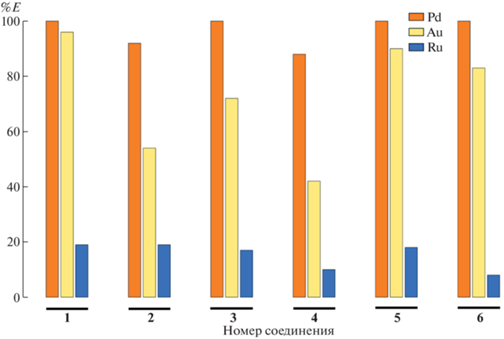
При однократной экстракции все исследованные соединения 1−6 демонстрируют схожую относительную селективность в ряду Pd−Au−Ru: степень извлечения палладия составляет 88–100%, золота – 42–96%, рутения – 8–19% (рис. 2). Наилучшую эффективность извлечения палладия показывают соединения 1, 3, 5 и 6, золота – соединения 1 и 5. Наличие карбонильных групп заметно снижает степень извлечения золота (соединения 2, 3 и 4), хотя закономерности степени извлечения золота от количества карбонильных групп не наблюдается.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектрально-аналитические характеристики органических веществ получены так, как описано в работе [29]. В качестве исходного соединения в конденсациях использовался оксим пинокарвона, полученный из (−)-α-пинена по реакции нитрозохлорирования-дегидрохлорирования [30].
Синтезы производных диазафлуорена. Дипинодизафлуорен 1 в виде кристаллов белого цвета с Тпл. = 262−264°C получали конденсацией оксима пинокарвона, а дипинодизафлуоренон 2 в виде желтоватых кристаллов с Тпл. = 245−247°C и димерный продукт 5 в виде оранжевого порошка получали окислением соединения 1 под действием SeO2, как описано в работе [31].
(1R,3R,8R,10R)-2,2,9,9-тетраметил-2,3,7,8,9, 10-гексагидро-1H-1,3:8,10-диметаноциклопента[1,2-b:5,4-b']дихинолин-4,12-дион 3. К раствору дипинодизафлуорена 1 (3.56 г, 10.0 ммоль) в ледяной уксусной кислоте (20 мл) прибавляли CrO3 (3.00 г, 30.0 ммоль) и реакционную смесь перемешивали 15 сут при комнатной температуре (23−25°C), после чего уксусную кислоту удаляли в вакууме. Остаток перемешивали с концентрированной соляной кислотой (10 мл) и экстрагировали хлороформом (3 × 30 мл). Экстракт сушили сульфатом натрия, упаривали в вакууме и полученный сырой продукт хроматографировали на силикагеле. При элюировании бензолом выделяли дипинодизафлуоренон 2. Последующее элюирование хлороформом позволило выделить дикетон 3 с выходом 50% в виде светло-желтых кристаллов с Тпл. = 262°С. Rf 0.2 (CHCl3). ИК (ν, см–1): 1716 (C=O), 1556, 1396, 1268. 1Н ЯМР (500 МГц, CDCl3, δ, м. д., J, Гц): 0.60 (с, 3H), 0.77 (с, 3H), 1.21 (д, J 9.8 Гц, 1H), 1.34 (с, 3H), 1.54 (с, 3H), 2.09 (д, J 9.4 Гц, 1H), 2.32 (м, 1H), 2.65 (ддд, J 9.7, 5.8 и 5.8 Гц, 1H), 2.79 (дд, J 5.6 и 5.6 Гц, 1H), 3.04 (д, J 5.8 Гц, 2H), 3.10 (дд, J 5.8 и 5.8 Гц, 1H), 3.20 (м, 2H), 7.41 (с, 1H), 7.72 (с, 1H). 13C ЯМР (125 МГц, CDCl3, δ, м. д.): 21.02, 22.33, 25.57, 26.35, 31.44, 37.32, 38.57, 39.20, 39.33, 46.64, 47.50, 52.03, 57.79, 126.87, 127.78, 131.23, 143.79, 147.56, 151.19, 160.86, 162.56, 165.44, 189.26, 197.40. ESI-MS, m/z: 384.1835 [M]+; вычислено для C25H24N2O2: 384.1832.
(1R,3R,8R,10R)-2,2,9,9-тетраметил-2,3,9,10-тетрагидро-1H-1,3:8,10-диметаноциклопента[1, 2-b:5,4-b']дихинолин-4,7,12(8H)-трион 4. Дипинодизафлуорен 1 окисляли CrO3 в течение 20 сут при мольном соотношении субстрат : окислитель = = 1 : 4 так же, как описано выше для получения дикетона 3. Хроматографированием сырого продукта на силикагеле отделяли примеси дипинодизафлуорена 2 (элюирование бензолом) и дикетона 3 (элюирование хлороформом). Последующим элюированием смесью хлороформ−этанол (14 : 1 по объему) выделили трикетон 4 с выходом 50% в виде желтых кристаллов, которые при нагревании разлагаются без плавления. Rf 0.3 (хлороформ−этанол = 14 : 1 по объему). ИК (ν, см–1): 1710 (C=O), 1448, 1388, 1272, 1232. 1Н ЯМР (500 МГц, CDCl3, δ, м. д., J, Гц): 0.81 (с, 6H), 1.60 (с, 6H), 2.15 (ддд, J 8.5, 2.3 и 2.3 Гц, 2H), 3.09−3.12 (м, 4H), 3.18 (дд, J 5.8 и 5.8 Гц, 2H), 7.85 (c, 2H). 13C ЯМР (125 МГц, CDCl3, δ, м. д.): 22.50, 26.45, 38.38, 47.70, 51.95, 57.91, 129.65, 131.17, 148.12, 152.46, 161.87, 188.48, 197.17. ESI-MS, m/z: 398.1631 [M]+; вычислено для C25H22N2O3: 398.1625.
4,4'-метилен-бис{N-[(1R,3R,8R,10R)-2,2,9,9-тетраметил-3,4,7,8,9,10-гексагидро-1H-1,3:8,10-диметаноциклопента[1,2-b:5,4-b']дихинолин-12(2H)-илиден]анилин} 6 в виде оранжевого аморфного порошка получали из дипинодизафлуорена 2 по методике, описанной в работе [32].
Исследование экстракционных свойств. В качестве источников металлов использовались Государственные стандартные образцы Российской Федерации: Li (ГСО 7780-2000, 1 мг мл−1 в 0.1 М НС1), Na (ГСО 7474-96, 1 мг мл−1 в H2O), K (ГСО 8092-94, 1 мг мл−1 в H2O), CrVI (ГСО 7257-96, 1.9 × 10−2 M в H2O), MnII (ГСО 7266-96, 1.8 × 10−2 M в 1 M HNO3), FeIII (ГСО 7254-96, 1.8 × 10−2 M в 1 M HNO3), CoII (ГСО 7880-2001, 1.7 × 10−2 M в 1 M HNO3), CuII (ГСО 7255-96, 1.6 × 10−2 M в 1 M HNO3), ZnII (ГСО 7256-96, 1.5 × 10−2 M в 1 M HNO3), RuIII (ГСО 146-052-440, 1.0 × 10−2 M в 10% HCl), PdII (ГСО 8432-2003, 0.9 × 10−2 M в 2M HCl), PtIV (ГСО 8431-2003, 0.5 × 10−2 M в 2M HCl), AuIII (ГСО 8429-2003, 0.5 × 10−2 M в 2M HCl). IrCl3 ⋅ (4−5H2O) получен от компании “Красцветмет” (Российская Федерация), RhCl3 ⋅ 3H2O (так называемый “водорастворимый хлорид родия”) получен из металлического Rh ([33], p. 1587). Содержание металлов в водных растворах определяли методом атомно-эмиссионной спектрометрии с микроволновой плазмой (MP-AES) (спектрометр Agilent Technologies 4100, Австралия). Пределы обнаружения благородных металлов составили, мкг л−1: 2.0 (Ru), 16 (Pd и Rh), 28 (Pt), 86 (Ir), 320 (Au). Кислотность водных растворов измеряли с помощью иономера-кондуктометра Анион 4154 (ООО НПП “Инфраспак-Аналит”, Россия).
Все эксперименты по извлечению металлов выполняли следующим образом. Раствор экстрагента в хлороформе (5 мл, 0.64 мг мл−1, 7 × 10−4−2 × × 10−3 М) добавляли к водному раствору смеси выбранных солей металлов (25 мл, 1 ppm каждого металла, рН 1.2) при комнатной температуре (298 К). Полученную смесь интенсивно перемешивали в течение 10 мин. После прекращения перемешивания и самопроизвольного разделения фаз (5 мин) водную фазу отделяли для анализа на содержание металлов. Экстракцию с каждым из соединений 1−6 проводили трижды. Водные растворы анализировали до и после экстракции методом атомно-эмиссионной спектрометрии с микроволновой плазмой. Содержание металлов в каждом из растворов является средним результатом двух параллельных определений. Инструментальная погрешность единичного определения составляла ≤5% отн. Процент извлечения (%E) рассчитывали следующим образом: %E = 100(ci − – cf)/ci, где ci и cf – начальная и конечная (после экстракции) концентрации выбранного металла в водной фазе соответственно.
ЗАКЛЮЧЕНИЕ
Гибридные нопинан-аннелированные гетероциклы, молекулы которых включают гетероциклическое ядро 4,5-диазафлуорена, конденсированное с фрагментами терпенового углеводорода α-пинена, обладают высокой липофильностью, которая обеспечивается наличием в структуре молекулы гидрофобных пространственно нагруженных углеводородных фрагментов терпеновых молекул, и сохраняют хелатирующие свойства 4,5-диазафлуоренового фрагмента. Исследованные производные дипинодиазафлуорена легко растворяются в малополярных органических растворителях и способны селективно экстрагировать палладий, золото и рутений из кислых водных растворов, содержащих сложные смеси 3d-элементов и благородных металлов.
Список литературы
Hagelüken C. // Platinum Met. Rev. 2012. V. 56. P. 29–35. https://doi.org/10.1595/147106712X611733
Zheng H., Ding Y., Wen Q., Liu B., Zhang S. // Resour. Conserv. Recycl. 2021. V. 167. P. 105417. https://doi.org/10.1016/j.resconrec.2021.105417
Ding Y., Zheng H., Zhang S., Liu B., Wu B., Jian Z. // Resour. Conserv. Recycl. 2020. V. 155. P. 104644. https://doi.org/10.1016/j.resconrec.2019.104644
Trinh H.B., Lee J., Suh Y., Lee J. // Waste Management. 2020. V. 114. P. 148–165. https://doi.org/10.1016/j.wasman.2020.06.030
Masuda C., Yonezu K., Watanabe K., Yokoyama T. // Procedia Earth Planet. Sci. 2013. V. 6. P. 435–440. https://doi.org/10.1016/j.proeps.2013.01.057
Jha M.K., Lee J., Kim M., Jeong J., Kim B.-S., Kumar V. // Hydrometallurgy. 2013. V. 133. P. 23–32. https://doi.org/10.1016/j.hydromet.2012.11.012
Bahaloo-Horeh N., Mousavi S.M. // J. Hazard. Mater. 2020. V. 400. P. 123186. https://doi.org/10.1016/j.jhazmat.2020.123186
Paiva A.P., Ortet O., Carvalho G.I., Nogueira C.A. // Hydrometallurgy. 2017. V. 171. P. 394–401. https://doi.org/10.1016/j.hydromet.2017.06.014
Gupta B., Singh I., Mahandra H. // Sep. Purif. Technol. 2014. V. 132. P. 102–109. https://doi.org/10.1016/j.seppur.2014.04.045
Ding Y., Zhang S., Liu B., Zheng H., Chang C., Ek-berg C. // Resour. Conserv. Recycl. 2019. V. 141. P. 284–298. https://doi.org/10.1016/j.resconrec.2018.10.041
Nguyen T.H., Sonu C.H., Lee M.S. // J. Ind. Eng. Chem. 2015. V. 32. P. 238–245. https://doi.org/10.1016/j.jiec.2015.08.022
Hasegawa H., Barua S., Wakabayashi T., Mashio A., Maki T., Furusho Y., Rahman I.M.M. // Microchem. J. 2018. V. 139. P. 174–180. https://doi.org/10.1016/j.microc.2018.02.025
Nguyen T.H., Sonu C.H., Lee M.S. // Hydrometallurgy. 2016. V. 164. P. 71–77. https://doi.org/10.1016/j.hydromet.2016.05.014
Morohashi N., Kurusu Y., Akasaka K., Hattori T. // RSC Adv. 2020. V. 10. № 58. P. 35473–35479. https://doi.org/10.1039/D0RA05339B
Annibale V.T., Song D. // Dalton Trans. 2016. V. 45. № 1. P. 32–49. https://doi.org/10.1039/C5DT03665H
Li H., Wang J., Shujiang Z., Gong C., Wang F. // RSC Advances. 2018. V. 8. P. 31889–31894. https://doi.org/10.1039/C8RA05280H
Ghosh S., Alghunaim A.S., Al-mashhadani M.H., Krompiec M.P., Hallett M., Perepichka I.F. // J. Mater. Chem. C. 2018. V. 6. P. 3762–3773. https://doi.org/10.1039/C7TC05051H
Batcup R., Annibale V.T., Song D. // Dalton Trans. 2014. V. 43. № 23. P. 8951–8958. https://doi.org/10.1039/C4DT01165A
Nocton G., Booth C.H., Maron L., Andersen R.A. // Organometallics. 2013. V. 32. № 5. P. 1150–1158. https://doi.org/10.1021/om300876b
Baysal A., Connor J., Wallis J. // J. Coord. Chem. 2006. V. 53. P. 347–354. https://doi.org/10.1080/00958970108022621
Shahraki O., Ghaznavi H., Akbarzadeh-T N., Shahraki S., Sheervalilou R., Kondori T. // Iran. J. Pharm. Res. 2021. V. 20. № 3. P. 618–635. https://doi.org/10.22037/ijpr.2021.114685.14996
Henke W.C., Stiel J.P., Day V.W., Blakemore J.D. // Chem. Eur. J. 2022. V. 28. № 9. P. e202103970. https://doi.org/10.1002/chem.202103970
Henke W.C., Hopkins J.A., Anderson M.L., Stiel J.P., Day V.W., Blakemore J.D. // Molecules. 2020. V. 25. № 14. P. 3189. https://doi.org/10.3390/molecules25143189
Wang Y., Jing T.-T., Zhang J.-L., Liu Y.-T., Wang S.-P., Zhang Q.-F., Zhang P.-Z., Tong B.-H., Ye S.-H., Bai F.-Q. // Inorg. Chem. Commun. 2022. V. 137. P. 109170. https://doi.org/10.1016/j.inoche.2021.109170
Cebeci C., Arslan B.S., Güzel E., Nebioğlu M., Şişman İ., Erden İ. // J. Coord. Chem. 2021. V. 74. № 9−10. P. 1366–1381. https://doi.org/10.1080/00958972.2021.1914332
Nongpiur C.G.L., Tripathi D.K., Poluri K.M., Rawat H., Kollipara M.R. // J. Chem. Sci. 2022. V. 134. № 1. P. 23. https://doi.org/10.1007/s12039-021-02004-2
Fomenko Y.S., Gushchin A.L., Tkachev A.V., Vasilyev E.S., Abramov P.A., Nadolinny V.A., Syrokvashin M.M., Sokolov M.N. // Polyhedron. 2017. V. 135. P. 96–100. https://doi.org/10.1016/j.poly.2017.07.003
Kokina T.E., Glinskaya L.A., Piryazev D.A., Vasiliev E.S., Sheludyakova L.A., Rakhmanova M.I., Tkachev A.V. // J. Struct. Chem. 2020. V. 61. № 10. P. 1606–1614. https://doi.org/10.1134/S0022476620100133
Vasilyev E.S., Bizyaev S.N., Komarov V.Y., Tkachev A.V. // Tetrahedron. 2021. V. 83. P. 131979. https://doi.org/10.1016/j.tet.2021.131979
Ткачев А.В. // Российский химический журнал. 1998. V. XLII. № 1–2. P. 42–66.
Vasilyev E.S., Bagryanskaya I.Y., Tkachev A.V. // Mendeleev Commun. 2017. V. 27. № 2. P. 128–130. https://doi.org/10.1016/j.mencom.2017.03.006
Vasilyev E.S., Bizyaev S.N., Komarov V.Y., Gatilov Y.V., Tkachev A.V. // Molecules. 2019. V. 24. № 17. P. 3186. https://doi.org/10.3390/molecules24173186
Handbook of Preparative Inorganic Chemistry, Vol. 2, Second Edition Brauer G. (Ed.). Academic Press, 1965.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах