Доклады Российской академии наук. Науки о Земле, 2022, T. 507, № 2, стр. 341-348
Биогеохимические механизмы реадаптации рыб к снижению токсичного загрязнения
Н. А. Гашкина 1, *, член-корреспондент РАН Т. И. Моисеенко 1
1 Институт геохимии и аналитической химии
им. В.И. Вернадского Российской академии наук
Москва, Росиия
* E-mail: ngashkina@gmail.com
Поступила в редакцию 07.07.2022
После доработки 09.08.2022
Принята к публикации 22.08.2022
- EDN: BUSOMW
- DOI: 10.31857/S2686739722601296
Аннотация
Изучены механизмы биогеохимической адаптации рыб к выживанию в исторически загрязненном озере Имандра, которые позволили установить роль микроэлементов в защитных функциях организма и их значение в процессах реадаптации организмов к улучшению среды обитания. Повышенное отношение S к Se указывает на высокий антиоксидантный статус рыб из исторически загрязненной части озера, тогда как повышенная аккумуляция Fe, Cu и Se может служить маркером патологий печени, Zn и Co – патологий почек.
ВВЕДЕНИЕ
Проблема восстановления экосистем и реакции выживых организмов в период загрязнения на улучшение условий обитания является одной из актуальных современных проблем биогеохимии и экологии. Рыбы являются наилучшими индикаторами состояния окружающей среды. Озеро Имандра – большое субарктическое озеро в Мурманской области, северная часть которого (Большая Имандра) сильно пострадала от деятельности горно-металлургических предприятий. Интенсивное загрязнение оз. Имандры началось в 1940-х гг., а с 1990-х гг. наметилась тенденция снижения антропогенной нагрузки на водоем. В период интенсивного загрязнения озера наряду с общими патологиями у сигов появилось специфическое заболевание – нефрокальцитоз, связанное с аккумуляцией Ni в почке рыб [1]. В период снижения токсичной нагрузки на водоем наблюдалось улучшение физиологического состояния сигов: с 1996 по 2003 г. снижается их заболеваемость, и в 2003 г. не были встречены особи с нефрокальцитозом [2]. Более того, в 2006–2007 гг. сиги из загрязненной части озера не показали значимого накопления токсичных металлов в органах и тканях и наблюдалось их лучшее физиологическое состояние по сравнению с сигами из незагрязненных частей озера [3].
Целью исследования было выявить биогеохимические и физиологические механизмы адаптации рыб к токсичному загрязнению, которые проявились после спада токсичной нагрузки на водоем.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В основу работы легли данные, полученные в 2018 г., обследования сигов в оз. Имандра. В данном исследовании в рассмотрение вошли 15 особей (9 из Большой Имандры, а также 6 из незагрязненных Йокостровской и Бабинской Имандры).
Отлов рыб сопровождался с одновременным отбором проб воды в местах отлова. Обработку материала проводили по общепринятым в ихтиологии методикам. Озерный сиг (Coregonus lavaretus L.) – бентофаг, он не мигрирует на большие расстояния и может использоваться как хороший локальный биоиндикатор водной среды [1]. Обследование рыб проводилось в преднерестовый период (август–сентябрь) одного и того же возрастного состава (4+–6+). Биологические образцы высушивали до постоянного веса при 105°С. На анализ содержания элементов отбирались жабры, печень, почка, мышцы и скелет. Определение концентраций элементов в пробах воды и биологических образцах (после мокрого озоления) проводилось методом масс-спектрометрии с индуктивно-связанной плазмой (Х-7, “Thermo Scientific”, США).
Гематологический анализ проводили сразу после отлова только на живой рыбе по стандартным методикам: измеряли концентрацию гемоглобина, проводили подсчет эритроцитов. Мазки крови фиксировали в этиловом спирте и окрашивали по Романовскому-Гимза. Было просчитано не менее 500 клеток крови.
На гистологический анализ пробы органов (жабры, печень и почки) фиксировали в смеси Буэна. Срезы депарафинировали в спиртах, окрашивались азаном по Гейденгайну и анализировали при помощи светового микроскопа (Axio A1). Гистологические изменения и некоторые морфометрические параметры измеряли, по меньшей мере, на 5 слайдах каждого органа каждой рыбы с использованием программного обеспечения микроскопа AxioVision. Гистопологический индекс органа оценивали с использованием адаптированного метода, предложенного D. Bernet et al. [4]. Индекс патологии органа рассчитывался как:
где Sпатi – площадь патологии, Sорг – площадь исследованной зоны ткани, wi – фактор значимости. Идентификация гистопатологических изменений и их факторов значимости (1–3) была основана на методe, предложенном в [4].Статистическая обработка данных выполнена с использованием программ Statistica и SPSS. Групповые различия были проверены с использованием непараметрического U-критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ
Содержание микроэлементов и их физиологическая роль в метаболизме. Содержание элементов в органах рыб отражает эволюционно-выработанные механизмы регуляции обменных процессов в организме. Концентрации основных загрязнителей (Ni и Cu) в воде остаются прежними (табл. 1), как и в 2006–2007 гг. [3], тогда как в период интенсивного загрязнения (1986–1992 гг.) концентрации могли достигать 290 и 28 мкг/л для Ni и Cu соответственно [1]. Концентрации элементов в органах у сигов из исторически загрязненной и незагрязненной частей озера не сильно различались, за исключением Se и Na (табл. 1). Большая концентрация Rb наблюдалась в жабрах, но меньшие концентрации Cd, Sb и Pr были в печени, а Mg, Al и Ce в почке сигов из Большой Имандры в отличие от таковых Йокостровской и Бабинской Имандры (табл. 1).
Таблица 1.
Средние значения и стандартные ошибки концентраций элементов в воде и органах сигов, выловленных из Большой Имандры (числитель) и из Йокостровской и Бабинской Имандры (знаменатель)
| Элемент | Вода | Жабры | Печень | Почка |
|---|---|---|---|---|
| мкг/л | мкг/г сухого веса | |||
| Mg | $\frac{{{\mathbf{1085}} \pm 15}}{{{\mathbf{1020}} \pm 13}}$ | $\frac{{1162 \pm 196}}{{1080 \pm 52}}$ | $\frac{{727 \pm 30}}{{820 \pm 60}}$ | $\frac{{{\mathbf{693}} \pm 31}}{{{\mathbf{1074}} \pm 177}}$ |
| Na | $\frac{{{\mathbf{17}}\,{\mathbf{740}} \pm 464}}{{{\mathbf{13}}\,{\mathbf{094}} \pm 1195}}$ | $\frac{{{\mathbf{7291}} \pm 471}}{{{\mathbf{6052}} \pm 255}}$ | $\frac{{{\mathbf{3435}} \pm 240}}{{{\mathbf{5006}} \pm 522}}$ | $\frac{{7392 \pm 505}}{{9168 \pm 602}}$ |
| S | $\frac{{{\mathbf{7835}} \pm 148}}{{{\mathbf{5872}} \pm 523}}$ | $\frac{{10\,356 \pm 382}}{{10\,019 \pm 418}}$ | $\frac{{11\,365 \pm 507}}{{11\,627 \pm 439}}$ | $\frac{{9908 \pm 529}}{{10\,515 \pm 607}}$ |
| Fe | $\frac{{19.1 \pm 3.5}}{{13.4 \pm 2.1}}$ | $\frac{{195 \pm 37}}{{237 \pm 71}}$ | $\frac{{142 \pm 12}}{{170 \pm 25}}$ | $\frac{{314 \pm 22}}{{294 \pm 34}}$ |
| Zn | $\frac{{1.35 \pm 0.23}}{{1.82 \pm 1.08}}$ | $\frac{{541 \pm 141}}{{522 \pm 87}}$ | $\frac{{284 \pm 32}}{{344 \pm 85}}$ | $\frac{{204 \pm 23}}{{207 \pm 21}}$ |
| Cu | $\frac{{{\mathbf{4}}{\mathbf{.81}} \pm 0.41}}{{{\mathbf{3}}{\mathbf{.17}} \pm 0.31}}$ | $\frac{{2.92 \pm 0.42}}{{2.47 \pm 0.21}}$ | $\frac{{57.3 \pm 12.2}}{{170 \pm 89}}$ | $\frac{{8.19 \pm 0.96}}{{10.5 \pm 2.2}}$ |
| Mn | $\frac{{10.8 \pm 1.3}}{{6.9 \pm 1.4}}$ | $\frac{{22.7 \pm 3.5}}{{17.7 \pm 2.5}}$ | $\frac{{7.85 \pm 0.51}}{{7.63 \pm 0.47}}$ | $\frac{{2.50 \pm 0.24}}{{3.34 \pm 0.40}}$ |
| Co | $\frac{{ < {\kern 1pt} 0.1}}{{ < {\kern 1pt} 0.1}}$ | $\frac{{0.11 \pm 0.03}}{{0.05 \pm 0.02}}$ | $\frac{{0.13 \pm 0.02}}{{0.13 \pm 0.02}}$ | $\frac{{1.12 \pm 0.22}}{{0.61 \pm 0.14}}$ |
| Se | $\frac{{ < {\kern 1pt} 0.3}}{{ < {\kern 1pt} 0.3}}$ | $\frac{{{\mathbf{3}}{\mathbf{.59}} \pm 0.30}}{{{\mathbf{5}}.{\mathbf{18}} \pm 0.57}}$ | $\frac{{{\mathbf{7}}{\mathbf{.96}} \pm 0.49}}{{{\mathbf{12}}.{\mathbf{05}} \pm 1.14}}$ | $\frac{{{\mathbf{7}}{\mathbf{.02}} \pm 0.55}}{{{\mathbf{9}}.{\mathbf{71}} \pm 0.82}}$ |
| Ni | $\frac{{{\mathbf{7}}{\mathbf{.50}} \pm 0.59}}{{{\mathbf{3}}.{\mathbf{30}} \pm 0.36}}$ | $\frac{{1.99 \pm 0.55}}{{1.21 \pm 0.31}}$ | $\frac{{0.44 \pm 0.10}}{{0.78 \pm 0.24}}$ | $\frac{{5.10 \pm 0.99}}{{5.83 \pm 1.28}}$ |
| Hg | $\frac{{ < {\kern 1pt} 0.01}}{{ < {\kern 1pt} 0.01}}$ | $\frac{{0.060 \pm 0.009}}{{0.070 \pm 0.010}}$ | $\frac{{0.163 \pm 0.035}}{{0.152 \pm 0.029}}$ | $\frac{{0.184 \pm 0.036}}{{0.192 \pm 0.025}}$ |
| Cd | $\frac{{ < {\kern 1pt} 0.004}}{{ < {\kern 1pt} 0.004\;(0.010)}}$ | $\frac{{0.07 \pm 0.02}}{{0.07 \pm 0.02}}$ | $\frac{{{\mathbf{0}}{\mathbf{.11}} \pm 0.02}}{{{\mathbf{0}}.{\mathbf{24}} \pm 0.02}}$ | $\frac{{2.25 \pm 0.55}}{{2.70 \pm 0.52}}$ |
| Pb | $\frac{{0.58 \pm 0.32}}{{0.94 \pm 0.33}}$ | $\frac{{0.73 \pm 0.25}}{{0.20 \pm 0.06}}$ | $\frac{{0.04 \pm 0.00}}{{0.05 \pm 0.01}}$ | $\frac{{0.07 \pm 0.02}}{{0.06 \pm 0.01}}$ |
| W | $\frac{{{\mathbf{0}}{\mathbf{.24}} \pm 0.03}}{{{\mathbf{0}}.{\mathbf{13}} \pm 0.02}}$ | $\frac{{0.069 \pm 0.029}}{{0.052 \pm 0.032}}$ | $\frac{{0.003 \pm 0.001}}{{0.009 \pm 0.006}}$ | $\frac{{0.041 \pm 0.016}}{{0.200 \pm 0.149}}$ |
| Sb | $\frac{{0.094 \pm 0.004}}{{0.083 \pm 0.008}}$ | $\frac{{0.003 \pm 0.001}}{{0.006 \pm 0.002}}$ | $\frac{{ < {\kern 1pt} {\mathbf{0}}{\mathbf{.002}}\;(0.009)}}{{{\mathbf{0}}.{\mathbf{003}} \pm 0.001}}$ | $\frac{{0.002 \pm 0.001}}{{0.005 \pm 0.001}}$ |
| As | $\frac{{0.14 \pm 0.02}}{{0.10 \pm 0.02}}$ | $\frac{{0.59 \pm 0.16}}{{0.25 \pm 0.25}}$ | $\frac{{0.14 \pm 0.08}}{{0.12 \pm 0.12}}$ | $\frac{{0.58 \pm 0.25}}{{0.25 \pm 0.25}}$ |
| Sr | $\frac{{54.3 \pm 2.0}}{{50.2 \pm 2.3}}$ | $\frac{{394 \pm 212}}{{168 \pm 6.5}}$ | $\frac{{4.54 \pm 2.49}}{{2.85 \pm 0.59}}$ | $\frac{{6.10 \pm 1.18}}{{8.65 \pm 2.34}}$ |
| Al | $\frac{{{\mathbf{36}}{\mathbf{.6}} \pm 8.0}}{{{\mathbf{16}}.{\mathbf{5}} \pm 1.5}}$ | $\frac{{32.9 \pm 15.6}}{{92.5 \pm 45.4}}$ | $\frac{{9.43 \pm 4.14}}{{14.1 \pm 3.3}}$ | $\frac{{{\mathbf{7}}{\mathbf{.80}} \pm 1.27}}{{{\mathbf{18}}.{\mathbf{7}} \pm 3.1}}$ |
| Rb | $\frac{{3.99 \pm 0.19}}{{3.59 \pm 0.33}}$ | $\frac{{{\mathbf{25}}{\mathbf{.8}} \pm 1.7}}{{{\mathbf{18}}.{\mathbf{3}} \pm 2.4}}$ | $\frac{{38.3 \pm 3.5}}{{28.7 \pm 4.8}}$ | $\frac{{28.3 \pm 2.4}}{{22.7 \pm 3.1}}$ |
| La | $\frac{{{\mathbf{0}}{\mathbf{.160}} \pm 0.046}}{{{\mathbf{0}}.{\mathbf{047}} \pm 0.006}}$ | $\frac{{0.137 \pm 0.056}}{{0.053 \pm 0.011}}$ | $\frac{{0.047 \pm 0.012}}{{0.078 \pm 0.014}}$ | $\frac{{0.031 \pm 0.007}}{{0.046 \pm 0.012}}$ |
| Ce | $\frac{{{\mathbf{0}}{\mathbf{.224}} \pm 0.071}}{{{\mathbf{0}}.{\mathbf{057}} \pm 0.009}}$ | $\frac{{0.214 \pm 0.096}}{{0.081 \pm 0.025}}$ | $\frac{{0.037 \pm 0.008}}{{0.069 \pm 0.013}}$ | $\frac{{{\mathbf{0}}{\mathbf{.043}} \pm 0.011}}{{{\mathbf{0}}.{\mathbf{080}} \pm 0.012}}$ |
| Pr | $\frac{{{\mathbf{0}}{\mathbf{.027}} \pm 0.007}}{{{\mathbf{0}}.{\mathbf{009}} \pm 0.001}}$ | $\frac{{0.025 \pm 0.010}}{{0.011 \pm 0.003}}$ | $\frac{{{\mathbf{0}}{\mathbf{.004}} \pm 0.001}}{{{\mathbf{0}}.{\mathbf{008}} \pm 0.001}}$ | $\frac{{0.006 \pm 0.001}}{{0.008 \pm 0.001}}$ |
Принципиальным отличием в содержании элементов является интенсивный метаболизм Na и Se у сигов из Большой Имандры. Повышенные концентрации Na в жабрах и пониженные в печени и почке, а также пониженные концентрации Se и повышенные молярные соотношения S:Se во всех органах и тканях наблюдались у сигов, подверженных тепловому загрязнению, вследствие высокой дыхательной активности и интенсивного метаболизма [5]. Транспорт Na+ связан с транспортом Н+. Частота дыхания создает предпосылки для большего поступления Na+ в обмен на H+, а также необходимости выводить излишки Na, что отразилось на концентрациях в жабрах и почке (табл. 1).
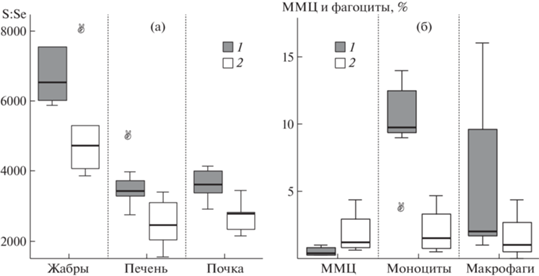
Металлы с переменной валентностью инициируют образование свободных радикалов за счет электрона, тогда как тяжелые металлы способны образовывать ковалентные связи с белками и ингибировать активность ферментов, в том числе антиоксидантных, что может вызывать окислительный стресс [6]. Группы селеноферментов представляют собой в том числе и антиоксидантные ферменты: глутатионпероксидазы (которые выполняют функцию восстановления гидропероксидов до соответствующих спиртов за счет глутатиона), тиоредоксинредуктазы (которые поддерживают окислительно-восстановительный статус клеток за счет снижения уровня цистеина) [6]. Пониженная аккумуляция Se во всех органах наблюдалась у сигов из Большой Имандры по сравнению с таковой у сигов из Йокостровской и Бабинской Имандры (табл. 1). Притом молярные соотношения S:Se во всех органах были больше у сигов из Большой Имандры (рис. 1 а). Можно предположить, что Se в большей мере включен в незаменимые селеноцистеин (SeCys) у сигов из Большой Имандры, тогда как запасной пул селенометионина (SeMet) формируется у сигов из Йокостровской и Бабинской Имандры. Активный метаболизм Se может указывать на стимуляцию антиоксидантных ферментов у сигов из исторически загрязненной части озера. В период высокой токсичности, по-видимому, одной из главных эволюционных задач было сохранять эффективность работы антиоксидантных систем организма.
Рис. 1.
а – Молярные отношения серы к селену (S:Se) в органах и тканях сигов из Большой Имандры (1) и Йокостровской и Бабинской Имандры (2); б – Процентное количество мелано-макрофагальных центров (ММЦ) в почках, фагоцитов (моноцитов и макрофагов) в периферической крови у сигов с уровнем лейкоцитов <12 × 103 клеток/мкл из Большой Имандры (1) и у сига с уровнем лейкоцитов >12 × 103 клеток/мкл из Йокостровской и Бабинской Имандры (2).
Адаптация кровеносной системы. Гематологические характеристики являются эффективными и чувствительными показателями физиологических изменений, состояния здоровья, приспособляемости рыб к окружающей среде и токсикологических симптомов, в том числе иммунных реакций, связанных с патологическими процессами [7].
Красная кровь. Хотя количество клеток красной крови при сходных соотношениях зрелых и незрелых форм достоверно не отличалось, концентрация гемоглобина в крови (Hb) была низкая у многих рыб (табл. 2). Hb у сигов в условиях экологического оптимума находится в пределах 80–130 г/л [1]. Гомеостаз рыб во многом определяется Hb. Если сопоставить средние величины, то среднее количество гемоглобина в эритроците было больше при меньшем количестве эритроцитов у сигов из Большой Имандры в сравнении с таковыми из Йокостровской и Бабинской Имандры (табл. 2). В период интенсивного загрязнения (1978–1997) средние значения Нb были 80 и 107 г/л, количество эритроцитов – 0.80 и 1.02 × 106 клеток/мкл и среднее количество гемоглобина в эритроците – 101 и 105 пг у сигов из загрязненных и реферативных частей озера соответственно [1]. Синтез гема, по-видимому, был смещен в сторону увеличения гемоглобина от синтеза других ферментов, использующих гемовое железо, что может быть наиболее вероятным объяснением повышения среднего количества гемоглобина в эритроците у сигов из Большой Имандры. Можно заключить, что спад токсичности выявил активацию адаптационных механизмов, которые были направлены на повышение эффективности эритропоэза путем увеличения количества гемоглобина в созревающих эритроцитах.
Таблица 2.
Средние значения и стандартные ошибки гематологических показателей, патологий жабр, печени и почек рыб, а также некоторые морфометрические параметры жабр
| Гематологические, гистологические и морфологические параметры | Большая Имандра | Йокостровская и Бабинская Имандра |
|---|---|---|
| Концентрация гемоглобина (Hb), г/л | 81 ± 9 | 75 ± 13 |
| Среднее количество гемоглобина в эритроците (MCH), пг | 155 ± 23 | 113 ± 23 |
| Эритроциты, 106 клеток/мкл | 0.56 ± 0.07 | 0.73 ± 0.11 |
| Зрелые эритроциты | 0.52 ± 0.07 (94.8 ± 1.4) | 0.70 ± 0.11 (96.1 ± 0.8) |
| Незрелые эритроциты | 0.028 ± 0.008 (5.2 ± 1.4) | 0.029 ± 0.006 (4.0 ± 0.8) |
| Базофильные эритробласты | 0.010 ± 0.005 (2.0 ± 1.0) | 0.012 ± 0.003 (1.7 ± 0.3) |
| Полихроматофильные эритробласты | 0.018 ± 0.006 (3.3 ± 1.0) | 0.017 ± 0.005 (2.3 ± 0.6) |
| Лейкоциты, 103 клеток/мкл | 10.6 ± 2.1 | 16.4 ± 3.5 |
| Лимфоциты | 7.1 ± 1.3 (67.9 ± 3.4) | 14.6 ± 3.2 (85.8 ± 4.2) |
| Моноциты | 1.18 ± 0.27 (11.2 ± 1.6) | 0.41 ± 0.16 (3.5 ± 1.3) |
| Макрофаги | 0.54 ± 0.19 (5.5 ± 1.9) | 0.28 ± 0.17 (2.1 ± 1.0) |
| Нейтрофилы | 1.51 ± 0.60 (12.5 ± 3.0) | 0.76 ± 0.20 (5.6 ± 1.3) |
| Палочкоядерные нейтрофилы | 0.77 ± 0.37 (6.0 ± 1.9) | 0.47 ± 0.17 (3.1 ± 1.0) |
| Сегментоядерные нейтрофилы | 0.74 ± 0.25 (6.5 ± 1.7) | 0.29 ± 0.09 (2.5 ± 0.8) |
| Жабры | ||
| Ширина вторичных ламелл | 32.7 ± 1.2 | 44.5 ± 3.5 |
| Число слоев вставочного эпителия | 4.3 ± 0.3 | 5.1 ± 0.1 |
| Количество слизистых клеток 1 мм2 | 324 ± 31 | 252 ± 91 |
| Патологии жабр (%): | ||
| Цитолиз, плазмолиз, гиперплазия (w = 1) | 16.0 ± 3.1 | 28.2 ± 9.7 |
| Утолщение на концах ламелл (w = 1) | 1.39 ± 0.88 | 0.28 ± 0.20 |
| Аневризма (w = 2) | 0.97 ± 0.57 | 0 |
| Слияние ламелл (w = 2) | 4.79 ± 1.37 | 1.35 ± 0.76 |
| Десквамация ламелл (w = 3) | 2.68 ± 1.33 | 4.32 ± 2.02 |
| Разрушение ламелл (w = 3) | 3.11 ± 1.48 | 0 |
| Гистопологический индекс жабр (Iжабры) | 0.46 ± 0.08 | 0.44 ± 0.14 |
| Патологии печени(%): | ||
| Фиброз кровеносных сосудов (w = 2) | 0.09 ± 0.05 | 0.38 ± 0.12 |
| Фиброз желчных протоков (w = 2) | 0.03 ± 0.02 | 0.05 ± 0.03 |
| Некроз (w = 3) | 0.45 ± 0.12 | 2.32 ± 0.89 |
| Гистопологический индекс печени (Iпечень) | 0.016 ± 0.004 | 0.078 ± 0.029 |
| Патологии почек (%): | ||
| Мелано-макрофагальные центры (ММЦ) (w = 1) | 0.82 ± 0.24 | 1.66 ± 0.64 |
| Фиброэластоз извилистых канальцев (w = 2) | 1.00 ± 0.61 | 0.23 ± 0.18 |
| Фиброэластоз кровеносных сосудов (w = 2) | 0.16 ± 0.08 | 0.11 ± 0.03 |
| Кровотечения (w = 2) | 0.44 ± 0.19 | 0.30 ± 0.13 |
| Некроз (w = 3) | 2.52 ± 1.92 | 1.41 ± 0.38 |
| Гистопологический индекс почек (Iпочка) | 0.120 ± 0.060 | 0.075 ± 0.016 |
Белая кровь. Хотя общее количество лейкоцитов достоверно не различалось у сигов из загрязненных и незагрязненных частей озера (табл. 2), оно было в диапазон 6–12 × 103 клеток/мкл у сигов из Большой Имандры и в диапазоне 12–24 × × 103 клеток/мкл у сигов из Йокостровской и Бабинской Имандры. Основная роль иммунной системы – это первая линия защиты хозяина в противодействии патогенным организмам и борьба с любыми чужеродными материалами [8]. В период интенсивного загрязнения (1978–1997) среднее количество лейкоцитов было 27 и 20 × 103 клеток/мкл у сигов из загрязненных и реферативных частей озера соответственно [1]. В 2018 г., если общее количество лейкоцитов сохранялось на прежнем уровне у большинства сигов из Йокостровской и Бабинской Имандры, как и в период загрязнения, однако значительно понизилось в современный период у большинства сигов из Большой Имандры. Пониженный уровень лейкоцитов у сигов из исторически загрязненной части озера может означать не столько супрессию иммунной системы, сколько измененный путь иммунного ответа, чему могут способствовать гибкость и избыточность иммунной системы.
Среди лимфоцитов семейство В-клеток отвечает за выработку иммуноглобулина, а семейство Т-клеток помогает обеспечивать стимул, естественные киллеры (NK) составляют лишь около 10% популяции лимфоцитов; лимфоцитоз связан с инфекцией или стрессом в большинстве случаев [8]. Превалирующее относительное и общее количество лимфоцитов наблюдалось у сигов из незагрязненной части озера (табл. 2), и развитие специфического иммунного ответа было характерно для них.
Лимфопения и нейтрофилия являются классической универсальной реакцией иммунной системы на токсичное или инфекционное воздействие [8]. Они также присущи сигам из Большой Имандры (табл. 2), тогда как нейтрофильный лейкоцитоз был типичен в период интенсивного загрязнения [1]. В современный период защитные реакции сигов из исторически загрязненной части озера осуществляются больше через активацию системы врожденного иммунитета.
Нейтрофилы были единственными положительными на миелопероксидазу (образование супероксидных радикалов и реактивных галогеновых соединений) [7]. Сдвиг в сторону преобладания более зрелых сегментоядерных нейтрофилов выражен у сигов из Большой Имандры, тогда как палочкоядерные нейтрофилы, относящиеся к незрелым циркулирующим клеткам, преобладают у сигов из незагрязненной части озера (табл. 2). Таким образом, нейтрофилы обладают повышенной способностью выделять активные формы кислорода у сигов из Большой Имандры. В случае дефицита глутатионредуктазы респираторный взрыв прекращается преждевременно из-за токсического воздействия накопления перекиси водорода на НАДФН-оксидазу; при дефиците глутатионсинтетазы респираторный взрыв протекает нормально, но перемежающая нейтропения (возможно, вызванная метаболическим ацидозом), а также гемолиз, вызванный оксидантами, также характерны [8]. Смещение отношения S:Se в сторону увеличения у сигов из Большой Имандры (рис. 1 а) указывает на преобладание SeCys над SeMet и активацию селеноферментов, в том числе антиоксидантных, что имеет решающее значение в защите как миелоидных и эритроидных клеток, так и других клеток и тканей. Существует значительная избыточность в антимикробном механизме фагоцитов, что позволяет одной системе компенсировать дефект в другой, поскольку используются как окислительные, так и неокислительные системы [8]. Таким образом, защитный механизм сигов из исторически загрязненной части озера активно использует окислительные системы неспецифического иммунитета, тогда как этот механизм у сигов из незагрязненной части озера использует больше адаптивный специфический иммунитет.
Гистопатология органов. Гистопатологический анализ является эффективным и чувствительным инструментом для оценки здоровья рыб и загрязнения окружающей среды. Более того, гистопатология – это ответ более высокого уровня, отражающий предшествующее изменение физиологической и биохимической функций, они представляют собой совокупность физиологических и химических изменений [9].
Жабры. Гистопатология жабр сигов была представлена множественными деформациями жаберного эпителия и достигала наибольших значений индекса патологичности в отличие от других органов (табл. 2). Цитолиз, плазмолиз и гиперплазию можно рассматривать как первые реакции на внешние факторы. Ширина вторичных ламелл коррелировала со степенью развития этих реакций (r = 0.77, p < 0.001), и они были более характерны для сигов из незагрязненной части озера. В [10] показано, что морфометрические данные жабр могут дать доказательства возможных респираторных нарушений: увеличение ширины вторичных ламелл значительно сокращает межламеллярное расстояние, и, как результат, доля вторичных ламелл, доступных для газообмена, также значительно сокращается. Плохое поглощение кислорода компенсировалось усилением эритропоэза и высвобождением как зрелых (r = = 0.61, p < 0.01), так и незрелых (r = 0.67, p < 0.005) эритроцитов в общую циркуляцию крови.
Жабры рыб являются регулятором “осмореспираторного компромисса”: большая функциональная площадь поверхности респираторного эпителия и небольшое расстояние способствуют абсорбции O2, тогда как функциональная небольшая площадь поверхности и диффузия на большие расстояния способствуют осмо/ионной регуляции; механизмы регулирования включают перераспределение кровотока и/или обратимое ремоделирование структуры [11]. Пролиферативное увеличение клеточной массы эпителия не только во вторичных ламеллах, но и в межламеллярном пространстве (увеличивая число слоев вставочного эпителия) наблюдалось у сигов из незагрязненной части озера (табл. 2). Прогрессирующее увеличение пролиферации филаментного эпителия может выполнять и защитные функции от загрязнителей, активных форм O2, паразитов, а также обеспечивать структурную поддержку [11].
Серьезные циркуляционные нарушения (аневризма) наблюдались только у сигов из исторически загрязненной части озера (табл. 2). Формирование аневризмы связано с повреждением столбчатых клеток и нарушением целостности сосудов с выделением большого количества крови, которая выталкивает ламеллярный эпителий наружу [11]. Обнаруженная взаимосвязь увеличения числа макрофагов в крови с развитием аневризмы в респираторных ламеллах (r = 0.82, p < 0.001) может указывать на воспалительные реакции. Но и истончение стенок сосудов также могло вызывать миграцию фагоцитарных клеток в орган. Повышенная фагоцитарная активность, по-видимому, могла быть провоцирующим стимулом развития аневризмы у сигов из Большой Имандры.
Слизистые клетки жабр обеспечивают жизненно важную защиту тонкой структуры и эпителия жабр и действуют как первичная ловушка для экзогенных веществ [12]. Количество слизистых клеток в жабрах сигов из Большой Имандры было несколько больше, хотя достоверных отличий не было обнаружено, что может быть связано и с их большими серьезными структурными повреждениями (табл. 2). Регрессия слизистых клеток жабр, связанная со структурными повреждениями, наблюдалась у ювенильных особей Solea senegalensis [12]. Структурные повреждения жабр провоцировали рост незрелых базофильных эритробластов (r = 0.75, p < 0.005), лейкоцитов (r = 0.68, p < < 0.005), в особенности фагоцитов (моноцитов (r = 0.79, p < 0.001) и нейтрофилов (r = 0.83, p < < 0.001)).
Если защитные реакции сигов из незагрязненной части озера связаны с пролиферативными изменениями, обеспечивая структурную поддержку, но ухудшая газообмен, то адаптивная стратегия сигов из исторически загрязненной части озера направлена на снижение компенсаторной пролиферации, тем самым улучшая газообмен.
Печень участвует в метаболизме загрязняющих веществ, что делает ее и мишенью, и органом, обеспечивающим защитные функции организма [9]. Гистопатологические изменения печени сигов из незагрязненной части озера были более значительно выражены, тогда как у сигов из исторически загрязненной части озера были незначительны (табл. 2). Наиболее частыми поражениями ткани печени были фиброз и некроз. Эти поражения, а также общий показатель гистопатологии печени (Iпечень) коррелируют с биоаккумуляцией Fe, Cu, Se, Ni и W (r > 0.65, p < 0.005).
Готовность к эндоцитозу и фагоцитозу поддерживается антиоксидантным статусом рыб (взаимосвязь нейтрофилов (r = 0.63, p < 0.01), сегментоядерных нейтрофилов (r = 0.654 p < 0.005) и моноцитов в крови (r = 0.70, p < 0.001) с отношением S:Se в печени рыб). Следует заметить, что биоаккумуляция Ni и W наблюдается, наоборот, с понижением антиоксидантного статуса (r = –0.65, p < 0.005 и r = –0.61, p < 0.01 соответственно), и их биоаккумуляция напрямую связана с поражениями печени. Следует также учитывать, что фагоцитарная активность приносит не только разрушение и воспалительные реакции, но и положительные эффекты, запускающие репаративные реакции. Например, нейтрофилы были положительными и на металлопротеиназы 2 и 9 (Ca2+ и Zn2+-зависимых протеиназ, участвующих в деградации компонентов внеклеточного матрикса и ремоделировании ткани) [7].
Метаболизм и хранение таких эссенциальных металлов, как Fe, Cu и Se в основном осуществляется в печени. Если они активно используются у сигов из исторически загрязненной части озера, то они, по-видимому, запасаются и захораниваются в ферритине и гемосидерине для Fe, церулоплазмине и MT для Cu и SeMet для Se, что может составлять как запасной пул, так и вероятную причину токсичности у сигов из незагрязненной части озера. Таким образом, тонкая грань между эссенциальностью и токсичностью Fe, Cu и Se проявилась у сигов из исторически загрязненной и незагрязненной частей озера.
Почки. Значительная часть зажаберной крови проходит через почки рыб и, следовательно, поражения почек могут являться индикатором интоксикации организма. Общая интоксикация, по-видимому, может налагать дополнительную нагрузку на почки в выведении не только токсичных веществ, но и эндогенных продуктов метаболизма. Хотя достоверных отличий в патологиях почек не было обнаружено (табл. 2), но механизмы, вовлеченные в процессы детоксикации и утилизации, могут сильно различаться (рис. 1 б).
Мононуклеарные фагоциты (моноциты и макрофаги) влияют на эффективность процессов эндоцитоза и деградации, с другой стороны, функции мелано-макрофагальных центров (ММЦ) – иммунные; хранение, разрушение и детоксикация экзогенных и эндогенных веществ; рециркуляция Fe [8]. Если увеличение числа и площади ММЦ при снижении моноцитов и макрофагов наблюдалось у сигов из незагрязненной части озера, то наоборот, снижение ММЦ при увеличении моноцитов и макрофагов было у сигов из исторически загрязненной части озера (рис. 1 б). Увеличение ММЦ, по-видимому, является следствием того, что мононуклеарные фагоциты не справляются с утилизаций экзогенных и эндогенных веществ.
Фиброэластоз и некроз, гистопатологический индекс почки (Iпочка) ассоциированы с биоаккумуляцией Zn (r > 0.69, p < 0.005) и Co (r > 0.63, p < < 0.005). Ratn и др. [13] показали, что Zn накапливается в почке рыб больше, чем в печени, и нарушения равновесной динамики нормального окислительного метаболизма приводят к последующим повреждениям ДНК и белков и вызывают дегенеративные изменения клубочков. Кобальт при любых экзогенных и эндогенных условиях перераспределяется в почку рыб [14]. Если Со является ключевым компонентом кобаламина и кофактором различных ферментов, то недавно было показано, что он является имитатором гипоксии и сигналом накопления поврежденных реактивными видами кислорода протеинов в почке рыб [15]. Таким образом, повышенная аккумуляция Zn и Co в почке рыб может служить маркером переизбытка накопления клеточного “мусора” и признаком того, что фагоцитарная система не справляется с их утилизацией.
ВЫВОДЫ
Таким образом, озеро Имандра, в прошлом интенсивно загрязняемый водоем тяжелыми металлами, является уникальной моделью для исследования физиологических реадаптаций рыб к улучшению условий после снижения поступления металлов. Повышенное отношение S к Se указывает на высокий антиоксидантный статус рыб из исторически загрязненной части озера, тогда как повышенная аккумуляция Fe, Cu и Se может служить маркером патологий печени, Zn и Co – патологий почек. В целом биологические реакции сига из исторически загрязненной части озера изменены: (1) высокий антиоксидантный статус поддерживает системы организма; (2) окислительные системы неспецифического иммунитета доминируют в защитных функциях; (3) адаптивная стратегия направлена на улучшение газообмена и увеличение гемоглобина в эритроцитах; (4) большая эффективность эндо- и фагоцитоза типична для рыб.
Список литературы
Моисеенко Т.И., Даувальтер В.А., Лукин А.А., Кудрявцева Л.П., Ильящук Б.П., Ильящук Л.И., Сандимиров С.С., Каган Л.Я., Вандыш О.И., Шаров А.Н., Шарова Ю.Н., Королева И.Н. Антропогенные модификации экосистемы озера Имандра. М: Наука, 2002. 476 с.
Моисеенко Т.И., Гашкина Н.А., Шаров А.Н., Ван-дыш О.И., Кудрявцева Л.П. Антропогенная трансформация арктической экосистемы озера Имандра: тенденции к восcтановлению после длительного периода загрязнения // Водные ресурсы. 2009. Т. 36. № 3. С. 312–325.
Gashkina N.A., Moiseenko T.I., Kudryavtseva L.P. Fish response of metal bioaccumulation to reduced toxic load on long-term contaminated Lake Imandra // Ecotoxicol. Environ. Saf. 2020. V. 191. P. 110205.
Bernet D., Schmidt H., Meier W., Burkhardt-Holm P., Wahli T. Histopathology in fish: proposal for a protocol to assess aquatic pollution // J. Fish Dis. 1999. V. 22. P. 25–34.
Gashkina N.A., Moiseenko T.I. Influence of Thermal Pollution on the Physiological Conditions and Bioaccumulation of Metals, Metalloids, and Trace Metals in Whitefish (Coregonus lavaretus L.) // Int. J. Mol. Sci. 2020. V. 12. P. 4343.
Fish Physiology: Homeostasis and Toxicology of Essential Metals. Wood C.M., Farrell A.P., Brauner C.J. (Eds.) London: Academic Press. 2012. V. 31A, 520 p.
Da Silva W.F., Egami M.I., Santos A.A., Antoniazzi M.A., Silva M., Gutierre R.C., Paiva M.J.R. Cytochemical, immunocytochemical and ultrastructural observations on leukocytes and thrombocytes of fat snook (Centropomus parallelus) // Fish Shellfish Immunol. 2011. V. 31. P. 571–577.
Hematology: Basic Principles and Practice. Hoffman R., Benz E.J., Silberstein L.E., Heslop H.E., Weitz J.I., Anastasi J., Salama M.E., Abutalib S.A. (Eds.). 7th ed. Philadelphia: Elsevier. 2018. 2408 p.
Hinton D.E., Baumann P.C., Gardner G.C., Hawkins W.E., Hendricks J.D., Murchelano R.A., Okihiro M.S. Histopathologic biomarkers / In Biomarkers: Biochemical, Physiological and Histological Markers of Anthropogenic Stress. New York: CRC Press. 2017. P. 155–210.
Nero N., Farwell A., Lister A., van Der Kraak G., Lee L.E.J., van Meer T., MacKinnon M.D., Dixon D.G. Gill and liver histopathological changes in yellow perch (Perca flavescens) and goldfish (Carassius auratus) exposed to oil sands process-affected water // Ecotoxicol. Environ. Saf. 2006. V. 63. P. 365–377.
Wood C.M., Eom J. The osmorespiratory compromise in the fish gill. // Comp. Biochem. Physiol. A. 2021. V. 254. P. 110895.
Costa P.M., Diniz M.S., Caeiro S., Lobo J., Martins M., Ferreira A.M., Caetano M., Vale C., DelValls T.Á., Costa M.H. Histological biomarkers in liver and gills of juvenile Solea senegalensis exposed to contaminated estuarine sediments: A weighted indices approach // Aquat. Toxicol. 2009. V. 92. P. 202–212.
Ratn A., Prasad R., Awasthi Y., Kumar M., Misra A., Trivedi S.P. Zn2+ induced molecular responses associated with oxidative stress, DNA damage and histopathological lesions in liver and kidney of the fish, Channa punctatus (Bloch, 1793) // Ecotoxicol. Environ. Saf. 2018. V. 151. P. 10–20.
Гашкина Н.А. Эссенциальные элементы в органах и тканях рыб в зависимости от токсичности среды обитания и физиологического состояния // Геохимия. 2017. Т. 55. № 10. С. 934–941.
Kubrak O.I., Husak V.V., Rovenko B.M., Storey J.M., Storey K.B., Lushchak V.I. Cobalt-induced oxidative stress in brain, liver and kidney of goldfish Carassius auratus // Chemosphere. 2011. V. 85. P. 983–989.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле


