Доклады Российской академии наук. Науки о Земле, 2023, T. 509, № 1, стр. 56-61
Экспериментальное обоснование влияния S и Ni на кристаллизацию малоазотных алмазов в расплаве Fe при высоком давлении
В. М. Сонин 1, Е. И. Жимулев 1, *, А. А. Чепуров 1, А. А. Томиленко 1, А. И. Чепуров 1, академик РАН Н. П. Похиленко 1
1 Институт геологии и минералогии им. В.С. Соболева Сибирского отделения Российской академии наук
Новосибирск, Россия
* E-mail: ezhimulev@igm.nsc.ru
Поступила в редакцию 14.11.2022
После доработки 01.12.2022
Принята к публикации 02.12.2022
- EDN: THVHNW
- DOI: 10.31857/S2686739722602599
Аннотация
На основе анализа результатов по синтезу и росту алмазов в металл-сульфидных расплавах при высоком давлении обосновывается причина кристаллизации малоазотных кристаллов алмаза. Введение серы в расплав железа приводит к уменьшению растворимости азота, что приводит, в свою очередь, к уменьшению содержания атомов азота в расплаве и вероятности их захвата растущими кристаллами алмаза в виде структурной примеси. Добавление никеля снижает температуру плавления ростовой системы, увеличивает количество расплава и, соответственно, способствует диссоциации молекулярного азота на отдельные атомы, которые захватываются алмазами при росте в виде структурной примеси.
ВВЕДЕНИЕ
Расплавы на основе железа широко используются для выращивания кристаллов алмаза при высоких давлениях и температурах. Для снижения температуры плавления среды кристаллизации алмаза и подавления процесса карбидообразования к Fe обычно добавляют Ni (или Co). Алмазы, выращиваемые данным способом, имеют желтый цвет и высокое содержание азота от 50 до 500 ppm в виде структурной примеси [1]. Азот захватывается растущими кристаллами алмаза в виде одиночных атомов (С-центры). Такая особенность в состоянии азота обусловлена диссоциацией молекулярного азота на одиночные атомы при растворении в расплавах переходных металлов группы Fe. При синтезе алмазов азот попадает в ростовую систему из пор, заполненных воздухом, при сборке внутреннего объема ячеек высокого давления. Если температура в экспериментах по выращиванию алмазов превышает 1500°C, то одиночные атомы азота в структуре алмаза агрегируются [1].
Растворимость азота в расплаве Fe подчиняется закону Сивертса. Значение растворимости пропорционально квадратному корню от парциального давления азота, т.е. чем выше парциальное давление азота, тем выше его растворимость [2]. При предельных значениях концентрации азота возможно образование нитридов Fe. В экспериментальных исследованиях по синтезу алмаза эта зависимость подтверждается [3]. На примере систем Fe–C и Fe–Ni–C было установлено, что при дополнительном введении азота в ростовую систему кристаллизуются алмазы с очень высоким содержанием азота в качестве структурной примеси (до 2500 ppm), причем количество примесного азота в алмазах возрастает с увеличением его концентрации в расплаве. Кроме того, в алмазах обнаружены включения нитрида Fe. В обычных экспериментах по синтезу алмазов (без добавок азота) нитриды не диагностированы. В нижнемантийных природных алмазах также обнаружены нитриды Fe, что по аналогии с экспериментом может свидетельствовать о высоких концентрациях азота в среде кристаллизации алмазов [4].
Для получения бесцветных малоазотных кристаллов алмаза в ростовую среду добавляют так называемые “геттеры азота”, наиболее часто используемым из которых является металлический титан. При введении Ti в количестве нескольких процентов растут бесцветные кристаллы алмаза с содержанием примесного азота менее 1 ppm [1]. В таких системах методом газовой хромато-масс-спектрометрии (ГХ-МС) во флюидных включениях в кристаллах алмаза диагностированы в большом количестве сложные, включая углеводородные, соединения азота [5]. Таким образом, в системах с металлическим Ti азот концентрируется, главным образом, не в молекулярной форме N2, а в виде сложных соединений, которые, по-видимому, не растворяются в металлическом расплаве. Этот эффект наблюдается и в случае добавления металлического Ti в металл-сульфидный расплав [6].
Бесцветные малоазотные кристаллы алмаза выращены в системе Fe–S–С без добавления металлического Ti или других геттеров азота [7–9]. Обнаруженное явление, по-нашему мнению, имеет большое значение, в первую очередь, для объяснения генезиса природных алмазов типа IIa по физической классификации, поскольку присутствие металлического Ti в природных минеральных ассоциациях маловероятно. Причина кристаллизации малоазотных алмазов в серосодержащем расплаве Fe не выяснена. Настоящая статья посвящена особенностям кристаллизации алмаза в данной системе при высоком давлении с объяснением возможных причин обнаруженного явления.
Для осуществления синтеза алмаза в металл-сульфидных расплавах необходимо соблюдение нескольких условий.
“КАРБИДНЫЙ БАРЬЕР”
Несмотря на относительно низкую температуру эвтектики в системе Fe–C, при РТ-параметрах термодинамической стабильности алмаза существуют две карбидные фазы: Fe3C и Fe7C3. Поэтому для кристаллизации алмаза температура должна превышать температуру плавления карбида Fe7C3 как более высокотемпературной фазы относительно карбида Fe3C.
ВЛИЯНИЕ СЕРЫ
При добавлении S в систему Fe–C карбидные фазы также присутствуют [10]. В указанном исследовании определены минимальные температуры кристаллизации алмаза в системе Fe–S–C при давлении 5.3–5.5 ГПа. Показано, что рост кристаллов алмаза происходил в интервале от 1300°С (температура перитектической реакции расплав + алмаз = Fe7C3) до 1370°С (температура появления термодинамически стабильного графита).
На рис. 1 представлена достаточно хорошо изученная при 0.1 МПа фазовая диаграмма системы Fe–S [11]. На диаграмму нанесены валовые составы растворителя в экспериментах, в которых были осуществлены синтез и рост алмазов на затравки из работ [8–10]. Эти эксперименты проведены в очень узком интервале составов по содержанию S: 1–4 мас. %. Вариации давления и температуры в экспериментах также были незначительны: 1300–1450°C; 5.3–5.5–6.0 ГПа. Судя по фазовой диаграмме, все успешные эксперименты по кристаллизации алмазов проведены в области составов, отвечающих совместному присутствию твердого железа и жидкости.
Рис. 1.
Фазовые взаимоотношения в системе Fe–S при 0.1 МПа [11] с нанесенными на диаграмму областью кристаллизации алмаза при давлении 5.3–5.5–6.0 ГПа (1); линии ликвидуса (2) в богатой Fe части диаграммы при 6.0 ГПа по [12] и линий термодинамического равновесия графит–алмаз при 5.5 и 6.0 ГПа (3, 4 соответственно) по [13].
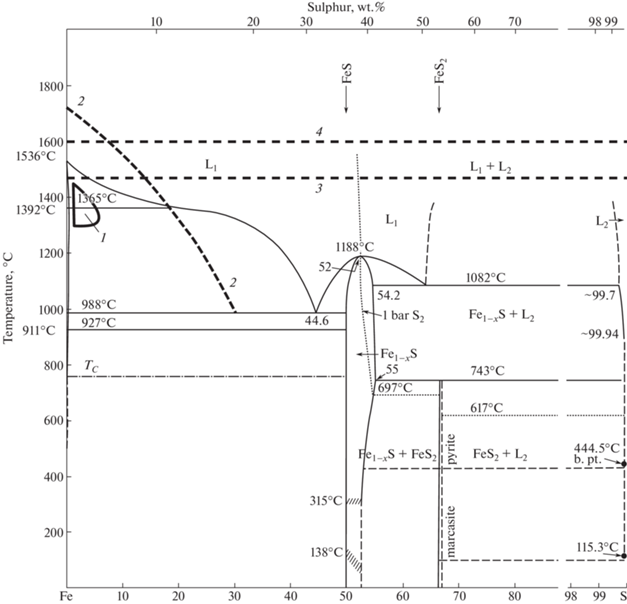
Система имела гетерогенный фазовый состав. Этим обстоятельством объясняется большое количество включений среды кристаллизации в алмазах (рис. 2) [10]. Минимизировать количество включений удается только при низких скоростях роста кристаллов [9]. При этом состав жидкости сильно отличается по содержанию S в сторону увеличения относительно валового состава в ростовой системе. На фазовую диаграмму системы Fe–S (рис. 1) нанесены также линия ликвидуса в богатой Fe части диаграммы при 6.0 ГПа по данным [12] и линии термодинамического равновесия графит–алмаз при 5.5 и 6.0 ГПа по [13]. Из диаграммы видно, что для получения гомогенного состава растворителя необходимо увеличить температуру, но это неминуемо приведет к кристаллизации графита, так как линия термодинамического равновесия графит–алмаз находится ниже по температуре, чем линия ликвидуса.
Рис. 2.
Кристалл алмаза, выращенный в системе Fe–C–S при высоком давлении с содержанием S 1 мас. %: а – общий вид; б – увеличенный фрагмент.

Гомогенную среду кристаллизации можно получить также, изменив валовый состав системы в сторону увеличения количества S. В вышеуказанных работах [8–10] содержание S в жидкости был примерно 4.9 мас. % при 1450°C и, соответственно, 8.7 мас. % при 1300°C (на линии ликвидуса при 6.0 ГПа). Гомогенный фазовый состав, состоящий только из расплава, должен быть при более высоком содержании S. Но в таком случае имеет место интересное явление: чем выше содержание S в расплаве, тем ниже растворимость углерода. Данное явление установлено экспериментально на примере изменения скорости растворения кристаллов алмаза в расплаве Fe–S при высоком давлении в зависимости от содержания S [14]. Этот эффект оказывает влияние и на кристаллизацию алмаза: максимальное валовое содержание S, при котором был получен алмаз, составляло 4 мас. % [10].
ВЛИЯНИЕ НИКЕЛЯ
Усложнение системы путем добавления Ni приводит к значительному снижению температуры тройной эвтектики Fe–Ni–C до 1060–1080°C [15], что на 200 градусов ниже двойной эвтектики Fe–С. Это приводит, в свою очередь, к расширению области существования расплава в ростовой системе и позволяет синтезировать алмаз при более высоком содержании S. Так, в работе [6] синтез и рост кристаллов алмаза на затравки в системе Fe–Ni–S–C (5.5 ГПа, 1300°C) осуществлены при содержании серы в растворителе 9.9 мас. %, а при 15.6 мас. % кристаллизовался только метастабильный графит. Содержание Ni в шихте варьировало от 21.92 до 30.60 мас. %. Были выращены кристаллы алмаза весом до 0.8 карата.
Эффект уменьшения растворимости углерода от увеличения содержания S в системе также имеет место. Увеличение количества S в системе до 35 мас. % приводит к уменьшению растворимости углерода в 20 раз по сравнению с системой без S [16]. Поэтому, как считают авторы исследования [16], низкая растворимость углерода в моносульфидном расплаве исключает возможность кристаллизации алмаза из расплава с высоким содержанием S.
В исследовании [17] для выращивания алмазов использовали сплав Fe64Ni36 с добавлением в ростовую систему сульфида FeS в количестве до 6 мас. % при 6.0 ГПа и 1300–1340°C. Выращенные кристаллы алмаза имели желтый цвет вследствие захвата примесного азота в виде С-центров в количестве 157–173 ppm. С другой стороны, в исследовании [18] в системе Fe–Ni–S–С при 6 ГПа и 1400°C синтезированы малоазотные кристаллы алмаза. Серу добавляли в ростовую систему в виде сульфида FeS2. Указывается, что при содержании S в ростовой системе в количестве 5 мас. % в алмазах присутствовали примеси структурного азота в количестве 10–50 ppm, а при содержании S в количестве 10–15 мас. % – 5–10 ppm. С увеличением содержания серы процент превращения графита в алмаз снижался, а при 20 мас. % S кристаллизовался исключительно метастабильный графит. Отличием от работы [17] было соотношение никеля к железу (10 мас. %). То есть тенденция роста малоазотных кристаллов алмаза в таком расплаве сохраняется, хотя и в менее ярко выраженном виде по сравнению с расплавом Fe‒S. Но в случае использования расплава Fe‒Ni(36 мас. %)–S такой эффект отсутствует.
В результате экспериментального исследования установлено, что при высоком давлении (2–7 ГПа) и высокой температуре (1600 и 1800°C) растворимость азота в расплаве Fe–Ni (5 мас. % по отношению к Fe) почти не меняется при содержании серы до 12–15 мас. % в системе, но резко падает в два раза при увеличении количества серы от 21 до 28 мас. % [19]. Подтверждена тенденция уменьшения растворимости азота при увеличении содержания серы в ростовой системе.
ЗАКЛЮЧЕНИЕ
Напомним, необходимым условием вхождения азота в структуру алмаза в виде С-центров является диссоциация молекулярного азота на отдельные атомы в расплавах переходных металлов. Растворение азота в таких расплавах – очень сложный и многостадийный процесс. В плане вышеизложенного материала должны интересовать, главным образом, три стадии этого процесса: адсорбция N2 на границе фазового раздела расплав–флюид; переход N2 через фазовую границу в расплав; и, собственно, стадия диссоциации на атомы.
Величины растворимости легких компонентов (С, S, N) в расплаве Fe имеют обратную зависимость относительно друг друга, т.е. чем больше количество одного компонента, тем меньше растворимость другого. Увеличение содержания углерода и серы в расплаве приводит к заметному уменьшению растворимости азота. А увеличение количества Ni в расплаве Fe только незначительно влияет на растворимость азота в сторону уменьшения [2].
Все эксперименты по синтезу и росту кристаллов алмаза в металл-сульфидных расплавах проведены по единой методике с валовым содержанием углерода, значительно превышающем его растворимость в используемых расплавах. Установлена зависимость образования алмаза в массовом выражении от содержания S. Эта зависимость обратно пропорциональная и имеет место как в системе Fe–S–C, так и в системе Fe–Ni–S–C. С введением серы атомы Fe связываются в квазимолекулярные объединения атомов, в ближнем порядке соответствующие не только карбидным фазам, но и FeS. Соответственно, чем выше содержание S, тем большее количество атомов Fe находится в связанном состоянии и тем меньше расплав способен растворять азот. Вероятно, это явление ухудшает не только растворимость азота, но и адсорбционные свойства расплава по отношению к нему. Косвенным доказательством может служить тот факт, что по результатам газового хромато-масс-спектрометрического (ГХ-МС) анализа в сплаве состава Fe–S–C (после экспериментов по росту алмазов) в отсутствие металлического Ti азот находится, главным образом, в молекулярной форме N2 [8]. Поэтому в ростовой системе в отсутствие металлического Ti механизм процесса, предложенный в [5], не имеет места. ГХ-МС-анализ продуктов экспериментов показал также отсутствие нитридных соединений серы типа S4N4, S4N2 [8], т.е. сера в буквальном смысле не является геттером (поглотителем) азота.
При прочих равных условиях проведения экспериментов значительное различие при введении в ростовую систему Ni (по сравнению с системой без Ni) заключается в увеличении количества металлической жидкости в ростовой системе. Ni не образует собственных фаз, но входит в качестве изоморфной примеси в карбиды и сульфид Fe [6]. Ni “разбавляет” расплав, тем самым увеличивая количество растворенного азота и, соответственно, повышая возможность его диссоциации на отдельные атомы. Поэтому в присутствии расплава Fe–Ni–S с большим содержанием никеля (36 мас. % по отношению к Fe) кристаллизуются алмазы с высоким содержанием примесного азота.
Природные алмазы полигенетичны, поэтому и механизм образования малоазотных алмазов может быть разным в зависимости от условий, которые определяются не только температурой и давлением, но и химизмом среды кристаллизации в мантии Земли. В частности, в глубинных алмазах диагностированы металлические и карбидные включения [4, 20]. Предложенный вариант является частным случаем, касающимся кристаллизации алмазов в металл-сульфидных системах.
Образование малоазотных кристаллов алмаза в металл-сульфидных расплавах имеет первостепенное значение, поскольку наиболее ценные природные алмазы типа CLIPPIR (Cullinan-like, inclusion-poor, relatively pure, irregularly shaped, and resorbed) кристаллизовались в процессе субдукции в мантии Земли в расплаве состава Fe–Ni–S–C [20]. Валовый состав металл-сульфидных включений в алмазах типа CLIPPIR соответствует вариациям в пределах: Fe0.61–0.75Ni0.10–0.13C0.15–0.20S0.05–0.12. Вероятно, такие алмазы кристаллизовались в расплаве с примерно 10-процентным содержанием Ni по отношению к Fe, т.е. в среде, в которой образуются алмазы типа II по содержанию структурных примесей азота.
Список литературы
Kanda H. Large diamond grown at high pressure conditions // Braz. J. Phys. 2000. V. 30 (3). P. 482–489.
Pehlke R.D., Elliott J.F. Solubility of nitrogen in liquid iron alloys // Trans AIME. 1960. V. 218. P. 1088–1101.
Liang Z-Z., Liang J-Q., Jia X-P. Effect of NaN3 added in Fe-C system on inclusion and impurity of diamond synthesized at high pressure and high temperature // Chin. Phys. Lett. 2009. V. 26 (3). P. 038104–3.
Kaminsky F., Wirth R. Nitrides and carbonitrides from the lowermost mantle and their importance in the search for Earth’s “lost” nitrogen // Am. Mineral. 2017. V. 102. P. 1667–1676. https://doi.org/10.2138/am-2017-6081
Sonin V., Tomilenko A., Zhimulev E., Bul’bak T., Chepurov A., Babich Yu., Logvinova A., Timina T., Chepurov A. The composition of the fluid phase in inclusions in synthetic HPHT diamonds grown in system Fe–Ni–Ti–C // Sci. Rep. 2022. V. 12: 1246. https://doi.org/10.1038/s41598-022-05153-7
Жимулев Е.И., Чепуров А.И., Синякова Е.Ф., Сонин В.М., Чепуров А.А., Похиленко Н.П. Кристаллизация алмаза в системах Fe–Co–S–C и Fe–Ni–S–C и роль металл-сульфидных расплавов в генезисе алмазов // Геохимия. 2012. № 3. С. 227–239. https://doi.org/10.1134/S0016702912030111
Жимулев Е.И., Шеин М.А., Похиленко Н.П. Кристаллизация алмаза в системе Fe–S–C // ДАН. 2013. Т. 451. № 1. С. 73–75.
Жимулев Е.И., Сонин В.М., Бульбак Т.А., Чепуров А.И., Томиленко А.А., Похиленко Н.П. Летучие соединения серы в системе Fe–C–S при 5.3 ГПа и 1300°С // ДАН. 2015. Т. 462. № 3. С. 340–345. https://doi.org/10.1134/S1028334X15050219
Yelisseyev A.P., Zhimulev E.I., Karpovich Z.A., Chepurov A.A., Sonin V.M., Chepurov A.I. Characterization of the nitrogen state in HPHT diamonds grown in an Fe–C melt with a low sulfur addition // Cryst. Eng. Comm. 2022. V. 24. P. 4408–4416. https://doi.org/10.1039/d2ce00487a
Жимулев Е.И., Сонин В.М., Миронов А.М., Чепуров А.И. Влияние содержания серы на кристаллизацию алмаза в системе Fe–C–S при 5.3–5.5 ГПа и 1300–1370°С // Геохимия 2016. Т. 54. № 5. С. 439–446. https://doi.org/10.1134/S0016702916050116
Von Goldbeck O.K. Iron-Sulfur. In: IRON – Binary Phase Diagrams. Springer-Verlag Berlin Heidelberg. 1982. P. 125–126.
Buono A.S., Walker D. The Fe-rich liquidus in the Fe-FeS system from 1 bar to 10 GPa // Geochim. Cosmochim. Acta. 2011. V. 75. P. 2072–2087. https://doi.org/10.1016/j.gca.2011.01.030
Kennedy C.S., Kennedy G.C. The equilibrium boundary between graphite and diamond // J. Geophys. Res. 1976. V. 81. P. 2467–2470.
Сонин В.М., Жимулев Е.И., Чепуров А.А., Чепуров А.И., Похиленко Н.П. Влияние содержания серы в расплаве Fe–S на сохранность алмазов при PT-условиях мантии Земли // ДАН. 2018. Т. 481. № 2. С. 193–196. https://doi.org/0.1134/S1028334X1807019X
Kocherzhiskii Yu.A., Kulik O.G., Turkevich V.Z. Phase equilibria in the Fe–Ni–C and Fe–Co–C systems under high temperatures and high pressures // High Temp.-High Pres. 1993. V. 25 (1). P. 113–116.
Zhang Z., Lentsch N., Hirschmann M.M. Carbon-saturated monosulfide melting in shallow mantle: solubility and effect on solidus // Contrib. Mineral. Petrol. 2015. V. 170: 47–13. https://doi.org/10.1007/s00410-015-1202-z
Fang S., Ma H., Wang Z., Yang Z., Cai Z.H., Ding L., Miao X., Chen L., Jia X. Study on growth characteristics of Ib-type diamond in an Fe-Ni-C-S system // Cryst. Eng. Comm. 2019. V. 21. P. 6010–6017. https://doi.org/10.1039/c9ce01194c
Palyanov Yu.N., Borzdov Yu.M., Khokhryakov A.F., Bataleva Yu.V., Kuprianov I.N. Effect of sulfur on diamond growth and morphology in metal-carbon systems // Cryst. Eng. Comm. 2020. V. 22. P. 5497–5508. https://doi.org/10.1039/d0ce00865f
Grewal D.S., Dasgupta R., Sun C., Tsuno K., Costin G. Delivery of carbon, nitrogen, and sulfur to the silicate Earth by a giant impact // Science Advances. 2019. V. 5 (1). eaau3669. https://doi.org/10.1126/sciadv.aau3669
Smith E.M., Shirey S.B., Nestola F., Bullock E.S., Wang J., Richardson S.H., Wang W. Large gem diamonds from metallic liquid in Earth’s deep mantle // Science. 2016. V. 35. P. 1403–1405. https://doi.org/10.1126/science.aal1303
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о Земле


