Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 44-48
ХАРАКТЕРИСТИКА ДОФАМИН-ПРОДУЦИРУЮЩЕЙ СИСТЕМЫ И РЕЦЕПТОРОВ К ДОФАМИНУ В СУПРАХИАЗМАТИЧЕСКОМ ЯДРЕ У КРЫС В ОНТОГЕНЕЗЕ
Т. С. Пронина 1, *, А. А. Колачева 1, Л. К. Дильмухаметова 1, Ю. О. Никишина 1, К. К. Сухинич 1, академик РАН М. В. Угрюмов 1
1 Институт биологии развития им. Н.К. Кольцова Российской Академии наук
Москва, Россия
* E-mail: tatiana.pronina@mail.ru
Поступила в редакцию 30.10.2019
После доработки 30.10.2019
Принята к публикации 30.10.2019
Аннотация
Одной из особенностей развития супрахиазматического ядра (СХЯ) – “биологических часов” организма является ранняя экспрессия рецепторов к дофамину (ДА) в отсутствиe дофаминергических нейронов как источника ДА. Только недавно нами было показано, что ДА в СХЯ синтезируется совместно нервными волокнами, содержащими только тирозингидроксилазу (ТГ), и нейронами, содержащими только декарбоксилазу ароматических L-аминокислот (ДАА). Целью данной работы явился анализ особенностей фенотипа ТГ-волокон в онтогенезе. Для этого было проведено ПЦР и иммуногистохимический анализ экспрессии таких генов и белков, как ТГ, ДАА, везикулярный моноаминовый транспортер (ВМАТ), рецепторы к ДА (Д1, Д2). В СХЯ у молодых и взрослых крыс обнаружены многочисленные ТГ-иммунореактивные волокна. В некоторых ТГ-волокнах обнаружен ВМАТ, что предполагает везикулярное запасание L-ДОФА. Учитывая ключевую роль ТГ-волокон в кооперативном синтезе ДА, нами предполагалось наличие их дофаминовой регуляции. С помощью двойного иммуномечения показано, что в ТГ-волокнах у взрослых крыс присутствуют Д1 и Д2, а у молодых – только Д1. По данным ПЦР, Д1 и Д2 также экспрессируются в нейронах СХЯ у взрослых крыс и только Д1 у молодых. Таким образом, впервые показано, что в СХЯ у молодых и взрослых крыс в нервных волокнах, содержащих ТГ и синтезирующих L-ДОФА, ко-экспрессируют ВМАТ и Д1 рецепторы, а у взрослых крыс еще и Д2 рецепторы, что предполагает соответственно везикулярное запасание и дофаминовую регуляцию секреции L-ДОФА.
Развитию супрахиазматического ядра (СХЯ) уделяется большое внимание, поскольку оно уже внутриутробно начинает функционировать как “биологические часы”, обеспечивающие у взрослых животных регуляцию многих функций в соответствии с циркадными ритмами [1–4]. Одной из важных характеристик развития СХЯ является высокий уровень экспрессии рецепторов к дофамину (ДА) особенно в перинатальном периоде [5–7]. Вызывает удивление то, что это происходит в отсутствие в СХЯ дофаминергических нейронов ДА (тел или волокон) как источника [8, 9].
Нами недавно было показано, что ДА в СХЯ так же, как и в аркуатном ядре, синтезируется совместно недофаминергическими нейронами, содержащими по одному из комплементарных ферментов его синтеза – тирозингидроксилазу (ТГ) или декарбоксилазу ароматических L-аминокислот (ДАА) [10]. Эти структуры представлены вазопрессинергическими нейронами, ко-экспрессирующими ДАА [11], и некатехоламинергическими волокнами, содержащими ТГ и лишенными ДАА [9]. Впервые наличие кооперативного синтеза ДА было продемонстрировано при изучении медиобазального гипоталамуса. В этом случае было показано, что L-диоксифенилаланин (L-ДОФА), синтезирующийся в ТГ-содержащих нейронах (телах и отростках), секретируется в межклеточные щели и захватывается с помощью мембранного транспортера ароматических L-аминокислот в нейроны, содержащие ДАА, где и происходит синтез ДА [12].
Учитывая ключевую роль некатехоламинергических ТГ-содержащих волокон в СХЯ в синтезе L-ДОФА как нейротрансмиттера и предшественника синтеза ДА в ДАА-содержащих нейронах, представлялось целесообразным оценить особенности их фенотипа, отражающие специфику функционирования.
Работу проводили на самцах крыс Вистар на 10-й и 60-й постнатальные дни (П). День рождения крысят считали П1. Животных содержали в стандартных условиях вивария при свободном доступе к пище и воде и 12-часовом режиме день–ночь. Все манипуляции с животными были проведены в соответствии с национальными и международными требованиями и правилами, утвержденными комитетом по охране животных ФГБУН Института биологии развития им. Н.К. Кольцова РАН.
В первой серии экспериментов крыс под наркозом изофлураном декапитировали, выделяли мозг, вырезали блок с областью СХЯ, который замораживали в парах азота. На криостате Leica CM1950 (“Leica”, Германия) делали серийные фронтальные срезы толщиной 12 мкм и монтировали на POL-мембраны (FrameSlides, “Leica”, Германия). Срезы на мембранах фиксировали ацетоном 5 мин при 4°С, окрашивали 1%-м толуидиновым синим и высушивали 70%-м спиртом. Затем проводили лазерную микродиссекцию каждого из билатеральных СХЯ, которые собирали в фиксатор IntactRNA (“Евроген”). В одну пробу собирали СХЯ от шести крыс на П10 и трёх крыс на П60. Тотальную РНК выделяли с использованием RNeasy Micro Kit (“QIAGEN”, Германия) согласно протоколу производителя. Библиотеки кДНК синтезировали при помощи набора реактивов RevertAid™ H MinusFirstStrandcDNASynthesisKit (“ThermoScientific”, США), используя рандомные гексаолигонуклеотиды и всю выделенную на первом этапе РНК в качестве матрицы. Продукты ПЦР анализировали с помощью агарозного гель-электрофореза и системы видеорегистрации Chemidoc Touch (“BioRad”, США). Специфические олигонуклеотиды для проведения ПЦР (табл. 1) подбирали с помощью сервиса NCBI Primer-BLAST с учетом экзон-интронной структуры генов.
Таблица 1.
Специфические гексоолигонуклеотиды
| Ген | 5'-3' смысловой | 5'-3' антисмысловой |
|---|---|---|
| TH | CTGTCCGCCCGTGATTTT | GAGGCCCCCAGAGATG |
| AADC | CCCCAGGAGCCAGAAACA | AGCCCAGGAGAAGCCAATG |
| VMAT2 | TATAACCGCGCAGTCACAGG | AGCAGCAGCGCAAGGAAC |
| D1R | CAACTGGGGCTGAACAAGAAG | GGAAACAGGCCGTGAGGAT |
| D2R | CAGACAGGCCCCACTACAACTA | ACAACCCACGGCATTACCA |
Во второй серии экспериментов проводили моно и двойное иммуногистохимическое мечение на срезах СХЯ ТГ, ДАТ, ВМАТ2, Д1 и Д2. Выделение мозга и приготовление замороженных фронтальных срезов СХЯ толщиной 20 мкм проводили по ранее описанной методике [13]. Для двойного иммуномечения использовали: 1) антитела овцы к ТГ (1 : 700) (“Chemicon”, США), 2) кроличьи антитела к ВМАТ2 (1 : 100) (“Chemicon”, США), к рецептору Д1 (1 : 200) (“Abcam”, США) и к рецептору Д2 (1 : 200) (“Chemicon”, США), 3) козьи антитела к иммуноглобулинам кролика Cy3 (1 : 800) (“Sigma”, США) и овцы Alexa Fluor 488 (1 : 1000) (“Thermo Fisher Scientific, США). Инкубации проводили в соответствии с рекомендациями производителей. Срезы изучали с помощью флуоресцентного микроскопа Zeiss Observer Z1 (“Zeiss”, Германия) и конфокального микроскопа Leica TCS SP5 (“Leica”, Германия) при увеличении объектива 40×. Целостное изображение СХЯ воссоздавали с помощью модуля MosaiX Axio Vision (“Zeiss”, Германия).
В данной работе, как и в предыдущих исследованиях [8, 9], в СХЯ у молодых крыс (П10) были обнаружены многочисленные ТГ-иммунореактивные волокна, образующие плотное сплетение в вентромедиальной области ядра. Более того, было показано, что это немоноаминергические волокна, поскольку в них отсутствует ДАА – второй фермент синтеза моноаминов [8]. Многочисленные ТГ-иммунореактивные волокна нами были выявлены в СХЯ не только у молодых (П10), но и у взрослых (П60) крыс (рис. 1). Важно отметить, что тела ТГ-иммунореактивных нейронов, которым принадлежат описанные волокна, по данным иммуноцитохимического анализа, располагаются не в самом СХЯ, а по его границе и поблизости от ядра [13]. Однако с помощью ПЦР в СХЯ нами была выявлена мРНК ТГ (рис. 2). Вероятно, несмотря на то, что для выделения СХЯ использовали лазерную микродиссекцию, в некоторые образцы для анализа попали ТГ-экспрессирующие нейроны, расположенные вдоль границы СХЯ.
Рис. 1.
Двойное иммуномечение на тирозингидроксилазу (ТГ) (зеленый цвет) и везикулярный моноаминовый транспортер 2-го типа (ВМАТ2) (красный цвет) в супрахиазматическом ядре у крыс на 10-й (а) и 60-й (б) постнатальные дни. Стрелки – мономеченные волокна и их варикозные расширения; овал – колокализация ТГ и ВМАТ2 (желтый цвет).
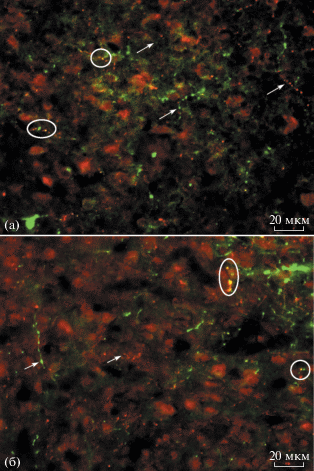
Рис. 2.
Экспрессия мРНК генов тирозингидроксилазы (ТГ), декарбоксилазы ароматических L-аминокислот (ДАА), везикулярного транспортера моноаминов 2-го типа (ВМАТ2), рецепторов к дофамину 1-го (Д1) и 2-го (Д2) типа в супрахиазматическом ядре у крыс на 10-й постнатальный день (П10) и на П60.
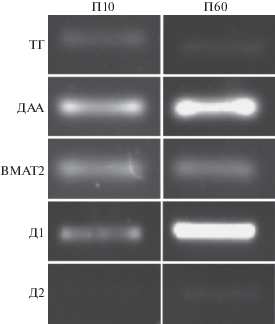
Недавно нами было впервые показано, что конечным секреторным продуктом в моноферментных ТГ-содержащих волокнах СХЯ у молодых и взрослых крыс является L-ДОФА [10]. При этом выделившийся из ТГ-содержащих волокон L-ДОФА превращается в ДА в ДАА-содержащих структурах [11], хотя L-ДОФА может играть и самостоятельную роль нейротрансмиттера. Данные литературы о наличии в СХЯ ДАА-содержащих нейронов [12], в которых может синтезироваться ДА из L-ДОФА, подтверждаются нашими данными об экспрессии гена ДАА как у молодых, так и у взрослых крыс (рис. 2).
Уже более десяти лет назад нами при изучении медиомазального гипоталамуса впервые были получены доказательства того, что конечным секреторным продуктом в моноферментных ТГ-содержащих нейронах является L-ДОФА [13], однако до сих пор непонятно, выделяется ли L-ДОФА из моноферментных ТГ-нейронов сразу же после синтеза в цитозоле или существует механизм его депонирования и выделения в ответ на определенный сигнал. Вопрос о возможности внутринейронального депонирования L-ДОФА до сих пор вообще не стоял, поскольку в катехоламинергических нейронах L-ДОФА быстро превращается в ДА.
Одним из гипотетических механизмов депонирования L-ДОФА в моноферментных ТГ-нейронах может быть его захват везикулами с помощью мембранного моноаминового транспортера (ВМАТ), участвующего в везикулярном запасании моноаминов в моноаминергических нейронах [15 ] . Действительно, нам удалось выявить у молодых и взрослых крыс в СХЯ в моноферментных ТГ-содержащих волокнах ко-локализацию ТГ и ВМАТ2 (рис. 1), что позволяет предположить наличие везикулярного запасания L-ДОФА. Однако в большинстве ТГ-содержащих волокон ВМАТ2 отсутствует (рис. 1). Это может означать, что в ТГ-содержащих волокнах в СХЯ: (а) L-ДОФА не депонируется, (б) механизм депонирования L-ДОФА отличается от депонирования моноаминов в моноаминергических нейронах, (в) содержание ВМАТ2 незначительно и находится за пределами разрешения иммуногистохимии. Нельзя также исключить, что наряду с подавляющим большинством моноферментных ТГ-содержащих волокон в СХЯ присутствуют единичные дофаминергические волокна. Однако это маловероятно, поскольку в СХЯ в ТГ-содержащих волокнах отсутствует ДАА и ДАТ [8, 9].
Функциональная роль нейрональных элементов, включая моноферментные ТГ-волокна в СХЯ, определяется не только секреторной активностью, но и её регуляцией. Показателем такой регуляции может служить наличие в нейронах рецепторов к химическим сигналам. Учитывая участие ТГ-содержащих волокон в СХЯ в кооперативном синтезе ДА, мы предполагали существование дофаминовой регуляции этого первого скоростьлимитирующего этапа синтеза. Проведенное нами для проверки этого предположения двойное иммуномечение, с одной стороны, ТГ, а с другой – одного из рецепторов к ДА–Д1 или Д2 показало, что в СХЯ оба рецептора присутствуют в ТГ-волокнах у взрослых крыс (П60) и только Д1 рецептор у молодых крыс (П10). Полученные данные свидетельствуют о том, что в постнатальном периоде формируется дофаминовый контроль моноферментных ТГ-волокон.
Вполне возможно, что дофаминовая регуляция в СХЯ не ограничивается ТГ-содержащими волокнами, а распространяется и на другие нейроны, включая моноферментные ДАА-содержащие нейроны, участвующие в кооперативном синтезе дофамина. Действительно, как показано в данной работе с помощью ПЦР, в СХЯ у молодых крыс (П10) экспрессируется ген Д1 рецептора, а у взрослых крыс не только Д1, но и Д2 рецепторы (рис. 2). В будущей работе следует проверить с помощью двойного иммуномечения наше предположение о том, что эти рецепторы могут экспрессироваться в ДАА-содержащих нейронах, участвуя в регуляции кооперативного синтеза дофамина.
Таким образом, впервые показано, что в СХЯ у молодых и взрослых крыс в нервных волокнах, содержащих только ТГ и синтезирующих L-ДОФА, могут ко-экспрессироваться ВМАТ2 и Д1 рецепторы, а у взрослых крыс еще и Д2 рецепторы, что предполагает соответственно везикулярное запасание L-ДОФА и формирование дофаминовой регуляции секреции L-ДОФА в онтогенезе.
Список литературы
Honma S., Ono D., Suzuki Y., Inagaki N., et al. Suprachiasmatic Nucleus: Cellular Clocks and Networks // Progress in Brain Research. 2012. V. 199. P. 129–141. https://doi.org/10.1016/B978-0-444-59427-3.00029-0
Moore R.Y. Organization of the Mammalian Circadian System // Ciba Found. Symp. 1995. V. 183. P. 88-99.
Kartasoreos I.N., Silver R. Karatsoreos I. N., Silver R. Minireview: The Neuroendocrinology of the Suprachiasmatic Nucleus as a Conductor of Body Time in Mammals // Endocrinology. 2007. V. 148. P. 5640–5647. https://doi.org/10.1210/en.2007-1083
Carmona-Alcocer V., Abel J. H., Sun T. C., et al. Ontogeny of Circadian Rhythms and Synchrony in the Suprachiasmatic Nucleus // J. Neuroscience. 2018. V. 38. № 6. P. 1326–1334. https://doi.org/10.1523/JNEUROSCI.2006-17.2017
Shearman L.P., Zeitzer J., Weaver D.R. Widespread Expression of Functional D1-dopamine Receptors in Fetal Rat Brain // Developmental brain research. 1997. V. 102. P. 105–115. https://doi.org/10.1016/S0165-3806(97)00091-6
Schambra U.B., Duncan G.E., Breese G.R., et al. Ontogeny of D1A and D2 Dopamine Receptor Subtypes in Rat Brain Using in Situ Hybridization and Receptor Binding // Neuroscience. 1994. V. 62. P. 65–85. https://doi.org/10.1016/0306-4522(94)90315-8
Strother W.N., Norman A.B., Lehman M.N. D1-dopamine Receptor Binding and Tyrosine Hydroxylase-immunoreactivity in the Fetal and Neonatal Hamster Suprachiasmatic Nucleus // Developmental brain research. 1998. V. 106. P. 137–144. https://doi.org/10.1016/S0165-3806(97)00205-8
Battaglia A.A., Beltramo M., Thibault J., et al. A Confocal Approach to the Morphofunctional Characterization of the Transient Tyrosine Hydroxylase System in the Rat Suprachiasmatic Nucleus // Brain Research. 1995. V. 696. P. 7–14. https://doi.org/10.1016/0006-8993(95)00675-G
Beltramo M., Calas M., Chernigovskaya E., et al. Postnatal Development of the Suprachiasmatic Nucleus in the Rat. Morpho-functional Characteristics and Time Course of Tyrosine Hydroxylase Immunopositive Fibers // Neuroscience. 1994. V. 63. P. 603–610. https://doi.org/10.1016/0306-4522(94)90553-3
Пронина Т.С., Дильмухаметова Л.К., Куртова А.И., Угрюмов М.В. Синтез дофамина недофаминергическими нейронами тубероинфундибулярной системы у крыс в онтогенезе // Нейрохимия. 2019. Т. 36. С. 292–301. https://doi.org/10.1134/S1027813319040034
Jaeger C. B., Albert V. R., Joh T. H. et al. Aromatic L-amino Acid Decarboxylase in the Rat Brain: Coexistence with Vasopressin in Small Neurons of the Suprachiasmatic Nucleus // Brain Research. 1983. V. 276. P. 362–366. https://doi.org/10.1016/0006-8993(83)90748-5
Ugrumov M.V., Melnikova V.I., Lavrentyeva A.V., et al. Dopamine Synthesis by Non-dopaminergic Neurons Expressing Individual Complementary Enzymes of the Dopamine Synthetic Pathway in the Arcuate Nucleus of Fetal Rats // Neuroscience. 2004. V. 124. P. 629–635. https://doi.org/10.1016/j.neuroscience.2004.01.002
Мирочник В.В., Макаренко И.Г., Угрюмов М.В. Источник транзиторной иннервации супрахиазматического ядра тирозингидроксилаза-иммуреактивными волокнами в постнатальном периоде у крыс // Онтогенез. 2002. Т. 33. С. 182-186.
Hoffman B.J., Hansson S.R., Mezey E., et al. Localization and Dynamic Regulation of Biogenic Amine Transporters in the Mammalian Central Nervous System // Frontiers in neuroendocrinology. 1998. V. 19. № 3. P. 187–231. https://doi.org/10.1006/frne.1998.0168
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


