Доклады Российской академии наук. Науки о жизни, 2020, T. 490, № 1, стр. 49-54
ЭКСТРАКЛЕТОЧНЫЕ ОКСИДАЗЫ БАЗИДИОМИЦЕТА Neonothopanus nambi: ВЫДЕЛЕНИЕ И НЕКОТОРЫЕ СВОЙСТВА
Н. О. Ронжин 1, *, О. А. Могильная 1, К. С. Артеменко 1, Е. Д. Посохина 1, 2, В. С. Бондарь 1
1 Институт биофизики Федерального исследовательского центра “Красноярский научный центр Сибирского отделения Российской Академии наук”
Красноярск, Россия
2 Сибирский федеральный университет
Красноярск, Россия
* E-mail: roniol@mail.ru
Поступила в редакцию 30.05.2019
После доработки 30.05.2019
Принята к публикации 30.05.2019
Аннотация
Из мицелия базидиомицета Neonothopanus nambi с помощью оригинального способа обработки биомассы β-глюкозидазой впервые выделен пул экстраклеточных ферментов гриба. Гель-фильтрационной хроматографией из экстракта выделены две белковые фракции, содержащие ферменты с оксидазной активностью, условно названные Ф1 и Ф2. Фермент Ф1 имеет нативную молекулярную массу 80–85 кДа, не содержит хромофорных компонентов, однако катализирует окисление вератрилового спирта с величиной Кm = 0.52 мМ. Вероятно, данный фермент является алкоголь-оксидазой. Фермент Ф2 имеет нативную молекулярную массу около 60 кДа, является ФАД-содержащим белком и катализирует соокисление фенола с 4-аминоантипирином без добавки экзогенного пероксида водорода, что отличает его от известных пероксидаз. Высказано предположение, что данный фермент может быть оксидазой со смешанной функцией. Для оксидазы Ф2 величина Кm по фенолу составляет 0.27 мМ. Максимумы активности оксидаз Ф1 и Ф2 наблюдаются при температурах 22–35 и 55–70°C и pH среды 6 и 5 соответственно.
Ферменты класса оксидоредуктаз (КФ1) представляют значительный интерес для решения широкого спектра биотехнологических задач и применяются в пищевой промышленности, медицинской диагностике и экологическом мониторинге [1]. В частности, ферменты этого класса привлекают внимание исследователей как высокоселективные биомаркёры для создания эффективных средств биомедицинской аналитики. Например, изучаются возможности конструирования новых индикаторных и диагностических тест-систем с помощью иммобилизации глюкозооксидазы и пероксидаз на различных типах носителей, включая наночастицы разной физико-химической природы [2–4].
Надо сказать, что учёные многих стран проводят поиск новых источников сырья для получения ферментов с оксидазной функцией. В настоящее время заметный интерес исследователи проявляют к использованию в аналитических приложениях оксидаз высших грибов [5–7]. Это стимулирует исследования, направленные на обнаружение новых видов грибов в качестве перспективных источников получения оксидазных ферментов, изучение возможностей увеличения продукции этих ферментов в грибной биомассе, выявление оксидаз с новыми свойствами. Совершенствуются методы выделения оксидазных ферментов из грибной биомассы, разрабатываются способы их иммобилизации на различных носителях для повышения устойчивости к воздействию негативных факторов и сохранения каталитической активности при многократном использовании [8–10].
Недавно мы предложили оригинальный способ обработки мицелия высших грибов β-глюкозидазой и хитиназой, позволивший без разрушения грибной биомассы выделить из двух видов базидиомицетов экстраклеточные пероксидазы и глюкозоксидазу [11, 12]. В свою очередь, иммобилизация этих ферментов на модельный носитель (наноалмазы взрывного синтеза) позволила создать бифункциональную индикаторную систему многократного действия, которая может быть использована для целей медицинской и экологической аналитики [13].
Настоящая работа посвящена выделению экстраклеточных оксидаз из мицелия базидиомицета Neonothopanus nambi с помощью обработки биомассы β-глюкозидазой и изучению их некоторых свойств.
В экспериментах использовали мицелий светящегося высшего гриба N. nambi IBSO 3293 из Коллекции микроорганизмов (CCIBSO 836) ИБФ СО РАН, ФИЦ “КНЦ СО РАН” (Красноярск). Биомассу мицелия получали при культивировании гриба в картофельно-сахарозной среде в погруженных условиях по разработанной нами ранее технологии [12], выращивание проводили в течение 7–9 суток. Полученные пеллеты мицелия извлекали из питательной среды и многократно промывали деионизованной (ДИ) водой (Milli-Q system, “Millipore”, США) для удаления остатков питательной среды и метаболитов. Для получения пула экстраклеточных ферментов (в том числе оксидаз) пеллеты мицелия обрабатывали β-глюкозидазой (КФ 3.2.1.21) из сладкого миндаля (“Serva”, Германия), исходный раствор которой готовили в 10 мM фосфатном буфере (рН 6.0). Отмытые пеллеты помещали в свежую порцию ДИ воды, добавляли раствор β-глюкозидазы до конечной концентрации фермента 0.5 МЕ/мл и инкубировали при 25°C в течение 24 ч при медленном перемешивании со скоростью 80 об/мин на шейкере OS-10 (“BIOSAN”, Латвия). По завершении инкубации жидкую часть (водный экстракт) отделяли от биомассы пеллет фильтрацией через бумажный фильтр. Для концентрирования выделенных экстраклеточных ферментов и удаления низкомолекулярных балластных соединений экстракт диализовали ультрафильтрацией через мембрану с пределом исключения 30 кДа (“EMD Millipore Amicon, Darmstadt”, Германия). В ходе ультрафильтрации в диализуемом образце трижды заменяли ДИ воду для более полного удаления низкомолекулярных примесей. Полученную после диализа надмембранную фракцию (концентрат ферментов) отбирали и использовали для исследований.
Разделение экстраклеточных ферментов, выделенных из мицелия N. nambi, проводили гель-фильтрационной хроматографией ферментного концентрата на колонке (1.6 × 33 см) с Sephadex G-200 (“Pharmacia”, Швеция), уравновешенной раствором 50 мМ NaCl. На колонку наносили 2 мл концентрата, в который был добавлен хлорид натрия до концентрации 50 мM. Хроматографию проводили при скорости протока 0.2 мл/мин, используя в качестве элюента водный раствор 50 мМ NaCl и собирая пробы объёмом по 2 мл. Для сравнительной оценки нативной молекулярной массы белков, полученных при хроматографии ферментного концентрата, при указанных выше условиях (размер колонки, объём наносимого образца, элюент и скорость протока) проводили хроматографию маркерных белков – БСА (“Sigma”, США) и цитохрома C (“Fluka”, Германия).
Концентрацию белка в ферментном концентрате и пробах после его хроматографии определяли микробиуретовым методом, используя БСА в качестве стандарта. Оценку проводили спектральным методом по величине оптической плотности образцов при 330 нм (спектрофотометр UV-1800, “Shimadzu”, Япония).
Наличие оксидазной активности в концентрате ферментов и полученных хроматографических фракциях оценивали с помощью реакции соокисления фенола с 4-аминоантипирином (4-ААП) и реакции окисления вератрилового спирта. Для этого использовали 4-ААП (1-фенил-2,3-диметил-4-аминопиразолон) квалификации ч.д.а. (“Реахим”, Россия), фенол (“Fluka”, Германия) и вератриловый спирт (“Sigma”, США), растворы которых готовили in situ в ДИ воде. При тестировании оксидазной активности с помощью первой реакции реакционная смесь объёмом 600 мкл содержала 5.96 мМ фенола; 0.49 мМ 4-ААП и 100 мкл изучаемого образца. Во втором случае реакционная смесь (600 мкл) содержала 10 мМ вератрилового спирта и 50 мкл изучаемого образца. В обоих случаях после добавления всех ингредиентов реакции образцы перемешивали в течение 3 с на Vortex-Genie 2 g-560E (“Scientific Industries, Inc.,” США) и инкубировали в течение 30 мин при температуре 22°C.
Уровень оксидазной активности в образцах оценивали по выходу продуктов указанных выше реакций, регистрируемых спектральным методом (спектрофотометр UV-1800) по величине оптической плотности при длинах волн 506 и 310 нм соответственно. Активность ферментов выражали в единицах оптической плотности на 1 мг белка.
Концентрацию фенола и вератрилового спирта в реакционных смесях, а также их температуру и рН изменяли при изучении зависимостей образования продуктов реакций.
Для выделения пула экстраклеточных ферментов базидиомицета N. nambi (в том числе ферментов с оксидазной функцией) нами была проведена инкубация биомассы мицелия в присутствии β-глюкозидазы. В предыдущих работах мы показали, что такая обработка мицелия высших грибов сопровождается выходом их экстраклеточных пероксидаз и глюкозооксидазы в среду инкубации [12, 13]. Такой методический приём может представлять самостоятельную биотехнологическую ценность, поскольку позволяет в относительно мягких условиях (без тотального разрушения биомассы) получать из базидиомицетов экстракты, обогащенные экстраклеточными грибными ферментами и содержащие малое количество балластных примесей.
На начальном этапе исследований в данной работе мы установили, что водные экстракты, полученные после инкубации пеллет мицелия N. nambi с β-глюкозидазой, содержат экстраклеточные ферменты гриба, обладающие оксидазной активностью и катализирующие окисление вератрилового спирта и соокисление фенола с 4-аминоантипирином. Об этом свидетельствовало образование продуктов при проведении указанных реакций.
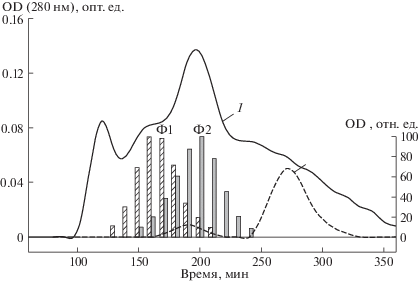
Гель-фильтрационная хроматография концентрата экстрагированных из гриба N. nambi экстраклеточных ферментов на колонке с Sephadex G-200 позволила выявить две белковые фракции, которые обладали оксидазной активностью (рис. 1). Как видно из представленных данных, белковая фракция с нативной молекулярной массой белка 80–85 кДа содержит фермент, который катализирует окисление вератрилового спирта и, вероятно, является алкоголь-оксидазой. Данную оксидазу мы условно назвали Ф1. В белковой фракции с нативной молекулярной массой белка около 60 кДа (рис. 1) мы обнаружили фермент, катализирующий реакцию соокисления фенола с 4-аминоантипирином. При этом следует подчеркнуть, что данный фермент катализирует указанную реакцию без добавки экзогенного пероксида водорода и это отличает его от известных пероксидаз. Этой оксидазе мы дали условное название Ф2.
Рис. 1.
Гель-фильтрационная хроматография белковых препаратов на колонке Sephadex G-200: 1 – концентрат экстраклеточных ферментов из гриба N. nambi, 2 – маркерные белки (БСА – 66.5 кДа и цитохром С – 12.3 кДа). Ф1 и Ф2 – распределение в хроматографических пробах активности оксидаз, катализирующих окисление вератрилового спирта и соокисление фенола с 4-аминоантипирином соответственно.
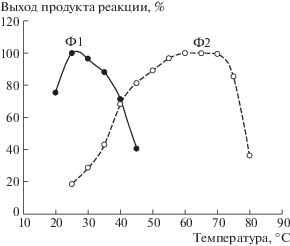
В экспериментах мы установили, что выделенные из базидиомицета N. nambi экстраклеточные оксидазы Ф1 и Ф2 могут функционировать в широких интервалах температур, однако значительно различаются температурными оптимумами каталитической эффективности (рис. 2). Из представленных данных видно, что оксидаза Ф1 проявляет максимум активности в диапазоне температур 22–35°C. При этом видно, что оксидаза Ф2 наиболее эффективно функционирует при температурах 55–70°C. Вероятно, смещение максимума функциональной активности оксидазы Ф2 в область высоких температур может быть преимуществом данного фермента при его использовании в аналитических приложениях. Однако это предположение требует отдельного исследования.
Рис. 2.
Образование продуктов реакций, катализируемых выделенными из базидиомицета N. nambi экстраклеточными оксидазами Ф1 и Ф2, в зависимости от температуры реакционной среды. Представленные данные нормированы на максимальные значения выхода соответствующих продуктов в рядах измерений. Оценка образования продуктов проведена после инкубации соответствующих реакционных смесей в течение 15 мин при разных температурах (термостат TB-85 Thermo Batch, “Shimadzu”, Япония).
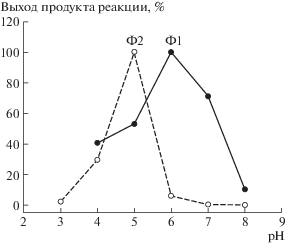
Для изучения эффективности функционирования выделенных оксидаз в зависимости от рН реакционной среды нами была использована серия 50 мМ Na-ацетатных буферов, имеющих значения рН в диапазоне от 3 до 8. Как показали эксперименты (рис. 3), оксидаза Ф2 проявляет наибольшую активность в очень узком диапазоне слабокислых значений рН среды с максимумом каталитической эффективности при pH 5. В то же время из представленных данных видно (рис. 3), что оксидаза Ф1 может эффективно функционировать в более широком диапазоне значений рН среды (от нейтрального до слабокислых), проявляя наибольшую активность при рН 6.
Рис. 3.
Образование продуктов реакций, катализируемых выделенными из базидиомицета N. nambi экстраклеточными оксидазами Ф1 и Ф2, в зависимости от рН среды. Представленные данные нормированы на максимальные значения выхода соответствующих продуктов в рядах измерений.
По данным проведенных нами исследований зависимостей выхода продуктов реакций, катализируемых выделенными оксидазами Ф1 и Ф2, величины кажущихся Кm для вератрилового спирта и фенола составили 0.52 и 0.27 мМ соответственно.
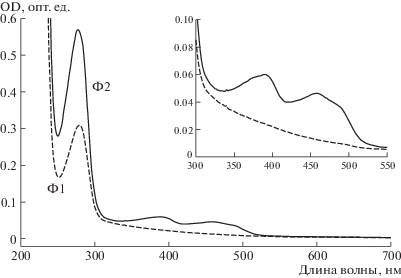
При изучении спектральных характеристик образцов экстраклеточных оксидаз, выделенных из гриба N. nambi, мы установили, что оксидаза Ф2 является ФАД-содержащим ферментом, в то время как оксидаза Ф1 не содержит в своей структуре каких-либо хромофорных компонентов. Из результатов спектрального анализа видно (рис. 4), что спектр поглощения водного образца оксидазы Ф1 соответствует типичному белковому спектру с единственным максимумом оптической плотности при 279 нм. В то же время в спектре поглощения водного образца оксидазы Ф2, помимо белкового пика (279 нм), регистрируются дополнительные пики оптической плотности при 390 и 457 нм (рис. 4). Это свидетельствует в пользу того, что в молекуле фермента Ф2 имеется ФАД. Хорошо известно, например, [8], что наличие таких пиков наблюдается в спектрах поглощения ФАД-содержащих ферментов. Результаты дополнительных экспериментов свидетельствуют в пользу того, что ФАД не связан с белковой частью молекулы фермента ковалентно. Мы показали, что после термообработки образца оксидазы Ф2 при 100°C в течение 5 мин и последующего его диализа через мембрану с пределом исключения 10 кДа ФАД обнаруживается спектрофотометрически в подмембранной фракции (спектр поглощения не приводится).
Рис. 4.
Спектры поглощения водных образцов экстраклеточных оксидаз Ф1 и Ф2, выделенных из базидиомицета N. nambi. На врезке приведены фрагменты спектров в диапазоне 300–550 нм.
Полученные в исследованиях оксидазы Ф2 данные (катализ соокисления фенола с 4-аминоантипирином без добавления экзогенного пероксида водорода, наличие ФАД в молекуле фермента), позволяют высказать требующую дальнейшего изучения гипотезу, что данный фермент может быть оксидазой со смешанной функцией. По-видимому, оксидаза Ф2 при наличии фенола в водной среде сначала генерирует пероксид водорода, который затем используется в реакции соокисления фенола с 4-аминоантипирином. Мы полагаем, что высказанная версия представляется правомочной, поскольку известны ФАД-содержащие ферменты, обеспечивающие образование Н2О2 за счёт окисления циклических ОН-содержащих соединений (например, ароматических спиртов) и О2 водной среды [14, 15]. Следует также сказать, что изучение структурно-функциональных особенностей обнаруженной оксидазы Ф2 представляет не только фундаментальный интерес, но и имеет практическое значение. В частности, в сравнении с известными пероксидазами применение Ф2 будет упрощать методику тестирования фенола (без использования пероксида водорода).
Таким образом, из мицелия базидиомицета N. nambi с помощью оригинального способа обработки биомассы β-глюкозидазой впервые выделен пул экстраклеточных ферментов гриба. Гель-фильтрационной хроматографией на Sephadex G-200 из экстрактов выделены две белковые фракции, в которых обнаружены ферменты с оксидазной активностью, условно названные Ф1 и Ф2. Показано, что фермент Ф1 имеет нативную молекулярную массу 80–85 кДа и не содержит в своей структуре хромофорных компонентов. Данный фермент катализирует окисление вератрилового спирта и, вероятно, является алкоголь-оксидазой. Установлено, что фермент Ф2 имеет нативную молекулярную массу около 60 кДа и является ФАД-содержащим белком. Высказана гипотеза, что данный фермент является оксидазой со смешанной функцией, поскольку в отличие от известных пероксидаз катализирует реакцию соокисления фенола с 4-аминоантипирином без добавки экзогенного пероксида водорода. Совокупность результатов проведенных исследований открывает перспективы для получения выявленных экстраклеточных оксидаз гриба N. nambi в гомогенном виде и изучения их структурно-функциональных особенностей и применимости в биотехнологических и аналитических приложениях.
Список литературы
Xu F. Applications of Oxidoreductases: Recent Progress // Industrial Biotechn. 2005. V. l. № 1. P. 38–50. https://doi.org/10.1089/ind.2005.1.38
Ciaurriz P., Bravo E., Hamad-Schifferli K. Effect of Architecture on the Activity of Glucose Oxidase/Horseradish Peroxidase/Carbon Nanoparticle Conjugates // J. Colloid and Interface Sci. 2014. V. 414. P. 73–81. https://doi.org/10.1016/j.jcis.2013.09.039
Yang H., Wei W., Liu S. Monodispersed Silica Nanoparticles as Carrier for Co-immobilization of Bi-enzyme and Its Application for Glucose Biosensing // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2014. V. 125. P. 183-188. https://doi.org/10.1016/j.saa.2014.01.004
Tan H., Guo S., Dinh N., et al. Heterogeneous Multi-compartmental Hydrogel Particles as Synthetic Cells for Incompatible Tandem Reactions // Nature Communications. 2017. V. 8. № 1:663. https://doi.org/10.1038/s41467-017-00757-4
Martínková L., Kotik M., Marková E., Homolka L. Biodegradation of Phenolic Compounds by Basidiomycota and Its Phenol Oxidases: A Review // Chemosphere. 2016. V. 149. P. 373–382. https://doi.org/10.1016/j.chemosphere.2016.01.022
Martinez A.T., Ruiz-Duenas F.J., Camarero S., et al. Oxidoreductases on Their Way to Industrial Biotransformations // Biotechnol. Advances. 2017. V. 35. № 6. P. 815–831. https://doi.org/10.1016/j.biotechadv.2017.06
Alneyadi A.H., Rauf M.A., Ashraf S.S. Oxidoreductases for the Remediation of Organic Pollutants in Water – a Critical Review // Critical Rev. Biotechnol. 2018. V. 38. № 7. P. 971–988. https://doi.org/10.1080/07388551.2017.1423275
Tamaru Y., Umezawa K., Yoshida M. Characterization of an Aryl-Alcohol Oxidase from the Plant Saprophytic Basidiomycete Coprinopsis cinerea with Broad Substrate Specificity against Aromatic Alcohols // Biotechnol. Letters. 2018. V. 40. № 7. P. 1077–1086. https://doi.org/10.1007/s10529-018-2534-3
Wang N., Ren R., Jia R., et al. Expression of a Fungal Manganese Peroxidase in Escherichia coli: A Comparison Between the Soluble and Refolded Enzymes // BMC Biotechnol. 2016. V. 16. № 87. https://doi.org/10.1186/s12896-016-0317-2
Zdarta J., Meyer A.S., Jesionowski T., et al. Developments in Support Materials for Immobilization of Oxidoreductases: A Comprehensive Review // Advances in Colloid and Interface Science. 2018. V. 258. P. 1–20. https://doi.org/10.1016/j.cis.2018.07.004
Mogilnaya O.A., Ronzhin N.O., Artemenko K.S., et al. Morphological Properties and Levels of Extracellular Peroxidase Activity and Light Emission of the Basidiomycete Armillaria borealis Treated with β-Glucosidase and Chitinase // Mycosphere. 2017. V. 8. № 4. P. 649–659. https://doi.org/10.5943/mycosphere/8/4/11
Mogilnaya O.A., Ronzhin N.O., Bondar V.S. Estimating Levels of Light Emission and Extracellular Peroxidase Activity of Mycelium of Luminous Fungus Neonothopanus nambi Treated with β-Glucosidase // Current Research in Environmental & Applied Mycology. 2018. V. 8. № 1. P.75–85. https://doi.org/10.5943/cream/8/1/6
Могильная О.А., Ронжин Н.О., Артеменко К.С., Бондарь В.С. Создание бифункционального индикаторного комплекса на основе наноалмазов и экстраклеточных оксидаз светящегося гриба Neonothopanus nambi // ДАН. 2018. Т. 480. № 1. С.112–116. https://doi.org/10.7868/S0869565218130236
Sützl L., Laurent C.V.F.P., Abrera A.T., Schütz G., Ludwig R., Haltrich D. Multiplicity of Enzymatic Functions in the CAZy AA3 Family // Applied Microbiol. and Biotechnol. 2018. V. 102. P. 2477–2492. https://doi.org/10.1007/s0025301887840
Hernández-Ortega A., Ferreira P., Martinez A.T. Fungal Aryl-Alcohol Oxidase: A Peroxide-Producing Flavoenzyme Involved in Lignin Degradation // Appl. Microbiol. and Biotechnol. 2012. V. 93. P. 1395–1410. https://doi.org/10.1007/s0025301138368
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


