Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 117-121
НЕЙРОПРОТЕКТОРНЫЙ ПОТЕНЦИАЛ ПЕПТИДОВ HFRWPGP (ACTH6–9PGP), KKRRPGP, PyrRP В КУЛЬТИВИРУЕМЫХ КОРКОВЫХ НЕЙРОНАХ ПРИ ГЛУТАМАТНОЙ ЭКСАЙТОТОКСИЧНОСТИ
З. В. Бакаева 1, *, **, А. М. Сурин 1, 2, Н. В. Лизунова 1, 3, А. Е. Згодова 1, 4, И. А. Красильникова 1, А. П. Фисенко 1, Д. А. Фролов 5, Л. А. Андреева 6, академик РАН Н. Ф. Мясоедов 6, В. Г. Пинелис 1
1 НМИЦ здоровья детей Минздрава России
Москва, Россия
2 НИИ общей патологии и патофизиологии
Москва, Россия
3 МГУ имени М.В. Ломоносова
Москва, Россия
4 Первый МГМУ имени И.М. Сеченова Минздрава России (Сеченовский Университет)
Москва, Россия
5 МИРЭА – Российский технологический университет
Москва, Россия
6 Институт молекулярной генетики Российской академии наук
Москва, Россия
* E-mail: bakaeva@nczd.ru
** E-mail: zv.bakaeva@gmail.com
Поступила в редакцию 06.02.2020
После доработки 06.02.2020
Принята к публикации 06.02.2020
Аннотация
Глутаматная (Glu) эксайтотоксичность, сопровождающая ишемию мозга или ЧМТ, является ведущим механизмом последующей гибели нейронов. В настоящей работе изучено влияние пептидов HFRWPGP(ACTH6–9PGP), KKRRPG и PyrRP на выживаемость культивируемых корковых нейронов на фоне эксайтотоксического действия Glu (100 мкM). Биохимический (МТТ/WST) и морфометрический анализы показали, что в зависимости от дозы ACTH6–9PGP и KKRRPGP защищают нейроны от гибели, в то время как PyrRP – усиливает. Нейропротекторный эффект ACTH6–9PGP заключается в замедлении развития отсроченной кальциевой дизрегуляции и синхронной митохондриальной деполяризации. Из исследуемых пептидов только ACTH6–9PGP достоверно увеличивал количество нейронов, восстановивших Са2+ гомеостаз после отмены действия Glu. Влияние KKRRPGP было менее выраженным, а PyrRP, наоборот, уменьшал число нейронов с низкой [Са2+]i. Данное исследование позволило выявить высокую терапевтическую значимость ACTH6–9PGP и оценить перспективы его возможного клинического применения.
Регуляторные пептиды являются естественными модуляторами метаболизма и множества различных физиологических процессов в головном мозге, способствуют адаптации клеток к факторам стресса, участвуют в механизмах нейропротекции и пролиферации [1]. Ранее в опытах на культивируемых нейронах нами были получены данные о нейропротекторных эффектах ACTH4–7PGP (cемакса) и PGP [2]. В условиях индуцированной Glu гибели нейронов семакс и PGP в зависимости от дозы препарата уменьшали количество нейронов с высоким уровнем Са2+. В исследованиях с участием детей в возрасте до 1 года, перенесших перинатальные нарушения мозгового кровообращения, было выявлено, что длительная (в течение месяца) терапия 0.1% раствором семакса приводит к уменьшению содержания биохимических маркеров повреждения мозга (S100b и NSE) и увеличению уровня маркера репарации нейронов (BDNF) [3]. В настоящее время появились данные, что наиболее коротким фрагментом молекулы АКТГ, сохраняющим нейротрофическую активность, является фрагмент АКТГ(6–9), а присоединение к нему PGP удлиняет время действия этого пептида [5, 6]. ACTH6–9PGP повышает жизнеспособность культивируемых клеток глии, полученных из коры больших полушарий мозга крыс с ишемическим повреждением мозга [6]. При исследовании влияния ACTH6–9PGP на размер некротического очага у крыс оказалось, что данный пептид, как и семакс, почти вдвое уменьшает размер некроза при развитии ишемического инсульта у крыс [5]. Однако механизмы его нейропротекторного действия и, в частности, на кальциевый гомеостаз и функцию митохондрий при Glu эксайтотоксичности не изучены. Ранее нами, а также другими авторами было показано, что при токсическом действии Glu в культивируемых нейронах развивается отсроченная кальциевая дизрегуляция (ОКД), сопровождаемая синхронной митохондриальной деполяризацией (МД) [7–9]. Развитие ОКД и МД приводит, в конечном счете, к гибели нейронов путем апоптоза или некроза [7, 10]. Целью настоящей работы являлось изучение влияния ACTH6–9PGP на выживаемость культивируемых нейронов, на кальциевый гомеостаз и функцию митохондрий при Glu эксайтотоксичности. Эффекты АКТГ(6–9)-PGP сравнивались с влиянием других синтезированных de novo олигопептидов KKRRPGP и PyrRP.
МЕТОДЫ
Нейроглиальные культуры приготавливали из коры головного мозга крысят (Р1-Р2) линии Вистар стандартным способом [11]. Эксперименты с животными выполняли в соответствии с нормативными документами, рекомендованными Европейским научным фондом и приказом Минздравсоцразвития России “Об утверждении правил лабораторной практики” № 708н от 23.08.2010 г.
Выживаемость нейроглиальной культуры в условиях Glu эксайтотоксичности определяли биохимическими методами и морфометрически как отношение живых к мертвым через 24 ч после прекращения действия Glu (100 мкM, Gly 10 мкМ, – Mg2+, 1 ч). Оптическую плотность формазана – восстановленной соли тетразолия (МТТ) или его водорастворимой формы (WST) измеряли с помощью мультимодального планшетного ридера ClarioStars (BMG Labtech, Германия). Полученные данные нормировали, принимая поглощение формазана в контрольных культурах за 100%, а поглощение в лунках, содержащих только буфер, за 0%. Пептиды PyrRP и KKRRPGP и ACTH6–9PGP добавляли за 1 ч до Glu. Фракцию живых клеток для морфометрического анализа определяли с помощью флуоресцентного зонда Syto-13 (1 мкМ, ex/em 485/530 нм); некротические клетки – по флуоресценции этидиум гомодимера (EthD-1) (2 мкМ, ex/em 565/610 нм); апоптотические клетки – по ядрам клеток, окрашенных Hoechst 33342 (1 мкМ, ex/em 343/483 нм). Флуоресцентные фотографии получали на микроскопе EVOS FL Auto (США) с использованием одноименной рабочей программы. Полученные изображения обрабатывали при помощи открытых программ: Ilastik, CellProfiler, CellProfilerAnalyst, Knime.
Флуоресцентно-микроскопические измерения концентрации свободного Са2+ в цитоплазме ([Ca2+]i) и трансмембранного потенциала митохондрий (ΔΨmit) выполнены в индивидуальных клетках с помощью флуоресцентно-микроскопической системы анализа изображения на основе микроскопа Olympus XI-70 (Япония), источника света Lumbda 10-2 (Sutter Instrumets, США), камеры CoolSnap HQ2 (Photometrics, США). Измерения производили непрерывно (1 кадр/30 с), используя низкоаффинный флуоресцентный Са2+ индикатор Fura-FF (еx/em 340 и 380/525 нм) и потенциал-чувствительный митохондриальный зонд Rh123 (ex/em 485/525 нм). Измерения выполнены, как описано в статье [7], при температуре 27–29оС в солевом буфере (мМ): 130 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 20 HEPES, 5 glucose, pH 7.4. Для отмывания Glu использовали буфер, в котором Са2+ заменен на EGTA (100 мкМ) и Mg2+ (2 мМ). Данные записывали программой MetaFluor в виде изображений всего наблюдаемого участка. Записанные изображения обрабатывали в программе MetaFluor Analyst (Molecular Device Corp., США). Статистическую обработку проводили при помощи программы “GraphPad Prism 6.0” (GraphPad Software Inc., США). В случае нормального распределения данных для оценки различий использовали One-Way Anova with Sidak’s multiple comparisons test; в противном случае – Kruskall-Wallis with Dunn’s multiple comparisons test.
РЕЗУЛЬТАТЫ
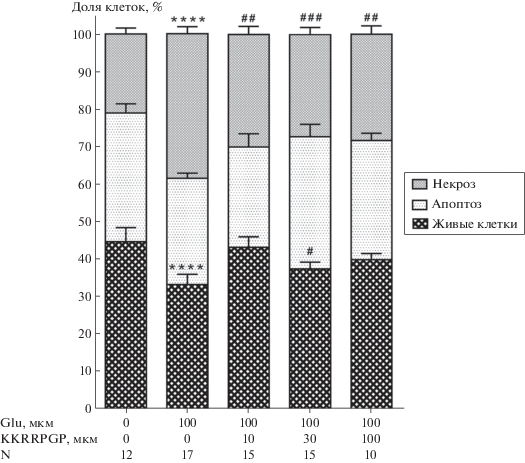
WST-тест показал гибель клеток (35%) на фоне токсического действия Glu. ACTH6–9PGP в концентрациях 10 и 30 мкМ достоверно увеличивал выживаемость клеток на 32 и 34% соответственно. Используемый в настоящей работе в качестве пептида сравнения PGP в дозе 10 мкМ оказывал нейропротекторный эффект аналогично ранее полученным данным [5]. Предварительная инкубация клеток с пептидом KKRRPGP (3–100 мкM) приводила к незначительному повышению выживаемости, а PyrRP (3–100 мкM) не оказывал защитного эффекта. Сами пептиды без Glu никак не влияли на смешанную клеточную культуру (не показано). Аналогичные результаты были получены при морфометрической оценке выживаемости и с использованием МТТ, где токсический эффект Glu составил более 50% (не показано). Морфометрический анализ клеточных культур также выявил небольшое увеличение доли живых клеток (15%) при совместной инкубации Glu и KKRRPGP (30 мкМ). Пептид в трех концентрациях (10, 30, 100 мкМ) статистически значимо снижал (21%) долю клеток с некрозом, не влияя на долю апоптотических клеток (рис. 2).
Рис. 1.
Влияния ACTH6–9PGP (3–100 мкМ) на выживаемость нейро-глиальной культуры в условиях глутаматной эксайтотоксичности (WST-тест). M ± SEM, N – количество лунок; **P < 0.01 к контролю; #P < 0.05 к Glu.
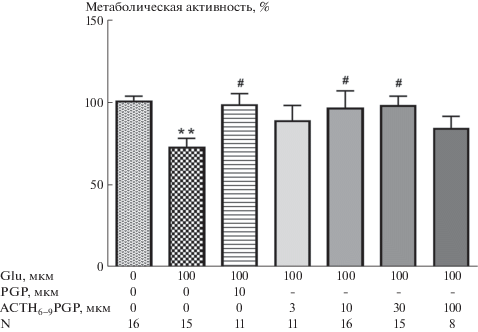
Рис. 2.
Морфологический анализ живых, апоптотических и некротических клеток нейро-глиальной культуры после инкубации с Glu (100 мкM) и ККRRPGP (10–100 мкМ). M ± SEM, N – количество фотографий, **** – P < 0.0001 к контролю, # – P < 0.05; ## – P < 0.01; ### – P < 0.005 к Glu.
Как и в предыдущих наших исследованиях, Glu вызывал развитие ОКД и синхронной МД [2, 7]. В большинстве нейронов ОКД заканчивалось развитием Ca2+–плато, большая часть клеток была не способна восстановить исходный (доглутаматный) уровень [Ca2+]i. ACTH6–9PGP в концентрациях 10 и 30 мкM повышал количество клеток, восстанавливающих Ca2+ гомеостаз на 56 и 80% соответственно. Пептид увеличивал на 57% латентный период наступления ОКД (LAG период), т.е. ОКД и синхронная МД развивались позже, чем при действии одного Glu (табл. 1). KKRRPGP только в дозе 10 мкM повышал на 9% способность клеток возвращаться к исходной [Ca2+]i. PyrRP (10 мкM) вызывал обратный эффект. Способность клеток восстанавливать кальциевый гомеостаз при этом уменьшилась на 17%, а скорость восстановления ΔΨmit снизилась на 52%.
Таблица 1.
Влияние пептидов на кальциевый гомеостаз клеток первичной нейро-глиальной культуры в условиях Glu эксайтотоксичности
| Параметр | |||
|---|---|---|---|
| Пептид | [Ca2+]i после отмены Glu | LAG период | Восстановление ΔΨmit |
| ACTH6–9PGP | ↓**** – P < 0.001 для концентраций 10 и 30 мкМ | ↑* – P < 0.05 для 30 мкМ | ↑** – P < 0.01 для 30 мкМ |
| KKRRPGP | ↓** – P < 0.005 для 10 мкМ | Нет эффекта | ≪ |
| PyrRP | ↑** – P < 0.01 для 10 мкМ | ≪ | ↓*** – P < 0.005 для 10 мкМ |
ОБСУЖДЕНИЕ
Нейротоксичность высоких доз Glu связана с интенсивным входом Ca2+ в нейроны, развитием ОКД и синхронной МД, что может играть решающую роль в повреждении и гибели нейронов [8–10]. Происходящие при этом внутриклеточные процессы включают активацию Ca2+-зависимых ферментов, например протеаз, с последующим изменением структуры и активности множества белков как в цитозоле, так и в органеллах [12, 13]. В последние годы большое внимание уделяется пептидергической регуляции гомеостаза [1, 4], которая формирует компенсаторно-приспособительные реакции организма на нарушение гомеостатического баланса, что послужило основой для создания лекарственных препаратов. В настоящей работе изучено влияние вновь синтезированных пептидов ACTH6–9PGP, KKRRPGP и PyrRP на выживаемость нейронов и нарушение Са2+ гомеостаза в культивируемых нейрональных клетках коры головного мозга при Glu эксайтотоксичности. Анализ выживаемости с помощью биохимических тестов показал, что ни один из исследуемых пептидов не оказывает токсического влияния на первичную нейро-глиальную культуру коры. Однако только ACTH6–9PGP (10 и 30 мкМ) повышает (31 и 34%) способность нейронов противостоять эксайтотоксическому действию Glu. Другие пептиды KKRRPGP и Pyr-RP не проявили выраженного защитного действия. Неожиданно выявленный при морфометрическом анализе, нейропротекторный эффект KKRRPGP, вероятно, связан с высокой чувствительностью данного метода.
Ранее мы показали, что семакс и PGP обладают нейропротекторным действием, нормализуя избыточную [Ca2+]i в нейронах, причем PGP был более эффективным, чем семакс [2]. В настоящем исследовании было обнаружено, что ACTH6–9PGP (10 и 30 мкМ) защищает нейроны от токсического действия Glu, увеличивая время наступления ОКД и количество нейронов восстановивших Са2+ гомеостаз. Менее выраженным эффектом обладал KKRRPGP, а PyrRP, наоборот, данные параметры снижал. В опытах in vivo было показано, что ACTH6–9PGP обладает ноотропной активностью, но длительность его эффекта значительно меньше, чем у семакса [5]. В настоящей работе в условиях in vitro ACTH6–9PGP в отличие от семакса [5] был эффективен в меньших дозах.
Таким образом, проведенные исследования показали, что ACTH6–9PGP и KKRRPGP защищают нейрональные клетки, нормализуя Са2+ гомеостаз, в то время как PyrRP не обладает таким эффектом.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа поддержана грантами РФФИ (КОМФИ) № 17-00-00105 и 17-00-00106.
Список литературы
Bezuglov V.V., Akimov M.G., Gretskaya N.M., et al. // Horizons in Neuroscience Research. 2015. V. 21. P. 151–170. ISBN: 978-1-63482-967-0
Сторожевых Т.П., Тухбатова Г.Р., Сеншова Я.Е., и др. // БЭБиМ. 2007. Т. 143. № 5. С. 538–541. https://doi.org/10.1007/s10517-007-0192-x
Пинелис В.Г., Сурин А.М., Сорокина Е.Г., и др. // Глава в монографии “Нейробиологические основы возникновения и восстановительного лечения перинатального поражения центральной нервной системы у детей”. Изд-во “Педиатр”, 2016. С. 9–76. ISBN: 978-5-906332-79-0
Мясоедов Н.Ф. // Вестник Российской академии наук. 2016. Т. 86. № 6. С. 488. https://doi.org/10.7868/S0869587316060074
Левицкая Н.Г., Глазова Н.Ю., Себенцова Е.А., и др. // Рос. Физиол. Журн. им. И.М. Сеченова. 2019. Т. 105. № 6. С. 761–770. https://doi.org/10.1134/S0869813919060049
Шевченко К.В., Вьюнова Т.В., Нагаев И.Ю., и др. // Биоорганическая химия. 2013. Т. 39. № 3. С. 320–325. https://doi.org/10.1134/S1068162011040133
Сурин А.М., Красильникова И.А., Пинелис В.Г. и др. // Патогенез. 2014. Т. 12. № 4. С. 40–46.
Khodorov B. // Progress in Biophysics & Molecular Biology. 2004. V. 86. P. 279–351. https://doi.org/10.1016/j.pbiomolbio.2003.10.002
Nicholls D.G. // Biochem. Soc. Trans. 2009. № 37. P. 1385–1388. https://doi.org/10.1042/BST0371385
Brustovetsky T., Li V., Brustovetsky N. // Cell Calcium. 2009. V. 46. № 1. P. 18–29. https://doi.org/10.1016/j.ceca.2009.03.017
https://www.rndsystems.com/resources/protocols/protocol-culturing-rat-cortical-neurons
Hardingham G.E., Bading H. Nature Reviews Neuroscience. 2010. V. 10. № 11. P. 682. https://doi.org/10.1038/nrn2911
Duchen M.R. // Pflügers Archiv-European Journal of Physiology. 2012. V. 1. № 464. P. 111–121. https://doi.org/10.1007/s00424-012-1112-0
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


