Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 212-216
УГЛЕВОДОРОДОКИСЛЯЮЩИЕ БАКТЕРИИ В ПИЩЕВАРИТЕЛЬНОМ ТРАКТЕ РЫБ КАК ИНДИКАТОР ЗАГРЯЗНЕНИЯ ПРИБРЕЖНОЙ МОРСКОЙ СРЕДЫ
Ю. М. Поляк 1, 2, *, А. С. Демчук 2, А. Н. Шаров 1, 3, Ю. И. Губелит 4, Н. А. Березина 4
1 Санкт-Петербургский научно-исследовательский центр экологической безопасности
Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Ярославская обл., Борок, Россия
4 Зоологический институт Российской академии наук
Москва, Россия
* E-mail: yuliapolyak@mail.ru
Поступила в редакцию 06.02.2020
После доработки 06.02.2020
Принята к публикации 06.02.2020
Аннотация
Оценка загрязненности объектов морской среды и биоты углеводородами имеет особенное значение, так как нефтепродукты относятся к числу приоритетных загрязнителей многих морей. Одним из перспективных направлений развития методов интегральной оценки эффектов загрязнения является разработка новых экотоксикологических биомаркеров. Впервые представлены результаты изучения содержания углеводородокисляющих бактерий в пищеварительном тракте прибрежных рыб (колюшек, ельца, густеры, уклейки, окуня, пескаря и плотвы) из восточной части Финского залива Балтийского моря, которые отражают изменения, происходящие в окружающей среде, и указывают на загрязнение воды и донных отложений нефтью и нефтепродуктами. Показано, что относительная численность углеводородокисляющих бактерий в пищеварительном тракте рыб является эффективным, чувствительным и доступным индикатором загрязнения, и может быть использована в мониторинге для оценки экологической ситуации в водных экосистемах.
В настоящее время многие водные экосистемы испытывают повышенную антропогенную нагрузку, связанную с загрязнением природных вод нефтью и нефтепродуктами (НП). Оценка загрязненности отдельных объектов морской среды и биоты углеводородами (УВ) имеет особенное значение, в связи с ростом темпов освоения нефтегазовых месторождений арктических и дальневосточных морей. Данная проблема необычайно актуальна и для регионов с активной хозяйственной деятельностью, таких как восточная часть Финского залива Балтийского моря, где расположены два крупнейших в Европе нефтеналивных терминала [1]. Мелководная прибрежная зона, вблизи портов, гаваней и городов наиболее подвержена нефтяному загрязнению [2]. В Финском заливе, транспортировка значительных объемов нефти и близость мегаполиса Санкт-Петербурга создают условия, способствующие загрязнению акватории.
Поступающие в воду НП накапливаются в донных отложениях, вызывая вторичное загрязнение, которое может привести к экологическим последствиям, в том числе, оказывать негативное воздействие на водные организмы [3]. Растворенные фракции нефти токсичны для рыб уже в очень низких концентрациях (0.0002–0.01 мг/л); ранние стадии онтогенеза рыб являются самыми уязвимыми к действию НП, эффекты выражаются в снижении выживаемости и замедлении роста. По критериям экологической опасности: токсичности, генотоксичности, канцерогенности и распространенности в донных отложениях НП относятся к числу приоритетных среди загрязняющих веществ в Балтийском море. Заметные функциональные изменения наблюдаются у бентосных организмов при 0.1–1 г/кг нефти в донных отложениях, а при более высоком содержании (>1 г/кг) могут отмечаться летальные эффекты [4].
Оперативным методом контроля, позволяющим охарактеризовать экологическую ситуацию в водных экосистемах, является микробная индикация. В основе метода лежит оценка степени доминирования микроорганизмов, способных к биодеградации загрязняющих веществ. Биодеградация НП – основной и наиболее надежный способ их удаления из окружающей среды, происходит благодаря углеводородокисляющим микроорганизмам [5, 6]. В силу своей способности утилизировать различные УВ, углеводород-окисляющие бактерии играют важную роль в морской среде, причем скорость процессов окисления УВ микроорганизмами может в десятки раз превышать скорость их самоокисления.
Загрязнение воды нефтепродуктами приводит к увеличению численности УВ-окисляющих бактерий, как в сообществе водных микроорганизмов, так и в микробиоте морских животных – рыб, моллюсков, ракообразных [7]. Накапливаясь в организмах различных трофических уровней, УВ нарушают процессы жизнедеятельности морских организмов. Особое значение имеет воздействие УВ на микробиоту пищеварительного тракта животных, которое проявляется в изменении состава микробного сообщества и вызывает дальнейшие изменения в организме [8, 9].
Способностью разлагать и утилизировать УВ обладают многие виды бактерий, обитающих в почве и донных отложениях, однако адаптационные возможности микроорганизмов пищеварительной системы водных животных к загрязнению НП пока изучены недостаточно [10, 11]. Целью настоящих исследований являлось изучение особенностей содержания углеводородокисляющих бактерий в пищеварительной системе рыб, и возможности использования данного индикатора для оценки экологической ситуации в прибрежной зоне Балтийского моря и других экосистем, загрязненных нефтью и нефтепродуктами.
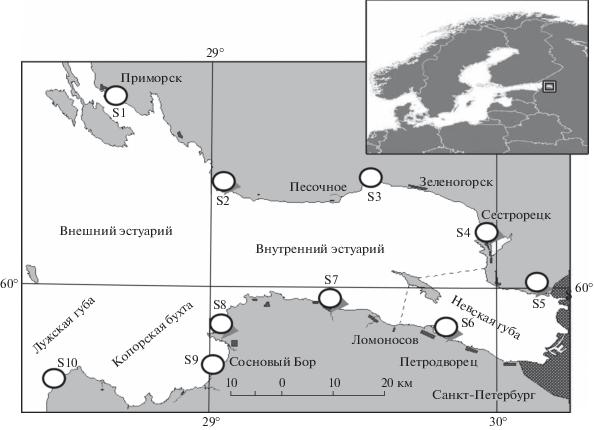
Отбор проб проводили в период с мая по сентябрь 2019 г. на 10 станциях наблюдения, расположенных в восточной части Финского залива Балтийского моря (рис. 1). Образцы рыб отбирали равнокрылым мальковым неводом и транспортировали в лабораторию при температуре 4°С. Микробиологический анализ проводили в течение 24 ч после отбора проб. Количество микроорганизмов определяли методом посева на агаризованные питательные среды [12]. Гетеротрофные бактерии высевали на среду на основе панкреатического гидролизата рыбной муки (ГРМ-агар), углеводородокисляющие бактерии – на среду Ворошиловой–Диановой. Численность углеводородокисляющих бактерий выражали в процентах к общему числу гетеротрофов. Анализ нефтепродуктов проводили флуориметрическим методом (ПНД Ф 16.1:2.21-98). Анализ полиароматических углеводородов проводили методом высокоэффективной жидкостной хроматографии (МВИ ФР.1.31.2004.01279). Статистический анализ выполняли в программе Statistica 10.0.
Проведенные исследования показали, что значительную часть микробиоты пищеварительного тракта многих рыб составляют УВ-окисляющие бактерии. Количество УВ-окисляющих бактерий различалось на разных станциях отбора проб и у различных видов рыб, и варьировало в интервале от 0.2 до 56.2% от общей численности гетеротрофных бактерий (табл. 1).
Таблица 1.
Численность УВ-окисляющих бактерий (%) в донных отложениях и пищеварительном тракте рыб, обитающих в прибрежной зоне восточной части Финского залива
| Стан-ция | Елец Leuciscus leuciscus |
Густера Blicca bjoerkna |
Трехиглая колюшка Gasterosteus aculeatus |
Девятииглая колюшка Pungitius pungitius |
Уклейка Alburnus alburnus |
Окунь Perca fluviatilis |
Пескарь Gobio gobio |
Плотва Rutilus rutilus |
Донные отложения |
|---|---|---|---|---|---|---|---|---|---|
| S1 | 39.7 ± 5.7 | 47.4 ± 6.0 | 30.5 ± 7.9 | 6.1 ± 1.3 | 4.3 ± 2.4 | 56.2 ± 8.6 | 10.6 ± 1.3 | ||
| S2 | 1.1 ± 0.3 | 0.2 ± 0.1 | 1.0 ± 0.4 | ||||||
| S3 | 16.2 ± 3.5 | 7.4 ± 4.3 | 3.4 ± 0.5 | ||||||
| S4 | 1.0 ± 0.4 | 9.2 ± 1.3 | 7.2 ± 2.0 | 8.3 ± 2.1 | |||||
| S5 | 2.5 ± 0.6 | 3.2 ± 0.5 | |||||||
| S6 | 0.2 ± 0.1 | 4.1 ± 0.3 | |||||||
| S7 | 13.3 ± 2.5 | 7.6 ± 2.2 | 0.3 ± 0.1 | 6.0 ± 0.8 | 8.0 ± 1.0 | ||||
| S8 | 5.8 ± 1.2 | 1.2 ± 0.9 | 0.4 ± 0.2 | 1.7 ± 0.4 | 1.7 ± 0.2 | ||||
| S9 | 12.7 ± 1.8 | 4.8 ± 1.1 | 1.2 ± 0.7 | 12.8 ± 5.2 | 11.4 ± 3.3 | 9.3 ± 0.8 | |||
| S10 | 4.1 ± 0.3 | 3.1 ± 0.4 |
Наиболее высокая численность УВ-окисляющих бактерий (>30%) была выявлена в районе станции S1 в пищеварительном тракте трехиглой колюшки, девятииглой колюшки, плотвы, ельца. В донных отложениях станции S1 количество УВ-окисляющих бактерий было также повышено, но в меньшей степени (10.6%). Учитывая более высокую численность бактерий в пищеварительном тракте рыб, по сравнению с микробиотой воды и донных отложений, такой индикатор загрязнения может быть чувствительнее других биомаркеров [11].
Повышенная антропогенная нагрузка на данную часть побережья была подтверждена и результатами химического анализа. Наиболее высокий уровень загрязнения полициклическими ароматическими углеводородами – более 900 мкг/кг, был выявлен в донных отложениях станции S1, расположенной вблизи крупного морского порта Приморск и нефтеналивного терминала порта Высоцк (табл. 2). В мышцах рыб содержание нефтепродуктов на всех изученных станциях не превышало 0.05 г/кг, что ниже порога отрицательного влияния на их организм. Однако содержание полиароматических углеводородов превышало норму в рыбах на ст. S4 и S8, а также в донных отложениях на ст. S1, S6 и S7.
Таблица 2.
Содержание флуорантена (FLU) и суммы 16-ти полиароматических углеводородов (Σ16ПАУ) в рыбах и донных отложениях на изученных станциях (мкг/кг)
| Стан-ция | Рыбы (мышцы) | Донные отложения | ||
|---|---|---|---|---|
| FLU | Σ16ПАУ* | FLU | ∑16ПАУ | |
| S1 | 2 | 2 | 1.4 | 971 |
| S2 | 4 | 4 | 0.3 | 59 |
| S3 | 2 | 2 | <0.1 | 35 |
| S4 | 4 | 6 | <0.1 | 45 |
| S5 | <1 | 1 | 0.15 | 41 |
| S6 | <1 | 1 | 2.1 | 239 |
| S7 | <1 | 1 | <0.1 | 344 |
| S8 | 2 | 10 | 0.18 | 67 |
| S9 | 2 | 2 | 1.7 | 60 |
| S10 | <1 | 1 | 5 | 59 |
Высокая численность УВ-окисляющих бактерий (11.4–16.2%) в пищеварительном тракте отдельных видов рыб (трехиглой колюшки, пескаря, плотвы, уклейки, ельца) была выявлена на станциях наблюдения S3, S7, S9 (табл. 1). В водных экосистемах численность УВ-окисляющих бактерий, превышающая 10% от общего числа гетеротрофов, рассматривается как показатель постоянного загрязнения нефтепродуктами [13].
На ряде станций наблюдения (S2, S5, S10) численность УВ-окисляющих бактерий в пищеварительном тракте была низкой и составляла от 0.2 до 5% от общего числа гетеротрофов. Содержание ПАУ в донных отложениях вышеперечисленных станций не превышало 60 мкг/кг. Наименьшая численность углеводородокисляющих бактерий – 1% и менее, в пищеварительном тракте рыб и донных отложениях, зафиксирована на станции наблюдения S2 (мыс Флотский), наиболее удаленной, по сравнению с другими станциями, от источников антропогенного воздействия.
Микробиота пищеварительной системы водных организмов находится под постоянным воздействием различных токсичных соединений, в том числе загрязняющих веществ, которые попадают в организм из окружающей среды. Углеводородокисляющие микроорганизмы используют углеводороды нефти и нефтепродуктов в качестве единственного источника углерода и осуществляют биодеградацию поллютантов, способствуя тем самым снижению токсического эффекта. Относительная численность углеводородокисляющих бактерий в пищеварительном тракте рыб отражает изменения, происходящие в окружающей среде, и указывает на загрязнение воды и донных отложений нефтью и нефтепродуктами. Простота и доступность данного метода оценки состояния окружающей среды позволяют рекомендовать его в качестве эффективного метода биоиндикации загрязнения прибрежных экосистем нефтью и нефтепродуктами.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа выполнена при поддержке Программы приграничного сотрудничества Россия–Эстония 2014-2020 (проект ER90 HAZLESS) и Минобрнауки России (по темам АААА-А19-119020190122-6 и АААА-А19-119020690091-0).
Список литературы
Поляк Ю.М., Губелит Ю.И., Шигаева Т.Д., и др. Мониторинг Финского залива Балтийского моря: влияние антропогенных факторов на биогеохимические процессы в прибрежной зоне // Проблемы экологического мониторинга и моделирования экосистем. 2018. Т. ХХIX. № 2. С. 99–117.
Немировская И.А. Нефть в океане (загрязнение и природные потоки). М.: Научный мир, 2013. 432 с.
Polyak Y., Shigaeva T., Gubelit Y., et al. Sediment microbial activity and its relation to environmental variables along the eastern Gulf of Finland coastline // J. Mar. Sys. 2017. V. 171. P. 101–110.
Патин С.А. Экологические проблемы освоения нефтегазовых ресурсов морского шельфа. М.: Изд-во ВНИРО, 1997. 349 с.
Das N., Chandran P. Microbial degradation of petroleum hydrocarbon contaminants: an overview // Biotechnol. Res. Int. 2011. V. 11. P. 1–13.
Xue J., Yu Y., Bai Y., et al. Marine oil-degrading microorganisms and biodegradation process of petroleum hydrocarbon in marine environments: a review // Curr. Microbiol. 2015. V. 71. P. 220–228.
Šyvokienė J., Butrimavičienė L. Aquatic organisms and petroleum hydrocarbon degrading bacteria associated with their digestive system // Environ. Res. Eng. Man. 2013. V. 4 (66). P. 6–19.
King S.C., Johnson J.E., Haasch M.L., et al. Summary results from a pilot study conducted around an oil production platform on the Northwest Shelf of Australia // Mar. Pollut. Bull. 2005. V. 50. P. 1163–1172.
Šyvokienė J., Mickėnienė L. Impact of crude oil on bacteriocenosis of the digestive tract of mollusks // Environ. Toxicol. 2004. V. 19 (4). P. 421–424.
Haritash A.K., Kaushik C.P. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review // J. Hazard. Mater. 2009. V. 169 (1–3). P. 1–15.
Karami A., Christianus A., Ishak Z., et al. Use of intestinal Pseudomonas aeruginosa in fish to detect the environmental pollutant benzo[a]pyrene // J. Hazard. Mater. 2012. V. 15 (215–216). P. 108–114.
Кузнецов С.И., Дубинина Г.А. Методы изучения водных микроорганизмов. М.: Наука, 1989. 286 с.
Vestal R., Conney J.J., Crow S., et al. The effect of hydrocarbons on aquatic microorganisms. In: Atlas R.M. (ed.). Petroleum microbiology. New York: Macmillan Publishing Co., 1984. P. 475–501.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни