Доклады Российской академии наук. Науки о жизни, 2020, T. 491, № 1, стр. 208-211
НОВЫЙ ТИП СВЕТОСОБИРАЮЩЕГО КОМПЛЕКСА ОБНАРУЖЕН ПРИ ВЫРАЩИВАНИИ Rhodopseudomonas palustris В УСЛОВИЯХ НИЗКОЙ ИНТЕНСИВНОСТИ СВЕТА
О. П. Сердюк 1, *, Л. Д. Смолыгина 1, А. А. Ашихмин 1
1 Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение ФИЦ ПНЦБИ РАН (ИФПБ РАН)
142290 г. Пущино, Россия
* E-mail: serdyuko@rambler.ru
Поступила в редакцию 16.12.2019
После доработки 16.12.2019
Принята к публикации 16.12.2019
Аннотация
Преобладание максимума при 800 нм у светособирающего комплекса LH4 (В800) и при 850 нм у LH2 (В800-850) из Rps. palustris определяется составом αβ-полипептидов и пигментов. При низкой освещенности (LL) у Rps. palustris, штамм КМ 286 (1e5), наряду с LH4, синтезировался комплекс LL LH2 с одинаковым поглощением при 800 и 850 нм. Он отличался от LH4 и LH2 комплекса, который синтезируется при высокой освещенности, составом и содержанием каротиноидов (Car) и бактериохлорофилла а (BChl a). LH4 отличался от LL LH2 и LH2 дополнительным максимумом эмиссии при 766 нм в спектрах флуоресценции BChl a. Все три комплекса имели приблизительно одинаковый уровень (около 45%) эффективности переноса энергии от Car к BChl a. Выделение комплекса LL LH2 из Rps. palustris подтверждает гипотезу о синтезе у этих бактерий в условиях низкой освещенности других типов комплексов, кроме LH4, что обусловлено множественными генами биосинтеза αβ-полипептидов и возможностью их различных комбинаций.
ВВЕДЕНИЕ
У фототрофной пурпурной бактерии Rhodopseudomonas (Rps.) palustris передачу солнечной энергии на реакционные центры (RC), в которых происходит первичное разделение зарядов и последующий перенос электронов по электрон-транспортной цепи, осуществляет светособирающий (LH) комплекс LH1 (B870), который, в свою очередь, получает энергию от хорошо изученного периферического комплекса LH2 (B800-850) [1, 2]. Пигмент-пигментные и пигмент-белковые взаимодействия определяют спектральные свойства комплексов, что создает градиент энергии и передачу ее в строго определенном направлении от комплекса к комплексу [3–5].
Считается, что у Rps. palustris комплекс LH2 с основным максимумом поглощения при 850 нм [1, 2] функционирует преимущественно в условиях высокой освещенности (HL), а комплекс LH4, обозначенный как B800 по основному и единственному максимуму в спектре поглощения, синтезируется в условиях низкой освещенности (LL) [6, 7]. Известно, что у Rps. palustris комплексы LH2 и LH4 являются нонамерами и октамерами [7], состоящими из αabβab- и αdβd-полипептидов, соответственно, с нековалентно связанными бактериохлорофиллом а (BChl a) и каротиноидами (Car) [2, 6]. Однако недавно было показано [8, 9], что в LL условиях у комплекса LH4 помимо основного максимума при 800 нм обязательно присутствует минорный максимум при 850 нм, что обусловлено наличием в структуре LH4 комплекса не только αdβd-полипептидов, но и отдельных цепей полипептидов LH2 комплекса.
В данной работе в LL условиях у Rps. palustris был обнаружен комплекс, обозначенный нами как LL LH2, который имел одинаковое поглощение при 800 и 850 нм, что отличало его от LH4 и LH2 комплексов. В задачи входило провести сравнительные исследования LL LH2 с комплексами LH4 и LH2 по спектральным свойствам, качественному и количественному составу Car и BChl a, флуоресценции BChl a, эффективности переноса энергии от Car к BChl a. На индивидуальных LL и HL комплексах из Rps. palustris, штамм КМ 286 (1e5) такие исследования были выполнены впервые.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования явилась фототрофная пурпурная несерная бактерия Rps. palustris, штамм КМ МГУ 286 (le5 strain, collection of Lehrstuhl fur Mikrobiologie, Freiburg, FRG), предоставленная кафедрой микробиологии МГУ им. М.В. Ломоносова. Бактерии культивировали анаэробно фотогетеротрофно на среде Хатнера с сукцинатом аммония, рН 6.8, при низкой (50 лк) и высокой (2000 лк) освещенностях, при T = 30°С.
Все LH комплексы выделяли из хроматофоров методом адсорбционной хроматографии на гидроксилапатите (ГА) по методике [10]. После уравновешивания колонки 20 мМ трис-HCl буфером, pH 7.8, комплекс LL LH4 элюировали этим же буфером. После промывания колонки 20 мМ Na-P буфером до бесцветного элюата LL LH2 и HL LH2 комплексы элюировали 20 мМ Na-P буфером с добавлением 0.25% Тритона Х-100. Элюаты комплексов очищали ионообменной хроматографией на колонке с ДЭАЭ-фрактогелем(M) TSK 650 (“Merck”, США). Анализ пигментного состава комплексов LH2 проводили методом ВЭЖХ [11]. Идентификацию пигментов проводили по их спектрам поглощения и времени удержания на колонке. Спектры поглощения регистрировали на спектрофотометрах Cary 50 (“Agilent Technology”, США) и Hitachi 557 (Япония). Спектры эмиссии и возбуждения флуоресценции регистрировали на спектрофлуориметре Cary Eclipse (“Agilent Technology”). Эффективность передачи энергии от Car к BChl а определяли путем сравнения спектров возбуждения флуоресценции со спектрами поглощения, преобразованными в спектры 1-T, где T – это коэффициент пропускания. Спектры нормализовали по пику Qх-перехода BChl при 590 нм. Все спектральные измерения проводили при комнатной температуре.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Rps. palustris является одной из немногих фототрофных пурпурных бактерий, имеющих несколько копий puc генов, кодирующих апопротеины LH комплексов [2, 6, 12, 13]. Благодаря этому при адаптации бактерий к условиям освещенности возможны комбинации различных белков и пигментов в структуре LH комплексов, что и приводит к их спектральному разнообразию [7–9]. В исследованиях влияния освещенности на свойства LH комплексов используется широкий диапазон интенсивностей света от экстремально высоких (7000 лк) до ультранизких (5.5 лк) [2, 3, 8, 9]. Мы использовали освещенности 2000 лк (HL) и 50 лк (LL), при которых разница в уровне биосинтеза комплексов очевидна [6–8]. В этих условиях было получено три типа комплексов из хроматофоров Rps. palustris: хорошо изученные комплексы LH2 [1, 2] и LH4 [3, 4, 8, 9, 13] и вновь выделенный LL LH2 комплекс (рис. 1). Спектр поглощения комплекса LH2 (рис. 1, спектр 1) был идентичен для LH2, выделенному ранее из Rps. palustris, штамм 1e5 [2]. Комплекс LL LH4 (рис. 1, спектр 3) помимо единственного максимума при 800 нм, как предполагалось ранее по анализу кристаллической структуры с разрешением 7.5 Å [7], имел максимум при 850 нм. Комплекс LL LH2 (рис. 1, спектр 2) с приблизительно равным поглощением в максимумах 800 и 850 нм отличался спектрально от двух других комплексов.
Рис. 1.
Спектры поглощения LH комплексов, изолированных из хроматофоров бактерии Rps. palustris КМ 286 (1e5), выращенной в условиях HL и LL освещенности: 1 – HL LH2 комплекс; 2 – LL LH2 комплекс; 3 – LL LH4 комплекс. Спектры нормализованы по полосе BChl a при 590 нм.
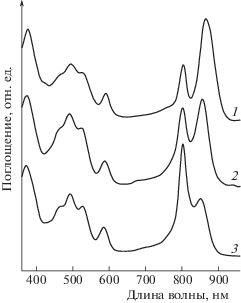
Для описанного ранее комплекса LH4 с минорным максимумом при 850 нм методом масс-спектрометрии было показано, что в этом комплексе, наряду с αdβd-полипептидами, присутствуют αaβab-полипептиды, характерные для LH2 комплекса [9]. Мы предполагаем, что полученный нами комплекс LL LH2 также может иметь специфический для него набор апопротеинов и будет отличаться от LH2 наличием αdβd-полипептидов, а от LH4 комплекса, судя по существенно большей абсорбции при 850 нм, другой комбинацией αβ-полипептидов. Подтверждением различных у LL комплексов состава белков и пигментов может служить разница их связывания с ГА на колонке, о чем судили по элюции LL LH2 фосфатным буфером с детергентом, а LH4 трис-HCl буфером без детергента.
В исследуемом нами штамме Rps. palustris КМ 286 (1e5) ранее были изучены свойства αβ-полипептидов в классическом LH2 комплексе [2] и до настоящего времени не было сведений о пигментном составе индивидуальных LH2 и LH4 комплексов. ВЭЖХ анализ пигментов всех трех типов комплексов показал существенные различия по составу или соотношению BChl a и Car (рис. 2). Комплексы LL отличались между собой по содержанию индивидуальных каротиноидов (табл. 1) и наличию у LL LH2 комплекса дополнительного пика BChl a. Все три комплекса отличались по соотношению BChl a: Car, вычисленному с учетом молярных коэффициентов экстинкции для BChl a 76 мМ–1 см–1 и Car 145 мМ–1 см–1, которое было равно для HL LH2 75.4 ± ± 2:22.2 ± ± 0.6 моль % (3.4), для LL LH2 62.2 ± ± 3.1:37.8 ± ± 3.1 моль % (1.7), для LL LH4 69.2 ± ± 5.8:30.8 ± ± 5.8 моль % (2.2).
Рис. 2.
Хроматограммы ВЭЖХ-анализа пигментов LH комплексов. Идентификация пиков: 1, 2, 4, 6, 7 – BChl а; 3 – диметилспириллоксантин; 5 – родовибрин; 8 – дидегидрородопин; 9 – родопин; 10 – спириллоксантин; 11 – ОН-нейроспорин; 12 – ангидрородовибрин; 13 – бактериофеофитин а; 14 – ликопин; 15 – нейроспорин.
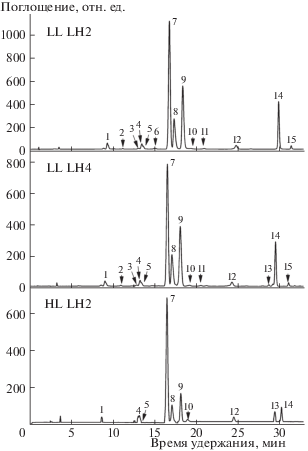
Таблица 1.
Качественный и количественный (моль %) состав каротиноидов LH и HL комплексов из хроматофоров Rps. palustris, выращенной в условиях HL и LL освещенности
| Каротиноид | HL LH2 | LL LH2 | LL LH4 |
|---|---|---|---|
| родовибрин | 7.9 | 1.6 | 1.7 |
| дидегидрородопин | 27.2 | 22.5 | 24.3 |
| родопин | 39.4 | 46.4 | 45.4 |
| спириллоксантин | 5.8 | 0.2 | следы |
| ангидрородовибрин | 6.4 | 3.3 | 3.7 |
| ликопин | 13.4 | 23.5 | 22.1 |
| диметилспириллоксантин | 0 | 0.5 | 0.8 |
| ОН-нейроспорин | 0 | 0.5 | 0.4 |
| нейроспорин | 0 | 1.4 | 1.5 |
Наблюдаемая разница в соотношении фотосинтетических пигментов у этих комплексов отражает гибкую адаптацию Rps. palustris к освещенности путем сборки LH комплексов из различных типов пептидов и пигментов.
Известно, что молекула каротиноида расположена между α- и β-спиралями апопротеинов LH комплексов и, проходя перпендикулярно плоскости мембраны, вместе с фитольными хвостами молекул BChl стабилизирует структуру этих комплексов [1, 5]. В исследуемых нами комплексах во всех световых условиях в количественном отношении преобладал родопин (табл. 1), а в LL условиях почти вдвое увеличивалось содержание ликопина. Такую же тенденцию к накоплению ликопина в LL условиях, а родовибрина в HL условиях наблюдали в клетках Rps. palustris, штамм 42OL [14].
Анализ спектров флуоресценции LH комплексов показал присутствие максимума эмиссии флуоресценции при 868 нм, характерного для BChl a (рис. 2, пик 7). В спектре флуоресценции LH4 комплекса присутствовал дополнительный максимум при 766 нм, который, по-видимому, можно отнести к одному из BChl a, отображенных на ВЭЖХ хроматограмме минорными пиками (рис. 2). LL и HL комплексы, несмотря на различия по составу и соотношению Car и BChl a, были приблизительно равны между собой (около 45%) по эффективности переноса энергии от Car к BChl a, что предполагает выделение их в нативном состоянии и функциональность in vivo.
Таким образом, выделение LL LH2 комплекса подтверждает существующую гипотезу о возможности сборки в LL условиях у бактерий Rps. palustris не только LH4, но и других, отличных по структуре комплексов, благодаря их сборке из различных комбинаций полипептидов и пиг-ментов.
Список литературы
Cogdell R.J., Gall A., and Köhler J. The architecture and function of the light-harvesting apparatus of purple bacteria: from single molecules to in vivo membranes // Quarterly Reviews of Biophysics. 2006. V. 39. P. 227–324.
Tadros M.H., Waterkamp K. Multiple copies of the coding regions for the light-harvesting B800–850 α- and β-polypeptides are present in the Rhodopseudomonas palustris genome // EMBO Journal. 1989. V. 8. P. 1303–1308.
He Z., Sundström V., Pullerits T. Intermolecular hydrogen bonding between carotenoid and bacteriochlorophyll in LH2 // FEBS Lett. 2001. V. 496(1). P. 36–39.
de Ruijter W.P.F., Oellerich S., Segura J.-M., Lawless A.M., et al. Observation of the Energy-Level Structure of the Low-Light Adapted B800 LH4 Complex by Single-Molecule Spectroscopy // Biophysical Journal. 2004. V. 87. P. 3413–3420.
Taniguchi M., Henry S., Cogdell R.G., Lindsey J.S. Statistical considerations on the formation of circular photosynthetic light-harvesting complexes from Rhodopseudomonas palustris // Photosynth Res. 2014. V. 121. P. 49–60.
Tharia H.A., Nichtingale T.D., Papiz M.Z., et al. Characterisation of hydrophobic peptides by RP-HPLC from different spectral forms of LH2 isolated from Rps. palustris // Photosynthesis Research.1999. V. 61. P. 157–167.
Hartigan N., Tharia H.A., Sweeney F., M.Z. et al. The 7.5 Å electron density and spectroscopic properties of a novel low-light B800 LH2 from Rhodopseudomonas palustris // Biophysical J. 2002. V. 82. P. 963–977.
Brotosudarmo T.H.P., Kunz R., Bohm P., et al. Single-Molecule Spectroscopy Reveals that Individual Low-Light LH2 Complexes from Rhodopseudomonas palustris 2.1.6. Have a Heterogeneous Polypeptide Composition // Biophysical J. 2009. V. 97 P. 1491–1500.
Brotosudarmo T.H.P., Collins A.M., Gall A., et al. The light intensity under which cells are grown controls the type of peripheral light-harvesting complexes that are assembled in a purple photosynthetic bacterium // Biochem. J. 2011. V. 440. P. 51–61
Serdyuk O.P., Smolygina L.D., and Khristin M.S. Membrane-Bound Bacteriophytochrome-Like Complex of Phototrophic Purple Non-Sulfur Bacterium Rhodopseudomonas palustris // Doklady Biochemistry and Biophysics. 2018. V. 482. P. 284–287.
Ashikhmin A., Makhneva Z., Bolshakov M., Moskalenko A. Incorporation of spheroidene and spheroidenone into light-harvesting complexes from purple sulfur bacteria // J. Photochem. Photobiol. B: Biol. 2017. V. 170. P. 99–107.
Fixen K.R., Oda Y., Harwood C.S. Clades of Photosynthetic Bacteria Belonging to the Genus Rhodopseudomonas Show Marked Diversity in Light-Harvesting Antenna Complex Gene Composition and Expression // mSystems. 2016. V. 1(1). P. e00006-15.
Southall J., Henry S.L., Gardiner A.T., et al. Characterisation of a pucBA deletion mutant from Rhodopseudomonas palustris lacking all but the pucBAd genes // Photosynth Res. 2018. V. 135. P. 9–21.
Muzziotti D., Adessi A., Faraloni C., et al. Acclimation strategy of Rhodopseudomonas palustris to high light irradiance // Microbiol Res. 2017. V. 197. P. 49–55.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


