Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 320-324
ВЯЗКИЕ СРЕДЫ ЗАМЕДЛЯЮТ РАСПАД КЛЮЧЕВОГО ИНТЕРМЕДИАТА БИОЛЮМИНЕСЦЕНТНОЙ РЕАКЦИИ БАКТЕРИЙ
А. Е. Лисица 1, *, Л. А. Суковатый 1, В. А. Кратасюк 1, 2, Е. В. Немцева 1, 2
1 Сибирский Федеральный Университет
Красноярск, Россия
2 Институт биофизики Сибирского отделения Российской академии наук
Красноярск, Россия
* E-mail: Alisitsa@sfu-kras.ru
Поступила в редакцию 25.10.2019
После доработки 04.02.2020
Принята к публикации 04.02.2020
Аннотация
Исследована скорость распада интермедиата биолюминесцентной реакции бактерий 4a-гидропероксифлавина в зависимости от вязкости среды. Обнаружено, что при низких концентрациях глицерина и сахарозы (вязкость 1.1–1.3 сП) скорость распада увеличивается, а дальнейший рост вязкости до 6.2 сП приводит к уменьшению скорости распада по степенному закону с показателем 0.82–0.84. Методами молекулярной динамики установлено, что в средах с глицерином и сахарозой происходит изменение подвижности аминокислотных остатков активного центра люциферазы, отвечающих за связывание флавина. Полученные результаты говорят о двух разнонаправленных эффектах вязких сред с добавлением глицерина и сахарозы: 1) дестабилизация 4a-гидропероксифлавина за счет изменения структурно-динамических свойств белка, 2) стабилизация этого интермедиата за счет снижения скорости диффузии продуктов его распада.
Во внутриклеточных условиях (in vivo) ферментативные реакции протекают под влиянием многих факторов, которые, как правило, не учитываются при стандартных биохимических исследованиях ферментов (in vitro). В частности, вязкость цитоплазмы достигает 2–15 сП в зависимости от типа клеток и их физиологического состояния [1], т.е. значительно превышает вязкость буферных растворов (≈1 сП). С точки зрения влияния на метаболические процессы это вызывает, помимо замедления диффузии субстратов и ферментов, изменение структурно-динамических характеристик белков [2], а значит оказывает воздействие на эффективность ферментативных реакций, в том числе через стабилизацию/дестабилизацию их интемедиатов. Поэтому для понимания принципов работы метаболических цепочек в условиях in vivo актуальным является изучение механизмов эффектов вязких, негомогенных сред (в том числе, содержащих биомакромолекулы [2, 3]) на интермедиаты ферментативных систем. В данной работе исследовано влияние вязких сред на скорость распада 4a-гидропероксифлавина в реакции, катализируемой бактериальной люциферазой, относящейся к классу флавинзависимых монооксигеназ.
В бактериях флавинзависимые монооксигеназы участвуют в метаболизме ароматических и алифатических соединений, биосинтезе антибиотиков и других важных процессах [4]. Эти ферменты катализируют окисление субстратов с использованием реактивного интермедиата, 4а-гидропероксифлавина [5]. Ускорение распада 4а-гидропероксифлавина приводит не только к снижению активности фермента, но и к увеличению концентрации перекиси водорода в клетке.
Бактериальная люцифераза отличается от других флавинзависимых монооксигеназ тем, что одним из продуктов катализируемой ею реакции является квант света в видимом диапазоне. Основной (световой) путь реакции, катализируемой люциферазой, проходит через ряд стадий (рис. 1), таких как: связывание FMNH2 (k1/b1), реакция флавина с O2 (k2), связывание альдегидного субстрата RCOH (k3/b3) и образование электронно-возбужденного интермедиата с последующим испусканием кванта света (k4) [6].
Рис. 1.
Стадии реакции, катализируемой бактериальной люциферазой [6]: Е – люцифераза, O2 – молекулярный кислород, FMNOOH – 4а-гидропероксифлавин, RCOOH – карбоновая кислота. Остальные обозначения расшифрованы в тексте.
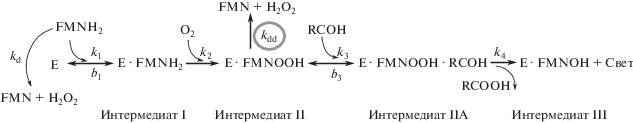
Распад интермедиата II, 4а-гидропероксифлавина, (kdd, рис. 1) оказывает существенное влияние на эффективность реакции [7]. От kdd зависит константа спада свечения – показатель, характеризующий нестационарную кинетику данной реакции, на основе которого люциферазы бактерий подразделяют на “быстрые” и “медленные” ферменты [8, 9]. Характер влияния вязких сред на стабильность интермедиата II биолюминесцентной реакции бактерий в настоящее время еще не установлен.
В работе использовали: лиофилизированный препарат люциферазы Photobacterium leiognathi (ООО “Биолюмдиагностика”, Россия), флавинмононуклеотид (FMN) (Sigma, Германия), EDTA (ROTH, Германия), сахарозу и глицерин (Panreac, Германия), соли для фосфатного буфера (0.05 M, pH 6.8) – Na2HPO4 и KH2PO4 (Fluka, Германия).
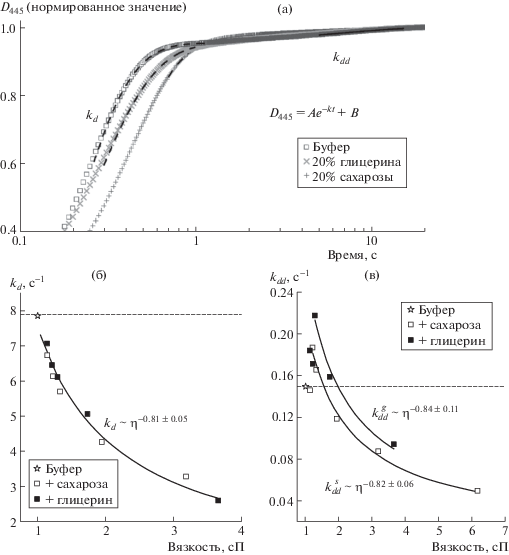
Кинетику реакции регистрировали методом остановленного потока на анализаторе SX-20 (Applied Photophysics, Великобритания) по изменению оптической плотности при 445 нм (D445) при 20°C. Реакцию запускали по известной методике [7], смешивая обескислороженный раствор люциферазы (6 мкМ) и фотовосстановленного флавинмононуклеотида (FMNH2, 30 мкМ), с буфером, содержащим растворенный О2 (≈240 мкМ). Вязкость изменяли, добавляя в оба раствора 5–40 wt % глицерина или сахарозы. Обескислороживание проводили барботированием аргоном в течение 10 мин. Константы скорости kd и kdd определяли с погрешностью ≤10% путем аппроксимации участков кинетической кривой согласно рис. 2а, с помощью Origin 8.1 (OriginLab).
Рис. 2.
Кинетика распада 4а-гидропероксифлавина в вязких средах: а – изменение оптической плотности при 445 нм (в полулогарифмических координатах). Штриховой линией показана аппроксимация кинетики реакции автоокисления FMNH2 (участок 0.3–1.0 с), сплошной линией – реакции распада пероксифлавина (участок 5–15 с) с помощью изображенного уравнения; б и в – зависимость kd и kdd от вязкости среды соответственно. Линии отражают аппроксимацию данных степенной функцией c указанными показателями (индексы s и g обозначают сахарозу и глицерин соответственно). Горизонтальная штриховая линия указывает значение константы скорости для буферного раствора (контроль).
Молекулярную динамику бактериальной люциферазы (Vibrio harveyi, PDB: 3FGC) [10] в окружении воды и 5–40 wt % сахарозы/глицерина рассчитывали в течение 40 нс с помощью пакета GROMACS 5.1.4 (силовое поле CHARMM36) [11].
Увеличение поглощения при 445 нм при добавлении буфера, содержащего растворенный О2, к смеси FMNH2 с люциферазой в обескислороженном буфере, является результатом одновременного протекания двух процессов (рис. 2а): (i) окисления свободного FMNH2 после его столкновения с О2 (kd, рис. 1) [12] и (ii) распада интермедиата II, образовавшегося после реакции кислорода и FMNH2 в активном центре фермента (kdd, рис. 1) [7]. Первый процесс протекает значительно быстрее второго и при 20°С заканчивается в течение <3 с, что позволяет без искажений определять kdd в диапазоне 5–15 с (рис. 2а).
Установлено, что увеличение вязкости раствора приводит к изменению как kd, так и kdd (рис. 2б, в). В то время как скорость автоокисления флавина (kd) снижается монотонно с ростом содержания глицерина и сахарозы в среде, kdd возрастает при низкой концентрации вязкого агента. Максимальная нестабильность интермедиата наблюдается в средах с вязкостью около 1.3 сП, при этом скорость распада увеличивается на 20 и 47% в присутствии сахарозы и глицерина соответственно. При дальнейшем росте вязкости kdd снижается аналогично kd (рис. 2б, в).
Для анализа механизмов влияния вязкости на ферментативные реакции используют полуфеноменологический подход, основанный на описании зависимости скорости элементарной биохимической стадии от вязкости среды степенной функцией с показателем δ [13], который принимает значение от 0 до 1 и характеризует чувствительность реакции к вязкости среды.
На рис. 2в, видно, что зависимость kdd от вязкости в диапазоне 1.3–6.0 сП описывается степенной функцией с δ = 0.82–0.84, что говорит о высокой степени сопряжения активного центра фермента со средой и характеризует реакцию распада интермедиата как процесс, близкий к диффузионно-контролируемому (δ = 1) [12]. Примечательно, что скорость автоокисления FMNH2, kd, снижается с ростом вязкости также с показателем δ = 0.81 ± 0.05 (рис. 2б). Этот химический процесс происходит без участия фермента и зависит от диффузии растворенного О2 и FMNH2 в среде. Близость значений δ для растворов сахарозы и глицерина указывает на сходство механизмов действия сред, независимо от химической структуры вязкого агента.
Поскольку одной из причин наблюдаемых эффектов сред может быть изменение конформационной подвижности активного центра люциферазы, в модельных средах была рассчитана среднеквадратичная флуктуация (RMSF) атомов белка в радиусе 6 Å от молекулы FMN согласно кристаллической структуры [9]. Установлены следующие эффекты: (i) снижение подвижности атомов основной цепи α-субъединицы на участке 74–79 а.о.; (ii) увеличение мобильности боковых групп полярных аминокислотных остатков, особенно атомов азота αArg107 и αArg125 и кислорода αAsp113, αSer176 и αThr179 (табл. 1). Известно, что первая группа атомов участвует в связывании изоаллоксазинового кольца, а вторая – в основном в фиксации фосфатной группы флавина [9]. В присутствии глицерина и сахарозы, начиная с самых малых концентраций (в нашем случае – 5%), RMSF атомов первой группы уменьшается приблизительно в 2 раза, а второй группы – увеличивается примерно в 1.7 раз (табл. 1).
Таблица 1.
Среднеквадратичная флуктуация (RMSF) атомов активного центра бактериальной люциферазы в средах с различным содержанием глицерина и сахарозы
| А.о./Атом | RMSF*, Å | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Вода | + Сахароза | + Глицерин | |||||||
| 5% | 10% | 20% | 30% | 5% | 10% | 20% | 30% | ||
| αAla74/Cα | 0.83 | 0.41 | 0.45 | 0.41 | 0.35 | 0.43 | 0.38 | 0.39 | 0.48 |
| αAla75/Cα | 0.69 | 0.34 | 0.37 | 0.37 | 0.31 | 0.48 | 0.31 | 0.34 | 0.52 |
| αIle76/Cα | 0.55 | 0.37 | 0.37 | 0.39 | 0.30 | 0.40 | 0.35 | 0.37 | 0.39 |
| αAsp113/Oδ2 | 0.61 | 0.63 | 1.29 | 1.08 | 1.17 | 1.39 | 1.14 | 1.22 | 1.16 |
| αSer176/Oγ | 0.70 | 1.24 | 1.16 | 1.22 | 1.29 | 1.10 | 0.77 | 1.22 | 1.31 |
Такие изменения могут приводить к ослаблению связывания ферментом субстрата (FMNH2) и/или интермедиата 4а-гидропероксифлавина, что в итоге усиливает темновой распад последнего. На рис. 2в эта тенденция ярко видна при концентрации глицерина или сахарозы <10%. Дальнейший рост концентрации приводит к увеличению вязкости среды, а значит – к затрудненной диффузии продуктов распада 4а-гидропероксифлавина (FMN и H2O2), что сдвигает равновесие реакции диссоциации в сторону исходных веществ (как, например, в работе [14]), то есть стабилизирует интермедиат II.
Полученные результаты говорят о том, что эффект вязких сред на стабильность интермедиата II реакции является результатом двух разнонаправленных процессов: дестабилизации 4а-пероксифлавина за счет взаимодействия аминокислотных остатков белка с молекулами вязкого агента и, напротив, стабилизации этого интермедиата за счет снижения скорости диффузии продуктов его распада.
Наблюдаемый механизм замедления темнового пути биолюминесцентной реакции за счет диффузионных затруднений продуктов распада ключевого интермедиата может быть реализован и во внутриклеточных условиях, поскольку люцифераза работает в окружении других ферментов и вспомогательных белков, закодированных в lux-опероне [15]. Таким образом, повышенная микровязкость служит фактором, не только защищающим люциферазу, как и другие белки, от термоинактивации, но, вероятно, и повышающим квантовый выход биолюминесцентной реакции. Также изменение вязкости внутри клетки может быть механизмом (регулятором) переключения реакции со светового пути на темновой, что требует дальнейшего детального исследования.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа выполнена при поддержке Министерства науки и высшего образования РФ (гранты № 6.7734.2017 и № 01201351504).
Список литературы
Пучков Е.О. // Биологические мембраны: Журнал мембранной и клеточной биологии. 2014. Т. 31. № 1. С. 3–13.
Gadda G., Sobrado P. // Biochemistry. 2018. V. 57. № 25. P. 3445–3453.
Gulnov D.V., Nemtseva E.V., Kratasyuk V.A. // Polymer Bulletin. 2016. V. 73. № 12. P. 3421–3435.
Huijbers M.M.E. et al. // Archives of biochemistry and biophysics. 2014. V. 544. P. 2–17.
Thotsaporn K. et al. // Journal of Biological Chemistry. 2011. V. 286. № 32. P. 28170–28180.
Немцева Е.В., Кудряшева Н.С. // Успехи химии. 2007. V. 76. № 1. P. 101–112.
Abu-Soud H., Mullins L.S., Baldwin T.O., Raushel F.M. // Biochemistry. 1992. V. 31. № 15. P. 3807–3813.
Cline T.W., Hastings J.W. // Biochemistry. 1972. V. 11. № 18. P. 3359–3370.
Deeva A.A. et al. // Bioinformatics. 2016. V. 32. № 20. P. 3053–3057.
Campbell Z.T. et al. // Biochemistry. 2009. V. 48. № 26. P. 6085–6094.
Berendsen H.J.C. // Journal of Computational Chemistry. 2005. V. 26. P. 1701–1718.
Gibson Q.H., Hastings J.W. // Biochemical Journal. 1962. V. 83. № 2. P. 368.
Sashi P., Bhuyan A.K. // Biochemistry. 2015. V. 54. № 29. P. 4453–4461.
Simopoulos T.T., Jencks W.P. // Biochemistry. 1994. V. 33. № 34. P. 10375–10380.
Bergner T. et al. // Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics. 2015. V. 1854. № 10. P. 1466–1475.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


