Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 230-232
ЖИРНОКИСЛОТНЫЙ СОСТАВ ТКАНЕЙ ЯКУТСКОЙ ЛОШАДИ
К. А. Петров 1, О. Н. Махутова 2, 3, *, М. И. Гладышев 2, 3
1 Федеральное государственное бюджетное учреждение науки Институт биологических проблем криолитозоны Сибирского отделения Российской академии наук
Якутск, Россия
2 Институт биофизики Федерального исследовательского центра “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
3 Сибирский федеральный университет
Красноярск, Россия
* E-mail: makhutova@ibp.krasn.ru
Поступила в редакцию 04.02.2019
После доработки 03.03.2020
Принята к публикации 03.03.2020
Аннотация
Исследовали состав и содержание жирных кислот печени, мышечной и жировой тканей лошадей якутской породы, обитающих в экстремальных температурных условиях криолитозоны. Незаменимые линолевая и альфа-линоленовая кислоты, поступающие к лошадям с пищей, распределялись в тканях животных по-разному. Печень была богата линолевой кислотой, а мышечная и жировая ткани накапливали альфа-линоленовую кислоту. Такое распределение свидетельствует о разной роли данных жирных кислот в метаболизме лошадей. Мышечная ткань лошадей якутской породы является ценным диетическим продуктом в отношении жирных кислот.
Лошади издавна используются человеком не только как тягловая сила, но и как источник питания. По данным FAO на 2013 г. доля России в мировом производстве конины была 7% [1]. В Республике Саха (Якутия) основу рациона местных жителей составляют лошади якутской породы, которые предположительно появились на этой территории несколько веков назад, мигрируя с якутским народом [2]. Обитая в экстремальных температурных условиях криолитозоны, лошади якутской породы демонстрируют яркий пример быстрой адаптации животных к условиям обитания [2]. Причины столь хорошей адаптации полностью не изучены. Предполагается, что питание криокормом, закаленной холодом отавой, обогащенной питательными веществами, помогает животным переживать экстремально холодные зимы [2]. Лошади эффективно ассимилируют из растительного корма полиненасыщенные жирные кислоты (ПНЖК), такие как линолевая (ЛК,18:2n-6) и альфа-линоленовая (18:3n-3, АЛК) благодаря строению желудочно-кишечного тракта, действию микроорганизмов и наличию специфических панкреатиновых липаз, связанных с протеином 2 (PLRP2) [1]. Эти липазы отсутствуют у жвачных животных, свиней и индеек, характеризующихся низким содержанием ПНЖК в тканях [3]. Предположительно микроорганизмы и/или липазы осуществляют гидролиз галактолипидов хлоропластов, что обеспечивает высокую эффективность ассимиляции растительных ПНЖК лошадьми [1]. Таким образом, конина рассматривается как самый полезный диетический продукт – источник незаменимых ПНЖК (18:2n-6 и 18:3n-3) [4–6] и потенциально может быть обогащена физиологически ценными длинноцепочечными омега-3 ПНЖК (20:5n-3 и 22:6n-3).
Целью нашей работы было сравнение состава и содержания жирных кислот (ЖК) печени, мышечной и жировой тканей лошадей якутской породы, обитающих в условиях экстремально низких зимних температур. Были исследованы ткани 5 особей – трех кобыл возрастом 7, 8 и 18 месяцев, и двух жеребцов возрастом 8 месяцев, забитых местным населением, в период массового забоя якутской лошади (ноябрь) в Верхоянском, Мегино-Кангаласском, Чурапчинском, Олекминском и Сунтарском районах Якутии. Рацион лошадей был преимущественно злаково-осоковым. Мышечная и жировая ткани были отобраны из реберной части животных. Дальнейшая процедура взвешивания, определения влажности, фиксации и анализа состава ЖК подробно описана в [7].
Во всех пробах было идентифицировано 53 ЖК. В дальнейшем анализе использовали 21 ЖК с уровнем >0.2% (табл. 1). В мышечной и жировой тканях лошадей более 70% всех ЖК составляли 18:1n-9, 16:0, 18:3n-3 и 18:2n-6, а в печени – 18:2n-6, 18:0, 16:0 и 18:1n-9 (табл. 1). В составе ЖК не было обнаружено транс-ЖК, а содержание разветвленных ЖК составляло менее 1% от общих ЖК.
Таблица 1.
Состав жирных кислот (среднее ± стандартная ошибка, % от общей суммы кислот), суммарное содержание ЖК (сумма ЖК, мг/г сырого веса) и влажность (%) в печени, мышечной и жировой тканях лошадей якутской породы (число проб 5). Средние, обозначенные одинаковыми буквами, достоверно не отличались при p < 0.05 по критерию HSD Тьюки для post hoc теста (для данных с нормальным распределением) и теста Краскела–Уоллиса (для данных с ненормальным распределением, стандартные ошибки отсутствуют) в дисперсионном анализе ANOVA (программа STATISTICA 9.0, StatSoft Inc.). При недостоверных значениях ANOVA буквы отсутствуют
| ЖК | Мышечная ткань | Печень | Жировая ткань |
|---|---|---|---|
| 10:0 | 0.2 ± 0.0A | 0.0 ± 0.0A | 0.5 ± 0.1B |
| 12:0 | 1.0 ± 0.2A | 0.2 ± 0.0A | 2.2 ± 0.4B |
| 14:0 | 4.4 ± 0.5A | 0.9 ± 0.2B | 6.6 ± 0.5C |
| 15:0 | 0.3 ± 0.0A | 0.1 ± 0.0B | 0.4 ± 0.0C |
| 16:0 | 21.0 ± 0.6A | 11.5 ± 1.2B | 22.0 ± 0.2A |
| 16:1n-9 | 0.4 ± 0.0A | 0.2 ± 0.0B | 0.5 ± 0.0A |
| 16:1n-7 | 6.1 ± 0.9A | 2.3 ± 0.3B | 7.0 ± 0.7A |
| 17:0 | 0.3 ± 0.0A | 0.4 ± 0.0B | 0.3 ± 0.0A |
| 18:0 | 6.9 ± 0.8A | 27.4 ± 1.7B | 4.5 ± 0.4A |
| 18:1n-9 | 23.0 ± 1.6A | 11.3 ± 0.5B | 22.4 ± 0.8A |
| 18:1n-7 | 2.6 ± 0.2A | 2.1 ± 0.1AB | 1.9 ± 0.0B |
| 18:2n-6 | 12.9 ± 1.7A | 28.8 ± 1.8B | 9.2 ± 0.5A |
| 18:3n-3 | 15.3 ± 0.9A | 6.1 ± 1.4B | 19.2 ± 0.5C |
| 20:1n-9 | 0.2 ± 0.0 | 0.3 ± 0.1 | 0.2 ± 0.0 |
| 20:2n-6 | 0.2 ± 0.0 | 0.3 ± 0.1 | 0.2 ± 0.0 |
| 20:3n-6 | 0.2 ± 0.1A | 0.5 ± 0.1B | 0.0 ± 0.0A |
| 20:4n-6 | 1.1 ± 0.4 | 4.0 ± 0.5 | 0.0 ± 0.0 |
| 20:3n-3 | 0.5 ± 0.1 | 0.4 ± 0.0 | 0.5 ± 0.0 |
| 20:5n-3 | 0.2 ± 0.0A | 0.3 ± 0.0A | 0.0 ± 0.0B |
| 22:5n-3 | 0.7 ± 0.2 | 0.3 ± 0.0 | 0.1 ± 0.0 |
| 22:6n-3 | 0.2 ± 0.1A | 0.1 ± 0.0A | 0.0 ± 0.0B |
| НЖК | 34.1 ± 0.3A | 40.8 ± 0.7B | 36.4 ± 1.2A |
| МНЖК | 33.5 ± 2.2A | 16.5 ± 0.8B | 33.3 ± 1.3A |
| ПНЖК | 32.0 ± 2.5A | 42.5 ± 0.6B | 29.8 ± 0.5A |
| Сумма ЖК | 33.1A | 28.3A | 660.6B |
| Влажность | 71.5 ± 0.9 | 67.5 ± 0.7 | 10.5 ± 2.0 |
Печень исследуемых животных отличалась от мышечной и жировой тканей по содержанию большинства ЖК. Так, в печени процентное содержание 17:0, 18:0, 18:2n-6 и 20:3n-6 было достоверно больше, а 14:0, 15:0, 16:0,16:1n-9, 16:1n-7, 18:1n-9, 18:3n-3 было достоверно меньше, чем в мышечной и жировой тканях лошадей (табл. 1).
Процентное содержание многих ЖК было сходным в мышечной и жировой тканях лошадей. Однако отличительной особенностью жировой ткани было самое высокое содержание 18:3n-3 и короткоцепочечных насыщенных ЖК (10:0, 12:0, 14:0), и отсутствие большинства длинноцепочечных ПНЖК, включая физиологически ценные арахидоновую (АРК, 20:4n-6), эйкозапентаеновую (ЭПК, 20:5n-3) и докозагексаеновую (ДГК, 22:6n-3) кислоты (табл. 1).
Суммарное абсолютное содержание (мг/г сырой массы) ЖК в жировой ткани было в 20 раз больше, чем в мышечной ткани и в печени (табл. 1).
Две незаменимые ПНЖК, ЛК и АЛК, по-разному распределялись в тканях исследованных лошадей. ЛК главным образом аккумулировалась в печени, в то время как АЛК накапливалась в жировой ткани. Мы предполагаем, что ЛК используется в качестве предшественника в синтезе физиологически ценной АРК, содержание которой было также самым высоким именно в печени (табл. 1). Накопление АЛК в жировой ткани свидетельствует об энергетической функции данной ЖК (табл. 1, рис. 1). Аналогичная особенность была обнаружена при исследовании распределения ЛК и АЛК в разных классах липидов иберийских лошадей [8]. Линолевая кислота накапливалась в полярных липидах, очевидно, выполняя строительную функцию, а альфа-линоленовая кислота, напротив, аккумулировалась в запасных липидах [8].
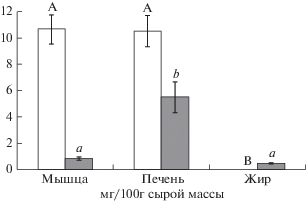
Рис. 1.
Среднее содержание (мг/100 г сырой массы) суммы эйкозапентаеновой и докозагексаеновой кислот (незакрашенные столбики) и соотношения n-6/n-3 (закрашенные столбики) в печени, мышечной и жировой тканях лошадей якутской породы (пояснения в тексте). Значения, обозначенные одинаковыми буквами, достоверно не различались при р < 0.05 по критерию HSD Тьюки для post hoc теста.
Состав ПНЖК мышечной и жировой тканей лошадей зависит от состава ПНЖК пищи. Например, содержание 18:2n-6 и 18:3n-3 – основных полиенов тканей лошадей, сильно варьируется в зависимости от рациона: 12–35.1% и 0.75–24.3% соответственно [1]. При этом и высокие и низкие значения данных ПНЖК были обнаружены у лошадей, обитающих в мягком климате. Лошади якутской породы питаясь отавой, прошедшей холодовое закаливание, и имеющей высокое содержание 18:3n-3 (~60%) и 18:2n-6 (~12%) богаты данными полиенами. Однако играют ли данные ПНЖК важную роль в адаптации лошадей к экстремально холодному климату, остается неизвестным.
Процент физиологически ценных омега-3 ПНЖК, а именно, ЭПК и ДГК в мышечной ткани и печени лошадей был незначительным и составлял 0.4% от суммы всех ЖК, несмотря на высокий процент предшественника этих ЖК – 18:3n-3 (табл. 1). Абсолютное содержание (мг/г сырой массы) ЭПК и ДГК, а также соотношение ПНЖК семейств омега-6 и омега-3 (n-6/n-3) используются для оценки пищевой ценности продуктов [7]. Печень и мышечная ткань не различались по абсолютному содержанию ЭПК и ДГК, однако соотношение n-6/n-3 было диетически более благоприятным в мышечной ткани. То есть, из трех исследованных видов тканей мышечная ткань является более ценным продуктом в отношении омега-3 ПНЖК.
Таким образом, впервые было исследовано относительное и абсолютное содержание ЖК лошадей якутской породы. Во всех исследованных тканях обнаружено высокое содержание линолевой и альфа-линоленовой кислот. Мы предполагаем, что линолевая кислота частично используется как предшественник в синтезе физиологически ценной арахидоновой кислоты, в то время как альфа-линоленовая кислота, в основном, выполняет энергетическую функцию. Конина (мышечная ткань) является ценным диетическим продуктом питания благодаря низкому соотношению n-6/n-3 ПНЖК < 1.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Работа поддержана Государственным заданием в рамках программы фундаментальных исследований РФ, тема № 51.1.1; Государственным заданием Министерства образования и науки РФ Сибирскому федеральному университету на выполнение НИР № 6.1504.2017/ПЧ.
Список литературы
Belaunzaran X., Bessa R.J.B., Lavín P., et al. // Meat Science. 2015. V. 108. P. 74–81.
Петров К.А., Перк А.А., Чепалов В.А., et al. // Сельскохозяйственная биология. 2017. Т. 52. С. 1129–1138.
De Caro J., Eydoux C., Chérif S., et al. // Comparative Biochemistry and Physiology, Part B. 2008. V. 150. P. 1–9.
Juárez M., Polvillo O., Gómez M.D., et al. // Meat Science. 2009. V. 83. P. 224–228.
Guil-Guerrero J.L., Rincón-Cervera M.A., Venegas-Venegas C.E., et al. // International Food Research Journal. 2013. V. 20. P. 3249–3258.
Belaunzaran X., Lavín P., Barron L.J.R., et al. // Meat Science. 2017. V. 124. P. 39–47.
Gladyshev M.I., Makhutova O.N., Gubanenko G.A., et al. // European Journal of Lipid Science and Technology. 2015. V. 117. P. 1417–1421.
Belaunzaran X., Lavín P., Mantecón A.R., et al. // Animal. 2018. V. 12. P. 417–425.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


