Доклады Российской академии наук. Науки о жизни, 2020, T. 492, № 1, стр. 233-237
КОНТРОЛЬ СКОРОСТИ МИГРАЦИИ И РАСПЛАСТЫВАНИЯ ФИБРОБЛАСТОВ ДЕФЕНСИНОВЫМ ОЛИГОПЕПТИДНЫМ ФРАГМЕНТОМ
В. П. Иванова 1, *, член-корреспондент РАН А. И. Кривченко 1
1 Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: valet@iephb.ru
Поступила в редакцию 16.12.2019
После доработки 03.03.2020
Принята к публикации 03.03.2020
Аннотация
Разработка способов направленной регуляции перехода клеток от неподвижного, фиксированного статуса к мигрирующему состоянию и наоборот относится к важнейшим задачам практической медицины. В настойщее время актуальна проблема создания биопрепаратов на основе природных соединений для минимизации или устранения негативных последствий при трансформации клеток. Нами было проведено исследование влияния синтетического пептида GERA, фрагмента антимикробных полипептидов дефенсинов, на процессы распластывания и миграции эмбриональных фибробластов. Установлено, что пептид увеличивает количество распластанных клеток в популяции по сравнению с контрольными клетками. Кроме того, пептид GERA стимулирует направленную миграцию фибробластов в зону повреждения клеточного монослоя, т.е. участков субстрата, свободных от клеток. Наиболее вероятными клеточными мишенями у распластывающихся и мигрирующих фибробластов, на которые действует пептид, являются структурные и регуляторные компоненты фокальных адгезий.
Большинство типов клеток в организме функционируют в многоклеточных комплексах и соответственно имеют постоянную пространственную локализацию в организме и являются неподвижными. При определенных условиях (в ходе эмбрионального развития или заживления поврежденных тканей) под воздействием разнообразных внешних и внутренних сигналов неподвижные клетки могут приобретать мигрирующий морфотип [1]. В этом случае нарушаются межклеточные взаимодействия и связи клетки с субстратом. Достигнув новой пространственной локализации, клетка прикрепляется к внеклеточному матриксу (ВКМ), распластывается и переходит к дифференцировке и размножению, теряя способность к перемещению. Далее происходит формирование новых участков ткани.
У нормально функционирующих клеток после взаимодействия с ВКМ может происходить либо их распластывание на поверхности субстрата (с последующим переходом к дифференцировке), либо перемещение на любые требуемые расстояния. Необходим баланс между этими процессами для поддержания нормальной жизнедеятельности клетки, ткани и организма в целом. Существенна роль регуляторных соединений, в том числе олигопептидов, в модуляции функциональной активности клеток, определяющей их адгезивные и миграционные свойства.
Ранее нами было показано, что тетрапептидный фрагмент дефенсинов Gly-Glu-Arg-Ala (GERA) активирует процессы изменения клеточной формы у эпителиоподобных клеток [2]. В отличие от эпителиальных клеток, мезенхимальные клетки, к которым относятся и фибробласты, способны мигрировать одиночно, покидая места постоянной дислокации в тканях [3]. Морфогенетические свойства фибробластов не только определяют регенеративные процессы в организме, но и важны для создания новых полимерных материалов. Последние могут быть использованы в качестве субстрата для колонизации мигрирующими клетками, включая фибробласты, с последующим их прикреплением к подложке и переходу к дифференциации и пролиферации [4].
В представленной работе изучали влияние тетрапептида GERA, фрагмента эндогенных антимикробных полипептидов животного происхождения – дефенсинов, на процессы распластывания и миграционную активность эмбриональных фибробластов.
Объектом исследования служили эмбриональные фибробласты мыши линии STO, полученной из коллекции культур США (“American Type Culture Collection”, ATCC). Клетки выращивали в пластиковых флаконах (“Corning”, США) в среде ДМЕМ/F12, содержащей 50 мкг/мл пенициллина и стрептомицина (“Gibco”, США) и 10% эмбриональной телячьей сыворотки (“Gibco”, США) в атмосфере 5% СО2 при 37°С.
Влияние пептида GERA, синтезированного на кафедре химии природных соединений СПбГУ, на распластывание клеток линии STO оценивали по описанному ранее методу [2]. Клетки (2 ⋅ 105 кл/мл) в питательной среде с добавлением 0.2% сыворотки рассевали на чашки Петри (“Corning”, США). Пептид в концентрации от 10–10 до 10–5 М вносили в клеточную суспензию перед посевом клеток на чашки Петри. Клетки выдерживали 45 мин в СО2-инкубаторе при 37°С. Учитывали долю клеток (%) с распластанным морфотипом. Распластанной считали клетку с выраженными отростками, нераспластанной – клетку округлой формы.
Клеточную миграцию оценивали по способности клеток мигрировать в свободное от клеток пространство. Клетки (3 ⋅ 105 кл/мл) в полной среде рассевали на чашки Петри и выращивали 24 ч до образования конфлюентного монослоя клеток. Затем повреждали монослой стерильным наконечником микропипетки и удаляли культуральную среду с флотирующими клетками, после чего вносили свежую питательную среду с добавлением 10% сыворотки. Пептид в концентрации 10–8 и 10–5 М добавляли в культуральную среду. Клетки выдерживали 12 ч в СО2-инкубаторе при 37°С. Сразу после формирования раны (0 ч) и спустя 12 ч фотографировали зону повреждения. Для этого использовали инвертированный микроскоп Axiovert40C (“Carl Zeiss”, Германия), оснащенный камерой SonyDSC-W1 (Япония). Площадь раны измеряли с помощью программы ImageJ. Степень закрытия раны вычисляли по формуле: Z = [(A0 – A12)/A0] × 100%, где Z – площадь закрытия раны (в %), A0 – площадь раны в момент нанесения повреждения (0 ч), A12 – площадь раны через 12 ч после нанесения повреждения.
Статистическую обработку результатов проводили с использованием t-критерия Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенных исследований установлено, что тетрапептидный фрагмент дефенсинов в широком диапазоне концентраций увеличивает количество распластанных клеток на твердом субстрате (рис. 1). При этом величина эффекта стимуляции распластывания фибробластов практически не изменялась в процессе последовательного 10-кратного уменьшения количества пептида в среде инкубации. Только при одной из использованных концентраций, 10–10 М, пептид не оказывал достоверного влияния на способность фибробластов к распластыванию. Стимулирующий эффект у изученного пептида GERA может быть связан с его действием на процессы, которые определяют контактное взаимодействие клеток с субстратом.
Рис. 1.
Влияние пептида GERA на распластывание фибробластов линии STO.
По оси абсцисс – концентрация пептида (М): 1– 10–10, 2 – 10–9, 3 – 10–8, 4 – 10–7, 5 – 10–6, 6 – 10–5. По оси ординат – количество распластанных клеток (%, M ± m). Пептид вносили в культуральную среду, содержащую 0.2% сыворотки. Подсчет клеток с распластанным морфотипом проводили через 45 мин инкубации при 37°С. Достоверность отличий от контроля отмечена:
* – р < 0.05; ** – р < 0.01; *** – р < 0.001. Число экспериментов 6.

В процессе распластывания и миграции клеток ключевую роль играют фокальные адгезии, представляющие собой кластер интегриновых рецепторов, взаимодействующих, с одной стороны, с белками ВКМ и, с другой стороны, с актиновым цитоскелетом, используя для этого белки, связывающиеся с актином [5]. Влияние пептида GERA на процессы распластывания и миграции может быть ограничено изменением активности либо интегриновых рецепторов, либо определенных актин-связывающих белков, либо и тех и других одновременно. Тетрапептид, находясь во внеклеточном пространстве, может изменять пространственную ориентацию отдельных участков эктодомена интегринов, тем самым способствуя структурным перестройкам, ускоряющим формирование кластеров интегринов, определяющих размеры и состав формирующихся фокальных комплексов.
Влияние изученного пептида на группу актин-связывающих белков, возможно, определяется его регуляторным воздействием на функции указанных белков, осуществляющих связывание цитоплазматического домена β-субъединицы интегриновых рецепторов с актиновым цитоскелетом клетки. Наиболее существенное влияние на стабилизацию фокальных адгезий оказывают актин-связывающие белки – талин, винкулин и α-актинин [5]. Первым в состав фокальных комплексов вовлекается талин, который находится в неактивном свернутом состоянии. Инактивация талина связана с внутримолекулярным взаимодействием F2 и F3 субдоменов головной области талина со спирализованными участками субдоменов R1, R2 и R9 хвостовой области талина. Можно предположить, что пептид, связываясь с заряженными аминокислотными остатками в субдоменах F2 и F3, может изменить конформацию молекулы талина таким образом, что будет разрушена внутримолекулярная связь, тормозящая функциональную активность талина. Освободившийся в результате подобных пространственных перестроек субдомен талина F3 получит возможность связывания с фрагментом NPXY цитоплазматического домена β-субъединицы интегринов, что обеспечит ускорение ассоциации интегринов с F-актином.
Помимо прямого контакта с интегриновыми рецепторами и F-актином талин может активировать другой актин-связывающий белок – винкулин [6]. В физиологических условиях винкулин также находится в неактивном состоянии, обусловленном наличием внутримолекулярной связи между N-концевым головным и С-концевым хвостовым доменами, которая препятствует взаимодействию хвостового домена винкулина с F-актином. Талин, связываясь с головным доменом винкулина, обеспечивает высвобождение хвостового домена винкулина для контакта с актиновыми филаментами. Это означает, что тетрапептид GERA, модулируя активность талина, может воздействовать опосредованно и на активность винкулина.
α-Актинин появляется в незрелых фокальных комплексах. Этот белок одновременно связывается как с актиновыми филаментами посредством двух N-концевых доменов, гомологичных кальпонину, так и с цитоплазматическим доменом β-субъединицы интегриновых рецепторов через сайт связывания, расположенный между спектриновыми повторами R1 и R2 в центральной части молекулы α-актинина [7]. Не исключено, что тетрапептид GERA может непосредственно воздействовать на отдельные участки молекулы α-актинина, вовлеченные в процесс связывания с интегринами и/или F-актином, приводя к ускорению контактного взаимодействия α-актинина как с β-субъединицей интегринов, так и с актиновыми филаментами.
Тетрапептид GERA может оказывать регуляторное влияние на динамику прикрепления фибробластов при распластывании либо дискретно, действуя на несколько мишеней одновременно на разных стадиях формирования фокальных адгезий, либо одномоментно через активацию интегриновых рецепторов, ускоряя протекание всех последующих межбелковых взаимодействий, приводящих к устойчивой ассоциации рецепторов с цитоскелетом, являющейся основой для укрупнения незрелых фокальных адгезий.
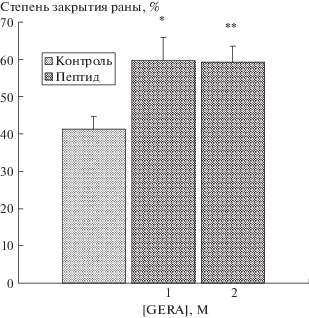
Используя метод “зарастания раны”, исследовали влияние пептида GERA на скорость направленной миграции фибробластов в свободное от клеток пространство. Как видно из данных, представленных на рис. 2, инкубация фибробластов с тетрапептидом приводила к активации процессов клеточной миграции. Скорость закрытия раны под действием пептида возрастала в 1.44 и 1.43 раза, соответственно, при 10–8 и 10–5 М по сравнению с контрольными клетками. Стимулирующий эффект пептида связан с его влиянием на скорость направленного перемещения фибробластов, движущихся в зону повреждения, т.е. участков субстрата, свободных от клеток.
Рис. 2.
Влияние пептида GERA на миграцию фибробластов линии STO.
По оси абсцисс – концентрация пептида (М): 1 – 10–8, 2 – 10–5. По оси ординат – степень закрытия раны (%). После нанесения царапины в сплошном монослое клеток добавляли полную питательную среду (10% сыворотки) с пептидом или без него и культивировали 12 ч при 37°С. Измерение площади раны проводили сразу после ее формирования (0 ч) и через 12 ч после повреждения монослоя. Число экспериментов 7–8. Достоверность отличий от контроля отмечена: * – р < 0.05; ** – р < 0.01.
Миграция клеток, как и распластывание, связана с процессами формирования фокальных адгезий, протрузий и ремоделирования актинового цитоскелета. Основное отличие этих клеточных процессов состоит в скорости динамических перестроек фокальных адгезий, скорости ремоделирования актиновых филаментов и способах образования протрузий [8].
Вероятно, тетрапептид GERA, регулируя миграционную активность фибробластов, ускоряет процессы сборки и разборки адгезионных комплексов и фокальных адгезий в ведущем крае и в зоне ретракции клеток. В результате увеличивается, с одной стороны, скорость прикрепления клеток к субстрату в области ведущего края клетки, с другой – скорость открепления с противоположного конца относительно направления перемещения поляризованной клетки.
Помимо воздействия на функции структурных компонентов адгезионных структур (как уже обсуждалось для процессов распластывания) тетрапептид GERA может участвовать в активации малых ГТФаз семейства Rho [9, 10]. Известно, что разные представители этого семейства действуют дискретно на процесс созревания адгезионных структур. Белки Rac и Cdc42 стимулируют появление первичных фокальных комплексов, образование протрузий в лидирующем крае клетки, т.е. отвечают за начальные стадии клеточного движения. В то же время белок Rho регулирует процессы созревания фокальных адгезий, а также способствует формированию пучков микрофиламентов и стресс-фибрилл и развитию актин-миозинового натяжения, что важно для перемещения тела клетки в пространстве.
Можно предположить, что тетрапептид GERA, изменяя активность разных представителей малых ГТФаз, может воздействовать как на начальные стадии клеточного движения (ускорение образования протрузий и сборки первичных фокальных комплексов), так и на более поздние этапы миграционного процесса (ускорение созревания и роста фокальных адгезий, а также образования стресс-фибрилл и актомиозиновых сократимых пучков, необходимых для перемещения клетки по субстрату). Можно говорить о возможном сочетанном влиянии тетрапептида на структурные и регуляторные компоненты адгезионных структур, определяющие протрузионную активность клеток и направленность миграционного процесса в целом.
Не исключено также, что в процессе клеточного распластывания тетрапептид GERA стабилизирует у фибробластов сформированные протрузии за счет более прочных субстрат-клеточных взаимодействий, которые в дальнейшем препятствуют образованию новых протрузий. В отличие от распластанных клеток, у которых мембранные протрузии формируются на всех направлениях, для мигрирующих клеток характерно образование протрузий в лидирующем крае клетки. Возможно, влияние изученного пептида на миграционную активность фибробластов в большей степени связано с регулированием динамики формирования временных (короткоживущих) протрузий в ведущем крае клетки через регуляцию взаимодействия винкулина с Arp2/3-комплексом в фокальных адгезиях, а также процессов ретракции хвостовой части клетки посредством ослабления связывания винкулина с F-актином [6], что в конечном итоге приведет к ускорению направленного перемещения фибробластов по оси клеточной поляризации.
Стимулирующий эффект тетрапептида GERA на распластывание и миграцию фибробластов, вероятно, связан с его влиянием на структурную и функциональную организацию фокальных адгезий. Скорее всего, в ходе клеточного распластывания пептид может обеспечивать стабилизацию фокальных адгезий, ограничивая тем самым число протрузий у фибробластов, а при направленной клеточной миграции пептид может ускорять динамику формирования адгезионных комплексов в лидирующем крае фибробластов, обеспечивая увеличение протрузионной активности, а значит и скорости перемещения клеток.
В заключении необходимо подчеркнуть, что направленная регуляция перехода клеток определенных типов от неподвижного (фиксированного) статуса к мигрирующему состоянию, и, наоборот, все еще остается на стадии разработки. Перспективными инструментами, способными блокировать у неопластических клеток свойственную им увеличенную миграционную активность, а также активировать (включать) заблокированную у трансформированных клеток способность прикрепляться и распластываться на ВКМ с последующим переходом к дифференцировке, могут быть препараты пептидных регуляторов.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа выполнена в рамках государственного задания (№ гос. регистрация АААА-А18-118012290371-3).
Список литературы
Lauffenburger D.A., Horwitz A.F. // Cell. 1996. V. 84. № 3. P. 359–369.
Иванова В.П., Ковалева З.В., Кривченко А.И. // ДАН. 2015. Т. 462. № 6. С. 719–722.
Александрова А.Ю. // В сб.: Методы культивирования клеток / под ред. Г.П. Пинаева, М.С. Богдановой. СПб: Изд-во Политехн. Ун-та, 2008. С. 40–55.
Winter J.O. // In: Nanotechnologies for the life sciences. V. 9. – Tissue, cell and organ engineering / Ed. by C. Kumar. Weinheim: Verlag, 2006. P. 388–460.
Li Z., Lee H., Zhu C. // Exp. Cell Res. 2016. V. 349. № 1. P. 85–94.
Bays J.L., DeMali K.A. // Cell Mol. Life Sci. 2017. V. 74. № 16. P. 2999–3009.
Kelly D.F., Taylor K.A. // J. Struct. Biol. 2005. V. 149. № 3. P. 290–302.
Wehrle-Haller B., Imhof B.A. // Int. J. Biochem. Cell Biol. 2003. V. 35. № 1. P. 39–50.
Raftopoulou M., Hall A. // Dev. Biol. 2004. V. 265. № 1. P. 23–32.
Ridley A.J. // Curr. Opin. Cell Biol. 2015. V. 36. P. 103–112.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


