Доклады Российской академии наук. Науки о жизни, 2020, T. 493, № 1, стр. 349-352
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ЭКСПРЕССИИ ГЕНОВ ДЛИННЫХ НЕКОДИРУЮЩИХ РНК В КЛЕТОЧНЫХ КУЛЬТУРАХ ГЕПАТОЦИТОВ И ПЕЧЕНИ ЧЕЛОВЕКА
О. Ю. Буренина 1, *, Т. С. Зацепин 1, 2, Э. Ф. Ким 3, А. В. Метелин 3, Д. А. Скворцов 2, 4, М. П. Рубцова 1, 2, академик РАН О. А. Донцова 1, 2
1 Центр наук о жизни, Сколковский институт науки
и технологий
Москва, Россия
2 Научно-исследовательский институт физико-химической биологии имени А.Н. Белозерского
и Химический факультет Московского государственного университета имени М.В. Ломоносова
Москва, Россия
3 Федеральное государственное бюджетное научное учреждение “Российский научный центр хирургии
имени академика Б.В. Петровского”
Москва, Россия
4 Факультет биологии и биотехнологии,
Высшая школа экономики
Москва, Россия
* E-mail: alunit@inbox.ru
Поступила в редакцию 10.03.2020
После доработки 23.03.2020
Принята к публикации 23.03.2020
Аннотация
Длинные некодирующие РНК (днРНК) – перспективные биомаркеры и потенциальные мишени для терапии рака печени. Для изучения функций днРНК, количество которых в клетке меняется при канцерогенезе, используют стабильные линии гепатоцитов in vitro. Мы впервые сравнили экспрессию генов известных днРНК в клетках условной нормы печени человека HepaRG и раковых линиях Huh7 и HepG2 и показали, что относительное количество этих днРНК в HepaRG наиболее близко к аналогичным показателям, измеренным в образцах здоровой печени доноров. Полученные данные свидетельствуют об уникальных особенностях HepaRG и подтверждают целесообразность ее использования в качестве модели нормальных гепатоцитов человека для изучения функций днРНК.
Гепатоцеллюлярная карцинома (ГЦК) является шестым по распространенности в мире злокачественным заболеванием. Отсутствие специфических биомаркеров вместе с бессимптомным протеканием болезни приводят к поздней диагностике данного типа рака и низкой выживаемости пациентов [1]. Длинные некодирующие РНК (днРНК) – многочисленный класс регуляторных молекул длиной более 200 нуклеотидных остатков, которые не подвергаются трансляции. Многие днРНК вовлечены в канцерогенез гепатоцитов и активность экспрессии их генов существенно меняется при ГЦК, что может быть использовано как для ранней диагностики, так и для потенциальной таргетной терапии этого вида рака [2].
Большинство исследований ГЦК in vitro проводится с использованием раковых клеточных культур печени человека, чаще всего Huh7 и HepG2. Обе линии выведены из первичных культур ГЦК пациентов (хотя HepG2 позднее была аннотирована как гепатобластома [3]), характеризуются высокой степенью дифференцировки и обладают по крайней мере основными фенотипическими особенностями, присущими опухолевым клеткам печени, включая экспрессию ГЦК-ассоциированных генов [4]. Ввиду невозможности иммортализации здоровых клеток печени, в качестве модели нормы часто используют культуры первичных гепатоцитов человека, которым, однако, свойственна высокая вариабельность от донора к донору, быстрая дедифференциация и отсутствие пролиферативных свойств, что сопряжено с низкой воспроизводимостью результатов [5].
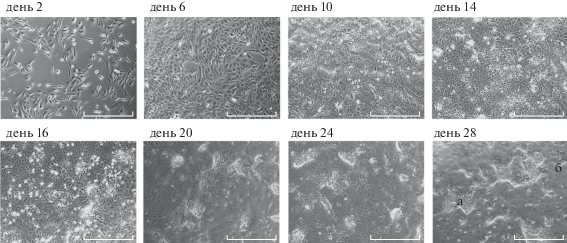
На сегодняшний день единственной клеточной культурой, приближенной к нормальным гепатоцитам по фенотипу и уровню экспрессии ключевых генов, является HepaRG – продукт компании Biopredic (Франция) [6]. Несмотря на тот факт, что данная клеточная линия была выведена из первичной культуры ГЦК, полностью дифференцированные клетки (HepaRG(d)) демонстрируют активную экспрессию генов основных цитохромов (CYP2E1, CYP3A4), цитокератина 18 (CK18) и различных ядерных рецепторов, нехарактерных для раковых клеточных линий печени [5, 7]. Это позволяет использовать HepaRG для тестирования различных лекарственных препаратов и проведения доклинических исследований [8]. Исходная недифференцированная культура HepaRG (HepaRG(n)) проявляет пластичность, свойственную стволовым клеткам печени (так называемым клеткам-предшественникам, “liver progenitor cells”), и в процессе культивирования дифференцируется в смешанную популяцию зрелых гепатоцитов и примитивных гепатобилиарных клеток (рис. 1).
Рис. 1.
Изменение морфологии клеток HepaRG в процессе культивирования (а – колонии зрелых гепатоцитов, б – эпителиальные (гепатобилиарные) клетки). Активная дифференциация клеток после 14-го дня культивации инициируется добавлением в среду 1.8% (v/v) ДМСО.
Множество исследований посвящено сравнительному анализу дифференциально экспрессируемых кодирующих генов в культурах клеток HepaRG и Huh7/HepG2 [9, 10], однако данные об экспрессии генов днРНК в HepaRG практически отсутствуют. Таким образом, целью данной работы являлся анализ экспрессии генов известных днРНК, ассоциированных с ГЦК, в клетках HepaRG разной степени дифференцировки и раковых линиях гепатоцитов Huh7 и HepG2. В экспериментах использовали культуру HepaRG 16-го пассажа (данная клеточная линия не является иммортализированной и сохраняет свои свойства до 20 пассажа). Выделение экстрактов общей клеточной РНК проводили по истечении 48 ч после рассева клеток (HepaRG(n)) и на 28-й день культивации (HepaRG(d)), проведенной согласно соответствующему протоколу для дифференциации (Biopredic). Измерение количества РНК проводили с помощью обратной транскрипции, сопряженной с ПЦР в реальном времени; для нормировки использовали U6 мяРНК. В первую очередь в качестве объектов исследования мы выбрали две печень-специфичные днРНК: HULC (от англ. “highly upregulated in liver cancer”), синтез которой активируется при ГЦК [11], и недавно открытую LINC01093, экспрессия гена которой, наоборот снижается при канцерогенезе [12], а также четыре известных онкогенных днРНК, характерных для многих типов раков: H19, CYTOR, MALAT1 и UCA1 [2]. Для сравнения мы оценили экспрессию генов всех выбранных нами днРНК в образцах ткани донорской (здоровой) печени.
На первом этапе работы для подтверждения статуса дифференцировки HepaRG мы оценили количество мРНК специфичного для гепатоцитов белка альбумина (ALB), которое ожидаемо повышалось в HepaRG(d) по сравнению с HepaRG(n) (рис. 2а). Активную экспрессию ALB наблюдали также и в других линиях клеток, причем ее уровень был сравним с аналогичным для нормы печени (ОПД). При этом содержание мРНК двух биомаркеров рака печени – альфа-фетопротеина (AFP) и глипикана 3 (GPC3) – в HepaRG было сравнимо или даже меньше, чем для ОПД, в отличие от Huh7 и HepG2, экспрессирующих эти гены на 2–4 порядка активнее. Таким образом HepaRG демонстрирует паттерн экспрессии генов, свойственный нормальным (здоровым) гепатоцитам.
Рис. 2.
Сравнительный анализ относительной экспрессии (ОТ-кПЦР) генов печень-специфичного белка ALB и ГЦК-специфичных белков AFP и GPC3 (а), а также печень-специфичных днРНК (LINC01093, HULC) и ГЦК-специфичных днРНК (H19, CYTOR, UCA1, MALAT1) (б), в раковых линиях гепатоцитов Huh7 и HepG2 и в клетках HepaRG разной степени дифференцировки (n – недифф., d – дифф.) по сравнению с усредненными значениями по трем образцам печени доноров (ОПД). Достоверный уровень значимости результатов согласно проведенному дисперсионному анализу (ANOVA): * – p < 0.05, ** – p < 0.01, *** – p = 0.0002, **** – p < 0.0001, н.д. – нет достоверных отличий.

На следующем этапе мы проанализировали экспрессию генов различных днРНК. LINC01093 практически не детектировалась в Huh7 и HepG2 – моделях ГЦК, тогда как клетки HеpaRG(n) и, в большей степени, HеpaRG(d), по-прежнему экспрессировали ген этой днРНК на высоком уровне (рис. 2б). Похожая ситуация была отмечена для днРНК H19, экспрессия гена которой также подавлена при ГЦК, и, как следствие, в клетках Huh7 и HepG2 (по сравнению с нормой печени и HepaRG). При этом относительное количество этих днРНК в дифференцированных клетках HepaRG было в среднем на порядок выше, чем в HepaRG(n), что свидетельствовало об их активном синтезе именно в зрелых гепатоцитах. Обратную тенденцию наблюдали в случае известных биомаркеров ГЦК HULC и UCA1 [2] – уровни экспрессии этих генов были повышены только в Huh7 и HepG2, но при этом содержание этих днРНК в HepaRG(d) было сравнимо с нормой печени (рис. 2б). Активная экспрессия HULC в Huh7 по сравнению с другими раковыми культурами гепатоцитов была описана ранее в работе [11].
Интересные данные были получены для двух других онкогенных днРНК, ассоциированных с ГЦК – CYTOR и MALAT1. А именно, все четыре клеточные линии характеризуются повышенным содержанием CYTOR по сравнению с нормой печени. Еще более неожиданным результатом оказалась активация синтеза MALAT1 в дифференцированных клетках HepaRG (рис. 2б). Тем не менее, несмотря на кажущееся противоречие этих данных с условным нераковым статусом HepaRG, необходимо принимать во внимание многообразие регуляторных функций днРНК. В частности, CYTOR оказывает непосредственно влияние на клеточный цикл, активируя экспрессию циклина D1 (CCND1) [13]. Активное деление характерно для in vitro культур гепатоцитов, в то время как в условиях in vivo эти клетки делятся крайне медленно. В процессе дифференциации HepaRG(n) скорость деления этих клеток снижается, что согласуется с соответствующим снижением относительного количества CYTOR в HepaRG(d) (рис. 2б).
MALAT1, наоборот, принимает непосредственное участие в дифференцировке гепатоцитов из их предшественников, связываясь с бел-ками TGF-β/Smad сигнального каскада [14], а также регулирует Wnt/β-катениновый путь, стимулируя регенеративные процессы в печени [15]. Следовательно, мы предполагаем, что повышенная экспрессия MALAT1 в HеpaRG(d) не связана с его онкогенными свойствами, а является отличительной особенностью данной клеточной культуры.
Таким образом, в ходе данной работы мы впервые провели сравнительный анализ экспрессии генов различных днРНК – потенциальных маркеров канцерогенеза печени в раковых и в условно нормальных клеточных линиях гепатоцитов человека и подтвердили уникальные свойства культуры клеток HepaRG, выгодно отличающие ее от клеточных линий ГЦК. На основании полученных данных мы предлагаем использовать линию клеток HepaRG в качестве модели нормальных гепатоцитов человека для изучения функций днРНК.
Список литературы
Mak L.Y., Cruz-Ramón V., Chinchilla-López P., et al. // Am Soc Clin Oncol Educ Book. 2018. V. 38. P. 262–279.
Lim L., Wong S.Y.S., Huang F., et al. // Cancer Res. 2019. V. 79. № 20. P. 5131–5139.
López-Terrada D., Cheung S.W., Finegold M.J., et al. // Hum Pathol. 2009. V. 40. № 10. P. 1512–1515.
Nwosu Z.C., Battello N., Rothley M., et al. // J. Exp. Clin. Cancer Res. 2018. V. 37. P. 211.
Kammerer S., Kupper J.-H. // J. Cell. Biotechnol. 2017. V. 3. P. 85–93.
Parent R., Marion M.-J., Furio L., et al. // Gastroenterology. 2004. V. 126. № 4. P. 1147–1156.
Marion M.-J., Hantz O., Durantel D. // Methods Mol Biol. 2010. V. 640. P. 261–272.
Poloznikov A., Gazaryan I., Shkurnikov M., et al. // ALTEX. 2018. V. 35. № 3. P. 397–412.
Yokoyama Y., Sasaki Y., Terasaki N., et al. // Biol Pharm Bull. 2018. V. 41. № 5. P. 722–732.
Ivanova O.N., Snezhkina A.V., Krasnov G.S., et al. // Cells. 2018. V. 7. № 12. P. 275.
Zhang H., Liao Z., Liu F., et al. // Aging. 2019. V. 11. № 20. P. 9111–9127.
He J., Zuo Q., Hu B., et al. // Cancer Lett. 2019. V. 450. P. 98–109.
Ma P., Wang H., Sun J., et al. // Cell Cycle. 2018. V. 17. № 8. P. 974–984.
Zhang J., Han C., Song K., et al. // PLoS One. 2020. V. 15. № 1. P. e0228160.
Li C., Chang L., Chen Z., et al. // Int. J. Mol. Med. 2017. V. 39. № 2. P. 347–356.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


